Медиана выживаемости при раке почки

Все пациенты по-разному реагируют на диагноз онкологического заболевания. Многие предпочитают избегать информации, которая может быть неприятной, в то время как другие ищут максимально точные ответы. Никто не может сказать, какая из этих стратегий является более правильной. Тем не менее, одним из частых вопросов онкологических пациентов является вопрос к врачу о предполагаемой продолжительности жизни. В онкологии для предполагаемой оценки продолжительности жизни пациентов используются различные статистические термины, многие из которых непонятны для пациента. В данном материале описаны основные термины, которые используют врачи для определения прогноза при онкологических заболеваниях.
Важно понимать, что ни один врач не может точно ответить пациенту на вопрос о его продолжительности жизни. Срок жизни любого человека зависит от многих факторов, не все из которых связаны с болезнью. Предполагаемая продолжительности жизни онкологического пациента зависит от:
- Вида злокачественной опухоли и её расположения в организме (локализации);
- Стадии заболевания, включая размеры и распространенность опухоли;
- Биологических особенностей опухоли. её агрессивности и скорости роста, а также некоторых генетических особенностей раковых клеток;
- Чувствительности опухоли к проводимому лечению;
- Возраста и общего состояния здоровья пациента.
Для оценки эффективности различных методов лечения применяются статистические методы, которые позволяет оценить выживаемость групп пациентов. Наиболее часто оцениваются следующие показатели выживаемости:
Разновидностью общей выживаемости является относительная выживаемость пациентов, которая является наиболее удобным показателем для оценки выживаемости пациентов пожилого возраста. При оценке этого показателя оценивается соответствие выживаемости пациентов определенного возраста со злокачественным новообразованием с выживаемостью людей схожего возраста, но без наличия онкологического заболевания.
Пример 1: 5-летняя выживаемость пациентов с диагнозом рака шейки матки составляет 68%. Это означает, что 68 пациенток из 100 переживает 5 лет с момента постановки диагноза.
Пример 2: медиана выживаемости пациенток с диагнозом определенной злокачественной опухоли составляет 60 месяцев. Это означает, что 50% пациенток с данным заболеванием переживают 5-летний срок с момента постановки диагноза.
Именно указанные выше показатели используются в клинических исследованиях (подробнее про клинические исследования – здесь) для того, чтобы оценить эффективность различных методов лечения и сделать вывод о целесообразности их применения.
Для графического отображения показателей выживаемости используются специальные графики, на которых изображаются так называемые "Кривые Каплана-Майера" (Рисунок 1).
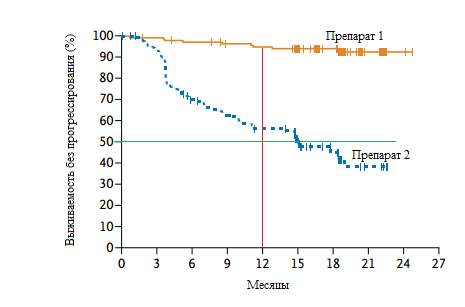
Рисунок 1. Пример кривых Каплана-Мейера по выживаемости без прогрессирования пациентов в одном из исследований. Красной линией обозначена 1-летняя выживаемость без прогрессирования, зеленой - медиана выживаемости без прогрессирования. Из графика видно, что препарат 1 демонстрирует значительные преимущества перед препаратом 2.
Таким образом, предсказать точную продолжительность жизни для отдельного пациента является крайне трудной задачей. Для предположительной оценки выживаемости врачи используют статистические данные, полученные в ходе проведения клинических исследований, в которых участвовало большое количество пациентов с определенными видами и стадиями опухолей. Такие оценки позволяют оценить среднюю выживаемость в больших группах пациентов, однако эту статистику бывает трудно перенести на отдельного пациента. Кроме того, методы лечения злокачественных опухолей постоянно совершенствуются, по этой причине данные такой статистики могут не учитывать все многообразие доступных методов лечения.
К примеру, Ваш врач может сообщить, что он оценивает прогноз течения заболевания как благоприятный. Это означает, что имеющиеся данные указывают на чувствительность опухоли к терапии и высокую вероятность хорошего контроля болезни в течение длительного времени, достижения длительной ремиссии – или даже излечения.
Подводя итоги, следует еще раз подчеркнуть следующие основные моменты:
- Статистика позволяет оценить выживаемость больших групп пациентов, но не позволяет предсказать прогноз течения заболевания и точную продолжительность жизни отдельного пациента;
- Статистика выживаемости может значительно отличаться при различных типах и стадиях опухолевого процесса, возраста пациента и проводимого лечения;
- Показатели общей выживаемости и выживаемости без прогрессирования широко применяются в клинических исследованиях для того, чтобы оценить эффективность изучаемого метода лечения;
- Статистические данные дают врачам полезную информацию для выбора наиболее подходящего метода лечения, но являются лишь одним из факторов, которые необходимо учитывать при выработке плана лечения.
Аннотация научной статьи по клинической медицине, автор научной работы — Мириленко Л. В., Полуянчик А. В.
Проведена оценка эффективности лечения и определены факторы прогноза скорректированной выживаемости (СВ) у пациентов с распространенным раком почки , пролеченных в Республиканском научно-практическом центре онкологии и медицинской радиологии за период с 1999 по 2011 г. Установлено, что независимое неблагоприятное влияние на СВ оказывают 7 факторов: наличие метастазов в регионарных лимфатических узлах , наличие отдаленных метастазов в костях, низкая степень дифференцировки опухоли, саркоматозная дифференцировка опухоли, уровень гемоглобина в крови многомерная математическая модель для определения принадлежности пациентов с IV стадией рака почки к группам риска : низкого (не более 2 неблагоприятных факторов), промежуточного (3-4 неблагоприятных фактора) и высокого (более 4 неблагоприятных факторов). Медиана выживаемости в группах низкого, среднего и высокого риска составила соответственно 34,7; 17,2 и 4,0 мес, 3-летняя СВ 48,6; 24,6 и 3,2 %.
Похожие темы научных работ по клинической медицине , автор научной работы — Мириленко Л. В., Полуянчик А. В.
Prediction of survival in patients with Stage IV kidney cancer
Прогнозирование выживаемости пациентов с IV стадией рака почки
Л.В. Мириленко, А.В. Полуянчик
Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова Республика Беларусь, 223 040 Минская область, Минский район, агрогородок Лесной
Контакты: Людмила Владимировна Мириленко ludamirilen@gmail.com
Проведена оценка эффективности лечения и определены факторы прогноза скорректированной выживаемости (СВ) у пациентов с распространенным раком почки, пролеченных в Республиканском научно-практическом центре онкологии и медицинской радиологии за период с 1999 по 2011 г. Установлено, что независимое неблагоприятное влияние на СВ оказывают 7факторов: наличие метастазов в регионарных лимфатических узлах, наличие отдаленных метастазов в костях, низкая степень дифференцировки опухоли, саркоматозная дифференцировка опухоли, уровень гемоглобина в крови 40 мм/ч, нерадикальный характер операции. Разработана многомерная математическая модель для определения принадлежности пациентов с IVстадией рака почки к группам риска: низкого (не более 2 неблагоприятных факторов), промежуточного (3—4 неблагоприятных фактора) и высокого (более 4 неблагоприятных факторов). Медиана выживаемости в группах низкого, среднего и высокого риска составила соответственно 34,7; 17,2 и 4,0 мес, 3-летняя СВ — 48,6; 24,6 и 3,2 %.
Ключевые слова: рак почки, почечно-клеточный рак, факторы прогноза, группы риска, метастазы, IVстадия рака почки, лимфатические узлы, степень дифференцировки, медиана выживаемости, многомерная математическая модель, скорректированная выживаемость
Prediction of survival in patients with Stage IV kidney cancer L. V. Mirilenko, A.B. Poluyanchik
N. N. Aleksandrov Republican Research and Practical Center for Oncology and Medical Radiology; Lesnoy Agrotown, Minsk District,
Minsk Region 223 040, Republic of Belarus
The efficiency of treatment was evaluated and the predictors of adjusted survival (AS) were identified in patients with disseminated kidney cancer treated at the Republican Research and Practical Center for Oncology and Medical Radiology in 1999 to 2011 (A.E. Okeanov, P.I. Moiseev, L.F. Levin. Malignant tumors in Belarus, 2001—2012. Edited by O.G. Sukonko). Seven factors (regional lymph node metastases; distant bone metastases; a high-grade tumor; sarcomatous tumor differentiation; hemoglobin levels of 60 232 106 68,6 31,4
Индекс массы тела, кг/м2: 20 17 321 5,0 95,0
Наличие симптомов: боль макрогематурия пальпируемая опухоль температура выше нормы 168 77 35 40 49.7 22.8 10,4 11,8
Сторона поражения: правая левая 163 175 48,2 51,8
Категория рТ: рТ1 рТ2 рТ3 рТ4 17 9 227 85 5,0 2,7 67,2 25,1
р№ рШ рШ-Ш 199 139 58,9 41,1
Размер, см: 10,0 103 118 117 30.5 34,9 34.6
Отдаленные метастазы: отсутствуют единичные множественные 114 194 30 33,7 57,4 8,9
Степень дифференцировки: «1 С2 С3 29 152 157 8,6 45,0 46,4
Морфологический вариант: светлоклеточный + остальные саркоматозная дифференцировка 299 39 88,5 11,5
Таблица 2. Локализация отдаленных метастазов
Локализация Число пациентов
Контралатеральный надпочечник 11 3,3
Головной мозг 6 1,8
Другие органы 14 4,1
* Процент (%) рассчитан к общему числу пациентов.
ного лечения, 177 (52,4 %) пациентов не получали никакого системного лечения.
Для статистического анализа были использованы следующие параметры: демографические (пол, возраст), клинические (индекс массы тела — ИМТ, артериальное давление, наличие боли, макрогематурии, пальпируемой опухоли, повышенной температуры тела); степень распространенности опухоли (TNM, ШСС 2009 г.), наличие метастазов в лимфатических узлах (ЛУ), степень дифференцировки, морфологический вариант, размер опухоли в наибольшем измерении, лабораторные показатели (уровень эритроцитов, лейкоцитов, тромбоцитов в крови, концентрация гемоглобина, скорость оседания эритроцитов (СОЭ), уровень мочевины, креатинина, билирубина, общего белка в сыворотке крови), наличие и локализация отдаленных метастазов, вид системного лечения, а также характер оперативного вмешательства (радикальное либо паллиативное).
СВ и медиана выживаемости определены по методу Каплана—Майера. Для сравнения данных по выживаемости в 2 группах использован ^-гапк-тест, в 3 и более — критерий хи-квадрат. Отношения рисков (ОР) и 95 % доверительный интервал (ДИ) получены с помощью регрессионной модели пропорциональных рисков Кокса.
Для выявления показателей, статистически значимо связанных с риском смерти от основного заболевания, проведен моновариантный анализ СВ по всем отдельным показателям. Для удобства последующего клинического применения разработанной в настоящем исследовании классификации количественные лабораторные показатели были дихотомизированы. Для поиска граничных значений использован СШРот^анализ, который основан на нахождении минимального значения Р (значимости различий) в рисках для групп, определяемых точкой разделения [6].
Показатели, связанные с риском смерти от основного заболевания с уровнем статистической значимости р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Следует отметить, что количественные показатели, такие как возраст, ИМТ, параметры артериального давления, размер опухоли, и данные лабораторных исследований включались в моновариантные модели и как количественные (в этих случаях 3-летняя выживаемость и медиана выживаемости в таблице отсутствуют) и как качественные (для лабораторных показателей — норма/не норма).
Параметры выживаемости и ОР
жен. (п = 84) 34,4 (5,7) 15,1 1,00 - -
муж. (п = 254) 30,5 (3,1) 18,8 1,02 0,76-1,38 0,875
Возраст, лет (количественный) - - 1,00 0,99-1,01 0,833
60 (п = 106) 34,8 (5,1) 22,6 0,83 0,63 - 1,10 0,192
ИМТ, кг/м2 (количественный) - - 0,98 0,95 - 1,01 0,181
30 (п = 68) 32,9 (6,0) 18,3 0,98 0,95-1,01 0,179
САД, мм рт.ст. (количественный) - - 0,99 0,99-1,00 0,104
140 (п = 107) 35,6 (5,0) 22,4 0,80 0,61-1,05 0,113
ДАД, мм рт.ст. (количественный) - - 0,99 0,98-1,00 0,086
90 (п = 57) 28,9 (6,3) 19,1 0,86 0,61-1,21 0,388
нет (п = 170) 38,1 (4,1) 25,5 1,00 - -
есть (п = 168) 24,3 (3,6) 13,1 1,37 1,06-1,77 0,015
нет (п = 261) 32,2 (3,1) 15,2 1,00 - -
есть (п = 77) 28,9 (5,8) 22,5 0,96 0,71-1,29 0,775
нет (п = 303) 30,6 (2,9) 17,2 1,00 - -
есть (п = 35) 38,0 (8,9) 23,0 0,97 0,64-1,47 0,898
правая (п = 163) 30,5 (3,9) 17,4 1,00 - -
левая (п = 175) 33,2 (3,9) 17,7 1,00 0,78-1,29 0,973
Окончание табл. 3
Показатель Параметры выживаемости и ОР
3-летняя выживаемость, % Ме ОР 95 % ДИ ОР ^-уровень
рТ1-Т2 (п = 26) 31,3 (10,8) 24,2 1,00 - -
рТ3а (п = 174) 27,0 (3,6) 16,0 1,53 0,90-2,59 0,114
рТ3Ь (п = 53) 27,3 (7,2) 13,3 1,48 0,81-2,72 0,204
рТ4 (п = 85) 42,8 (5,7) 26,5 1,05 0,60-1,83 0,871
рШ (п = 199) 36,6 (3,7) 21,9 1,00 - -
рШ-Ы2 (п = 139) 23,6 (4,1) 13,1 1,46 1,13-1,88 0,004
М0 (п = 114) 39,2 (4,9) 26,0 1,00 - -
М1 (п = 224) 27,4 (3,3) 14,6 1,29 0,99-1,69 0,063
отсутствуют (п = 114) 39,2 (4,9) 26,0 1,00 - -
единичные (п = 194) 28,3 (3,6) 15,5 1,24 0,94-1,63 0,133
множественные (п = 30) 21,1 (8,7) 7,8 1,87 1,15-3,04 0,011
нет (п = 114) 39,2 (4,9) 26,0 1,00 - -
легкие (п = 155) 26,4 (4,0) 13,7 1,30 0,97-1,74 0,082
печень (п = 16) 25,0 (10,8) 13,1 1,41 0,78-2,55 0,261
кости (п = 56) 20,9 (5,8) 13,6 1,66 1,16-2,39 0,006
головной мозг (п = 6) 50,0 (20,4) 1,3 1,53 0,56-4,21 0,408
контралатеральный надпочечник (п = 11) 28,3 (15,5) 10,4 1,28 0,59-2,78 0,536
другие органы (п = 14) 50,5 (14,8) 24,0 0,84 0,39-1,83 0,662
Размер опухоли (количественный) - - 1,01 0,99-1,04 0,369
Размер опухоли, см:
10,0 (п = 117) 31,5 (4,6) 13,7 1,2 0,88-1,65 0,249
G1—G2 (п = 181) 38,0 (3,9) 24,9 1,00 - -
Gз(п = 157) 23,7 (3,8) 9,5 1,78 1,38-2,30 нормы (п = 40) 22,1 (7,3) 9,3 1,54 1,07-2,22 0,020
нет (п = 177) 30,8 (3,6) 16,6 1,00 - -
иммунотерапия (п = 54) 29,6 (8,2) 14,3 1,05 0,72-1,55 0,792
ОГТ (п = 100) 33,8 (5,2) 19,5 0,85 0,64-1,14 0,280
радикальная (п = 120) 42,8 (4,9) 28,5 1,00 - -
паллиативная (п = 218) 25,0 (3,3) 13,4 1,59 1,21-2,08 30кг/м2 — наличие ожирения.
В результате моновариантного анализа установлено, что неблагоприятными факторами прогноза, статистически значимо связанными с увеличением риска смерти от РП являются:
♦ наличие множественных отдаленных метастазов, при котором риск умереть от основного заболевания в 1,87 раза (95 % ДИ 1,15-3,04;р = 0,011) выше, чем при отсутствии отдаленных метастазов, 3-летняя
Таблица 4. Результаты моновариантного анализа (лабораторные показатели)
Показатель Параметры выживаемости и ОР
(число пациентов) 3-летняя выживаемость, % (SE) Ме ОР 95 % ДИ ОР ^-уровень
Эритроциты, 1012/л - - 0,88 0,73-1,04 0,140
Эритроциты, 1012/л: 5,1 (п = 79) 25,0 (8,2) 31,1(3,3) 34,0 (6,0) 12,6 18,4 23,6 1,00 0,82 0,79 0,53-1,27 0,48-1,29 0,378 0,351
Гемоглобин, г/л - - 0,99 0,99-1,00 0,039
Гемоглобин, г/л: 116 (п = 232) 26,8 (4,7) 33,3(3,4) 14,1 19,5 1,00 0,91 0,69-1,19 0,497
Лейкоциты, 109/л - - 1,06 1,04-1,09 8,8 (п = 91) 33,9 (3,3) 24,6 (4,9) 18,9 14,4 1,00 1,23 0,94-1,63 0,134
Тромбоциты, 109/л - - 1,00 1,000-1,001 0,108
Тромбоциты, 109/л: 400 (п = 93) 35,1(3,3) 21,5 (4,7) 21,7 12,5 1,00 1,38 1,04-1,83 0,024
СОЭ, мм/ч - - 1,01 1,00-1,01 30 (п = 204) 39,8 (4,6) 25,7 (3,4) 25,3 12,8 1,00 1,53 1,18-1,99 0,002
Мочевина, ммоль/л - - 1,06 0,99-1,13 0,086
Мочевина, ммоль/л: 8,3 (п = 36) 31.8 (2,9) 27.9 (8,1) 17,9 14,6 1,00 1,22 0,82-1,79 0,327
Креатинин, мкмоль/л - - 1,01 1,01-1,02 110 (п = 42) 35,1 (3,3) 15,3 (6,8) 21,5 13,2 1,00 1,51 1,03-2,21 0,022
Билирубин, мкмоль/л - - 0,96 0,93-0,99 0,006
Билирубин, мкмоль/л: 20 (п = 20) 29,7 (2,8) 59,4 (12,2) 16,8 34,9 1,00 0,48 0,24-0,97 0,04
Общий белок, г/л - - 0,99 0,97-1,01 0,457
Общий белок, г/л: 65-85 (п = 301) 85 (п = 19) 31,6 (2,9) 23,8 (11,9) 35,5 (11,2) 17.7 12.8 25,6 1,00 1,30 0,86 0,69-2,46 0,51-1,46 0,419 0,582
СВ составляет 21,1 % (8,7 %) против 39,2 % (4,9 %) при М0 (р = 0,035);
♦ наличие метастазов в костях, повышающее риск в 1,66 раза (95 % ДИ 1,16-2,39; р = 0,006) по сравнению с риском при отсутствии отдаленных метастазов, 3-летняя СВ пациентов с метастазами в костях состав-
ляет 20,9 % (5,8 %) против 39,2 % (4,9 %) при М0 (р = 0,009);
♦ наличие поражения регионарных ЛУ, увеличивающее риск смерти от основного заболевания в 1,46 раза (95 % ДИ 1,13-1,88; р = 0,004) по сравнению с отсутствием поражения ЛУ, 3-летняя СВ -
23,6 % (4,1 %) против 36,6 % (3,7 %) при N0 (р = 0,004);
♦ низкая степень дифференцировки опухоли, при которой риск в 1,78 раза (95 % ДИ 1,38-2,30; р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
♦ характер операции: отсутствие возможности провести радикальную операцию увеличивает риск смерти для пациентов с IV стадией РП в 1,59 раза (95 % ДИ 1,21-2,08, р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Злокачественные опухоли почки составляют 2% всех злокачественных новообразований. Преимущественный возраст больных от 40 до 70 лет.

Более 85% злокачественных первичных опухолей почки составляет почечноклеточная аденокарцинома, исходящая из паренхимы почки (синонимы: почечноклеточный рак, светлоклеточный рак, гипернефроидный рак, гипернефрома, опухоль Гравитца).
Около 7% опухолей почки представлены переходно-клеточным раком лоханки, так же как и переходно-клеточным раком мочеточников, исходящим из эпителия, выстилающего коллекторную систему. В связи с биологическими особенностями переходно-клеточного рака почки, он рассматривается отдельно в конце настоящей главы.
Основным фактором прогноза при раке почки является стадия заболевания.
По системе TNM различают:
Т1 — опухоль почки ? 7 см.
Т2 — опухоль почки > 7см.
Т3 — опухоль, вовлекающая вены или надпочечники, или околопочечную клетчатку, не выходя за пределы фасции Герота.
Т3а — распространение на надпочечник или околопочечную клетчатку, не выходя за пределы фасции Герота.
Т3b — вовлечение в процесс v.renalis или v.cava ниже диафрагмы.
Т3с — вовлечение в процесс v.renalis или v.cava выше диафрагмы.
Т4 — опухоль распространяется за пределы фасции Герота.
N1 — метастазы в 1 лимфоузел.
N2 — метастазы более чем в 1 лимфоузел.
Группировка рака почки по стадиям
Выживаемость больных зависит от стадии в момент установления диагноза: 10-летняя выживаемость при I стадии более 80%, при IV стадии медиана выживаемости менее 1 года. Продолжительность жизни большинства неоперированных больных с опухолью почки с момента появления первых симптомов составляет 1-3 года, но известны единичные случаи индолентного течения болезни, когда пациенты живут 5 лет и более. Длительное выживание наблюдается в ряде случаев после хирургического удаления первичной опухоли и единичных отдаленных метастатических узлов.
Единственным радикальным методом лечения опухоли почки является нефрэктомия. Резекция может использоваться при двустороннем поражении, чтобы избежать диализа или трансплантации.
Аденокарцинома почки и ее метастазы малочувствительны к лучевому лечению. Однако его используют с паллиативной целью для местного контроля и снятия болевого синдрома при костных поражениях, иногда — при метастазах в головной мозг.
Рак почки — одна из наиболее устойчивых к химиотерапии опухолей. Эффективность таких препаратов как ломустин (CCNU), фторбензотеф, блеомицин, винбластин, винкристин, цисплатин, этопозид, доксорубицин, гидроксимочевина, циклофосфамид, метотрексат, незначительна. Комбинированная химиотерапия при раке почки так же малоэффективна (до 10%).
При генерализованных процессах традиционно используются прогестины, антиэстрогены, антиандрогены, однако эффективность гормонотерапии минимальна.
В настоящее время стандартным лечением при метастазах рака почки следует считать использование ИФН-a, дающее до 15% полных чисел или частичных ремиссий. Регрессиям подвергаются, как правило, единичные, небольших размеров метастазы в легкие. Эффект от применения ИФН может иногда проявляться через несколько месяцев после начала терапии. Лечение необходимо проводить постоянно, не прерывая его и после достижения ремиссии. Препараты ИФН вводят в дозах от 6 до 20 млн ед.; они вызывают такие побочные эффекты как гипертермия, боль в мышцах, иногда — снижение массы тела. По эффективности с ИФН при метастазах рака почки может конкурировать лишь ИЛ-2 (пролейкин), который обладает выраженными побочными эффектами, однако является терапией 1-й линии.
Окончательно оптимальные дозы и режимы введения ИЛ-2 не установлены. Существуют режимы высоких и низких доз (см. ниже). ВХТ более эффективна, но и более токсична.
Лечение ИЛ-2 в сочетании с ИФН-a не показало лучшие результаты, чем применение только высоких доз ИЛ-2.
Используемые терапевтические режимы
Алдезлейкин (Пролейкин) — 9-18х106 ед. п/к 3-5 раз в неделю в течение 4-6 нед., затем 2-3-недельный перерыв (амбулаторный режим).
Пролейкин — 600 000 — 720 000 МЕ/кг в/в в течение 15 мин. каждые 8 часов в течение 5 дней. Перерыв 7-10 дней, затем повторный курс (стационарный режим).
Реаферон (ИФН-a) — 3 млн ЕД в/м ежедневно в течение 10-14 дней. Интервал между курсами 3 нед.
Интрон А (ИФН-a2b) — 6 млн ЕД/м2 п/к 3 раза в неделю или в том же режиме как Реаферон.
Почечноклеточный рак (ПКР)
ПКР происходит из клеток проксимальных канальцев. К моменту диагноза у 25% больных опухоль носит местнораспространенный характер, а у 20% имеются метастазы. Метастазы ПКР у 75% больных локализуются в легких, у 36% — в ЛУ и/или в мягких тканях, у 26% — в костях, у 18% — в печени и у 0,05), 2 года — соотв. 32% и 16% (р
Почечно-клеточный рак занимает 3-е место по заболеваемости среди злокачественных новообразований мочеполовой системы после опухолей предстательной железы и мочевого пузыря.
Согласно статистике Американского общества рака (АОР) почечно-клеточный рак (ПКР) и рак лоханки занимают 10-е место среди причин смерти в США. В 2008 г. АОР зарегистрировало 54 390 новых случаев заболевания ПКР и раком лоханки и 13 010 смертей.
Заболеваемость почечно-клеточным раком увеличивается в среднем на 2% в год.
В Европе выявляют около 40 тыс. новых случаев заболевания ПКР, что приводит к 20 тыс. ожидаемых смертей. В 2008 г. в России зарегистрировали 17 563 больных почечно-клеточным раком, при этом смертность достигла 8370 человек. По темпам прироста онкологической заболеваемости в России почечно-клеточным раком устойчиво занимает 2-е место после рака предстательной железы (41,35%).
ПКР относят к агрессивным злокачественным опухолям. При первичном обращении у 25-30% первичных больных выявляют отдаленные метастазы, а у большинства (70-80%) больных диагностируют локализованный ПКР, однако у 20-50% из них впоследствии отмечают метастазы. Медиана общей выживаемости больных метастатическим ПКР составляет 13 мес, а ожидаемая 5-летняя выживаемость — менее 20%. Наиболее часто метастатические очаги выявляют в легких (55%), лимфатических узлах (34%), костях (32%), печени (32%), надпочечниках (19%), контралатеральной почке (11%) и головном мозге (5,7%).
Как известно, почечно-клеточный рак нечувствителен к лучевой терапии, химиотерапии и гормонотерапии. Применение гормональных и химиопрепаратов не приводит к улучшению результатов лечения, и общий ответ составляет менее 5%. Лучевую терапию используют только у больных ПКР с нерезектабельными метастазами в головной мозг или для снижения болевого синдрома, обусловленного костными метастазами.
Возможность возникновения спонтанных регрессий и стабилизации позволила отнести ПКР к разряду иммуногенных и предопределила развитие иммунотерапевтического направления в качестве основного лечебного подхода у больных диссеминированным ПКР. Иммунотерапия на протяжении почти двух последних десятилетий прочно занимала ведущие позиции в лечении метастатического ПКР.
В настоящее время накоплен достаточный опыт применения препаратов интерферона а2 (ИНФ-а) и интерлейкин (ИЛ)-2 как в монорежиме или в сочетании друг с другом, так и в комбинации с различными химио- и гормонопрепаратами. Суммарный ответ на иммунотерапию колеблется от 10 до 20%. К основным недостаткам иммунотерапии цитокинами относят нестойкий эффект лечения и высокую частоту побочных реакций. По данным большинства исследований, иммунотерапия цитокинами эффективна только у строго отобранных групп больных.
В клинических исследованиях с применением цитокинов выявлен ряд прогностических факторов, оказывающих влияние на результаты лечения и выживаемость больных ПКР. Одной из наиболее известных является модель Memorial Sloan-Kettering Cancer Center (MSKCC), открытая R. Motzer и соавт. на основании результатов исследования, которое включало 670 пациентов с диссеминированным почечно-клеточным раком; на основании многофакторного анализа выделили пять независимых неблагоприятных прогностических факторов, к которым отнесли соматический статус по шкале Карновского 1,5 раза нормы уровня лактатдегидрогеназы (ЛДГ), высокую концентрацию скорректированного кальция в сыворотке крови (>10 мг/дл), уровень гемоглобина
Наиболее часто приходится дифференцировать опухоль от солитарной кисты почки, тем более что оба заболевания иногда сочетаются. В дифференциальной диагностике опухоли и кисты почки может оказать помощь нефротомография, при которой опухоль почки контрастируется, а киста отличается пониженной контрастн.
При осмотре и пальпации выявляются обычно опухоли почки в далеко зашедшей стадии. О большой опухоли почки свидетельствует деформация живота. Осмотр может выявить варикоцеле, а при обструкции нижней полой вены — расширение вен передней брюшной стенки, отечность нижних конечностей.
Поскольку опухоли почечной паренхимы и опухоли лоханки во многом отличаются как по структуре, так и по путям распространения и требуют различных оперативных методов лечения, оправданно их выделение в отдельные группы. В настоящее время принята следующая классификация опухолей почки.
Опухолевые заболевания почки разделяются на доброкачественные и злокачественные. Почечно-клеточный рак возникает из проксимального изогнутого канальца нефрона, является самым частым видом опухоли почки и составляет около 3% в структуре всех злокачественных заболеваний. Частота заболеваемости ежегодн.
Эпителиальные опухоли почечной лоханки и мочеточника представляют собой особую группу новообразований, значительно отличающихся от опухолей паренхимы почки как по клиническому течению, так и по методам лечения. Опухоли лоханки встречаются гораздо реже, чем опухоли почечной паренхимы, составляя приме.
Опухоль Вильмса встречается у детей любого возраста, начиная с новорожденного, но наиболее часто — в возрасте 2—7 лет. Девочки и мальчики заболевают с одинаковой частотой. У 5% больных опухоль Вильмса бывает двусторонней, как правило, у детей раннего возраста. Нередко у ребенка диагностируется.
В диагностике заболеваний почек, предстательной железы, яичка и его придатка, а также семенного пузырька нередко решающее значение приобретает пункционная биопсия. Пункционная биопсия почки может быть открытой и закрытой. Открытую биопсию почки производят при ее обнажении во время операции или специ.
21 октября 2016
- 7652
- 6,2
- 0
- 0
Первый опыт осознанного применения иммунотерапии при саркоме кости приведен в Annals of Surgery 1891 года. Для выяснения молекулярных основ противоопухолевого иммунитета ученым понадобилось более 100 лет.
![]()
Алла Солодова
![]()
Антон Чугунов![]()
Ольга Волкова

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
От иммунотерапии к иммунотерапии!
В 2004 году Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA) назвало появление препаратов, подавляющих формирование кровеносных сосудов новым видом лечения [4], который и обозначил новую эру в лечении рака почки [5].
Когда же опухоль перестает реагировать на терапию первой линии, то лечение направляется на подавление мишени рапамицина (mammalian target of rapamycin, mTOR), которая регулирует клеточный рост и апоптоз. Но и оно в сравнении с плацебо дает преимущество в выживаемости без прогрессирования всего 3 мес. [6]! И лишь за неимением лучшего ингибитор мишени рапамицина (эверолимус) с 2009 года оставался стандартом лечения во второй линии — то есть после прогрессирования в первой линии.
Однако в текущем году эверолимус уступил свои позиции — теперь стандартом лечения во второй линии признана иммунотерапия. Но не такая, с которой начиналась попытка лечить рак почки, а принципиально новая — направленная на тонкое и чуткое моделирование естественной противораковой защиты организма. Препарат, о котором пойдет речь далее, называется ниволумаб.
Иммунотерапия по-новому
Большинство из нас живут с опухолями различных органов, но без каких-либо признаков болезни. И один из механизмов, посредством которого рак убивает, — это ускользание от иммунитета.
Поэтому блокада сигнальных путей, которые помогают опухоли прятаться [8], — это и есть современная иммунотерапия, в корне отличающаяся от массированного стимулирования интерферонами и/или интерлейкинами, описанного выше.
Всего пару лет назад о препаратах, прерывающих взаимодействия между этими рецепторами и их лигандами говорили в будущем времени [8]. Теперь они одобрены FDA для лечения злокачественных опухолей: ипилимумаб (ингибитор CTLA-4) показан при диссеминированной меланоме, а пембролизумаб (ингибитор PD-1) — для терапии немелкоклеточного рака легкого. Еще один ингибитор PD-1 — ниволумаб, ранее зарегистрированный FDA для лечения диссеминированной меланомы, в 2015 г. по результатам исследования CheckMate 025 получил новое показание — применение после антиангиогенной терапии при мПКР [15].
Каков механизм действия ниволумаба? Он связывается с PD-1-рецептором на поверхности T-клеток. В отсутствии ниволумаба PD-1-рецептор взаимодействует со своим лигандом — PD-L1, что приводит к снижению темпов пролиферации T-лимфоцитов, продукции цитокинов и цитотоксической активности. Однако в присутствии ниволумаба взаимодействия не происходит, иммунные реакции не подавляются, и T-лимфоциты вступают в борьбу с опухолевыми клетками (рис. 1).

На ежегодном конгрессе Европейского общества медицинской онкологии (ESMO) в 2015 г. было отмечено преимущество ниволумаба по сравнению с эверолимусом: медиана общей выживаемости (ОВ) составила 25 и 19,6 мес. соответственно. Более того, при применении ниволумаба регресс болезни наблюдался в пять раз чаще! Именно после обнародования этих данных ниволумаб получил приоритетный статус и прошел ускоренную процедуру одобрения FDA для применения при метастатическом раке почки.
В январе 2016 года на конгрессе Американского общества клинической онкологии (ASCO) представлены обновленные данные CheckMate 025 [16]. Помимо подтверждения преимущества ниволумаба в общей популяции больных, показана необходимость его применении у пациентов с неблагоприятным прогнозом: общая выживаемость выше в два раза, чем при применении эверолимуса.
Сто лет ожидания
Сложности иммунотерапии
В литературе описаны случаи полного ответа, длившегося более двух лет после прекращения лечения ниволумабом [22]. Так же врачи могут наблюдать отсроченный терапевтический эффект после кажущегося прогрессирования заболевания.
Стоит также отметить, что уровень лиганда определяется иммуногистохимическими методами: отличия антител и разница в техниках окраски приводят к тому, что заключения двух исследователей по одной и той же ткани могут существенно различаться [23]. Поэтому поиски предикторов ответа на иммунотерапию продолжаются. При этом вполне возможно, что пересмотр тех же образцов может дать другие результаты, — обращают внимание эксперты, обсуждая отсутствие связи с экспрессией PD-L1.
Ниволумаб уже включен в рекомендации профессиональных ассоциаций. По мнению экспертов, единственным сдерживающим фактором применения иммунотерапии остается только стоимость — более $10 000 за месячный курс.
Иммуноредактирование
Здоровая иммунная система не позволяет опухоли стать клинически значимой. Способность иммунитета контролировать опухоль — иммуноредактирование — это результат трех процессов, которые происходят одновременно или последовательно:
- элиминация (elimination) — иммунологический надзор, при котором в естественных условиях опухолевые клетки успешно ликвидируются иммунитетом как внешним супрессором;
- равновесие (equilibrium) — иммунный контроль над ростом и размножением трансформированных клеток;
- ускользание (escape) — формирование клеточных вариантов со сниженной иммуногенностью или способностью ослаблять иммунологический ответ.
Читайте также:




