Макрофаги и раковые клетки

Схема эксперимента, в котором выясняют механизм влияния нового препарата на взаимодействие опухолевых клеток и макрофагов. Мышам внутрибрюшинно вводят раковые клетки, а через три дня вкалывают связанные с опухолью макрофаги и либо дают мышам лекарство, либо нет. Через 45 дней опухоль вырезают для исследования
Mingzhu Yin et al. / Nature Communications, 2020
Ученые разработали вещество, которое ингибирует белки группы BET и подавляет развитие раковых опухолей различного типа эффективнее, чем аналоги, которые проходят клинические испытания. Препарат не только напрямую подавляет рост раковых клеток, но и не дает тем вербовать связанные с опухолью макрофаги. Исследователи выяснили молекулярный механизм влияния ингибиторов BET на это взаимодействие. Статья опубликована в журнале Nature Communications.
Эпигенетические взаимодействия играют важную роль в развитии различных типов рака, поэтому многие способы терапии направлены на подавление этих механизмов. В частности, нарушения в работе белков группы BET связаны с раком. Эти молекулы узнают ацетилированные гистоны, садятся на них и участвуют в регуляции транскрипции ДНК. Особенно много белков BET в супер-энхансерах, которые запускают производство факторов, важных для развития рака.
Существует ряд ингибиторов BET, в частности, белка BRD4, эффективных против рака в животных моделях. Однако в клинических испытаниях действенность препаратов оказалась не столь высокой. Исследователи пытаются улучшить вещества, но пока не удалось разработать лекарство, которое было бы высоко эффективным и доступным для орального приема.
Другая мишень терапий рака — связанные с опухолью макрофаги, иммунные клетки, которые в большом количестве находят в опухолевых тканях. При попадании в опухоль эти клетки перестраиваются и помогают раковым клеткам развиваться, запускают рост сосудов и подавляют иммунитет.
Группа ученых из Китая и США под руководством Цинь Янь (Qin Yan) из Йельской школы медицины модифицировала один из хорошо проявивших себя в клинических испытаниях ингибитор BRD4 и повысила его эффективность. Лучшим из полученных экземпляров оказалось вещество под названием NHWD-870. Его действие проверили на клеточных культурах различных типов опухолей.
Затем изучили фармакокинетику препарата при его оральном введении мышам и крысам. Препарат также протестировали на мышиных моделях девяти различных опухолей, включая рак легкого, яичника и молочной железы, лимфому и меланому.
NHWD-870 оказался в 3 раза эффективнее, чем его предшественник, и в 50 раз — чем JQ1, стандартный ингибитор BET. Он подавлял экспрессию BRD4 и протоонкогена c-MYC в культуре опухолевых клеток, что приводило к их гибели.

Культуры клеток различных опухолей. Слева - контроль, посередине - с JQ1, справа - с NHWD-870
Mingzhu Yin et al. / Nature Communications, 2020
Неоднозначность ответа на рост злокачественно трансформированных клеток присуща также различным фагоцитирующим клеткам, в частности макрофагам, моноцитам и нейтрофилам.
В этом плане наиболее изучены клетки моноцитарно-макрофагального ряда, а их способность усиливать опухолевую прогрессию известна достаточно давно.
Однако подобно тому, как это имело место в отношении CD4+- и СD8+Т-лимфоцитов, от констатации способности фагоцитирующих клеток усиливать рост опухоли до выяснения механизмов этого процесса прошло достаточно много времени.
Несмотря на то что работ, посвященных выяснению механизма усиления роста опухоли фагоцитирующими клетками, сравнительно немного и основная часть их появилась преимущественно в последние годы, представляется возможным обсуждать различные механизмы, с помощью которых осуществляется это усиление.
К ним, в первую очередь, относятся:
1) индукция воспаления, которое, как известно, может быть фактором риска развития опухоли;
2) усиление ангиогенеза;
3) выделение супрессирующих цитокинов и других факторов, усиливающих рост опухоли;
4) трансформация клеток, способных участвовать в стимуляции роста опухоли в определенный фенотип.
Макрофаги, моноциты
Как отмечено выше, макрофаги так же, как и другие фагоцитирующие клетки, особенно нейтрофилы, участвуют в реализации различных воспалительных реакций. Несмотря на то что определенный уровень интенсивности воспаления во многих случаях — реакция адаптации, в последнее время все чаще и чаще появляются данные о том, что воспаление — фактор риска развития опухоли.
В настоящее время появилась возможность рассматривать молекулярные и клеточные основы воспаления и те его компоненты, которые могут способствовать развитию опухоли.
Продукты, выделяемые указанными клетками в процессе воспаления, в частности реактивные кислородные радикалы, простагландины, лейкотриены, различные ростовые факторы и другие биологически активные вещества, могут приводить к повреждению передачи сигнала трансдукции пролиферирующим клеткам и способствовать развитию опухоли. Более того, высказывается точка зрения, что макрофаги могут быть необходимы для развития опухоли.
При изучении роли макрофагов в опухолевом процессе, как отмечено ранее, преимущественно использовались макрофаги, инфильтрирующие опухоль, что обусловлено вполне понятными причинами.
Согласно современным представлениям, макрофаги, которые проходят сложный путь от циркуляции в кровяном русле до инфильтрации опухоли и непосредственно взаимодействуют с опухолевыми клетками, — очень важный информативный объект изучения взаимодействия с опухолевыми клетками.
Функции макрофагов, инфильтрирующих опухоль, прямо зависят от микроокружения, включая цитокины и гипоксию. Поэтому в высшей степени обоснована необходимость выяснения особенностей функционального состояния, фенотипа макрофагов и молекулярных основ, которые определяют этот фенотип.
Возможное сочетание инфильтрации опухоли макрофагами и плохого прогноза зависит от ряда причин. К их числу относится способность макрофагов продуцировать цитокины, которые участвуют в стимуляции роста опухоли, усиливая прежде всего ангиогенез и воспаление.
При исследовании биопсийного материала рака молочной железы и кишечника наблюдалась экспрессия мРНК VEGF-A и VEGF-C, но не VEGF-E или VEGF-D макрофагами, которые при добавлении опухолевых клеток в культуру, содержащую и полиморфноядерные клетки, начинали секретировать VEGF.
В системе in vivo отмечено, что продукция VEGF, усиление ангиогенеза и инфильтрация макрофагами ассоциируется с усилением роста опухоли, а также значительным увеличением количества антител против опухолеассоциированных антигенов.
Наличие таких клеток, как тучные и макрофаги, участвующих в воспалении, наблюдалось при аденокарциноме поджелудочной железы. Эти клетки в значительно большем, чем в нормальных тканях, количестве находились в участках роста опухоли и метастазов в лимфатические узлы, экспрессировали VEGF-A, VEGF-C и EGFP (во многих случаях эти цитокины экспрессировали и опухолевые клетки).
Поскольку авторы исследований наблюдали экспрессию указанных цитокинов и инфильтрацию моноцитами, макрофагами и при хроническом панкреатите, они отметили, что при хроническом панкреатите также происходит инфильтрация этими клетками. По их мнению, это создает благоприятный фон для перехода в злокачественное новообразование.
Роль макрофагов в развитии гепатоцеллюлярной карциномы констатируют и другие авторы, которые наблюдали продукцию VEGF макрофагами и эндотелиальными клетками, активацию тромбоцитов тканевым фактором, что сочеталось с аномальным ангиогенезом, в частности артериализацией печеночных синусоидов.
Однако продукция макрофагами не только VEGF, но и других цитокинов способствует ангиогенезу. При исследовании макрофагов, инфильтрирующих карциному пищевода, было показано, что их взаимодействие с опухолевыми клетками приводит к продукции такого хемоаттрактанта, как МСР-1 и экспрессии рецептора CCR-2.
В этих условиях опухолевые клетки также секретировали VEGF, а уровень инвазии, неоваскуляризации и количество макрофагов были существенно выше в МСР-1-положительных опухолях. Авторы пришли к заключению, что МСР-1, продуцируемый макрофагами, может играть роль в прогрессии карциномы пищевода.
Активная инфильтрация макрофагами наблюдается и в строме, что установлено при изучении образцов немелкоклеточного рака легкого. В этих случаях инфильтрация макрофагами сочеталась с инфильтрацией лимфоцитами.
Многие макрофаги продуцировали IL-1в, IL-la, TL-6, TNFa и TGFP, однако уровень их продукции был незначительным при высоком уровне PDGF. Важный факт, установленный в этих исследованиях, состоит в том, что лимфоциты инфильтрирующие опухоль (ЛИО) проявляли слабую способность к цитотоксичности, и это было связано не только с тем, что опухолевые клетки экспрессировали низкий уровень антигенов I класса главного комплекса гистосовместимости (ГКГ), но и с тем, что низкий уровень продукции цитокинов макрофагами ограничивал цитотоксичность цитотоксических лимфоцитов (ЦТЛ).
Наряду с этим инфильтрация макрофагами способствовала опухолевой прогрессии, влияя на строму и ангиогенез, что в основном, как уже указывалось, было связано с выделением PDGF и происходило на фоне выделения опухолевыми клетками TGFв.
Зависимость между инфильтрацией макрофагами и микроциркуляцией изучали и при увеальной меланоме, которая, как известно, характеризуется быстрым метастазированием в печень.
При исследовании образцов метастазов выявлено, что они имеют значительно более низкий уровень пигментации, большее число эпителиоидных клеток, СD68-положительных макрофагов и высокую плотность васкуляризации по сравнению с первичными меланомами.
Отмечено, что наличие эпителиоидных клеток и плотность васкуляризации увеличиваются при переходе в метастазы параллельно с усилением пигментации и инфильтрацией макрофагами, что изменяет морфологический тип опухоли.
Эти новые данные раскрывают еще один важный аспект — наличие макрофагов, инфильтрирующих опухоль, связано не только с ангиогенезом, но и с формированием определенного морфологического типа опухоли.
Зависимость образования микрососудов от инфильтрации макрофагами изучали также при доброкачественных лимфоаденопатиях и неходжкинских лимфомах. На основании иммуногистохимических и электронно-микроскопических исследований удалось установить связь между образованием микрососудов и наличием макрофагов — факт, который подтверждает, что при неходжкинских лимфомах, как и при различных солидных опухолях, макрофаги способствуют усилению ангиогенеза, что приводит к прогрессии роста опухоли.
Как уже отмечено, одним из механизмов участия макрофагов в стимуляции роста опухоли является их способность выделять различные факторы. В частности, макрофаги могут способствовать усилению выделения клетками меланомы фактора ингибиторной активности меланомы (melanioma inhibitiry activity — MIA), который ингибирует фиксацию клеток меланомы к экстрацеллюлярному матриксу, усиливая инвазию.
При изучении клеток меланомы сосудистой оболочки глаза линии HUMCL в системах in vitro показано, что действительно макрофаги секретируют факторы, которые могут стимулировать клетки меланомы к усилению продукции MIA.
Известно, что моноциты и макрофаги — клетки, которые могут активно взаимодействовать с другими типами клеток. Такая способность необходима для поддержания нормального иммунологического гомеостаза. К сожалению, в условиях роста опухоли эти межклеточные взаимодействия могут приводить к противоположному эффекту — усилению ее роста.
В частности, в опытах с перевивной рабдомиосаркомой показано, что по мере развития опухоли начинает формироваться опухолеассоциированная супрессия, которая достигает максимума на этапе наиболее выраженного роста опухоли. Исследования, направленные на выяснение вопроса, какие же клетки формируют эту супрессию, показали, что ее морфологическую основу составляют макрофаг-лимфоцитарные агрегаты.
Это было подтверждено опытами с адоптивным переносом таких макрофаг-лимфоцитарных агрегатов, которые способствовали выраженному усилению роста опухоли после перевивки опухолевых клеток интактным животным. В последующем были получены данные о том, что макрофаги способны образовывать конъюгаты с Т-лимфоцитами при участии антител или иммунных комплексов.
В свете этих данных вызывает большой интерес новая информация о том, что опухолевые клетки могут образовывать конъюгаты с макрофагами, инфильтрирующими опухоль, и эта форма взаимодействия играет роль в опухолевой прогрессии и инвазии.
Соответствующие данные были получены при исследовании клеток молочной железы, которые экспрессируют эндотелины (ЕТ-1, ЕТ-2 и ЕТ-3) и их рецепторы (ET-RA и ET-RB), что способствует усилению хемотаксиса опухолевых клеток. Этот процесс взаимодействия опухолевых клеток и макрофагов сопровождается увеличением продукции макрофагами ММП-2 и ММП-9 и усилением инвазии.
Взаимодействие макрофагов с другими клетками
Взаимодействие макрофагов с другими клетками, в частности гранулоцитами, также может способствовать инвазии и метастазированию, что происходит на фоне деградации матрикса и усиления ангиогенеза. В опытах, в которых были созданы соответствующие условия, установлено, что в этом взаимодействии существенную роль играет появление иммунных комплексов, которые также способствуют усилению деградации матрикса и ангиогенеза.
Представления о способности макрофагов участвовать в усилении роста опухоли расширяются благодаря информации о том, что макрофаги, инфильтрирующие опухоль, могут вызывать апоптоз Т-клеток, что приводит к элиминации активированных специфических Т-лимфоцитов внутри опухоли.
Такие данные получены на моделях различных опухолей мышей, при этом отмечено, что инфильтрирующие опухоль макрофаги выделяют TNFa, экспрессируют I и II типы рецепторов TNF и при контакте с ЦТЛ индуцируют выделение IFNy, продукцию NO. Киллинг Т-лимфоцитов мог быть блокирован in vitro антителами против IFNy, TNFa и указанных рецепторов.
При изменении условий эксперимента (использование мышей, дефицитных по рецепторам TNF) не наблюдали ни апоптоза, ни продукции NO. Механизм апоптотического действия не был связан с системой Fas/FasL, так как применение соответствующих антител не влияло на макрофагозависимый лизис Т-лимфоцитов.
Не меньший интерес представляют данные о том, что супернатанты макрофагов, добавленные в культуру опухолевых клеток человека и мышей, активно усиливают пролиферацию, интенсивность которой не изменяется после удаления супернатантов и добавления свежей среды — факт, который нуждается в дальнейшем изучении. На рис. 65 представлены пути включения макрофагов в стимуляцию роста опухоли.

Рис. 65. Пути участия макрофагов в стимуляции роста опухоли при их взаимодействии с опухолевыми клетками
Несмотря на приведенную информацию, имеются отдельные сообщения, авторы которых оставляют открытым вопрос о возможности участия макрофагов в усилении роста опухоли. Такой точки зрения придерживаются исследователи, изучавшие роль макрофагов на моделях опухолей головного мозга, в частности глиомы и астроцитомы, активно инфильтрируемых макрофагами.
На модели астроцитомы, индуцированной клетками линии CNS-1, показано, что клетки этой опухоли активно продуцируют хемоаттрактант клеток моноцито-макрофагального ряда — МСР-1, постоянно экспрессируют TGFp, а в опухолях in vivo было выявлено большое количество различных цитокинов (IL-la, IL-lв, TNFa, TNFp, IL-10, IFNy).
Констатация того, что клетки астроцитомы могут продуцировать хемотаксические факторы, свидетельствует, что они способны привлекать макрофаги в участки развития опухоли. Однако, по мнению авторов, роль макрофагов в усилении роста опухоли нуждается в дальнейшем изучении.
В связи с нередким сочетанием плохого прогноза с инфильтрацией опухоли макрофагами, продуцирующими хемоаттрактанты, можно понять попытки новых подходов к терапии.
Один из них — применение антагонистов рецепторов хемокинов и его перспективность продемонстрирована на модели рака молочной железы мышей, клетки которой активно продуцируют RANTES, инфильтрированы макрофагами и лейкоцитами, экспрессирующими рецепторы для этих хемокинов. Примение указанного антагониста замедляло развитие опухоли и снижало уровень инфильтрации макрофагами.
Предположение о том, что не все макрофаги, а лишь их определенный клон, могут способствовать инвазии и прогрессии опухоли, начинает получать подтверждение. На модели рака мочевого пузыря установлено, что макрофаги, инфильтрирующие опухоль, продуцируют домен эндотелиального белка (endothelial Per-ARNT-Sim domen protein-1 — EPAS-1), который индуцирует гипоксию и трансактивацию генов, включающихся в ангиогенез и метаболизм.
Авторы показали, что не все инфильтрирующие макрофаги, а лишь их небольшая часть экспрессируют EPAS-1 и именно эти клетки способствуют прогрессии рака мочевого пузыря.
Из этого следует, что при инвазивном раке мочевого пузыря оценка не общего количества инфильтрирующих макрофагов, а лишь определенной их части может быть важна для прогностического значения; появление ERAS-1-положительных макрофагов было связано с уменьшением выживаемости.
Реальность того, что макрофаги, инфильтрирующие опухоль, представлены различными субпопуляциями, подтверждается данными изучения многих опухолей. Проведенные исследования свидетельствуют, что опухолевое микроокружение (опыты in vitro) существенно влияет на дифференцировку и активацию макрофагов, культивируемых с опухолевыми клетками.
В результате культивирования изменяются фенотип макрофагов, их активность; такие макрофаги характеризуются низкой экспрессией дифференцировочных антигенов и признаками постоянной активации.
Поскольку не только в различных опухолях, но и в пределах одной и той же опухоли разные ее участки могут иметь и разное микроокружение, становится вполне реальным наличие в опухоли макрофагов с разным фенотипом и различным влиянием на рост опухоли.
Неоднозначная роль макрофагов в опухолевом процессе объясняется и новыми фактами на уровне генетической регуляции. Так, имеется доказательство того, что гибриды, полученные от генетически близких макрофагов и слабоиммуногенных клеток меланомы линии S91, обладают различным метастатическим потенциалом — от слабого до высокого.
Сравнение экспрессии генов, ассоциированных с метастазами, гибридными клетками, с родственными клетками меланомы и нормальными макрофагами показало выраженные различия в экспрессии генов: в одних случаях наблюдалось усиление, в других — ослабление. Такую гибридную модель авторы рассматривают как уникальную для изучения генов, формирующих метастатический фенотип.
В свете изложенных данных и учитывая различные точки зрения не должна вызывать удивления постановка вопроса о том, что макрофаги, инфильтрирующие опухоли, необходимы для ее развития, прежде всего в связи с продукцией хемоаттрактантов.
В опытах, проведенных на мышах, дефицитных по макрофагам, показано, что их отсутствие не влияет ни на частоту возникновения, ни на характер роста первичных опухолей, но снижает уровень прогрессии и ингибирует метастазирование.
Понять эти данные могут помочь представления о функциях макрофагов, в частности их участии в воспалении, ремоделировании матрикса, ангиогенезе, продукции различных факторов.
Все эти функции макрофаги реализуют при воспалении, а это предполагает, что воспаление, индуцированное острой или персистирующей инфекцией, а также другими факторами, может быть важным в генезе и усилении роста опухолей.
Понимание причин участия макрофагальных клеток в стимуляции роста опухоли довольно сложно, так как в отличие от CD4+- и СD8+Т-лимфоцитов, среди которых выделены фенотипы клеток с выраженным супрессорным действием, утверждать, что такие клоны есть в общей популяции макрофагов, в настоящее время нет достаточных оснований.
Можно предполагать возможность трансформации макрофагов в клон клеток, обладающих способностью усиливать рост опухоли, однако еще неясно, какие условия этому способствуют и какими свойствами характеризуются эти клетки. Весьма реальны предположения, высказываемые A. Mantovani и соавторами, согласно которым в ответ на различные сигналы, поступающие из окружающей среды, макрофаги могут реализовывать разные программы.
Соответственно этим программам может происходить поляризация макрофагов на I и II типы — процесс, который происходит с участием цитокинов, выделяемых Т-лимфоцитами и опухолевыми клетками.
С использованием мышей, у которых преобладают активности Тh1- или Тh2-лимфоцитов, показано, что у мышей с выраженным ответом Тh1-лимфоцитов преобладают макрофаги М1, которые характеризуются преимущественно секрецией NO, а при преобладании активности Тh2-лимфоцитов — макрофаги М2, отличающиеся преимущественно продукцией TGFp.
В такой поляризации макрофагов центральная роль принадлежит IL-2. Макрофаги I типа способны повышать экспрессию В7.1 и В7.2, в то время как М2 ослабляют экспрессию этих ко-стимулирующих молекул.
Опухолевые клетки при их взаимодействии с макрофагами могут по-разному влиять на функции последних благодаря выделению различных молекул с регуляторной активностью. Одно из проявлений такого влияния — деактивация функций макрофагов и последующее ослабление противоопухолевой защиты.
Изложенные данные, показывают, что макрофаги, наряду с активным участием в противоопухолевой защите (соответствующие факты представлены выше), способны стимулировать рост опухоли. Такое их действие, которое некоторые авторы склонны называть парадоксальным, нуждается в ответе на вопрос, чем же определяется неоднозначность действия макрофагов.
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
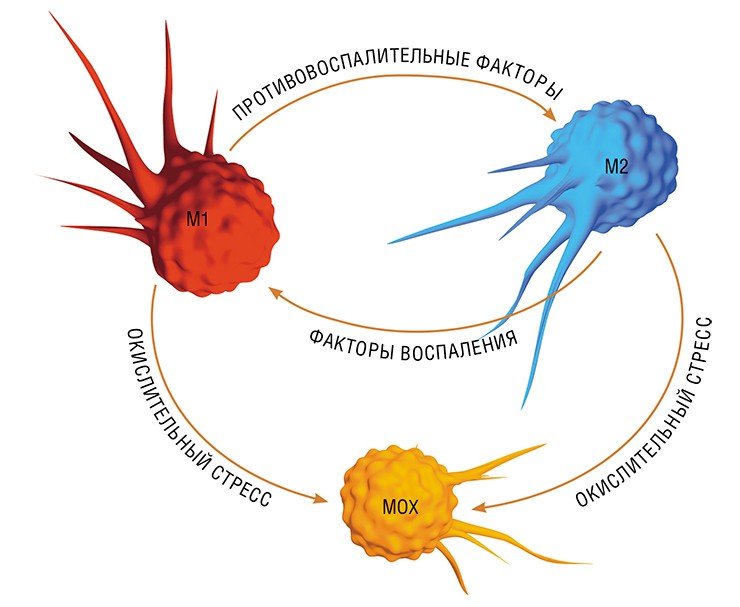
Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
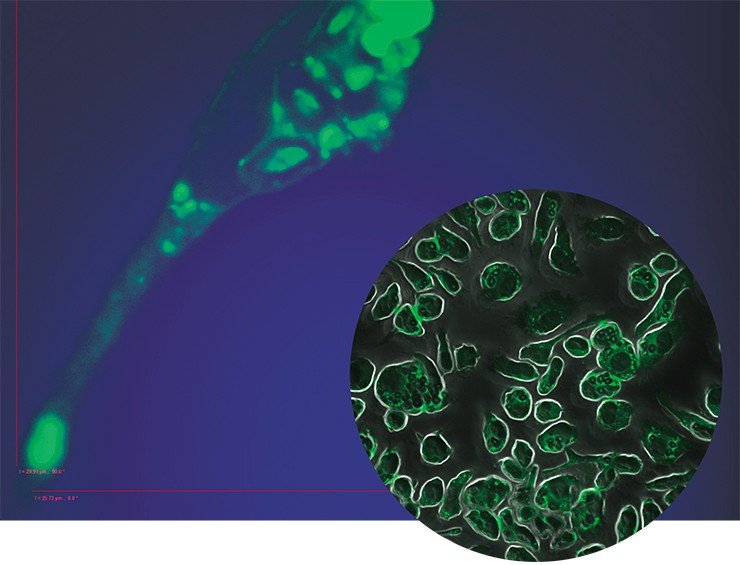
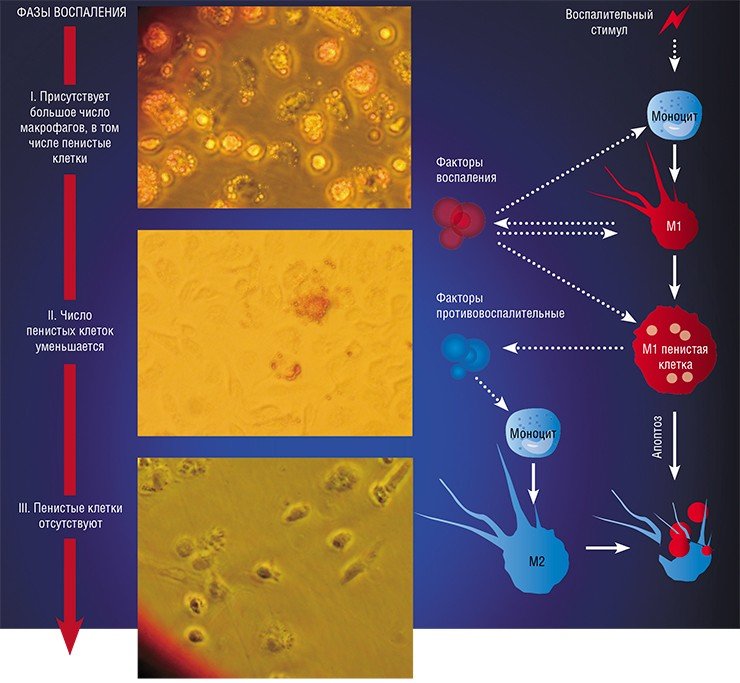
Пенистый камикадзе
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
Фармакологическая мишень
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
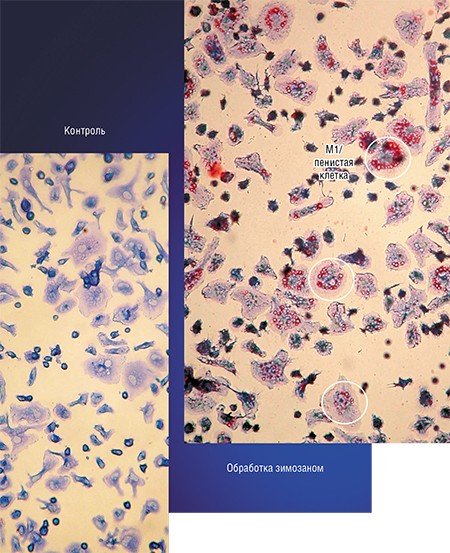
Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
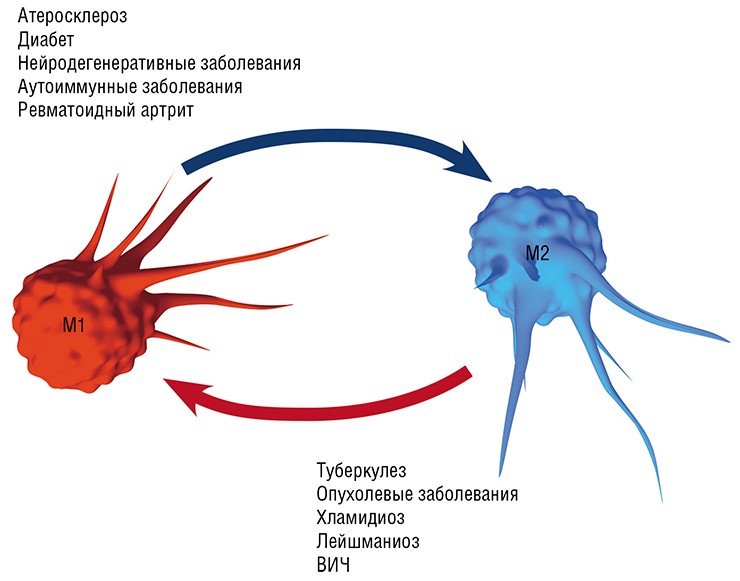
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях, но при этом имеют выраженные тяжелые побочные действия.
Эти обстоятельства стимулируют химиков и фармакологов к созданию безопасных и эффективных аналогов. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование Мox фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
С помощью финансовой поддержки государства можно в самое ближайшее время создать отечественные средства для фармакологических и генетических манипуляций с макрофагами, благодаря которым появится реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия, 2012. T. 77. C. 419—432.
Смирнов А. Н. Липидная сигнализация в контексте атерогенеза // Биохимия. 2010. Т. 75. С. 899—919.
Шварц Я. Ш., Свистельник А. В.Функциональные фенотипы макрофагов и концепция М1-М2-поляризации. Ч. 1 Провоспалительный фенотип. // Биохимия. 2012. Т. 77. С. 312—329.
Читайте также:

