Лимфогранулематоз ремиссия 5 лет
Накоплен достаточно большой опыт программной химио- химиолучевой терапии лимфогранулематоза. Используются программы первой, второй линии , высокодозные программы, ауто- или алло-трансплантация костного мозга при первичной лекарственной резистентции опухолевой ткани, при развитии раннего рецидива и непрерывно рецидивирующем течении процесса.
В настоящее время признанной является комбинированная терапия при П, П1 и даже 1V стадиях, но при этом предусмотрен месячный перерыв после химиотерапии.
В последние годы прослеживается уменьшение объема и доз облучения при сохранении тех же результатов лечения.
При проведении только цикловой полихимиотерапии в любой стадии лимфогранулематоза лечение следует осуществлять до достижения полной ремиссии, после чего необходимо провести как минимум 2 консолидирующих (закрепляющих) цикла. Полная ремиссия, особенно в генерализованных стадиях заболевания, редко достигается ранее 4-го цикла полихимиотерапии, поэтому необходимый минимум программы лечения составляет 6 циклов.
Полихимиотерапия позволила решить проблему лечения первичных больных в генерализованных стадиях, но при этом осталась проблема рецидивов. Характер рецидивов был различным: после лучевой терапии чаще наблюдались рецидивы в новых зонах, а после полихимиотерапии — в исходных (у 40% пациентов по данным ОНЦ РАМН).
В 1976г. L.Prosnitz предложил использовать лучевую терапию в сниженных дозах (СОД 20Гр) в середине курса полихимиотерапии, когда основная опухолевая масса сокращена на 50— 80%.
При сочетании двух методов число рецидивов сократилось до 10-12% (данные ОНЦ РАМН).
В последнее десятилетие четко прослеживается тенденция к более высокой индивидуализации лечения: сокращению объема и интенсивности терапии у больных с благоприятным и промежуточным прогнозом и интенсификация лечения больных с неблагоприятным прогнозом.
Для лечения больных во II стадии без неблагоприятных фактов предпочтение отдано сокращенной программе лечения, которая включает 4 циклы полихимиотерапии по схеме ЦВПП + облучение только зон исходного поражения в СОД, не превышающей 36—40 Гр. По данным ОНЦ РАМН, такая программа лечения позволяет получить 98% полных ремиссий, 6-летнее безрецидивное течение составляет 94%, а 6-лeтняя общая выживаемость- 100%.
Для лечения больных во II стадии с факторами риска (при наличии хотя бы одного из них) необходим больший объем терапии: З цикла полихимиотерапии по одной из схем первой линии + облучение всех лимфатических коллекторов выше диафрагмы в СОД до 40гр, затем таких же 3 курса полихимиотерапии.
В результате полные ремиссии получены у 96—98% больных, 6-летняя безрецидивная выживаемость - у 79—90% и у 85-91% больный достигнута 6-летняя общая выживаемость.
Анализ результатов лечения показал достоверное преимущество схемы ABVD перед схемой МОПП в рамках комбинированной терапии при оценке отдаленных результатов. Аналогичную химиолучевую программу предлагают и при лечений больных в IIIA стадии без факторов риска: после 4 - 6 циклов полихимиотерапии первой линии проводят два этапа лучевой терапии — облучение лимфатических коллекторов выше диафрагмы ,затем облучение селезенки и забрюшинных лимфоузлов.
Сорокалетний опыт лечения больных в ранних стадиях лимфогранулематоза позволил исследователям как европейской, так и американской научных школ сформулировать концепцию излечимости лимфогранулематоза:
- единственным непосредственным, адекватным результатом проведенной терапии считается полная ремиссия длительностью не менее 4мес;
- достижение частичной ремиссии или стабилизации по окончании всей терапевтической программы были признаны такими же неудачами лечения, как и прогрессирование.
1. 1. Безрецидивная выживаемость (DFS-disease free survival) рассчитывается от даты констатации полной ремиссии до даты рецидиваили последней явки больного. Безрецидивная выживаемость характеризует только группу больных, достигших полной ремиссии, и показывает, какая часть из этих больных имеет возможность прожить указанный срок без признаков возврата заболевания.
2. 2. Выживаемость, зависящая от заболевания(DSS — disease specific survival), рассчитывается от даты начала лечения до даты смерти от данной болезни или до даты последней явки больного. Выживаемость, зависящая от заболевания, характеризует всю группу больных, начавших лечение, и показывает, какая часть больных могла бы прожить указанный срок, если бы не было осложнений лечения, снижающих качество жизни, и смертей от осложнений лечения в полной ремиссии заболевания
3.Общая выживаемость (OS — overal survival) рассчитывается от даты начала лечения до смерти от любой причины или до даты последней явки больного.
Общая выживаемость характеризует всю группу больных, начавших лечение, показывает фактическую выживаемость на указанный срок наблюдения.
Выживаемость, свободная от неудач лечения, характеризует всю группу больных, начавших лечение, и показывает, какая часть из всей группы больных имеет возможность прожить указанный срок без признаков заболевания
В последнее время больных во IIВ стадии с большим средостением, экстранодальным поражением в пределах стадии Е, в IIIА стадии и с факторами риска, в IIIB и IV стадиях предложено объединить в группу с неблагоприятным прогнозом.
При применении любых схем полихимиотерапии первой линии ремиссии достигаются у 60—80% больных, однако 5—7 летняя выживаемость не превышает 70%.
В середине 80-х годов был предложен другой принцип интенсификации лечения этих больных: сокращение интервалов между курсами полихимиотерапии или непрерывная терапия с последующим облучением в сниженных дозах зон исходного массивного поражения. Внедрение в клиническую практику колониестимулирующих факторов Г-КСФ, ГМ-КСФ (G-CSF, GM-CSF) создало благоприятные возможности для таких программ. Результаты первых трех программ были опубликованы в последние 3 года.
Рецидивы наблюдаются у 10—40% больных в зависимости от исходной стадии заболевания, прогностических признаков и метода индукционной терапии. Из общего числа рецидивов половина отмечается в первый год после окончания лечения и еще 20—25% — в течение второго года, остальные — позже без какой-либо закономерности.
Полные ремиссии при рецидивах, возникших после радикальной лучевой терапии, достигаются у 90 % больных при использовании любого режима первой линии полихимиотерапии. Длительная безрецидивная выживаемость составляет 60—70%.
Больных с рецидивами после полихимиотерапии или индукционного комбинированного химиолучевого лечения по характеру течения лимфогранулематоза и ответу на повторное лечение можно разделить на три группы:
1) больные, не достигшие полной ремиссии после первой программы лечения (первично-резистентные);
2) больные, у которых ремиссия сохранялась менее 1 года – ранние рецидивы
3) больные, у которых ремиссия сохранялась более 1 года – поздние рецидивы
Как показал D.Longo, в этих группах после рецидива медиана выживаемости составляет 1,3; 2,6 и 4,3 года соответственно.
Рецидивы после полихимиотерапии чаще всего возникают в зонах первичного поражения.
При распространенности рецидива в пределах I—II стадий больные без факторов риска, с длительностью ремиссии более 1 года, могут быть вылечены при помощи радикальной лучевой терапии.
Применение схем второй линии позволяет увеличить частоту полных ремиссий до 25—40%, но 3-летнее безрецидивное течение наблюдается лишь у 10% больных.
При поздних рецидивах, возникших через 5—7 лет полной ремиссии, целесообразно проводить повторную биопсию с целью исключения опухоли другого генеза.
ограничений. Достижение полных и длительных ремиссий у больных с поздними рецидивами возможно и при химиотерапии по другим схемам первой линии.Применение полихимиотерапии у этих больных не имеет
Частота повторных, полных ремиссий в группе больных с поздними рецидивами достигает 75%, а 10-летнее безрецидивное течение в группе больных, достигших повторной полной ремиссии — 45%, однако длительная общая выживаемость почти вдвое ниже из-за вторичных миелоидных лейкозов, опухолей и других осложнений, связанных с лечением.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Информация для родителей
Лимфома Ходжкина (болезнь Ходжкина или лимфогранулематоз) – злокачественное заболевание лимфатической системы.
Причины развития
Лимфома Ходжкина (ЛХ) возникает из-за злокачественного изменения (мутации) В-лимфоцитов. В-лимфоциты — это белые кровяные клетки крови, которые находятся в основном в лимфатической ткани. Поэтому лимфома Ходжкина может развиваться везде, где есть лимфатическая ткань, также она может поражать и другие органы (печень, костный мозг, лёгкие и/или селезёнку).
Распространенность
- Лимфома Ходжкина занимает 5-е место в структуре заболеваемости у детей и подростков и состаляет 5-7%.
- Заболеваемость лимфогранулематозом в России составляет 0,8 на 100 тыс. детского населения.
- Наиболее часто болеют дети и подростки старше 11 лет.
- В детском и подростковом возрасте мальчики болеют немного чаще, чем девочки, соотношение по полу составляет 1,6 : 1 (мальчики : девочки).
Формы
Морфологическим субстратом опухоли являются клетки Березовского-Штенберга-Рид, однако, их количество в опухолевой ткани редко превышает 10%. Второй вариант клеток – клетки Ходжкина, которые являются провариантом клетки Березовского-Штенберга-Рид. В зависимости от того, как выглядит ткань опухоли под микроскопом, выделяют пять форм лимфомы Ходжкина.
- Вариант болезни Ходжкина с лимфоцитарным преобладанием составляет 5-6% от всех случаев ЛХ. Клеток Березовского-Штенберга-Рид очень мало.
- Смешанно-клеточный вариант диагностируется у трех четвертей пациентов. Клетки Березовского-Штенберга-Рид и клетки Ходжкина встречаются в достаточном количестве.
- Лимфоцитарное истощение – наиболее редко встречающийся морфологический вариант опухоли (менее 1%).
- Наиболее часто встречается вариант лимфомы Ходжкина с нодулярным склерозом.
- При нодулярном лимфоидном преобладании ткань лимфатического узла полностью или частично замещена инфильтратом нодулярного строения, часто сочетающегося с зонами диффузного роста.
Клинические стадии
Клиническая стадия определяется согласно классификации Ann Arbor (1971), дополненной рекомендациями, принятыми в Котсвольде (1989):
I стадия — поражение одной или двух группы лимфатических узлов (I) или одного нелимфатического органа (или ткани) — (IE);
II стадия — поражение двух или более лимфатических областей по одну сторону диафрагмы (II) или вовлечение одного нелимфатического органа (или ткани) и одной (или более) лимфатических областей по одну сторону диафрагмы (IIE), поражение селезенки (IIS);
III стадия — поражение лимфатической системы по обе стороны диафрагмы (III), которое может сочетаться с локализованным вовлечением одного нелимфатического органа или ткани (IIIE), или с вовлечением селезенки (IIIS), или поражением того и другого (IIIES);
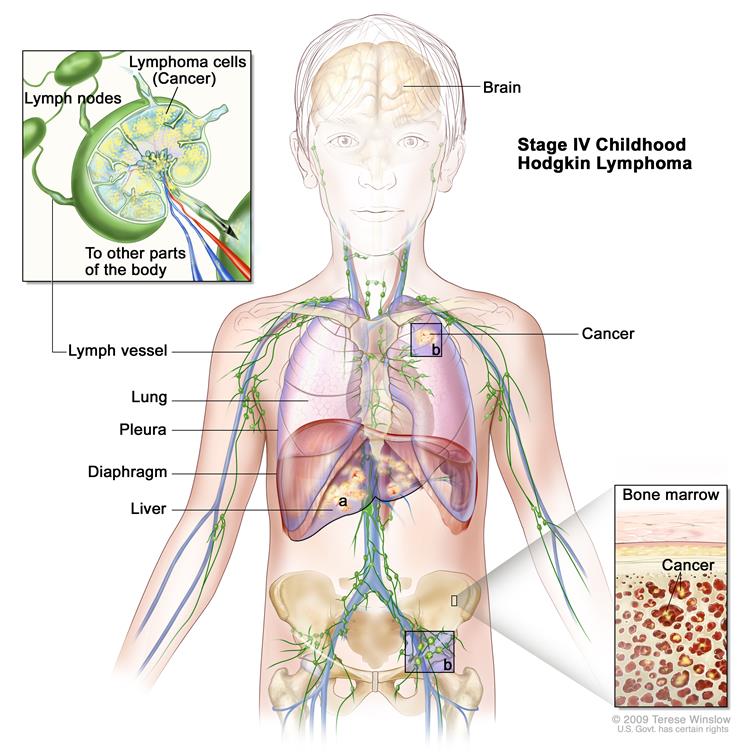
IV стадия — распространенное поражение одного и более нелимфатических органов (легких, плевры, перикарда, костного мозга, костей и проч.) в сочетании или без вовлечения лимфатических узлов.
На рис. 1 представлены зоны поражения при лимфоме Ходжкина.
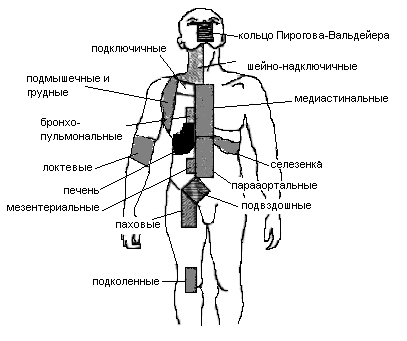
Рис. 1. Зоны поражения при болезни Ходжкина
Симптомы
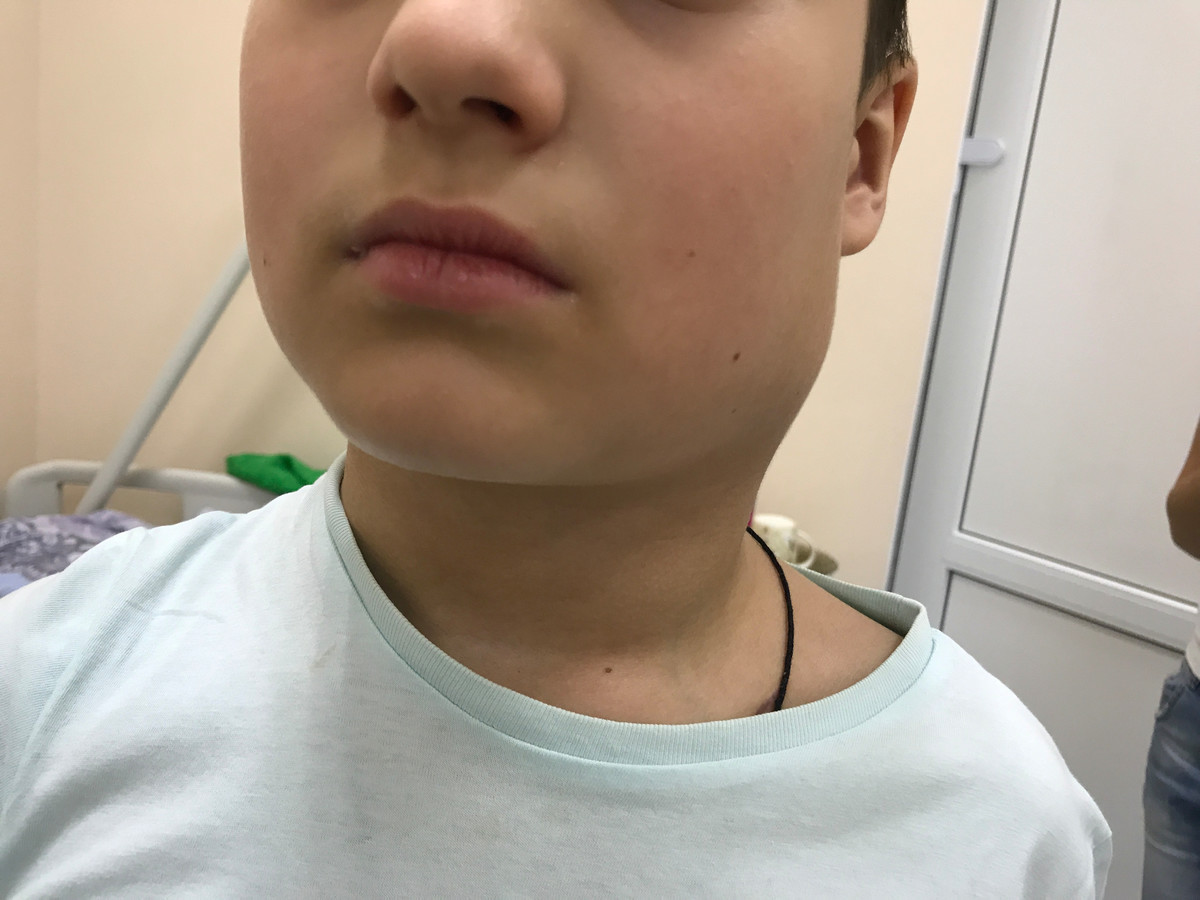
Рис. 2. Поражение шейных лимфатических узлов при лимфоме Ходжкина.
Если увеличенные лимфоузлы находятся в грудной клетке (средостении) (рис. 3), могут появляться приступы кашля или одышка.
Иногда увеличиваются печень и селезенка (в медицинской практике это называется гепатомегалия и спленомегалия).
Поражение ЦНС может развиться в далеко зашедших случаях лимфомы Ходжкина.
Поражение костей: чаще поражаются позвонки, тазобедренные суставы.
Вовлечение костного мозга встречается в 5-10% случаев болезни Ходжкина.
Для стадирования необходимо учитывать биологическую активность заболевания. Определяется она на основании двух и более следующих показателей: СОЭ ≥ 30 мм/час; фибриноген ≥ 4 г/л; альбумин ≤ 40 %; СРБ (++ и более); число лейкоцитов ≥ 12х10 /л; альфа-2-глобулин ≥ 12%
Диагностика
Если после тщательного осмотра педиатр находит признаки лимфомы Ходжкина, то он дает направление в специализированный стационар (клинику детской онкологии и гематологии).
В стационаре проводятся:
- Исследование пораженной ткани. Основным методом диагностики лимфомы является биопсия (оперативное удаление пораженного лимфатического узла или ткани и изучение материала под микроскопом). По результатам исследования образца ткани можно точно определить, болен ребенок лимфомой Ходжкина, и если да, то каким именно ее видом.
- Анализ распространенности болезни в организме. После установления диагноза необходимо выяснить, насколько болезнь успела распространиться по организму и какие органы она успела поразить. С этой целью выполняют ПЭТ-КТ всего тела с глюкозой. По показаниям проводят исследование костного мозга (трепан–биопсия костного мозга у больных с IВ, IIB-IV стадиями), остеосцинтиграфию, МРТ при костных поражениях.
- Если в анамнезе имеется сердечно-сосудистая патология, выслушивается сердечный шум, выполняется ФВЛЖ (функция выброса левого желудочка).
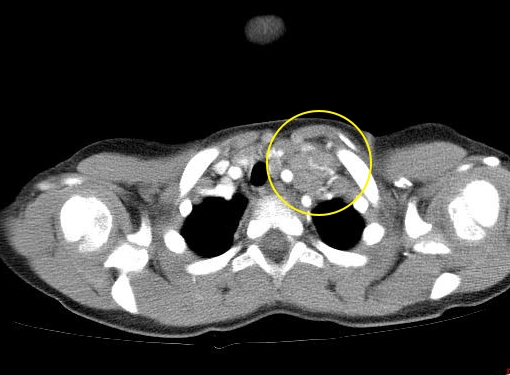
Рис. 3. Поражение внутригрудных лимфатических узлов при лимфоме Ходжкина
Современные подходы к лечению
Основное место в лечении лимфомы Ходжкина занимает химиотерапия.
Химиотерапия – это лечение лекарственными препаратами (цитостатиками), которые блокируют деление или убивают опухолевые клетки. Максимального эффекта можно добиться используя комбинации цитостатиков (полихимиотерапия — ПХТ), которые по-разному действуют на клетки.
Полихимиотерапия проводится в соответствии с группой риска, в которую отнесен больной при первичном стадировании, в специализированном стационаре.
Первый цикл ПХТ начинается сразу же после подтверждения диагноза и установления стадии, в случае проведения оперативного лечения полихимиотерапия начинается через 5 дней после операции.
После химиотерапии проводится лучевая терапия (облучение) пораженных зон. Лучевая терапия должна начинаться в течение 14 дней от окончания химиотерапии при нормальных показателях крови.
В России сегодня используются две основные программы лечения лимфомы Ходжкина: DAL-HD и СПбЛХ. Оба протокола включают в себя полихимиотерпию и завершающую лучевую терапию. Количество циклов ПХТ зависит от стадии болезни и от выбора терапевтической группы, по которой лечат пациента. Больные обычно получают следующую программу: при благоприятных вариантах (1-я группа риска) – 2 цикла химиотерапии, при промежуточном прогнозе (2-я группа риска) – 4 цикла химиотерапии, при неблагоприятных вариантах (3-я группа риска) – 6 циклов химиотерапии. Разделение больных на группы риска имеет некоторые отличия в зависимости от применяемого протокола.
В программе DAL-HD используются схемы OPPA/OEPA и COPP. В протоколе СПбЛХ – схемы VBVP и ABVD.
Лучевая терапия
Завершающим этапом лечения лимфомы Ходжкина является облучение всех пораженных зон лимфатических узлов. Как правило, лучевую терапию начинают через 2 недели после окончания лекарственной терапии при нормализации показателей крови.
Доза облучения зависит от полноты ремиссии после лекарственной терапии: при достижении полной ремиссии (исчезновение всех клинических и радиологических признаков заболевания) в лимфатической зоне по данным ПЭТ-КТ доза облучения составляет 20 Гр. Если размер опухоли после полихимиотерапии уменьшился на 75% и более от первоначальной опухоли и/или отмечается снижение гиперфиксации РФП по ПЭТ-КТ до 2-3 по Deauville, то доза облучения составляет 25 Гр. При уменьшении опухолевых образований менее чем на 75% и/или сохранении гиперфиксации РФП по ПЭТ-КТ 4-5 по Deauville, то дозу облучения увеличивают до 30 Гр.
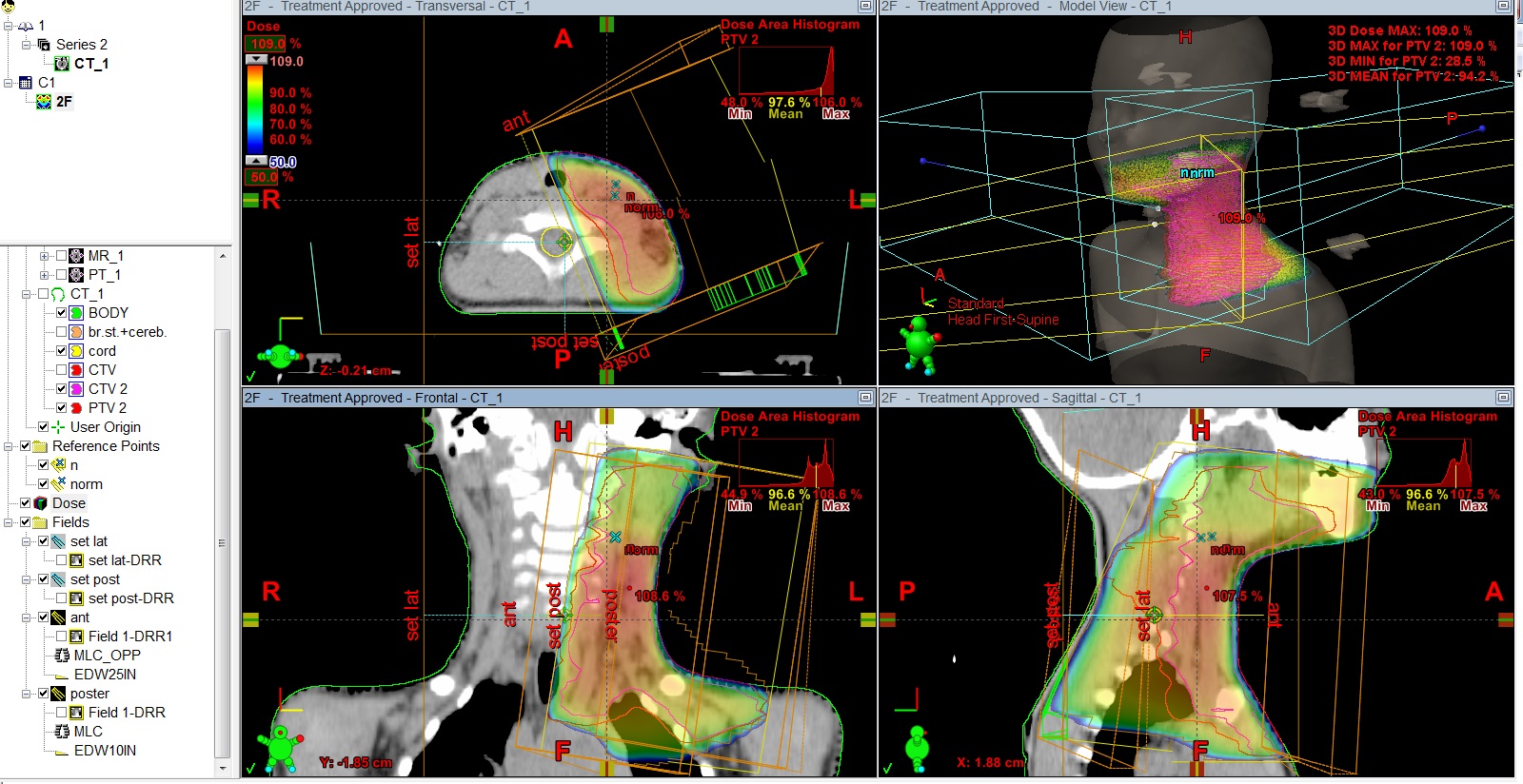
Рис.5 План лучевого лечения. Пациент И., 4 года 6 мес. Лимфома Ходжкина IIст. с поражением шейных, надключичных, подключичных л/у слева, вилочковой железы, носоглотки. Состояние после 4 курсов курсов ПХТ, ремиссия. Облучение шейно-над-подключичных л/у слева с консолидирующей целью, СОД 20 Гр.
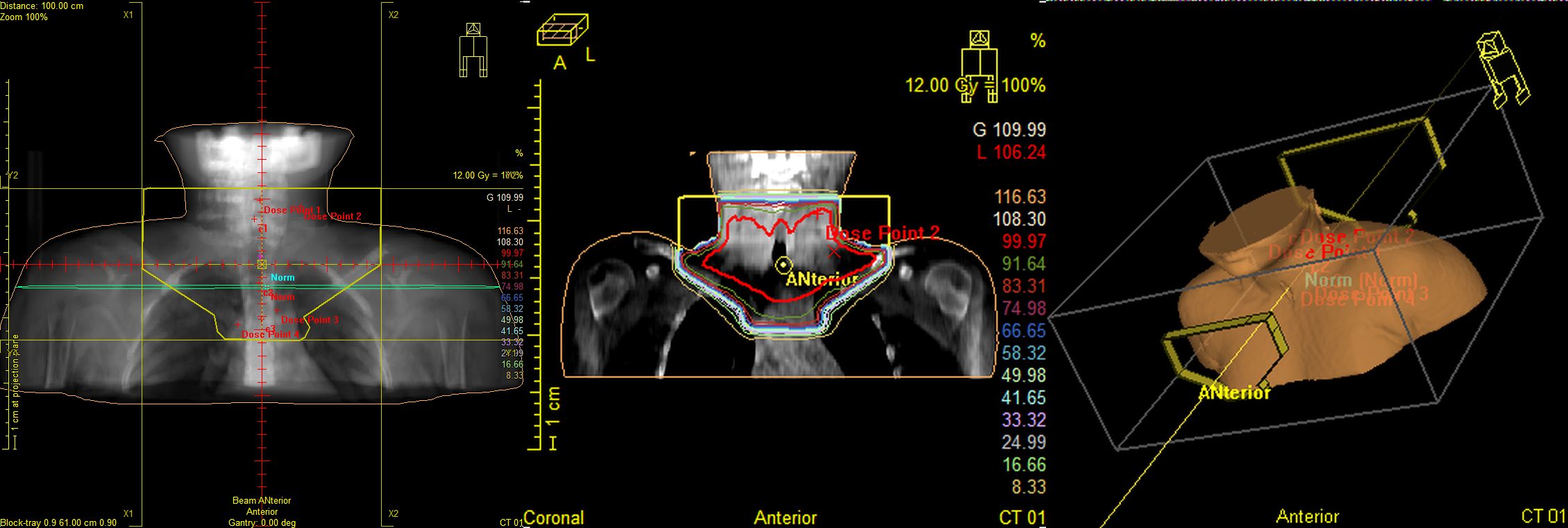
Рис.6 Пациентка М., 11лет. Лимфома Ходжкина II ст. с поражением мягких тканей шеи, лимфатических узлов шеи. Состояние после 2 курсов ПХТ. По данным контрольного ПЭТ/КТ метаболически значимых очагов не выявлено, ремиссия. Проведение лучевой терапии первично вовлеченных зон в суммарной очаговой дозе 20,0Гр с целью консолидации.
Критерии оценки полноты ремиссии
Критерии оценки ремиссии нужны врачу для определения необходимости продолжения лечения или интенсификации программ терапии, либо перевода пациента под динамическое наблюдение.
- Полная ремиссия — полный регресс всех признаков заболевания (клинических, гематологических и других проявлений болезни) по данным визуализирующих методов обследования, определяемая дважды с интервалом не менее 4 недель.
- Частичная ремиссия — уменьшение размеров опухолевых образований не менее, чем на 50% на срок от 4 недель при отсутствии новых очагов поражения.
- Стабилизация заболевания – уменьшение размеров опухолевых образований менее, чем на 50% или увеличение их не более, чем на 25% от первоначального объема при отсутствии новых очагов поражения.
- Прогрессирование — появление в процессе лечения новых очагов поражения или увеличение ранее имевшихся более, чем на 25%, а также появление симптомов интоксикации.
- Рецидив — появление новых очагов поражения после достижения полной ремиссии.
Диспансерное наблюдение
Наблюдение детей и подростков с лимфомой Ходжкина проводится в течение не менее 3-х лет после завершения лечебной программы.
В первом квартале пациент обследуется каждый месяц, в последующие 9 месяцев – каждый квартал и в последующие годы – раз в полгода.
Лимфома Ходжкина относится к числу наиболее излечиваемых онкологических заболеваний и около 80% пациентов живут более 10 лет после окончания лечения.

Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА
заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, доктор медицинских наук
Лимфогранулематоз – злокачественное заболевание лимфатической системы – носит также название “болезнь Ходжкина”. Патологическое размножение клеток лимфоидной ткани сопровождается образованием гранулем (узелков) в лимфатических узлах. Их клеточный состав преимущественно представлен гигантскими опухолевыми клетками и клетками, типичными для воспаления. Первое описание болезни осуществил патологоанатом Т. Ходжкин в 1932-м. Лимфогранулематоз у детей проявляется преимущественно в подростковом возрасте. Если говорить о ранних годах жизни, то болезнь встречается чаще у мальчиков, но в пубертатном периоде соотношение выравнивается.
Лимфогранулематоз у детей – кто в группе риска?
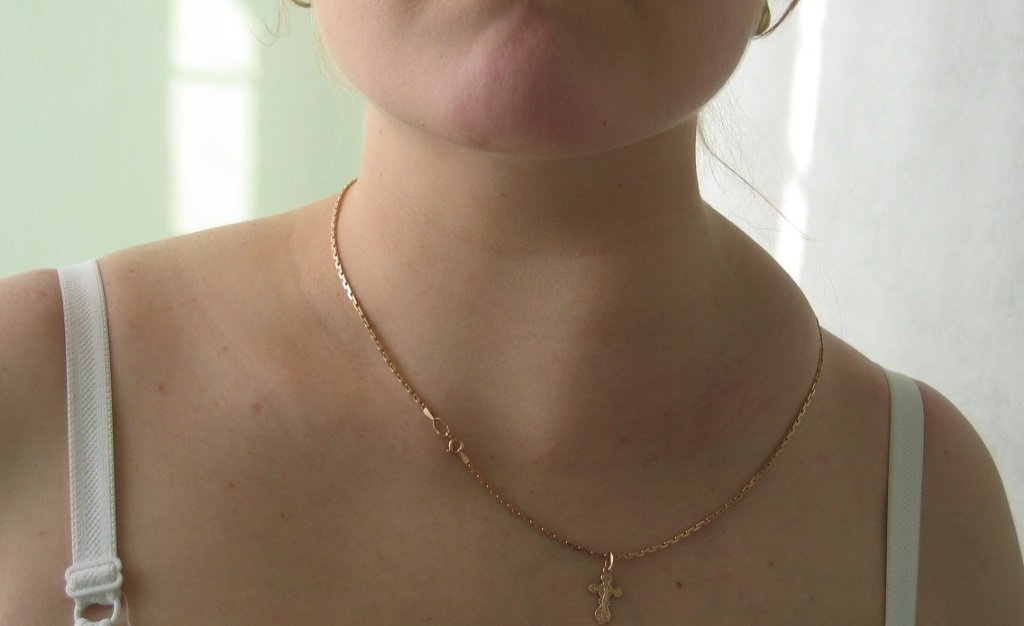
Характерная особенность лифмогранулематоза – это первичное поражение шейных и надключичных лимфоузлов
Данные ВОЗ свидетельствуют о том, что лимфогранулематоз в детском возрасте подтверждается в около 60% случаев при установлении диагноза злокачественной лимфомы. Пик приходится на 2 возрастные группы:
- 5-7 лет;
- 13-15 лет.
Не зарегистрировано ни одного случая болезни до 2-летнего возраста, а до 5 лет такая онкология проявляется редко.
Анализ причин возникновения опухолевой аномалии указывает на следующие три фактора:
- практически в каждом случае в организме был обнаружен вирус Эпштейна-Барра, отмечается, что экспрессия ДНК-1 вируса определяется у около 80% больных до 10 лет;
- на момент развития болезни у подростков сильно подавлена иммунная функция;
- в некоторых случаях прослеживается генетическая связь.
Патогенез лимфогранулематоза представлен прогрессирующим размножением мутировавших клеток с последующим образованием метастазов в лимфоузлах и тканях кровеносных сосудов. Ретикулярные гигантские клетки размножаются очагово, они носят название клеток Березовского-Штернберга и отличаются наличием светлой цитоплазмы и нескольких ядер.
Практически все случаи детского лимфогранулематоза характеризуются вначале безболезненным и бессимптомным течением. На первых стадиях клиническая картина никак не проявлена. Если ребенок регулярно проходит медицинские осмотры, то болезнь может быть выявлена случайно, при обследовании других органов или при получении результатов крови, где отражено катастрофическое снижение Т-лимфоцитов. Сам ребенок на ухудшение самочувствия не жалуется, его активность остается прежней.
В самом начале прогрессирования патологии могут то увеличиваться, то уменьшаться шейные или надключичные лимфоузлы. Затем поражаются паховые и подмышечные узлы. После лимфогранулематоз у детей распространяется на органы и системы: страдает костный мозг, селезенка, печень. На 10% от всех случаев приходится поражение почек и легких.
При множественных и крупных опухолях происходит сдавливание корешков спинномозговых нервов, вследствие чего нарушается работа нервной системы.
Симптоматика и классификация

Ранним симптомом лимфогранулематоза в детском возрасте является повышение температуры тела до 39°
Если доктор подозревает у ребенка лимфогранулематоз, то он соотносит клиническую симптоматику с существующей классификацией патологии. Деление на группы основывается на морфологических, генетических и иммунологических характеристиках организма конкретного пациента.
Исходя из указанных особенностей, выделяют два вида болезни Ходжкина:
- Классическая лимфома.
- Нодулярная с лимфоидным преобладанием.
Классический тип подразделяется на еще три подтипа: смешанно-клеточный, лимфоидно истощенный, нодулярный склероз. Каждый из подвидов имеет свои области поражения, степень агрессивности и фиброза, соотношение мутировавших клеток к здоровым.
Симптомы лимфогранулематоза в зависимости от описанной выше классификации:
- Нодулярная форма с лимфоидным преобладанием. Лабораторное исследование покажет, что ткани опухоли состоят из лимфоцитов и гистиоцитов. Клетки Березовского-Штернберга встречаются редко. При такой форме поражаются лимфатические узлы одной группы, а признаки болезни проявлены слабо.
- Нодулярный склероз. Под микроскопом видно значительное количество клеток Б-Ш, поражение распространяется на разные группы лимфатических узлов на теле ребенка. Это наиболее распространенный вид классической лимфомы.
- Смешанно-клеточный тип. Является вторым по частоте. Лабораторное исследование выявляет большое количество клеток Б-Ш, которые окружены участками фиброза или воспалительными клетками.
- Лимфоидное истощение. Наиболее сложная форма детского лимфогранулематоза. Симптомы проявляются бурно, среди них: лихорадка, множественные поражения лимфатических узлов. Болезнь также затрагивает костный мозг. Лимфоидное истощение очень сложно лечится.
Для каждого из подвидов характерна своя клиническая картина. Часто единственным признаком патологии является увеличение лимфоузлов, а главная особенность при этом — что они не болят, не воспалены, кожа не изменила цвет. Часто доктора ошибочно принимают увеличенные узлы за вторичный признак респираторной вирусной инфекции или какого-либо воспалительного процесса в организме, и назначают лекарственные препараты, которые не приносят никакого результата.
По статистике, в 20% случаев патология затрагивает внутригрудные и брюшные лимфатические узлы. В зависимости от локализации можно выделить следующие симптомы:
- если процесс распространился на грудные узлы, ребенок начинает кашлять (сдавливаются или раздражаются воздухоносные пути);
- давление на магистральные сосуды приводит к компрессии верхней полой вены (из верхней части туловища кровь отходит со сбоями). Это проявляется отеками, кожные покровы становятся синюшными, появляется одышка, нестабильно работает сердце;
- давление лимфоузлов на возвратный нерв приводит к осиплости голосовых связок;
Лимфогранулематоз брюшных лимфоузлов будет проявляться в зависимости от того, какие органы были задеты. К примеру, может развиваться кишечная непроходимость из-за сдавливания кишечника или желтуха, признаки печеночной недостаточности, если поражаются лимфоузлы около печени.
Причины
Причины лимфомы Ходжкина не установлены точно. Медики выделяют несколько факторов, которые влияют на вероятность её возникновения:
- продолжительное воздействие на организм высоких доз радиации. Это может происходить по причине проживания в экологически неблагоприятном регионе или лечения других видов онкологии;
- генетические мутации, которые провоцируют неправильное развитие лимфоидных тканей.
Существует теория, что болезнь Ходжкина может иметь вирусное или туберкулезное происхождение, но научного подтверждения она не получила.
Диагностика

Комплексная диагностика поможет выявить причину патологии
Для выявления данного недуга необходима комплексная диагностика. Она начинается с осмотра больного и сбора анамнеза. Следует понимать, что, поскольку симптомы заболевания не являются специфическими, то поставить диагноз на основании одних лишь жалоб ребенка не удастся. Комплексная диагностика опирается на лабораторные и инструментальные методики.
Безошибочно выявить наличие патологического очага в организме позволяет проведение общего и биохимического анализов крови. Их результаты позволяют установить следующее:
- снижение количества тромбоцитов (тромбоцитопения);
- количество лимфоцитов близко к нулю;
- снижено количество сывороточного железа;
- анемия;
- число лейкоцитов, эозинофилов, нейтрофилов и СОЭ повышено.
Наиболее информативным считается гистологический анализ лимфоузла. О наличии заболевания свидетельствуют следующие отклонения:
- в узле обнаружены некротические очаги;
- происходит замещение лимфоидной ткани другими клетками;
- клеточное ядро по размерам превышает норму;
- клетки Ходжкина присутствуют в большом количестве.
Речь идет о целой группе методик, наиболее результативными из которых являются:
- МРТ и КТ. На сегодняшний день томография является одной из самых информативных методик. Она позволяет исследовать структуру костей и мягких тканей, определив локализацию патологического очага и его размеры.
- Рентгенография. Обладает довольно низкой информативностью, однако эта методика незаменима при выявлении очагов метастазирования.
- УЗИ. Классическая диагностическая методика, позволяющая выявить структуру, размер патологии и определить степень поражения внутренних органов.
Лечение
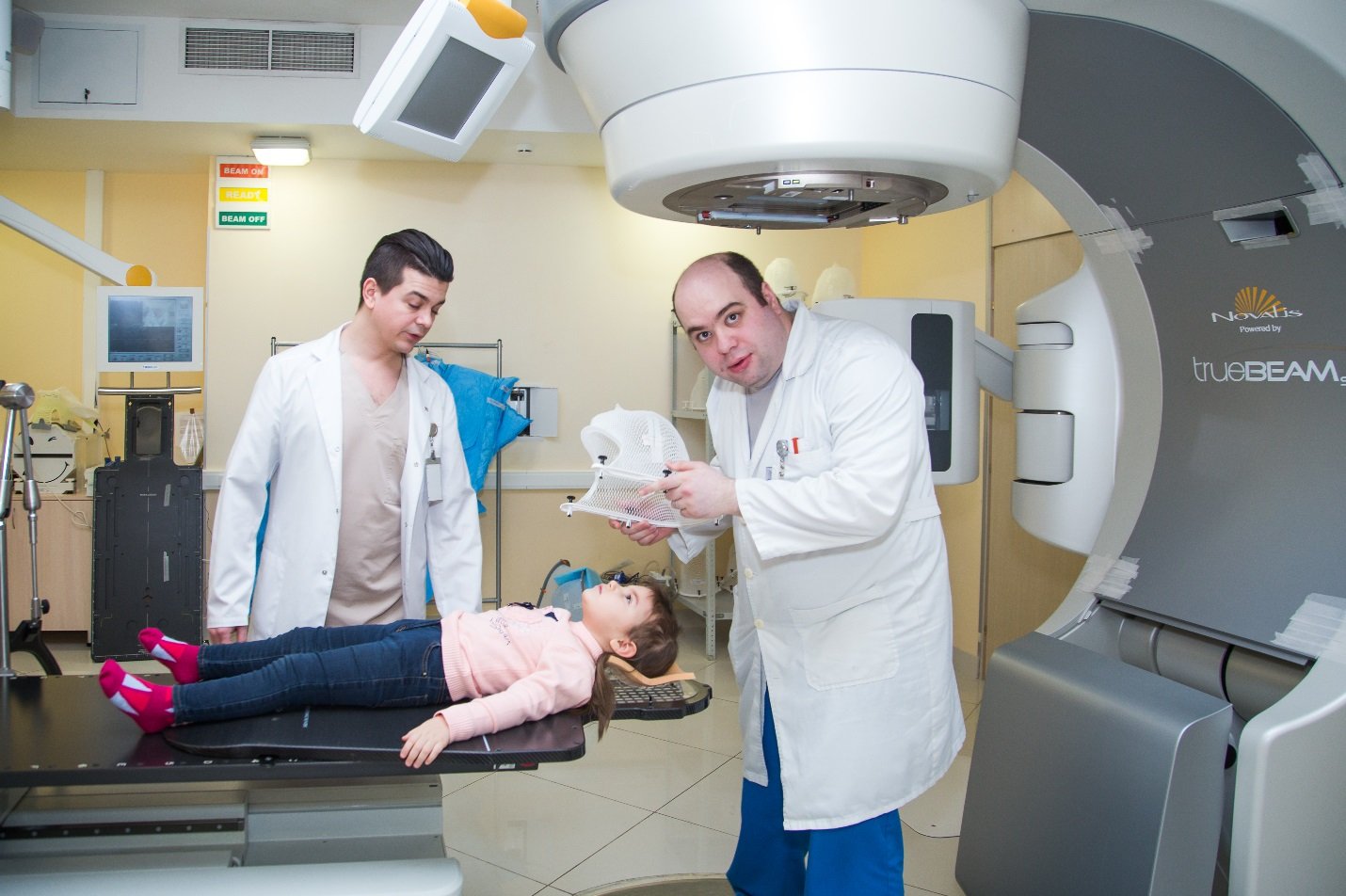
Для лечения лимфогранулематоза применяют лучевую терапию
На данный момент лечение лимфогранулематоза у детей предполагает использование следующих методик:
- Лучевая терапия.
- Химиотерапия.
- Хирургическое вмешательство.
Данная методика предполагает воздействие на раковые клетки медикаментами, которые разрушают патологически измененные ткани. Минусом процедуры является негативное влияние и на здоровые клетки.
Химиотерапия является основой лечения множества онкологических заболеваний. Как правило, она предполагает комплексное использование нескольких препаратов. Для лечения лимфогранулематоза у детей применяются следующие медикаменты:
- Адриамицин;
- Винбластин;
- Блеомицин и др.
Предполагает воздействие на опухоль радиоволнами. Как правило, данная методика применяется вместе с химиотерапией и усиливает эффективность последней. В качестве отдельной процедуры используется крайне редко.
Чаще всего применение лучевой терапии проводится на последних стадиях заболевания.
Предполагает удаление пораженных тканей. Наиболее эффективно на начальных стадиях развития недуга, когда болезнь поразила лишь один-два узла.
После операции за пациентом ведется постоянное наблюдение, чтобы контролировать развитие болезни в динамике. При отсутствии симптомов рецидива другое лечение может не назначаться, а пациент возвращается к полноценной жизни.
Если у ребенка наблюдается рецидив заболевания, то для подавления болезни применяется химиотерапия.
Прогноз

Своевременно начатое лечение увеличивает шансы на благоприятный исход
Доктор может давать какие-либо прогнозы, исходя из клинической картины и стадии, на которой находится болезнь Ходжкина. Если лечение было начато, когда болезнь еще только начала свое развитие, то, по статистике, излечивается полностью 90% больных. На стадии развернутого развития статистика указывает на 70% полностью излечившихся. Но риск рецидива значительно повышается в таком случае.
Неблагоприятные прогнозы устанавливаются в двух случаях:
- рецидив наступил в течение 12 месяцев с периода лечения;
- болезнь плохо поддается терапии и быстро прогрессирует.
На последних стадиях лимфома может перейти в лимфосаркому. Такая онкология прогрессирует стремительно и практически не лечится. Смерть в таком случае наступает спустя несколько месяцев.
Профилактика лимфогранулематоза у детей подразделяется на первичную и вторичную. Для предупреждения заболевания следует укреплять организм и иммунную систему, своевременно лечить инфекционные заболевания, избегать радиационного воздействия.
Суть вторичной профилактики заключается в том, чтобы избежать возникновения рецидива. Для этого ребенок должен находиться под диспансерным наблюдением онколога и регулярно проходить обследование.
Читайте также:

