Лейкоз и рак спинного мозга
Рак спинного мозга — онкологическое заболевание, которое располагается в области позвоночника или самого спинного мозга и проявляет свои симптомы в основном только на последней стадии развития, в результате успешность терапии встает под вопрос. Во время роста опухоли происходит сдавливание спинного мозга в целом и спинномозгового нерва в частности. Среди всего многообразия опухолевых заболеваний данный вид рака редко встречается, а сложность его диагностики заключаются в большом разнообразии клинических проявлений. Диагноз рак спинного мозга одинаково встречается и среди мужчин и среди женщин, а также редко встречается у детей или престарелых людей.
Классификация
Существует несколько классификаций опухолей спинного мозга. Прежде всего, разделяют:
Доброкачественная опухоль — растет очень медленно, не дает метастазы;
Злокачественная опухоль — очень агрессивна в развитии.
Особенность заключается в том, что и тот и другой вид опухолей несут опасность для жизни человека. Это происходит потому, что любые новообразования могут привести к нарушениям позвоночника, а, следовательно, сдавливаются нервы, кровоток и ликвообращение нарушаются, в результате наступают тяжкие последствия.
По причине возникновения различают:
первичную опухоль — зарождается напрямую в позвоночнике, и основывается на его тканях, сосудах, корешках, мозговом веществе и оболочки мозга;
вторичную опухоль — зарождается в результате того, что онкозаболевания иных органов метастазируют в позвоночник: легкие, щитовидная, предстательная и молочная железы, органы желудочно-кишечного тракта.
По месту локализации различают:
экстрамедуллярные (95% случаев) — поражают ткани позвоночника, оболочки, корешки и сосуды, которые расположены вокруг спинного мозга (остеосаркома, невринома, миелома, менингиома, геменгиобластома, нейрофибриома, липома, шваннома);
интрамедуллярные (5% случаев) — развиваются в спинном мозге (глиома, эпендимома, астроцитома);
Более того, новообразования разделяют на опухоли образованные в отделах шеи, груди, поясницы, отделах спинного мозга, в районе конского хвоста и мозгового конуса.

Стадии
У рака спинного мозга имеется 3 стадии развития:
В начале развития онкологического заболевания наблюдается парапарез мышц в легкой степени, нарушается проводниковая чувствительность, периодически возникают боли в районе спины. Данная стадия может развиваться долго, парой даже и 10 и 15 лет. Часто больные даже не предполагают наличие заболевания.
Наступает после разрастания опухоли, которая начинает оказывать давление на спинной мозг и смещает его. В результате этих изменений, появляются болевые ощущения в корешках, нарушается чувствительность, выявляется фрагментарный паралич в мышцах нижних конечностей и проводниковые симптомы. Важно знать, что многие виды рака спины эту стадию пропускают и переходят сразу к третьей.
Наступают дисфункции таза и вегетативной системы, сенсорно-моторные расстройства, выраженный и нарастающий болевой синдром, полный или частичный паралич конечностей происходит попарно, ноги вытягиваются и наблюдается присутствие спазматического тремора, а в области локализации опухоли возникает гиперемия кожных покровов. Полный паралич всего организма может произойти уже через 3-4 месяца (в случаях развития злокачественной опухоли спинного мозга), или через несколько лет (в случаях развития доброкачественной опухоли). А длительность жизни на третьей стадии в среднем продолжается от полугода до одного года.
Симптомы
Рак спинного мозга обычно начинает проявлять признаки только после того, как пройдет несколько лет от начала заболевания и он перейдет на вторую или третью стадию развития. А симптоматика может изменяться в зависимости от расположения опухоли и ее вида.
Итак, основные симптомы рака спинного мозга:
начальные симптомы: быстрая утомляемость, слабость, сонливость, снижение иммунитета, тошнота и рвота;
боли в спине, конечностях (на третьей стадии очень сильные и непрекращающиеся);
покалывания кожи, подергивание мышц, легкое онемение, прилив жары или холода к конечностям;
затруднение в процессе глотания и разговора;
нарушение координации движения и походки;
падение или полное отсутствие чувствительности в отдельных частях тела;
полный или частичный паралич;
недержание мочи, запоры;
нарушение работы сердца;
проявление синдрома Бергнара-Гонера.
Важно понимать, что симптомы у данного заболевания могут нарастать стремительно, или же наоборот, ни каким образом не проявляться.
Можно сказать, что повезет тому, у кого рак спинного мозга обнаружится в результате обследований по иным проблемам. Ведь данная патология очень слабо либо вовсе не имеет каких-либо проявлений. В том случае, когда человек начинает испытывать болевые ощущения в области позвоночника, необходимо без замедления обратиться за помощью к специалисту.
Для начала врач выяснит, какие признаки вызывают беспокойство у пациента, далее проведен визуальный анализ. Очень ярким проявлением рака спинного мозга, является простреливающая боль в определенном месте позвоночника. Такие симптомы как паралич, дисфункция в тазовых органах, парез, также говорят о наличии заболевания.
Присутствие в анамнезе опухоли любого другого органа может являться признаком развития рака спинного мозга. Еще важными симптомами новообразования в позвоночнике будут нарушенная координация и измененная походка.
Причины
Ученные пока не могут выделить определенных причин, в результате которых развивается рак спинного мозга. Тем не менее, можно проследить закономерности развития заболевания. На развитие опухолей спинного мозга могут оказывать влияние следующие причины:
- Генетическая предрасположенность (наследственность). Если в семье были случаи заболевания раком спинного мозга, необходимо систематически проводить обследования и предпринимать все меры профилактики.
- Наличие таких заболеваний, как вирус иммунодефицита человека, лимфома спинного мозга, лейкоз.
- Облучение радиацией и ультрафиолетом.
- Излучение микроволновыми и электромагнитными приборами.
- Воздействие химикатов.
- Присутствие в атмосфере вредного вещества.
- Наличие болезни Хиппель-Линдау.
- Систематические стрессы.
Факторы риска
На сегодняшний день учеными принято выделять 2 фактора, благодаря которым формируется и распространяется патологический процесс:
- Экзогенные факторы:
- плохая экологическая обстановка;
- влияние на организм химических препаратов;
- работа на вредном производстве;
- воздействие радиации по различным причинам.
- Эндогенные факторы:
- пониженный иммунитет;
- патологический характер генетического нарушения по неизвестной причине;
- наследственность;
- наличие в анамнезе других злокачественных новообразований;
- Наличие неврофиброматоза 1 или 2 степени.
Осложнения
Онкологическое заболевание спинного мозга и позвоночника может привести к следующим осложнениям:
систематические боли в спине;
двигательные функции нарушаются, парез или паралич приводят к инвалидности;
различные дисфункции таза (неспособность сдерживать мочу, кал или, наоборот, запор);
нарушенная чувствительность различной степени выраженности.
После полного удаления доброкачественной опухоли, около 80% больных продолжают вести привычный образ жизни, другие — становятся инвалидами на всю жизнь. Часто инвалидность от новообразования в спинном мозге настает в результате метастазов и при интрамедуллярных формах рака.

Фото спинного мозга при нейрофиброматозе со множественными шванномами
Диагностика
Во время осмотра приема пациента врач должен выяснить, какие симптомы беспокоят больного, собрать полный анамнез, выявить возможные предрасположенности к заболеванию рака спинного мозга, произвести осмотр больного. Если что-то вызовет подозрение на онкологическое заболевание, для начала назначаются анализы на другие заболевания — туберкулез, сифилис, остеоартрит и т.п. Далее назначают неврологические исследования сцинтиграфия, МРТ, КТ, биопсию, спинномозговую пункцию.

В комплекс диагностических процедур входит неврологическое обследование, при помощи которого выясняется уровень тонуса мышц, сенсорная сила и другие показатели. Так же в медицинской практике принято проводить анализ крови на определение маркеров в крови, особенно в случаях высокой вероятности развития заболевания (высокая предрасположенность к заболеванию). Это помогает вовремя приступить к профилактическим мерам, обнаружить первые симптомы, пройти эффективное лечение заболевания уже на этапе его зарождения.
Благодаря такому обширному исследованию возможно уточнение причины и иных признаки недуга, подтвердить или опровергнуть подозрения на рак спинного мозга, установить место локализации, стадию развития и гистологию структуры. В результате врач сможет подобрать наиболее эффективные методы лечения.
Сцинтиграфия — радиоизотопная визуализация. Для проведения процедуры в организм пациента вводятся радиоактивные изотопы, которые поглощают ткани костей и раковые клетки в различной степени, что проявляется во время сканирования на гамма-томографе. Эта процедура позволяет обнаружить на первоначальных стадиях злокачественные новообразования.
Магнитно-резонансная томография применяется совместно с контрастным веществом, что позволяет получить более точные сведения, которые можно увидеть на изображении поперечного среза позвоночника. С помощью МРТ можно обнаружить самые маленькие отклонения или опухолевые образования.

На фото: Астроцитома у 11-летнего мальчика. (A) — изображение Sagittal T2 MR шейного и верхнего грудного отдела позвоночника демонстрирует частично кистозную и твердую интрамедуллярную опухоль спинного мозга. (B) — изображение Sagittal T2 MR грудного отдела позвоночника демонстрирует частично кистозную и твердую интрамедуллярную опухоль спинного мозга. (C) — Sagittal T1-взвешенный постконтрастный МР-изображение показывает усиление твердых частей опухоли и периферическое усиление кистозных компонентов.
Компьютерная томография показывает изображение на мониторе компьютера с подробными данными, где можно заметить сужения в позвоночном канале, защемление нервов, точно определить расположение, размер и степень распространенности опухоли. Единственный минус КТ — воздействие большой дозы радиации.
Применяется биопсия для определения степени злокачественности и типа рака спинного мозга. Данная диагностическая процедура выполняется путем забора кусочка опухоли.

Один из методов безоперационной биопсии.
Отвечаем на самые важные вопросы про лейкоз
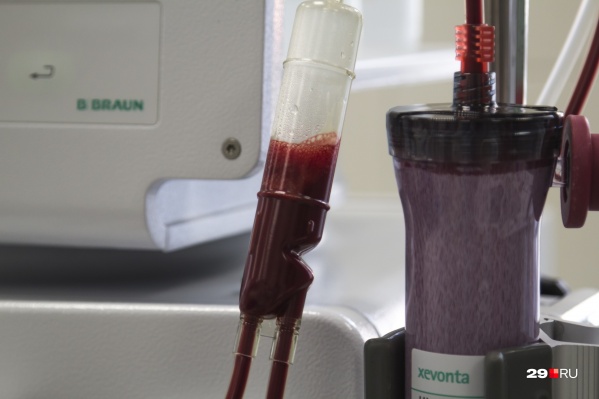
" title="Показать лейкоз может исследование периферической крови
" itemprop="contentUrl">
Показать лейкоз может исследование периферической крови
Фото: Сергей Яковлев
В сентябре мы познакомились с архангелогородкой Вероникой Рожновской, жизнь которой изменилась, когда у её дочери Даши диагностировали лейкоз. Девочка в тот момент училась в пятом классе, а на недомогания врачи не обращали должного внимания. Специалисты отмечают, что рак крови действует тем агрессивнее, чем моложе организм, который поражает болезнь. На другие важные вопросы об этом раке отвечают профессор кафедры онкологии и медицинской радиологии Уральского государственного медицинского университета Сергей Берзин и гематолог из Уфы Нэлли Янтурина.
Лейкоз — опухолевое заболевание клеток крови. При лейкозе происходит патологическая трансформация лейкоцитов и их бесконтрольное деление. В итоге они замещают собой нормальные клетки костного мозга, из которых образуются циркулирующие в крови лейкоциты, эритроциты и тромбоциты.
При хронических лейкозах деление клеток идёт медленнее, и клиника тоже развивается с меньшей скоростью. Лейкозный клон током крови разносится по всей кроветворной ткани. Органами-мишенями, где откладываются метастазы, становятся почки и кости. Оседая в костной ткани, эти клетки, по-другому они называются миеломные, нарушают ее структуру. Это может проявляться частыми переломами, болью в позвоночнике, ребрах. Хронические лейкозы могут годами протекать без каких-либо явных отклонений в самочувствии, тогда выявить их можно только при исследовании крови.
Начало заболевания нередко протекает без выраженных симптомов. Больные отмечают общую слабость, утомляемость, неопределенную боль в костях, непостоянную температуру по вечерам в пределах 37,1–38 градусов. Но уже в этот период у некоторых больных можно обнаружить небольшое увеличение лимфатических узлов, селезенки. В анализе крови тоже будут изменения — повышение или снижение количества лейкоцитов, анемия.
Лейкоз может проявляться разнообразными симптомами. При острой форме пациенты могут жаловаться, что стали часто простывать, у них возникли инфекционные осложнения или синяки на теле, а кого-то будет беспокоить резкая потеря веса, появление шишек на теле или увеличение лимфоузлов.
Симптомы лейкоза неспецифичны, они таковы:
- слабость;
- головокружения;
- высокая температура без явных на то причин;
- боли в руках и ногах;
- кровотечения.
При замещении патологически размножающимися лейкоцитами других клеток крови на первое место выходят анемии и кровотечения из-за уменьшения числа других клеток крови — эритроцитов и тромбоцитов. Из-за накопления лейкоцитов в лимфоузлах, печени или селезёнке эти органы могут увеличиться, но обнаружить эти симптомы уже может только врач.
При лейкозе субстратом опухоли является костный мозг, который находится во всех трубчатых и плоских костях. Здесь же развиваются предшественники крови: эритроциты, лейкоциты и тромбоциты. Когда в ткани начинают развиваться опухолевые клетки, места для нормальных здоровых клеток крови просто не остается. Если в случае с раком желудка пораженный участок можно удалить, вовремя провести химиотерапию и добиться длительной ремиссии, то при раке крови такая тактика не приемлема.
Есть формы острого лейкоза, которые могут развиваться с первых дней жизни человека. Хроническим формам лейкоза подвержены люди старшего возраста. Чем моложе возраст, тем агрессивнее протекает болезнь, но при современных методиках лечения больной может жить до 5–7 лет. На течение хронического миелолейкоза (и это научно доказано) большое влияние оказывает состояние нервной системы больного — если есть стрессы, депрессии, люди сгорают буквально на глазах.
Лечение лейкоза — это достаточно длительный процесс. В среднем на достижение ремиссии при острых лейкозах уходит от 3 месяцев до 2–3 лет.
Первый и самый сложный этап в лечении острого лейкоза — это интенсивная химиотерапия, с помощью которой мы должны убить опухолевые клетки. Пациенты должны находиться в специальном асептическом блоке, в котором созданы стерильные условия, чтобы исключить их контакт с любой инфекцией. Больные в этот момент не имеют никаких собственных факторов защиты, потому что кроветворение у них пострадало от самой болезни и применяемых химиопрепаратов. Для закрепления результатов терапии после этапа восстановления (или поддержки ремиссии) принимается решение о необходимости трансплантации костного мозга.
Пересадку можно делать, если пациента ввели в ремиссию. Она бывает двух видов: аутотрансплантация, когда пересаживается костный мозг самого больного, и аллотрансплантация, в этом случае ткани забирают у донора.
В первом случае у пациента из вены берется периферическая кровь, из нее при помощи сепаратора извлекают стволовые клетки, консервируют и передают на хранение в банк. Затем пациенту проводят сильнейшую химиотерапию, а следом проводят пересадку — так же, через вену, вводят стволовые клетки, и они начинают творить новое потомство. Технически это выглядит как переливание крови. Пересадка может быть сделана и при хроническом лейкозе.
Аллотрансплантация дает хорошие результаты, если доноры — родные сестра или брат, у них самый близкий фенотип. Пересадка даже от двоюродных родственников не всегда бывает столь успешна, но все равно это шанс на то, что человек будет жить.
Лучшие доноры костного мозга — это мужчины в возрасте 30–40 лет, семейные, имеющие постоянное место работы. Желательно — на промышленном производстве, на заводах. Практика показывает, что именно такие люди относятся к донорству с наибольшей ответственностью.
Женщина тоже может стать донором костного мозга. Но здесь важно учесть, что после родов и беременностей в крови у женщин циркулируют антитела, и их лейкоциты уже настроены бороться с чужеродными антигенами. Поэтому результат пересадки может оказаться хуже.

Рис. 1. Предполагаемый механизм проникновения клеток острого лимфобластного лейкоза в центральную нервную систему (ЦНС). Оболочка мозга состоит из трех слоев: твердая оболочка (Dura mater), паутинная (арахноидальная) оболочка (Arachnoid), подпаутинное (субарахноидальное) пространство (Sub-arachnoid space) и мягкая оболочка (Pia mater). Клетки острого лимфобластного лейкоза покидают место их формирования в костном мозге и по наружной поверхности кровеносных сосудов попадают в подпаутинное (субарахноидальное) пространство — полость между мягкой и паутинной мозговыми оболочками головного и спинного мозга, заполненная спинномозговой жидкостью (ликвором). Процесс миграции зависит от фермента PI3Kδ (не показан) и требует наличия рецепторного белка интегрина альфа-6 (α6 integrin) на поверхности мигрирующей клетки. Этот рецептор может связываться с белком ламинином, локализованным на наружной поверхности кровеносных сосудов, а также в оболочках мозга. В норме ламинин способствует миграции клеток нервной системы при развитии организма. Таким образом, раковые клетки, вероятно, осуществляют пиратский захват компонентов естественного пути миграции. Рисунок из популярного синопсиса к обсуждаемой статье в Nature Medicine
Острый лимфобластный лейкоз — злокачественное заболевание, при котором неконтролируемо размножаются незрелые белые кровяные клетки (лимфобласты). Попадание таких клеток в центральную нервную систему отягощает прогноз течения болезни. Терапия в таких случаях затруднена из-за того, что большинство лекарств не могут преодолеть гемато-энцефалический барьер, защищающий мозг от вредных веществ и микроорганизмов. Однако лимфобластам как-то удается попасть в мозг, несмотря на наличие этого барьера. Ученые из Университета Дьюка (США) изучили на модельных мышах пути проникновения клеток острого лимфобластного лейкоза в центральную нервную систему и обеспечивающие его механизмы. Оказалось, что эти клетки проникают в мозг по кровеносным сосудам, но не с кровотоком, а мигрируя по их наружной поверхности. Ключевую роль в такой миграции играет взаимодействие интегрина лимфобластов с ламинином сосудов. Подавление экспрессии интегрина или нейтрализация его специфическими антителами блокирует миграцию клеток острого лимфобластного лейкоза в мозг и вызываемое ими поражение центральной нервной системы.
Злокачественные клетки острого лимфобластного лейкоза (англ. Acute lymphoblastic leukemia, ALL) склонны проникать в центральную нервную систему (ЦНС) и образовывать там метастазы. В отличие от метастазов солидных опухолей (развившихся не из клеток кроветворной системы, а из различных тканей организма) метастазы острого лимфобластного лейкоза редко проникают во внутренние отделы мозга, а локализуются на его оболочках. Проникновение клеток острого лимфобластного лейкоза в мозг сильно снижает эффективность противораковой терапии. А применяемые в таком случае химиотерапевтические средства и радиотерапия могут повредить мозг.
Оболочки мозга представляют собой структуру из четырех слоев. Дальше всего от мозга находится твердая оболочка состоит из соединительной ткани и выстилает внутреннюю часть черепа и спинномозгового канала. Сразу под ней расположена тонкая паутинная (арахноидальная) оболочка, снабженная небольшим количеством нервов и сосудов. Самая внутренняя — мягкая оболочка. Она сращена с мозгом, заходит в борозды и содержит большое количество кровеносных сосудов. Между мягкой и паутинной оболочкой находится подпаутинное (субарахноидальное) пространство, содержащее спинномозговую (цереброспинальную) жидкость, или ликвор, омывающую головной и спинной мозг. Она обеспечивает механическую защиту этих органов и поддерживает обменные процессы между центральной нервной системой и кровью. По составу ликвор похож на плазму крови, прошедшую через фильтр тонкой очистки, но, в отличие от плазмы крови, в ликворе почти нет белков (около 0,3% от белков плазмы), в норме нет красных кровяных клеток и совсем немного белых кровяных клеток.
Чтобы проникнуть в ЦНС, клетки острого лимфобластного лейкоза должны преодолеть гемато-энцефалический барьер (ГЭБ, см. картинку дня Гемато-энцефалический барьер) — физиологический барьер, который защищает нервную ткань и отделяет спинной и головной мозг от обслуживающих их кровеносных сосудов. Стенки этих сосудов ЦНС более плотные, чем в остальных органах и тканях, поэтому многие лекарства, микроорганизмы и даже собственные иммунные клетки сами по себе в мозг проникнуть не могут — только с помощью специального активного транспорта. Однако клеткам острого лимфобластного лейкоза как-то удается попасть в ЦНС — но как именно, оставалось загадкой.
Известно, что метастазы в тканях ЦНС могут образовываться при всех подтипах острого лимфобластного лейкоза. Значит, лимфобласты могут пользоваться каким-то общим консервативным механизмом для того, чтобы достичь мозговых оболочек. Ученые из Института онкологии при Университете Дьюка (Duke Cancer Institute) во главе с Дороти Сипкинс (Dorothy Sipkins) показали, каким может быть этот механизм.
Фермент фосфоинозитид-3-киназы (англ. Phosphoinositide 3-kinases, или PI3K) играет важную роль в передаче межклеточных сигналов, которые регулируют рост и выживание клеток. Его дельта-изоформа — PI3Kδ — присутствует на поверхности нейронов и иммунных клеток, и его ингибиторы (например, иделалисиб) успешно применяются для лечения некоторых форм лимфомы. О влиянии ингибиторов PI3K на острый лимфобластный лейкоз данных не было. Испытание одного из таких ингибиторов, химического соединения GS-649443, провели на мышах, которым предварительно ввели внутривенно линию клеток острого лимфобластного лейкоза человека — Nalm-6. У мышей с иммунодефицитом после инъекций развилась острая лейкемия, поражающая ЦНС.
Рис. 2. Подавление активности PI3Kδ блокирует in vivo патологию центральной нервной системы, вызванную клетками острого лимфобластного лейкоза. a. Схема лечения иммунодефецитных мышей от острого лимфобластного лейкоза веществом GS-649443. b. Выживаемость мышей при лечении GS-649443. Изображение из обсуждаемой статьи в Nature
Рис. 3. Поражение центральной нервной системы, вызванное острым лимфобластным лейкозом, при позднем и раннем начале терапии веществом GS-649443. Изображение из обсуждаемой статьи в Nature
Испытание показало, что применение этого вещества продлевало жизнь мышей, больных острым лимфобластным лейкозом, на 50% (рис. 2), а количество опытных животных с поражением ЦНС снижалось в 3–6 раз (рис. 3). Еще одним важным результатом этого эксперимента было то, что, хотя в контрольной и опытной группе практически не различалось влияние болезни на клетки крови, костный мозг и селезенку, у мышей, получавших GS-649443, было заметно меньше развитие острого лимфобластного лейкоза в центральной нервной системе.
Далее надо было определить функцию PI3Kδ в проникновении клеток острого лимфобластного лейкоза с периферии в центральную нервную систему. Было известно, что ферменты семейства PI3K играют важную роль в миграции клеток. Оставалось проверить, влияет ли PI3Kδ на подвижность клеток острого лимфобластного лейкоза. Подавление PI3Kδ веществом GS-649443 существенно снижало их подвижность как in vitro, так и in vivo. Подвижность клеток, обработанных GS-649443 (то есть с подавленной PI3Kδ), снижалась как in vitro, так и in vivo: у этих клеток снижалась активность легкой цепи миозина (см. Myosin light chain) — молекулярного мотора, преобразующего химическую энергию клетки в кинетическую.
С помощью метода интравитальной микроскопии (см. Intravital microscopy ученые проследили распределение клеток острого лимфобластного лейкоза в костном мозге, но не нашли никаких отличий между больными мышами, которым вводили плацебо (контрольная группа), и теми, кому вводили GS-649443 (опытная группа). Это означало, что лимфобласты не полностью утратили подвижность после ингибирования PI3Kδ, то есть миграция клеток в центральную нервную систему регулировалась каким-то другим механизмом.
Для определения молекул, участвующих в этом механизме, ученые провели анализ экспрессии генов, связанных (см. Фокальные контакты) с перемещением и прикреплением клеток к поверхности, в клетках спинномозговой жидкости и костного мозга опытных мышей. Результат оказался как раз таким, каким его ожидали: экспрессия этих генов была понижена. Но более всего ученых заинтересовал ген ITGA6, кодирующий белок интегрин альфа-6, поскольку он связан и с миграцией клеток, и с развитием центральной нервной системы. Они определили подвижность клеток острого лимфобластного лейкоза in vitro, сравнив их перемещения на специальных подложках — матрицах, моделирующих внеклеточный матрикс (сравнивали матрицы, состоящие только из коллагена, из коллагена и фибронектина и из коллагена и ламинина). Выяснилось, что во взаимодействии с PI3Kδ, интегрин альфа-6 контролирует миграцию клеток вдоль матрицы, образованной белками ламинином и коллагеном. В ЦНС ламинин локализован на наружной поверхности сосудов, на оболочках мозга и на поверхности сосудистого сплетения мозга.
Чтобы определить, проходят ли клетки острого лимфобластного лейкоза через стенки сосудов мягкой и паутинной оболочки, мышам ввели флуоресцентные клетки Nalm-6 и с помощью интравитальной микроскопии в реальном времени проследили распределение клеток Nalm-6 в сосудистой сети (рис. 4). Несмотря на то что в день инъекции клетки острого лимфобластного лейкоза циркулировали в сосудах мягкой и паутинной оболочек, клетки Nalm-6 не проходили через гематоэнцефалический барьер в течение всего времени наблюдения (см. видео в дополнительных материалах к статье). Зато клетки Nalm-6 быстро проникали через стенки сосудов костного мозга вскоре после внутривенной инъекции. Гистохимическое окрашивание отделов ткани головного мозга подтвердило, что клетки Nalm-6 отсутствовали в ткани мягкой и паутинной мозговых оболочек до поздних стадий заболевания.


Рис. 4. Схема проведения конфокальной интравитальной микроскопии в реальном времени, с помощью которой авторы обсуждаемой работы проследили распространение клеток острого лимфобластного лейкоза в кровеносных сосудах мягкой и паутинной оболочек мозга. Leptomeningeal vasculature — кровеносные сосуды паутинной и мягкой оболочек, Bone marrow — костный мозг, Calvarium bone — кость свода черепа, Sub-arachnoid space — подпаутинное пространство, Cerebral cortex — кора головного мозга. Рисунок из обсуждаемой статьи в Nature
Детальный иммуногистохимический анализ показал, что эти клетки проникают в мозговые оболочки очень необычным путем — не через кровеносные сосуды с кровотоком, а путем миграции по наружной поверхности сосудов, проходящих напрямую между костным мозгом позвоночника или черепа и подпаутинным пространством. Базальная мембрана этих сосудов насыщена ламинином, про который известно, что он координирует перемещения нейронных клеток-предшественников. GS-649443 подавлял эту миграцию. Аналогично действовали антитела к интегрину альфа-6, не влияя на прогрессию заболевания вне центральной нервной системы.
Результаты, полученные на мышах, соответствовали клиническим наблюдениям. У больных острым лимфобластным лейкозом частота инвазии лимфобластов в мозг положительно коррелировала с высоким уровнем экспрессии интегрина-альфа-6.
Блокирование проникновения раковых клеток в мозг представляется очень эффективным подходом с точки зрения клинической практики для лечения как острого лимфобластного лейкоза, так и ряда других форм онкологических заболеваний. В частности, другой ингибитор PI3Kδ, иделалисиб, уже успешно применяется для лечения ряда гематологических раков. Возможно, он откроет пути предотвращения миграции острого лимфобластного лейкоза или других раков в мозг.
Эта элегантная работа не только открывает новые перспективы исследований, но и ставит ряд вопросов. Пока неясно, полностью ли верны для человека результаты, полученные на модельных мышах, и могут ли клетки солидных (негематологических) раков использовать пути проникновения в мозг, свойственные для острого лимфобластного лейкоза. Ранее на модельных мышах было показано, что проникновению раковых клеток в мозг, в том числе при лейкозе, мешает подавление активности VEGF-A — фактора роста эндотелия сосудов (V. Münch et al., 2017. Central nervous system involvement in acute lymphoblastic leukemia is mediated by vascular endothelial growth factor). При остром лимфобластном лейкозе уровень экспрессии VEGF-A повышен, и антитела к нему могут подавить миграцию злокачественных клеток в мозг.
Авторы обсуждаемой работы показали, что лечение мышей ингибитором PI3Kδ веществом GS-649443 существенно снижало экспрессию VGEF-A, но вопрос об участии этого белка в колонизации ЦНС клетками острого лимфобластного лейкоза пока остался без ответа. В отличие от солидных раков, формирование новых кровеносных сосудов в случае острого лимфобластного лейкоза, вероятно, не требуется. Возможно, VGEF-A производит какую-то модификацию кровеносных сосудов, способствующую проникновению лимфобластов в мозг.
Источники:
1) Hisayuki Yao, Trevor T. Price, Gaia Cantelli, Brandon Ngo, Matthew J. Warner, Lindsey Olivere, Sarah M. Ridge, Elizabeth M. Jablonski, Joseph Therrien, Stacey Tannheimer, Chad M. McCall, Anjen Chenn & Dorothy A. Sipkins. Leukaemia hijacks a neural mechanism to invade the central nervous system // Nature. 2018. V. 560. P. 55-60.
2) Frank Winkler. Leukaemia follows a blood-vessel track to enter the nervous system // Nature. 2018. V. 560. P. 35-36. (Популярный синопсис к обсуждаемой статье.)
Читайте также:

