Краниальное облучение при лейкозе
Лимфобластный лейкоз крови считается самой распространенной онкологической патологией детей. Она составляет примерно 25% от общего количества раковых опухолей, выявляемых в педиатрии. Далее рассмотрим подробнее лейкоз крови – что это такое, почему он появляется и какие терапевтические мероприятия проводятся при этой патологии.

Общие сведения
Лейкоз крови – что это такое? Данное заболевание относится к группе онкологических. ОЛЛ (острый лимфобластный лейкоз), симптомы которого будут рассмотрены ниже, представляет собой группу гетерогенных новообразований из клеток, которые имеют определенные иммунофенотипические и генетические характеристики. Увеличению выработки и накоплению этих элементов в костном мозге способствуют вторичные аномалии пролиферации, дифференцировки либо того и другого. В результате происходит инфильтрация клетками паренхиматозных органов и лимфатических узлов. Большая часть (порядка 80%) всех лейкемий (лейкозов), выявляемых у детей, имеет лимфоидную природу.
Распространенность
Злокачественные заболевания крови сегодня встречаются в мире повсеместно. Распространенность ОЛЛ в развитых странах составляет 3-4 случая на сто тысяч детей ежегодно. В странах Средней Азии и Африки патология встречается реже. Часто ОЛЛ отмечается в США, Японии, Китае, Европе. Пиком заболеваемости у детей считается возраст 2.5-5 лет. Чаще патология развивается у мальчиков.
Предрасполагающие факторы
В первую очередь к ним следует отнести возраст матери в дородовой период, большой вес новорожденного – больше 4000 г, пост- и пренатальную экспозицию к ионизирующей радиации. В каких случаях еще может возникнуть острый лимфобластный лейкоз? История болезни матери может содержать информацию о гибели плода в предыдущей беременности. Это могло произойти вследствие неблагоприятных условий среды или из-за генетической предрасположенности. В случае наличия в семье онкологически больных родственников, увеличивается вероятность того, что у будущих поколений возникнет острый лимфобластный лейкоз. Причины заболевания могут быть связаны с синдромами нестабильности хромосомных элементов. К ним, в частности, относятся синдром Дауна, нейрофиброматоз, вариабельный иммунодефицит, анемия Фанкони, Х-сцепленная агаммаглобулинемия (врожденная) и прочие. В результате ряда исследований специалисты пришли к выводу, что при остром лимфобластном лейкозе, как и при развитии прочих онкологий, происходит спонтанная мутация клеток-предшественников. Она впоследствии осложняется пусковыми факторами среды, которые активизируют пролиферацию. Это наиболее распространенные явления, которые могут спровоцировать лейкоз. Причины возникновнения патологии являются одним из основополагающих моментов при выборе терапевтических методов.
Диагностика
При выявлении любой патологии онкологического характера принимаются во внимание клинические характеристики и признаки клеток, которые составляют опухолевый субстрат. Диагноз ОЛЛ ставится на основании параклинического и физикального обследований, данных анамнеза и лабораторных исследований.
Клиническая картина
Признаки лейкоза представляют собой комплекс нескольких синдромов:
- Интоксикационный. При остром лимфобластном лейкозе отмечается недомогание, снижение веса, слабость, лихорадка. Последняя может быть спровоцирована вирусной, бактериальной, протозойной (редко) или грибковой инфекцией, в особенности у пациентов с нейтропенией.
- Гиперпластический. При остром лимфобластном лейкозе происходит инфильтрация селезенки и печени. Это, в свою очередь, приводит к гепатоспленомегалии, которая может проявляться болезненностью в животе. Первые признаки лейкоза - патологические переломы трубчатых костей либо позвоночника. Болезненность и отечность суставов изначально могут быть приняты за проявления ревматоидного артрита либо иных нарушений. Поражения костей – за остеомиелит. При лейкемической инфильтрации суставной капсулы и надкостницы, инфаркте кости и опухолевом увеличении костного мозга в объеме появляются обширные боли. Вместе с этим на рентгенограмме выявляются свойственные патологическому состоянию изменения. Особенно явно видны они около крупных суставов и в трубчатых костях. Болезненность может возникнуть и позже, вследствие асептического некроза и остеопороза.
- Анемический. При остром лимфобластном лейкозе отмечается тахикардия, бледность, кровоточивость слизистых во рту, геморрагический синдром на кожном покрове. Вследствие интоксикации и анемии развивается слабость.
Проявление патологии
В 5-30% случаев первичного острого лимфбластного лейкоза у мальчиков наблюдается инициальное увеличение яичек. Отмечаются двух- или односторонние плотные безболезненные инфильтраты. В практике зарегистрированы случаи существенного увеличения почек. При этом могут отсутствовать клинические проявления их поражения. К редким осложнениям относят выпотной перикардит и инфильтрацию миокарда на фоне обструкции лимфооттока между эпикардом и эндокардом. При увеличении лимфоузлов в средостении могут возникать нарушения в деятельности дыхательной системы. Эти признаки лейкоза Т-клеточного типа приводят к развитию синдрома полой верхней вены. Может также возникнуть и дыхательная недостаточность. В ряде случаев отмечается лейкемическая инфильтрация легочных тканей или кровоизлияния в них. Иногда специалистам трудно дифференцировать данные осложнения с инфекционными патологиями. Среди распространенных признаков поражения глаз на фоне острого лимфобластного лейкоза следует отметить кровоизлияние в сетчатку, отек соска в зрительном нерве, инфильтрацию сосудов. При офтальмоскопии могут быть выявлены бляшки на дне глазного яблока. Вероятно также наличие плотных синюшных инфильтративных безболезненных элементов на коже. При любом повреждении покрова может развиться инфекция. В связи с этим в процессе диагностики могут быть выявлены панариции, паронихии, инфицированные укусы различных насекомых, следы уколов и т. п.
Параклинические исследования: ОАК
Гемоглобин может быть пониженным либо нормальным. Гематокрит и количество эритроцитов обычно снижены. Отмечается уменьшение числа ретикулоцитов. Количество лейкоцитов может быть сниженным, повышенным или нормальным. Однако при этом не во всех случаях могут обнаруживаться властные клетки. Для патологии характерен "лейкемический провал". Речь идет о наличии властных клеток на фоне отсутствия промежуточных форм – метамиелоцитов и миелоцитов - в кровяной формуле. Обычно наблюдается тромбоцитопения.
Миелограмма
Данная процедура представляет собой взятие костномозговой пункции. Забор материала должен осуществляться минимум из двух точек. Процедуру проводить желательно под общим наркозом. У детей старше двух лет пункцию берут из передних и задних гребней подвздошных костей, до 2-х лет – из пяточных сегментов или бугристости большеберцовых элементов. При цитологическом морфологическом исследовании, как правило, обнаруживается гиперклеточный костномозговой материал с суженными ростками нормальной системы кроветворения и инфильтрацией бластными клеточными структурами.
Цитохимическое исследование
Это один из обязательных этапов диагностики. С использованием цитохимического окрашивания выявляется, к какой линии принадлежат клетки. Обязательно применяется исследование на миелопероксидазу.
Спинномозговая пункция
Это также обязательная диагностическая процедура при подозрении на острый лимфобластный лейкоз, причины которого указаны выше. Спинномозговая пункция должна проводиться в условиях седации и в случае наличия в периферической крови не менее 30 тыс/мкл тромбоцитов. При необходимости перед проведением процедуры проводят трансфузии тромбовзвеси. Для того чтобы приготовить цитопрепарат, потребуется не меньше двух миллилитров ликвора. При обнаружении властных элементов и признаков повреждения в черепно-мозговых нервах ставится диагноз нейролейкоз - лейкемическое поражение ЦНС. Следует, однако, отметить, что проникновение в нервную систему лимфобластов и инфильтрация оболочек мозга происходят во всех случаях, даже при отсутствии клинических и лабораторных проявлений. Также желательно, а при выявлении неврологических симптомов обязательно, провести компьютерную либо магнитно-ядерную томографию спинного или головного мозга.

Прочие исследования
При помощи УЗИ забрюшинного пространства и брюшной полости можно уточнить размеры паренхиматозных инфильтрированных органов, увеличенных лимфоузлов в брюшной полости и прочих областях, органов в малом тазу, яичек. В рамках диагностики проводят рентгенографию грудной клетки в двух проекциях. Это необходимо для обнаружения увеличения средостения. При наличии показаний назначается рентгенография суставов и костей. В рамках лабораторных исследований проводится биохимический анализ. Он, как правило, показывает увеличение ЛДГ больше 500 МЕ, вероятные нарушения в деятельности печени и почек. Перед началом химиотерапии рекомендованы ЭхоКГ и ЭКГ. Сегодня, кроме прочих методов, в исследовании пораженных клеток используются молекулярно-генетические и цитогенетические способы определения числа хромосом, а также их структурных изменений.
Терапия: общие сведения
Базовым принципом, на котором строится современная педиатрическая онкогематология, является разделение пациентов на группы по интенсивности терапии. Она выбирается в зависимости от тяжести, с которой протекает острый лимфобластный лейкоз. Прогноз состояния также имеет большое значение. Так, к примеру, тем, кому для устранения патологии достаточно умеренной химиотерапии, категорически не рекомендовано получать более токсичные и тяжелые средства. При этом для тех, чья предполагаемая выживаемость не так высока, интенсификация мероприятий может стать шансом на выздоровление. При разделении на группы пациентов, у которых диагностирован лейкоз, прогноз составляется на основании предшествующего опыта, а также отдельных протоколов, внесенных в системы классификации. В каждом из них формируется та или иная стратегия терапевтических мероприятий определенной интенсивности. При существующей классификации принято общее соглашение по распределению по группам риска больных, которым установлен диагноз "острый лимфобластный лейкоз". Лечение детей было разработано еще в конце шестидесятых годов прошлого столетия в Америке. По большому счету принципы, на которых строится терапевтическая тактика, не претерпели особенных изменений. У пациентов в возрасте до года патология проявляется в крайне агрессивной форме и характеризуется нейролейкозом, лейкоцитозом.
Основные терапевтические методы
В лечении используются такие препараты, как "Преднизолон" и "Винкристин". Применяется также эндолюмбальное введение средства "Метотрексат" и краниальное облучение для предупреждения нейролейкемии. Также была разработана специальная программа лечения. Это значит, что все пациенты получали определенные четко дозировки и комбинации химиопрепаратов в установленные конкретные сроки, соответственно протоколу. К концу семидесятых годов стало ясно, что после прохождения такой программы выздоравливали порядка 50% детей, у которых был диагностирован лейкоз. Причины дальнейшего прогресса в терапии патологии обусловлены определением гетерогенности ОЛЛ и введением впоследствии систем международной цитологической классификации и прогностических факторов, распределением пациентов по группам, разработкой дифференцированных программ. Важнейшее значение имела организация мультицентровых исследований, изучение фармакокинетики разных цитостатических средств для формирования более эффективных химиотерапевтических режимов, а также интенсивное развитие сопроводительных мероприятий.
Основные принципы терапии
Благодаря описанным выше мероприятиям, были созданы программы химиолечения нового поколения. Большинство используемых сегодня протоколов строится на принципах инициальной интенсивной терапии, целью которой является максимальное разрушение пула патологических клеток. В основе создания терапевтических программ лежит применение цитостатиков в виде комбинаций, сменяющих друг друга (ротация), высокодозных химиотерапевтических режимов, а также проведение интенсивной профилактики патологии.
Особенности применения препаратов
К основным лечебным и профилактическим мерам при нейролейкемии являются интратекальное введение средств "Преднизолон", "Цитозар", "Метотрексат" (в дозировках согласно возрасту) и краниальное облучение. Последнее осуществляется на начальных этапах терапии. При эндолюмбальном введении препарат "Метотрексат" оказывает системное действие. В связи с этим для уменьшения опухолевой массы необходимо раннее проведение первой люмбальной лечебной пункции. Краниальное облучение обладает отдаленными и непосредственными побочными эффектами. В связи с этим исследования по оптимизации терапии ОЛЛ, проводимые сегодня, направлены на уменьшение дозы и четкое выделение больных из группы пониженного риска, для которых эта лучевая терапия не является обязательной. Все эти достижения позволили в конце восьмидесятых готов прошлого века преодолеть 70-процентный барьер пятилетней выживаемости при лейкозе у детей без рецидивов.
Современные терапевтические программы
Лечение, которое применяется сегодня, включает в себя несколько фаз. Первой является индукция ремиссии с использованием трех и более агентов, которые вводят на протяжении 4-6 недель. Второй – мультиагентная консолидация предыдущей фазы. Третьей – поддерживающая терапия. Как правило, на последней фазе в течение 2-3 лет применяются антиметаболиты. Сопроводительная терапия способствует предупреждению и устранению многих осложнений, связанных с индуцированной цитопенией и иммуносупрессией. Необходимость применять поддерживающую терапию на протяжении 2-3 лет была доказана еще в середине прошлого столетия. Обычно в течение этого периода каждый день пациент принимает препарат "6-Маркаптопуриин". Еженедельно ему вводят средство "Метотрексат". В зависимости от числа лейкоцитов устанавливается дозировка. Как практика показывает, у пациентов удовлетворительная переносимость такого терапевтического режима. Выполнение поддерживающих мероприятий на 80% от требуемого объема считается неблагоприятным прогностическим фактором в плане рецидива.
Дополнительные сведения
Существует ряд проблем в лечение ОЛЛ. В частности, увеличивается количество больных с мутантными клонами клеток опухоли, устойчивых к химиотерапии, высокая стоимость и появление поздних побочных эффектов (нейроэндокринные расстройства, нарушение роста, вторичные опухоли). Неудачи индукционного лечения обусловлены ранней смертью пациентов в связи с токсическими осложнениями либо резистентной опухолью. Также весьма ограничены подходы к терапии больных, не ответивших на стандартный режим. В качестве альтернативных применяют такие средства, как "Тенипозид", "Вепезид", "Цитозар". Сегодня порядка 70% детей имеют 5-летнюю ремиссию. Острый лимфобластный лейкоз у взрослых рецидивирует в каждом седьмом случае. Это говорит о том, что длительности периода ремиссии удается достичь лишь в 20% случаев. Как правило, возврат патологии отмечается в первые 2 года после диагностирования. Состояние ремиссии характеризуется как отсутствие в крови властных клеток, наличие менее 5% бластов в костномозговой ткани, появление признаков восстановления нормы гемопоэза. При анализе спинномозговой жидкости выявляется менее 5 мононуклеаров/микролитр. Для успеха лечения обязательно быстрое достижение состояния ремиссии. У 90% больных, как правило, патологические клетки проявляют чувствительность к химиотерапии.
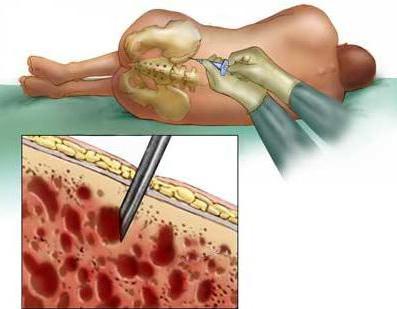
В заключение
Основной задачей терапии является избавление больного от патологии и возврат его к нормальной общественной жизни и к хорошему состоянию здоровья при минимальном количестве осложнений, обусловленных лечением. Добиться этого сегодня достаточно сложно. Связано это с тем, что большинство антилейкемических медикаментов недостаточно селективны и токсичны. Однако достижения в области понимания клинической и биологической гетерогенности патологии, постоянное проведение различных исследований дают надежду на то, что молекулярный патогенез заболевания будет все же расшифрован до конца. В этом случае знания о механизмах опухолевой трансформации позволят разработать более эффективные и наименее токсичные терапевтические средства.
Раком крови в непрофессиональном общении называют злокачественные новообразования, первично поражающие кроветворную ткань и циркулирующие в крови лейкоциты. В официальной медицинской терминологии такие заболевания называются лейкозами или лейкемией. Иногда раком крови называют лимфомы, но это не совсем так, поскольку в этом случае поражение костного мозга служит лишь следствием метастазирования.
Злокачественное перерождение при лейкозах происходит на уровне стволовых клеток. Процессы патологического деления и клонирования атипичных клеток, подавление естественной клеточной гибели приводят к замещению нормальных форменных элементов крови опухолевыми.
Основы классификации
- Клеточный фенотип — совокупность всех происходящих в клетке процессов.
- Степень дифференциации на момент клинических проявлений. Все разнообразные клетки организма берут общее начало от стволовых. По мере своего созревания они постепенно приобретают узкую специализацию. Чем выше степень дифференциации, тем клетка больше отличается от стволовых предшественников
Таким образом, выделяют 4 основных лейкоза, каждый из которых делится на множество подтипов:
- Острый лимфоцитарный лейкоз — самое распространенное онкологическое заболевание у детей. Представлен незрелыми и аномально долго живущими лимфоцитами.
- Хронический лимфоцитарный лейкоз. Чаще встречается в зрелом и пожилом возрасте. Представлен атипичными, но морфологически созревшими лимфоцитами.
- Острый миелоцитарный лейкоз — самый распространенный лейкоз у взрослых, который может носить вторичный характер. Представлен клетками-предшественниками миелоидного ряда — гранулоцитов и моноцитов.
- Хронический миелоцитарный лейкоз. Встречается в любом возрасте и представлен большим количеством незрелых клеток миелоидного ряда.
В отдельную группу выделяют так называемые миелодиспластические синдромы — целую группу заболеваний, при которых наблюдается неправильное развитие (дисплазия) клеток-предшественников различных линий кроветворения и дефицит зрелых форменных элементов в крови. У пациентов с такими заболеваниями повышается риск развития острого миелоидного лейкоза, но у большинства больных этого не случится.
Различные типы лейкоза имеют свои особенности, обусловливающие клиническую картину, течение заболевания, прогноз для жизни. Возможны бластные кризы, при которых заболевание приобретает характеристики острой патологии и угрожает жизни пациента.
Причины и факторы риска
Истинные причины большинства лейкозов пока неизвестны. Существуют факторы, которые возможно увеличивают риск развития заболевания:
- проникающая радиация;
- действие некоторых химических соединений, например, бензола;
- лечение некоторыми цитостатиками (химиотерапия);
- инфицирование вирусом Эпштейна–Барра;
- хромосомные нарушения, в том числе синдром Дауна;
- иммунодефицитные состояния.
Следует отметить, что, несмотря на то, что перечисленные факторы повышают риск развития лейкемии, у подавляющего большинства людей этого не происходит.
Клинические появления
Острые лейкозы обычно развиваются достаточно стремительно, и первые симптомы дают знать о себе за несколько недель до постановки диагноза. Нарушение нормального кроветворения приводит к таким частым симптомам лейкемии, как анемия и повышенная кровоточивость. В то же время другие проявления патологии неспецифичны и не всегда позволяют объективно ее заподозрить. Это слабость, недомогание, лихорадка, снижение веса. Обычно причины лихорадки при этом неизвестны, хотя в некоторых случаях дефицит гранулоцитов способствует быстрому развитию бактериальных инфекций.
Повышенная кровоточивость проявляется склонностью к образованию гематом, петехиальными высыпаниями, носовыми кровотечениями, менструальными нарушениями. Поражение костного мозга может вызвать боли в костях, что особенно характерно для детей с острыми лимфолейкозами. Возможно появление признаков инфильтрации атипичным клетками тех или иных органов: увеличение печени, селезенки, лимфатических узлов.
Хронические лимфолейкозы прогрессируют медленно. Нередко они вообще не имеют клинических проявлений или сопровождаются неспецифическими симптомами — незначительной лихорадкой или немотиврованной слабостью. Клинические проявления на ранних стадиях хронического миелолейкоза похожи, но спустя определенный промежуток времени происходит избыточное накопление опухолевых клеток и заболевание переходит в фазу бластного криза с резким ухудшением состояния пациента.
Прогноз
Значимые различия в природе и течении лейкозов обусловливают разный общий прогноз заболевания и эффективность проводимого лечения.
Ремиссия после стандартной терапии у детей имеет место в более чем 95% случаев. Более того, пятилетняя выживаемость без признаков заболевания, которую можно расценивать как выздоровление, у детей достигает 75% и более. У взрослых эти показатели составляют 70–90% и 30–40% соответственно.
Ремиссию удается достигнуть у 50–85% пациентов. В 20-40% случаев отмечают длительный безрецидивный период. Последний показатель несколько повышается при проведении интенсивной химиотерапии или пересадки стволовых клеток.
В отсутствие лечения, пациенты на начальных стадиях заболевания живут в среднем 5-20 лет, на поздних — 3-4 года после постановки диагноза. Меньшая продолжительность жизни связана с быстрым развитием недостаточности спинного мозга. Излечение при этой патологии обычно невозможно, а задача терапии состоит в увеличении продолжительности жизни и улучшении ее качества.
До появления таргетных цитостатиков, и в частности иматиниба, в течение двух лет после постановки диагноза погибало до 10% пациентов. Сегодня, если лечение начато в хроническую фазу, пятилетняя выживаемость превышает 90%. Основная опасность этого типа лейкозов заключается в бластных кризах, после которых в течение достаточно короткого времени погибает абсолютное большинство больных.
Диагностика
В постановке диагноза и дифференциальной диагностике ключевую роль играют лабораторные исследования:
- Общий анализ и мазок периферической крови. Можно отметить снижение уровня гемоглобина и тромбоцитопению, нарушение дифференцировки лейкоцитов, появление бластных клеток. Содержание белых кровяных телец может колебаться от 1*109/л до 200*109/л.
- Коагулограмма. Возможны различные нарушения в свертывающей системе крови, особенно при промиелоцитарном лейкозе.
- Аспирационная биопсия костного мозга. В биоптате обнаруживают высокое содержание бластов — до 95%.
- Иммунофенотипирование — лабораторный метод, позволяющий определить тип лейкоза, что крайне важно для определения тактики лечения.
- Цитогенетическое исследование. Проводится для определения хромосомных аномалий, которые могли привести к развитию заболевания.
- Биохимический анализ крови. Позволяет определить общее состояние организма, например, обнаружить почечную или печеночную недостаточность.
Помимо этого, для выявления инфильтрации клетками различных органов применяются методы лучевой диагностики: УЗИ, КТ, рентгенография.
Лечение
Тактика терапии при различных типах лейкемии может существенно отличаться. Основные методы лечения:
- Химиотерапия. Применяется для достижения ремиссии и ее закрепления практически при всех типах лейкемии.
- Терапия моноклональными антителами. Сравнительно молодой метод таргетной терапии, обеспечивающий избирательное уничтожение клеток опухоли. Применяется при острых и хронических лимфолейкозах.
- Дистанционная лучевая терапия. Вспомогательный метод лечения, в большей степени востребованный при поражении ЦНС или с паллиативной целью при хроническом лимфолейкозах.
- Пересадка гемопоэтических стволовых клеток. Высокоэффективный, но не всегда доступный метод лечения, который может применяться при большинстве лейкемий.
В каждом случае перед врачом стоит задача выбора наиболее оптимальной тактики в зависимости от типа лейкемии и ее стадии. Так, например, агрессивное ведение хронического миелолейкоза подчас оказывается опаснее для пациента, чем лечение в недостаточном объеме.
Томотерапия при раке крови
Лучевая терапия при лейкозах имеет ограниченное применение. Повреждающее действие ионизирующего излучения на здоровые ткани отнюдь не способствует улучшению общего состояния пациента и плохо влияет на общий прогноз. С учетом того, что химиотерапия позволяет достаточно эффективно добиваться ремиссии, классическая лучевая терапия отходит на второй план.
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Дата написания: 07.09.18
Дата обновления: 29.11.19
Проверил: Моров Олег Витальевич
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается немного чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев ОЛЛ не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться совершенно по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка - как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции. Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации. Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы - нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей традиционно считается связанным с несколько более высоким риском по сравнению с В-клеточным.
- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни. Так, филадельфийская хромосома – транслокация t(9;22) – требует подключения дополнительных лекарств к терапии. Транслокация t(4;11) часто требует трансплантации костного мозга. В то же время, например, транслокация t(12;21) чаще всего связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться, в зависимости от протокола, такие лекарства, как гормоны-глюкокортикостероиды, аспарагиназа и пэгаспаргаза, винкристин, антрациклины (даунорубицин и др.), иногда и другие препараты. Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ. При плохом ответе на терапию индукции пациент переводится в группу более высокого риска.
Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться, опять-таки в зависимости от конкретного протокола, метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.
Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – полтора-два года. На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения. Лекарства принимаются в виде таблеток, их прием не требует пребывания в больнице.
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. Для интратекального введения при ОЛЛ используется метотрексат, цитарабин и глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия. Выбор метода лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех лекарственной терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива или при плохом ответе на терапию индукции), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой, чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
В последние годы появилось несколько новых возможностей лечения сложных случаев ОЛЛ. Особо следует отметить иммунопрепарат блинатумомаб и CAR T-клеточную терапию, применяемые при В-клеточном ОЛЛ.
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить около 85% больных детей. У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение многих лет.
Читайте также:

