Для доброкачественных опухолей характерно отсутствие метастазов
Опухоль – новообразование, которое появилось в организме в результате нарушения роста, деления и дифференцировки клеток. Все опухоли разделяются на доброкачественные и злокачественные. Их основное отличие заключается в степени дифференцировки. Доброкачественные опухоли имеют зрелые клетки, которые можно отнести к определенному виду ткани, они медленно растут и не дают метастазов. Злокачественные опухоли состоят из клеток с низкой дифференцировкой, склонны прорастать в окружающие ткани и давать метастазы, поражая другие органы.
Причины появления в организме доброкачественных опухолей
Существует ряд факторов, которые могут увеличивать вероятность возникновения доброкачественных опухолей. Наиболее частыми из них являются:
- Вирусная инфекция.
- Травмирование тканей.
- Нарушение иммунитета.
- Гормональные заболевания.
- Влияние ультрафиолета и радиации.
- Врожденные аномалии.
В результате воздействия этих причин повреждаются молекулы ДНК клеток, и тем самым нарушаются процессы их деления.
Симптомы доброкачественных опухолей
Общая симптоматика может быть сходна при всех видах доброкачественных опухолей. Основными проявлениями могут быть усталость, нарушение сна, снижение веса, ощущения инородного тела и сдавливания. Если опухоль находится близко к коже, то ее можно определить на ощупь. Для доброкачественных новообразований характерна подвижность и лёгкая болезненность. Иногда цвет участка кожи над опухолью может отличаться. Если опухоль вырастает до больших размеров, появляются симптомы сдавливания окружающих тканей и нарушается функционирование органа.
Среди наиболее частых доброкачественных опухолей, которые диагностируют у лиц молодого и среднего возраста, являются:
- Фиброма (фиброаденома) молочной железы. Эта опухоль из соединительной ткани, которая локализуется между долек молочной железы. Пациенты могут жаловаться на болезненность в железе, изменения её размера и формы. При ручном осмотре обнаруживаются подвижный плотный узелок. Для более точного определения типа опухоли необходимо провести дополнительное исследование, например, кор-биопсию молочной железы.
- Липома. Опухоль из жировой ткани, одна из наиболее распространенных. Может формироваться в любой части тела (в области поясницы, живота, в руках и ногах). Липомы могут быть одиночными и множественными, а также иметь разную морфологическую структуру. При подкожном расположении она определяется как округлое плотное образование, не связанное с окружающими тканями, как правило, безболезненное.
- Гемангиома печени. Сосудистая опухоль печени может долго не давать никаких симптомов и обнаруживается случайно. При больших размерах появляются боли в правом подреберье, симптомы диспепсии. Опасным осложнением этой опухоли является кровотечение, требующее экстренного оперативного вмешательства.
Кроме того, доброкачественные опухоли могут развиваться и в других органах – желудке, кишечнике, почках и т.д.
Диагностика доброкачественных опухолей
Существуют разнообразные способы диагностики доброкачественных опухолей. Так как клинические проявления долгое время отсутствуют, очень часто опухоли обнаруживают случайно во время профилактического осмотра или в процессе лечения других заболеваний.
Пальпация позволяет определить новообразование, расположенное близко к коже. В других случаях используют ультразвуковое исследование, рентген, компьютерную или магнитно-резонансную томографии. Для установления типа клеток, из которых состоит опухоль, в некоторых случаях проводят биопсию с последующим анализом полученного материала.

Осложнения
Обычно доброкачественные новообразования имеют благоприятное течение, но в некоторых случаях могут возникать осложнения:
- Перерождение в раковую опухоль.
- Нарушение кровоснабжения и иннервации рядом расположенных тканей, когда во время роста опухоли затрагиваются сосуды и нервы.
- Сдавливание опухолью находящихся рядом органов может приводить к серьезным нарушениям их работы.
- Если опухоль имеет ножку, может случиться ее перекручивание с отмиранием опухоли и последующей интоксикацией организма.
Для того чтобы не допустить развития подобных ситуаций, необходимо регулярно проходить профилактическое обследование и своевременно устранять проблему.
Лечение доброкачественных опухолей
Варианты лечения опухолей зависят от следующих факторов: локализация, размер, состояние пациента. В одних случаях достаточно наблюдать за опухолью. В других случаях рекомендуется хирургическое лечение, которое может включать малоинвазивные операции, либо радикальное вмешательство с удалением части тканей или всего органа целиком (например, при угрозе превращения в злокачественную опухоль). Если опухоль продуцирует гормоны, требуется медикаментозная коррекция гормонального дисбаланса.
Регулярные профилактические осмотры позволяют своевременно обнаружить опухоль, провести лечение и предотвратить возможные осложнения.
Клинически опухоли делят на доброкачественные и злокачественные.
Доброкачественные опухоли:
1) Состоят из незрелых малодифференцированных клеток, но близких к исходной ткани.
2) Характерен тканевой атипизм.
3) Экспансивный рост.
4) Не дают метастазов.
5) Не оказывают общего отрицательного влияния на организм.
6) При определенных условиях могут приобретать злокачественный рост (или переходить в злокачественные)- малигнизироваться (озлокачествляться).
Злокачественные опухоли:
1) состоят из незрелых клеток.
2) Характерен как тканевой, так и клеточный атипизм.
3) Инвазивный рост.
4) Дают метастазы, т.е. клетки опухоли могут переноситься с током крови (чаще лимфы) по организму и вызывать развитие вторичных опухолевых узлов в других органах и тканях. (поэтому при онкозаболеваниях проверяют лимф.узлы).
5) Способны рецидивировать, т.е. после удаления или химиотерапии возобновлять свой рост.
Влияние доброкачественной опухоли на организм:
1. оказывает местные изменения – сдавливает окружающие ткани и соседние органы.
Влияние злокачественной опухоли на организм:
1. изменяется картина крови: а) развивается анемия
б) ↑ СОЭ (до 80мм/ч, норма 15)
2. изменяется обмен веществ в организме и развивается кахексия- высшая степень истощения или атрофии.
3. местные изменения – разрушение органа.
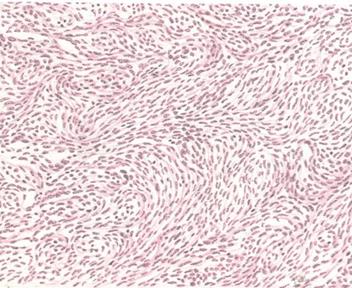
Рис. 13. Лейомиома. Пучки неисчерченных мышечных клеток различной толщины, расположены неравномерно.

Рис. 14. Интраканаликулярная фиброаденома молочной железы. Железистые образования опухоли (а) сжаты пучками стромы (б).

Рис. 15. Carcinoma in situ шейки матки.
a — слой покровного эпителия слизистой оболочки утолщен, его клетки полиморфны,
атипичны, ядра гиперхромны, много митозов; б — базальная мембрана сохранена;
в — подлежащая соединительная ткань; г — кровеносные сосуды.

Рис. 16. Аденокарцинома желудка, а — железистые образования опухоли;
б—митозы в раковых клетках.
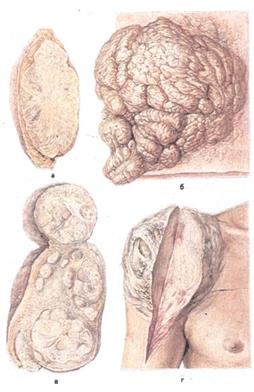
Рис. 17.Мезенхимальные опухоли. а — твердая фиброма подкожной клетчатки;
б — мягкая фиброма кожи; в — множественные лейомиомы матки;
г — фибросаркома мягких тканей плеча.

Рис.18.Пигментный невус.Меланинсинтезирующие клетки образуют островки
(а), разделенные прослойками соединительной ткани (б). Зерна меланина в цитоплазме соединительнотканных клеток (в).

Рис. 19. Костный мозг при остром лимфобластном лейкозе.
Ткань мозга состоит в основном из лимфобластов (а), просветы сосудов заполнены теми же клетками (б).
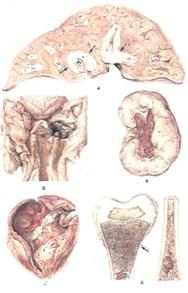 |
Рис. 20. Острый лейкоз, а — лейкозная инфильтрация печени (показано стрелками); б—некроз миндалины (некротическая ангина); в — лейкозная инфильтрация почек;
г— множественные кровоизлияния в эпикарде и эндокарде; д — лейкозная инфильтрация костного мозга (пиоид-ный костный мозг), истончение кортикального слоя бедренной кости (показано стрелкой).
Классификация опухолей:
I. опухоли эпителиальной ткани:
Ø из железистого эпителия- аденома
Ø из покровного эпителия – папиллома
2. злокачественная опухоль эпител.ткани – рак, аденокарцинома- железистый рак.
II.опухоли соединительной ткани:
1. доброкачественные (по названию ткани + Ома):
Ø жировой ткани – липома
Ø хрящевой ткани –хондрома
Ø соединительной ткани – фиброма
Ø костной ткани –остеома, остеобластома
Ø кровеносных сосудов -гемангиома
2. злокачественная опухоль соед. ткани -саркома (остеосаркома, хондросаркома, ангиосаркома и т.д); меланома- злокачественная опухоль меланинобразующей ткани (одна из самых злокачественных).
III. опухоли мышечной ткани:
1. доброкачественные -миома
IV. опухоли нервной ткани :
1. спинного мозга и головного мозга
2. ВНС (симпатобластома – крайне злокачественная, встречается редко обычно удетей)
3. оболочек головного мозга(менингиома- доброкачественная)
4. периферической н.с.(ганглионеврома- доброкачественная)
V. тератомы (врожденные уродства) доброкачественные опухоли из бластомеры;
тератобластомы – злокачественные опухоли бластомер.
 Рис. 21 |
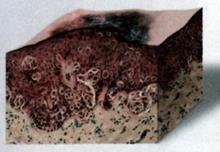 Рис. 22 |
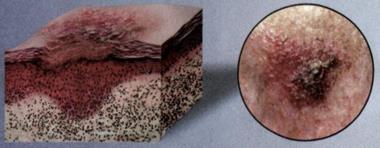 Рис. 23 |
 Рис. 24 |
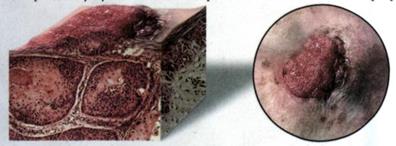 Рис. 25 |
 Рис. 26 |
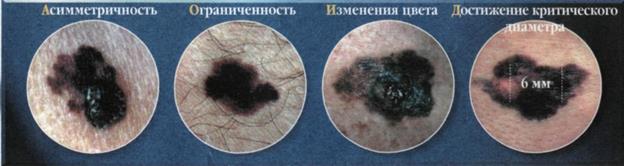 Рис. 27 |
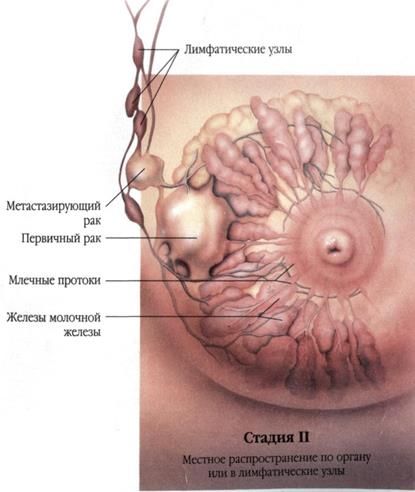 Рис. 28 |
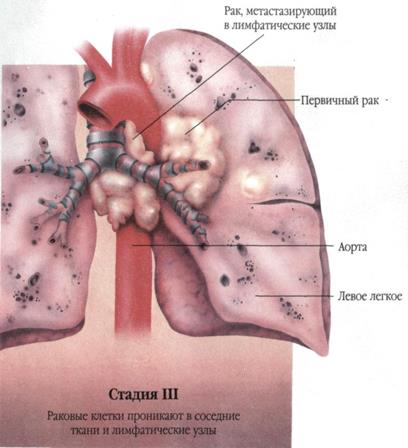 Рис. 29 |
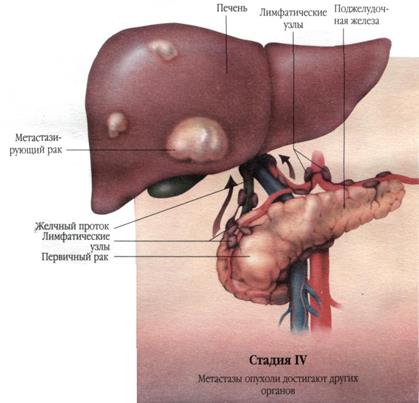 Рис. 30 |
 Рис. 31. Рак толстой кишки. а— полипозный; б—полипозный с выраженными вторичными изменениями (некроз, воспаление); в — грибовидный с изъязвлением; г — циркулярный. |
Опухоли
1. В опухоли различают
а) строму и паренхиму;
б) верхушку и основание;
в) дистальную и проксимальную части;
г) протоки и секреторную область.
2. Клеточный атипизм — это
а) появление клеток, принадлежащих к определенным тканям в нехарактерных для них местах;
б) быстрое размножение клеток;
в) появление структурных изменений в клетках, их отличие от обычных клеток конкретных тканей;
г.) врастание, опухолевых клеток в соседние с опухолью ткани.
3. При экспансивном росте опухоль
а) раздвигает окружающие ткани;
б) прорастает в окружающие ткани;
в) растет в просвет полого органа;
г) растет в толще стенки полого органа.
4. При инфильтрирующем росте опухоль
а) раздвигает окружающие ткани;
б) прорастает в окружающие ткани;
в) растет в просвет полого органа;
г) растет в толще стенки полого органа.
5. При экзофитном росте опухоль
а) раздвигает окружающие ткани;
б) прорастает в окружающие ткани;
в) растет в просвет полого органа;
г) растёт в толще стенки полого органа.
6. Метастаз — это
а) повторное появление опухоли на месте удаленной;
б) распад опухолевой ткани;
г) расстройство кровообращения в зоне опухолевого процесса.
7. Метастазы чаще всего распространяются
а) с током лимфы;
б) с током крови;
в) с током лимфы и крови;
г) при непосредственном контакте с опухолыо.
8. Для доброкачественных опухолей характерно
а) отсутствие метастазов;
б) клеточный атипизм;
в) наиболее частая локализация в костной ткани;
г) выраженное расстройство периферического кровообращения.
.а) злокачественная опухоль из эпителия;
б) доброкачественная опухоль из гладких мышц;
в) злокачественная опухоль из соединительной ткани;
г) доброкачественная опухоль из жировой ткани.
10. Саркома — это
а) злокачественная опухоль из эпителия;
б) доброкачественная опухоль из гладких мышц;
в) злокачественная опухоль из соединительной ткани;
г) доброкачественная опухоль из жировой ткани.
а) злокачественная опухоль из эпителия;
б) доброкачественная опухоль из гладких мышц;
в) злокачественная опухоль из соединительной ткани;
г) доброкачественная опухоль из жировой ткани.
12. Опухоль, возникающая из-за нарушения закладки эмбриональных листков, называется
13. Канцерогенные вещества — это
а) токсины, возникающие в организме при росте опухоли;
б) экзогенные вещества, способные вызвать возникновение злокачественной опухоли;
в) противоопухолевые антитела;
г) противоопухолевые химиопрепараты.
ОПУХОЛИ
На ФАП к фельдшеру обратилась женщина 52 лет с жалобой на появление уплотнений в разных участках тела.
Объективно: у женщины с ожирением II степени, масса 120 килограмм, на левой руке, спине, передней брюшной стенке определяются мягкие, эластичные, с четкими контурами, разных размеров безболезненные опухолевидные образования.
1.Назовите опухоль, из какой ткани она образовалась ?
2.Доброкачественная пли злокачественная ?
3.Прогноз для жизни.
При патронаже медицинская сестра у новорожденного при осмотре кожных покровов обнаружила на спине опухолевидное образование синюшно-красного цвета размером 3x5 сантиметров с неровной поверхностью, выступающее над поверхностью кожи. При надавливании - бледнеет.
1.Назовите опухоль, из какой ткани она образовалась ?
2.Доброкачественная или злокачественная ?
3.Какова тактика медицинской сестры ?
Мужчина 43 лет, обратился с жалобой на изменение внешнего вида пигментного пятна па левой руке.
Из анамнеза: известно, что по специальности он - каменщик, родимое пятно несколько раз кровоточило, в результате повреждения его металлическим браслетом от часов, периодически возникала тупая боль.
Объективно: на наружной поверхности предплечья, в области левого лу-чезапястного сустава видно пигментное пятно темно-коричневого цвета, размером 6x2 см, с блестящей поверхностью, кожа над ним с трещинами, приподнята. Вокруг пятна гиперемированный ободок, но признаков воспаления нет.
Опухоль была удалена хирургическим путем. При гистологическом исследовании новообразования выявлены клетки различной величины и формы, в цитоплазме большинства их обнаруживается черно-бурый пигмент.
1.Назовите опухоль, из какой ткани она развилась?
2.Укажите, что произошло с родимым пятном?
3.Чем обусловлен цвет опухоли?
Женщина 48 лет случайно у себя обнаружила в правой полочной железе небольшое плотное безболезненное образование.
Объективно: правая молочная железа несколько уменьшена в размерах, сморщена, сосок опущен вниз, по сравнению с соском здоровой железы.
В центральной части железы пальпируется безболезненное плотное образование величиной 2.5 * 2 сантиметра, с бугристой поверхностью. Пальпируются подмышечные и подключичные лимфоузлы справа.
Произведена секторальная резекция молочной железы. При гистологическом исследовании ткани опухоли обнаружено разрастание волокнистой соединительной ткани, среди которой найдены мелкие гнездные скопления атипичных клеток эпителия.
1.Назовите опухоль, из какой она ткани ?
2.Какая форма рака ?
3.Что преобладает: строма или паренхима ?
После ушиба колена, у мальчика появилось опухолевидное разрастание в области эпифиза бедренной кости. После стационарного обследования произведена ампутация бедра. При обследовании удаленной конечности в области нижнего эпифиза бедра обнаружено разрастание опухоли разрушающей кость, не имеющей четких границ, серо-розовою цвета вида "Рыбьего мяса". При исследовании микроскопической картины опухоли отмечается большое количество атипичных остеобластов.
1.Назовите опухоль, из какой она развилась ?
2.Доброкачественная или злокачественная ?
На ФАП к фельдшеру обратился мужчина с жалобами на длительно незаживающую ранку на нижней губе.
Из анамнеза: известно 4 месяца, отлетевшая щепка поранила нижнюю губу (больной по профессии лесоруб). На этом месте образовалась припухлость, которая стала изъявляться, увеличиваться в размерах, не болит, не кровоточит. Больной отмечает, что много курит.
Объективно: На нижней губе слепа видно небольшое образование диаметром 1 сантиметр, возвышается над слизистой красной каймой. Имеет плотную консистенцию, покрыто плоскими корочками, мало болезненно при пальпации. Пальпируются подчелюстные лимфоузлы, слева.
1. Назовите предположительный диагноз.
2.Назовите вид роста опухоли.
Мужчина 56 лет, обратился с жалобами на поперхивание, приступообоазный кашель, в мокроте обнаруживает прожилки крови.
Из анамнеза: больной курит с 15 лет, страдает хроническим бронхитом.
При бронхоскопии слизистая оболочка бронхов в области бифуркации не ровная, с участками разрастания опухолевидной ткани. При гистологическом исследовании ткани опухоли обнаружены множественные гнездные скопления эпителиальных клеток с явлениями полиморфизма и большим числом митозов.
1. Из какой ткани развилась опухоль?
2. Что является предраковым заболеванием?
3. Какие методы исследования можно применить для подтверждения диагноза.
Больной К., 36 лет, рабочий анилинового завода, поступил в урологическое отделение с жалобами на тянущие боли над лобком во время мочеиспускания. При цистоскопии в области правого мочеточника видна грубоворсинчатая папиллярная опухоль. Слизистая мочевого пузыря, окружающая опухоль умеренно гиперемнрована, отечна. На основании проведенного обследования поставлен диагноз: рак мочевого пузыря. Больному назначена плановая операция.
1. Какова возможная причина возникновения опухоли?
2. Какие факторы могут определить эффективность оперативного лечения данного больного.
Больной Д., 62 лет, в прошлом кочегар, поступил в клинику с жалобами на общую слабость, резкое похудание, осиплость голоса, затрудненное дыхание, неприятный запах изо рта, сухой кашель. При ларингоскопии гортани обнаруживается бугристая изъязвленная опухоль, захватывающая более половины гортани. Опухоль прорастает в голосовые связки и надгортанник. Шейные лимфоузлы увеличены, плотные на ощупь, безболезненны. При анализе крови обнаружена выраженная анемия.
1. Как объяснить изменения общего состояния больного?
2. Как называется описанный характер роста опухоли и для каких новообразований он свойственен?
3. Характерно ли метастазирование для таких опухолей?
Пациент М, 56 лет, страдающий более 20 лет атрофическим гастритом и низкой желудочной кислотностью, жалуется на быструю утомляемость, слабость, боль в эпи-гастрии, плохой аппетит, быструю насыщаемость при еде, тошноту, значительное похудание в последние 4 месяца, постоянную лихорадку
При лабораторном исследовании: анемия, лейкоцитоз, снижение кислотности и активности ферментов желудочного сока. Гастроскопия выявила сглаживание рельефа слизистой пилорического отдела желудка и наличие диффузной опухоли с изъязвлением ткани в её центре (в виде блюдца).
1. Почему наличие хронического атрофического гастрита способствует возникновению и развитию опухоли желудка?
2.Можно ли в данном случае, помимо прочего, предполагать у пациента недостаточность механизмов антибластомной резистентности организма? Если да, то каких именно? Если нет, то почему?
3. Каковы возможные причины и механизмы развития лихорадки и анемии в данном случае?
4. Каковы механизмы похудания пациента?
ТЕСТОВЫЕ ЗАДАНИЯ

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).


Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Все опухоли подразделяют в зависимости от их потенций к прогрессии и клинико-морфологических особенностей на две основные группы:
• доброкачественные опухоли
• злокачественные опухоли
Имеются 5 классических особенностей опухолевой ткани: атипизм (тканевой, клеточный), органоидность строения, прогрессия, относительная автономность и неограниченный рост.
Доброкачественная опухоль
Доброкачественные (зрелые, гомологичные) опухоли состоят из клеток, дифференцированных в такой мере, что можно определить, из какой ткани они растут. Для этих опухолей характерен медленный экспансивный рост, отсутствие метастазов, отсутствие общего влияния на организм. Доброкачественные опухоли могут малигнизироваться (превращаться в злокачественные).
Злокачественная опухоль
Злокачественные (незрелые, гетерологичные) опухоли состоят из умеренно- и малодифференцированных клеток. Они могут утратить сходство с тканью, из которой они исходят. Для злокачественных опухолей характерен быстрый, чаще инфильтрирующий, рост, метастазирование и рецидивирование, наличие общего влияния на организм.
Для злокачественных опухолей характерен как клеточный (утолщение и атипизм базальной мембраны, изменение соотношения объемов цитоплазмы и ядра, изменение ядерной оболочки, увеличение объема, а иногда и числа ядрышек, увеличение числа фигур митоза, атипизм митоза и др.), так и тканевой атипизм (нарушение пространственных и количественных соотношений между компонентами ткани, например, стромой и паренхимой, сосудами и стромой и т. д.). Опухоли головного мозга, как правило, являются злокачественными.
Влияние опухоли на организм
Местное влияние заключается в сдавливании или разрушении (в зависимости от типа роста опухоли) окружающих тканей и органов. Конкретные проявления местного действия зависят от локализации опухоли.
Общее влияние на организм характерно для злокачественных опухолей, проявляется различными нарушениями метаболизма, вплоть до развития кахексии.
Лечение: иссечение изменённых опухолью тканей, частичное иссечение близлежащих тканей и метастаз по ходу распространения.
Лечение опухоли
Оно может быть паллиативным или же радикальным. Радикальное лечение новообразований ориентируется на полное уничтожение патологического очага ракового процесса, предполагает возможность перехода злокачественного процесса на этап продолжительной ремиссии.
Паллиативная медицина в онкологии занимается использованием всевозможных вариантов радикальной медикаментозной терапии, ее меры направлены в первую очередь не на лечение, а на продление и улучшение качества жизни. Основной принцип паллиативной медицины – это максимально уменьшить страдания онкологического больного. Рецидивы при этом случаются довольно часто, но предпринимаются всевозможные меры для того, чтобы больной был полноценным членом общества.
Стандартная схема терапия подразумевает комбинацию хирургического метода, лучевой терапии и химиотерапии, в редких запущенных случаях допускается применение биологических противоопухолевых препаратов. Планировка терапевтического курса происходит с учетом особенностей больного, его специфических нужд, общего состояния, семейного положения, статуса в обществе.
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
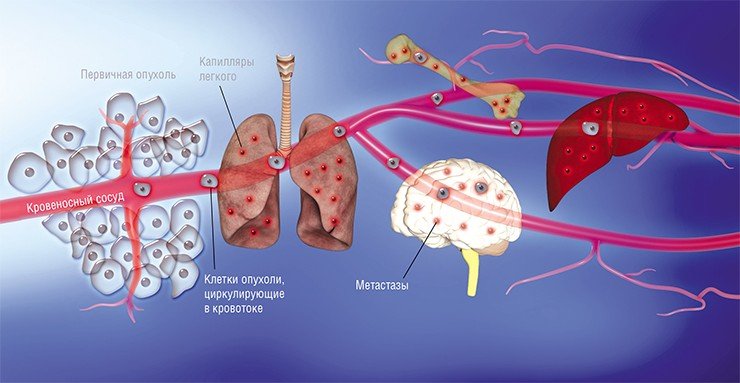
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
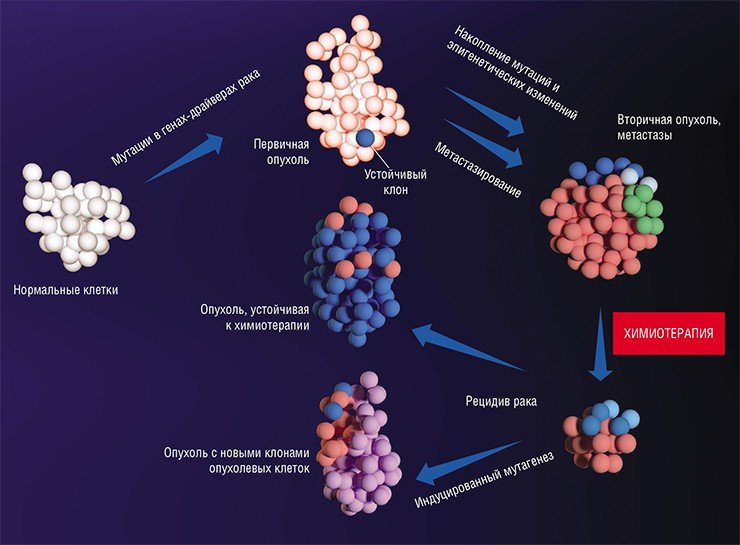
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
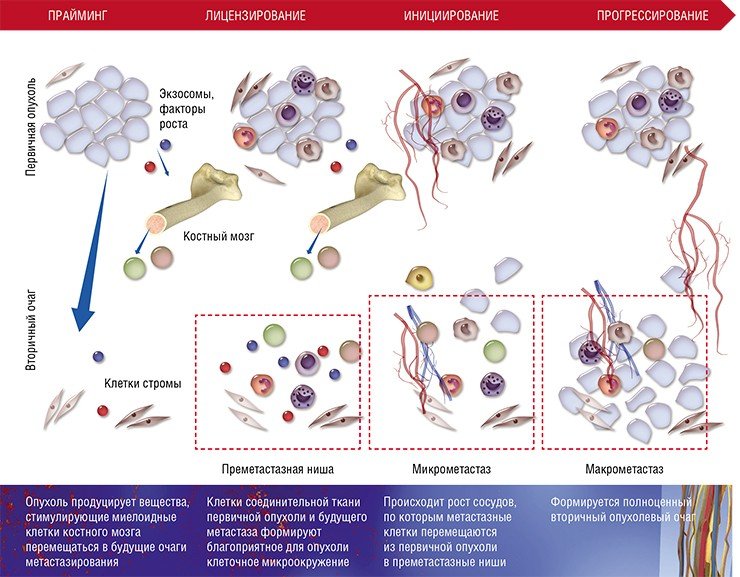
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
Читайте также:

