Кортикостероиды список препаратов при онкологии
Стероиды, продуцируемые корой надпочечников, получили название кортикостероидов.
В связи с тем что выработка гормонов коры надпочечника стимулируется адренокортикотропным гормоном гипофиза (АКТГ), последний также применяют в онкологической практике.
Известно, что среди большого числа гормонов коры надпочечников часть обладает свойствами половых гормонов андрогенного и эстрогенного действия.
После овариэктомии, производимой у молодых женщин по поводу рака молочной железы, обычно развивается гиперплазия коры надпочечников, и временно понизившийся уровень эстрогенов вновь повышается, чем, по-видимому, и объясняется непродолжительный эффект после овариэктомии. Следовательно, для усиления эффекта овариэктомии необходимо подавление функции коры надпочечников и дополнительной интерреналовой ткани с тем, чтобы добиться угнетения их эстрогенной функции. Это достигается путем либо адреналэктомии и гипофизэктомии, либо систематического введения кортикостероидов в течение длительного времени. Кортикостероиды угнетают продукцию АКТГ и опосредствованно через гипофиз приводят к угнетению функции интерреналовой ткани, включая кору надпочечников.
в случае их использования после орхиэктомии и терапии эстрогенами.
Кортикостероиды тормозят процессы пролиферации и благоприятно влияют на процессы созревания клеточных элементов кроветворной системы. Они подавляют митозы преимущественно в родоначальных клетках лимфоретикулярной ткани. В связи с этими свойствами кортикостероиды применяют при острых лейкозах. Данные об использовании кортикостероидов в терапии острых лейкозов представлены в монографии М. С. Дульцина, И. А. Кассирского, М. О. Раушенбаха (1965) и ряде других работ.
Однако полная гематологическая ремиссия под влиянием одних кортикостероидов наблюдается редко. В современной химиотерапии острого лейкоза кортикостероиды входят в качестве обязательного компонента в различные комбинации лекарственных средств.
При хроническом лимфолейкозе использование кортикостероидов нередко позволяет длительное время контролировать течение заболевания. Эффект кортикостероидов при лимфопролиферативных заболеваниях, в том числе при лимфолейкозе, объясняется лимфотропным действием, угнетающим влиянием на пролиферацию патологической незрелой ткани, стимулирующим влиянием на эритропоэз и гранулоцитопоэз и, наконец, способностью глюкокортикоидов подавлять аллергические и иммунные процессы, что делает эти препараты особенно ценными в борьбе с аутоиммунными осложнениями, характерными для течения лимфолейкоза.
Они входят также во многие схемы комбинированной химиотерапии солидных опухолей, например ангиогенных сарком. Кроме того, кортикостероиды используют для симптоматической терапии инкурабельных онкологических больных.
снимая явления отека вещества мозга; их назначают при гиперкальциемии, вызванной метастазами в кости, в более низкой дозе (10—40 мг) кортикостероиды нормализуют температуру тела, снижают опухолевую интоксикацию.
При назначении кортикостероидов с целью улучшения общего состояния необходимо помнить о возможности получения нежелательных эффектов. Wolf (1966) обнаружил, что применение кортикостероидов у больных неоперабельным раком легкого ведет с сокращению продолжительности их жизни по сравнению с контрольной группой, не получавшей никакого лечения.
Побочные явления при применении препаратов этой группы сводятся к нарушениям водного и солевого обмена, развитию алкалоза, повышению содержания сахара в крови, неврозу с возбуждением, бессоннице, иногда гирсутизму. Возможно развитие синдрома Кушинга, образование пептических язв желудка и двенадцатиперстной кишки.
Для предупреждения побочных явлений рекомендуется ограничить введение хлорида натрия, вводить соли калия и белковые вещества. Необходим контроль за содержанием сахара крови и изменениями психики. При длительном приеме высоких доз кортикостероидов с целью предохранения от распада белка целесообразно одновременно назначать анаболические средства, например метиландростендиол (25—50 мг в день), метандростенолон (дианабол, неробол).
Наибольшую опасность для ослабленных онкологических больных представляет присоединение вторичной инфекции, в частности грибковых заболеваний, так как глюкокортикоиды, подавляя реакции иммунитета, создают известную беззащитность организма. После длительного применения кортикостероидов может развиться угнетение функции надпочечников, поэтому в случае отмены лечения дозу кортикостероидов следует снижать постепенно, а для стимуляции коры надпочечников за 5—7 дней до прекращения приема кортикостероидов назначают АКТГ (10—20 единиц).
Наиболее распространенными препаратами группы кортикостероидов являются кортизон, гидрокортизон, преднизон, преднизолон, дексаметазон и триамцинолон.

выпускается обычно в виде кортизон-ацетата и представляет собой прегнен-4-диол-17а, 21-триона3,11,20-21-ацетат.
Применяется внутрь или внутримышечно. При острых лейкозах могут быть использованы высокие дозы: в начале лечения в течение 3—5 дней назначают по 75—100 мг 3 раза в сутки, затем по 50—75 мг 3 раза в сутки до наступления терапевтического эффекта. После этого препарат применяют по 50 мг 3 раза в сутки. Длительность лечения и дозы устанавливают индивидуально.
ежедневная суточная доза препарата составляет 50 мг, лучше вводить ее в 3—4 приема.
Выпускается в виде суспензии во флаконах по 5 мл (1 мл суспензии содержит 25 мг гидрокортизона) и применяется внутримышечно при тех же заболеваниях, что и кортизон. В связи с большой активностью гидрокортизона его доза обычно составляет 2/3 дозы кортизона.
представляет собой дегидрокортизон.
Эти синтетические препараты обладают эффектом кортизона, однако в 3—5 раз более активны и, что особенно важно, побочные явления при их применении менее выражены. Их применяют обычно внутрь при тех же заболеваниях, что и кортизон.
Дозы преднизолона и преднизона составляют 1\3 - 1\5 дозы кортизона. При острых лейкозах преднизон и преднизолон применяют в начальной дозе до 50—80 мг в сутки (дают за 2—3 приема). Длительность курсов и величина доз варьируют в зависимости от течения лейкоза. При применении методики средних доз до получения ремиссии принимают по 50—80 мг преднизолона в сутки, при наступлении терапевтического эффекта лечение не прекращают, а назначают поддерживающую дозу (15—30 мг в сутки). В случае выраженного угнетения интерреналовой системы через каждые 20—30 дней интенсивного лечения кортикостероидами надо вводить АКТГ в небольших стимулирующих дозах (15—20 единиц) в течение 4—5 дней.
— от 200—250 мг в сутки и даже до 1000 мг в сутки. Терапию кортикостероидами, даже в случаях отсутствия непосредственного эффекта, следует продолжать 4—5 нед. Обычно ее проводят в комбинации с лечением противоопухолевыми препаратами, в частности с антиметаболитами.
Учитывая возможность осложнений при длительной и массивной стероидной терапии целесообразно использовать прерывистый метод лечения, предусматривающий прекращение применения стероидных препаратов на время ремиссии.
— 9а-фтор-16а-метилпреднизолон в 8—10 раз активнее преднизона и преднизолона и в 35 раз активнее кортизона, в то же время в терапевтических дозах он, в отличие от кортизона, не вызывает задержки воды и хлорида натрия в организме. Выпускают препарат в таблетках по 0,0005 г (0,5 мг). Суточная доза 3—6 мг; принимают ее за 3—4 приема во время или после еды. Поддерживающая доза дексаметазона— 1 —1,5 мг в сутки.
Триамцинолон (Triamcinolonum) — 9а-фтор-16а-оксипреднизолон. Более активен, чем преднизолон; не вызывает задержки в организме воды и хлорида натрия, не оказывает влияния на калиевый баланс. Выпускают препарат в таблетках по 4 мг. Принимают внутрь в суточных дозах 16—40 мг. Поддерживающие дозы 2—10 мг (для. взрослых).
БАД "Фотостим" предназначен для:
- онкологических больных, имеющих злокачественные опухоли разных стадий;
- лиц с риском перерождения доброкачественных дерматозов (родинок, бородавок, папиллом) и предраковых состояний (лейкоплакий, дисплазивных очагов) в онкологические заболевания;
- лиц пожилого возраста для повышения сопротивляемости организма онкологическим заболеваниям;
- лиц, перенесших тяжелые хирургические, лучевые, химиотерапевтические* воздействия, в реабилитационный период для скорейшего восстановления организма;
- кроме того, "фотостим" рекомендуется к применению лицами с ослабленным иммунитетом.
Показания к применению фотостима.Существует несколько показаний для применения "Фотостима" : Механизм действия фотостима."Фотостим" усиливает гуморальный иммунитет в 60-70% случаев за счет роста популяции лимфоцитов, а в 30-40% случаев - популяции нейтрофилов в крови. Стимуляция клеточного иммунитета при употреблении "Фотостима" достигается за счет роста абсолютного количества фагоцитов а у 35% лиц также и за счет роста активности фагоцитов и NK-клеток. NK-клетки активируются под влиянием дисплазивных (аномальных) клеток, бактерий, их токсинов или продуктов метаболизма. В целом, " Фотостим" специфически стимулирует пролиферацию клонов В-клеток костного мозга и продукцию вилочковой железы. "Фотостим" стимулирует формирование антител к опухолевым клеткам, активирует регенерацию пораженных тканей и, таким образом, увеличивает продолжительность жизни (или предотвращает ее сокращение) и значительно улучшает качество жизни онкологических больных. Кроме того, во многих случаях тормозится рост первичного очага опухоли и предотвращается появление метастазов. "Фотостим" способен не только тормозить рост опухолей и вызывать их разрушение, усиливать и активировать имеющиеся механизмы защиты организма, но и уничтожать предшественников раковых клеток - дисплазивные (аномальные) клетки. Образно выражаясь, фотостим является "разведывательно-диверсионной группой", задачей которой является обнаружение врага - клеток, отличающихся от нормальных, передача информации в центр (в мозг) и осуществление скоординированных мероприятий по их уничтожению. Клинические исследования фотостима.Клинические исследования показали, что "Фотостим" :
"ФОТОСТИМ" Его уникальность заключается в том, что 1) Онкологическая клетка поглощает фотосенсибилизатор, например, "ФОТОСТИМ".
2) Орган освещается светом. Онкологическая клетка погибает.
Заключение института Геронтологии. Анализ полученных результатов свидетельствует о том, ВЫВОДЫ (фрагмент из заключения института геронтологии): "Фотостим" оказывает положительное влияние 1. Сдавление спинного мозга и отдельных нервных стволов. 2. Метастазы в печени. 3. Обструкция верхней полой вены. 4. Карциноматозный лимфангоит. 5. Усиление боли при приеме химиотерапевтических препаратов. 6. Обструкция дыхательных путей. 7. Реактивный отек после лучевой терапии. 8. Боли во время дефекации при опухоли прямой кишки. Кортикостероиды применяются вместе с другими анальгетиками при повышении внутричерепного давления, а также сдавлении спинного мозга и отдельных нервных стволов. Следует остановиться на особенностях обезболивания при различных причинах возникновения болевого синдрома. Костная боль возникает при увеличении образования в зоне опухолевого поражения простагландина Е, при вовлечении в процесс высокочувствительного периоста или при переломе кости. Средством выбора в подобных ситуациях является паллиативная лучевая терапия, которая имеет наименьший объем неблагоприятных побочных эффектов. Среди блокаторов синтеза 1 простагландинов избирательно более активны препараты типа С напроксена (0,5-1,0 г в день), доналгина (0,25-1,09 г в день) или пироксикама (20 мг в день). Опиаты применяются в дозах, зависимых от эффекта радиотерапии (возможно уменьшение дозировок). В стационарах и хосписах возможно применение субпериостальных инъекций препаратов, используемых для лечения гиперкалшиемии. При невропатической боли (связанной со сдавленней нервных стволов) лечение начинается с применения преднизолона (30 мг в день) или дексаметазона (4 мг) в течение недели, после чего поддерживающая доза снижается наполовину. Анальгетики используются по принципам аналь-гетической лестницы. В дальнейшем применяются различные методы не-вральных блокад. Гиперэстезия наблюдается при ретикулезах, мелкоклеточных бронхоген-ных раках и меланомах. Помощь оказывают умелые сестры, с успехом использующие охлаждающие фены, припудривание. Пациенты должны отказаться от нейлонового белья. Применяются также Н-гнетам и ноблокаторы (квамател 40 мг в день) и р-адреноблокаторы (лропранолол — 10 мг). Головная боль выявляется при повышении внутричерепного давления, особо — при отеке мозга, но может быть связана и с опухолевой эрозией костной ткани. Средствами специфической терапии являются хирургические вмешательства, лучевые воздействия и химиотерапия. Дексаметазон применяется в целях острого снижения внутричерепного давления (16 мг — в первый день, 12 мг — во второй, 10 мг — в третий и 8 мг — четвертый день). Теоретически опиаты повышают внутричерепное давление, однако на практике нередко наблюдается уменьшение интенсивности головной боли. Поддерживающей терапией служит прием парацетамола с 4-часовыми интервалами, Неноцицептивная боль (дизэстезия, деафферентация или нейропатичес-кая боль) не всегда одинаково описывается больными, которые отмечают ее неопределенность, вероятно, обусловленную инфильтративным характером опухолевого роста. Ее выделение важно, поскольку при ней недейственными оказываются опиатные анальгетики. Не следует забывать и о том, что определенный вклад в уменьшение боли может быть получен и при достижении неспецифического результата: улучшении аппетита, повышении настроения, уменьшения слабости, снижении температуры в условиях применения кортикостероидов или антидепрессантов. В составе комплексной терапии рака простаты отдельное место отводится лечению медицинскими препаратами. При своевременном применении в совокупности с лучевой терапией, хирургическим вмешательством в среднем способна продлить жизнь пациента на 10 лет, а также существенно улучшить качество жизни онкобольного.
Сущность медикаментозного леченияМедикаментозная терапия рака простаты проводится комплексно, при лечении ставится много задач, каждую из которых решает отдельный медикамент. Так, одни лекарства уничтожают клетки рака, другие облегчают симптомы течения онкологии, устраняют причину болезни, снижают рост новообразования и т. д. На ранних этапах онкологии предстательной железы используется гормональная терапия, по мере появления метастазов назначают химиотерапию. Медикаментозное лечение не применяется самостоятельно, его использование эффективно в комплексе с лучевой терапией и хирургическим вмешательством. На крайних стадиях рака цель терапии – управлять онкологией, а не вылечить ее. Лечение позволяет максимально увеличить продолжительность жизни больного и предотвратить дальнейшее развитие метастазов. Кроме того, назначается прием симптоматических средств, чтобы облегчить состояние больного, снять болевой синдром, отечность. Виды используемых препаратовВыбор конкретного препарата при онкологии простаты проводится только лечащим врачом, учитывая следующие характеристики:
Задайте вопрос врачу-урологу! Выделяют следующие группы препаратов, используемых при онкологии:
Гормональные препараты воздействуют на причину возникновения рака. Медикаменты этой группы предотвращают синтез тестостерона и ограничивают его влияние на простату. Патогенетическая терапия направлена на восстановление прежнего функционирования организма больного. После химиотерапии и лучевого лечения онкобольной нуждается в повышении иммунитета и восстановлении первичного метаболизма. Симптоматическое лечение направлено на устранение болевого синдрома, облегчение опорожнения мочевого пузыря. Применяя препараты, угнетающие выработку андрогенов, невозможно полностью устранить воздействие тестостерона на раковые клетки. В небольшом количестве гормон вырабатывается надпочечниками. Антиандрогенные препараты не воздействуют на работу внутренних желез, они предотвращают взаимодействие простаты с тестостероном.
Список лучших представителей группы:
Абиратерон является новейшим препаратом, может использоваться даже на запущенных стадиях онкологии. Таблетки обладают выраженным обезболивающим эффектом, благодаря чему используются у больных с метастатической формой рака. Подавляет выработку тестостерона в яичках, надпочечниках и самой опухоли. Препарат предназначен для мужчин с раком простаты, который перестал отвечать на гормональную терапию.
Бикалутамид относится к нестероидным медикаментам с противоопухолевыми свойствами. Воздействует на эндокринную систему, останавливает поступление андрогенов к клеткам рака. Препарат Касодекс является его аналогом, действующее вещество которого бикалутамид. Флутамид применяется при метастатической форме патологии. Препарат подавляет активность тестостерона на клеточном уровне. Фирмагон имеет действующее вещество дегареликс, способствует снижению продуцирования тестостерона в семенниках. Форма макропрепарата – инъекции. Нилутамид применяют при паллиативном лечении рака с метастазами. Способствует нарушению деления раковых клеток железы. Назначают сразу после хирургической или медикаментозной кастрации. Энзалутамид блокирует андрогенные рецепторы и тормозит прогрессирование заболевания. Применяют при онкологии простаты завершающей стади. Апалутамид относится к классу нестероидных антиандрогенов (как и энзалутамид), однако имеет повышенную удельную активность и меньшее воздействие на нервную систему. Это лекарства с цитостатическим эффектом. Препараты блокируют деление патологических клеток, их рост и развитие, способствуют гибели раковых клеток. Противоопухолевые медикаменты не используются на ранних этапах онкологии, они применяются на стадии появления метастазов, когда оперативным путем удалить новообразование не представляется возможным.
Препарат Эстрацит имеет действующее вещество эстрамустина фосфат. Действие заключается в понижении концентрация тестостерона в организме, как после хирургической кастрации. При этом Эстрацит при приёме умеренной дозы не допускает сильного кроветворного ингибирования. Различают следующие разновидности иммунотерапии:
Представители препаратов данной группы – бисфосфонаты. Используются для лечения костных метастазов, предотвращают костные осложнения и купируют болевой синдром. Золендроновая кислота относится к бисфосфонатам третьего поколения и в 100 эффективнее первого поколения. Деносумаб – генно-инженерный препарат на основе моноклональных антител, применяется при костных метастазах рака простаты. Препарат способствует укреплению костных тканей, уменьшает вероятность компрессии спинного мозга. Лекарство воздействует на обмен веществ костной и хрящевой тканей. Препараты снимают воспалительный процесс, используются при лечении онкологии с образованием метастазов при отсутствии улучшений после гормональной терапии. К кортикостероидам, используемым для лечения рака предстательной железы, относятся Преднизолон, Гидрокортизон и Дексаметазон.
Преднизолон улучшает самочувствие пациента, снижает показатель ПСА (простатспецифического антигена). Гидрокортизон, Дексаметазон и Преднизолон применяют в сочетании с противоопухолевыми препаратами. Небольшие дозы медикаментов способны подавлять надпочечниковые андрогены. Способствуют улучшению качества жизни больного, снимают воспаление. Препараты на стадии экспериментовНаиболее перспективным направлением в борьбе с онкологией простаты является вакцинирование от рака – разработка израильских врачей. За основу вакцины берется собственная кровь больного. После ее синтетической обработки и введения наблюдается активизация иммунитета. Эксперты установили, что вакцина способна остановить метастазирование у 77% больных. Около 50% больных в ходе исследования отмечали уменьшение опухоли. Заявлено о способности продлить жизнь онкобольного на несколько лет. Апробирование методики происходит в Германии, США. Пока не обозначается дата, когда вакцина станет общедоступной, но обычно от момента клинических исследований до продажи препарата проходит 10–15 лет. Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам. Болевой синдром при раке проявляется у 35-50% пациентов на ранних стадиях злокачественного процесса. По мере прогрессирования болезни уже до 80% чувствуют боль от умеренной до сильной. В терминальной стадии больно уже почти всем – 95% пациентов. Боль мешает спать, есть, двигаться, принимать осознанные решения, влияет на работу органов и систем. Хорошая новость в том, что современная медицина научилась держать эту боль под контролем в 90% случаев. То есть либо купировать болевой синдром полностью, либо значительно уменьшать его интенсивность. Таким образом, на любых стадиях рака можно сохранять онкологическим пациентам нормальное качество жизни. В России есть специфические проблемы, связанные как с получением анальгетиков, особенно наркотических, так и с несоблюдением в некоторых медучреждениях рекомендаций ВОЗ по обезболиванию. Сегодня постараемся разобраться, какие же лекарства кому и когда нужны, и как еще современная медицина умеет бороться с болью.
Но в нездоровом организме онкологического пациента (а также пациента с сердечно-сосудистым заболеванием или ВИЧ, или, например, туберкулезом) боль утрачивает свою полезную сигнальную функцию и наоборот, мешает как основной терапии, так и оказанию паллиативной помощи. Пациент впадает в депрессивное состояние, теряет силы, необходимые для борьбы с болезнью. Хронический болевой синдром превращается в самостоятельную патологию, которую нужно отдельно лечить. Именно поэтому более чем миллиону человек в России ежегодно требуется обезболивание. Причем от 400 до 800 тысяч из них (по разным подсчетам) нуждаются в опиоидных анальгетиках. Чтобы разобраться, какой подход нужен для купирования боли, врачу-онкологу нужно понять ее причину и происхождение. Одна из больших трудностей диагностики ЗНО (злокачественных новообразований) – у пациента часто сначала вообще ничего не болит. Опухоль банально может быть пока слишком маленькой. Еще такое случается, если опухоль растет в неплотных тканях (таких как молочная железа) или увеличивается внутри полости органа (например, желудка). Также без боли могут развиваться те виды рака, при которых нет солидных первичных опухолей – лейкозы, злокачественные заболевания системы кроветворения. В нашей практике были случаи, когда бессимптомно протекали даже IV стадии онкологических процессов – вплоть до появления множественных метастазов пациенту не было больно. Во всех остальных случаях, когда боль присутствует, врачу важно знать, из-за чего она появилась. По причинам возникновения выделим три основных группы.
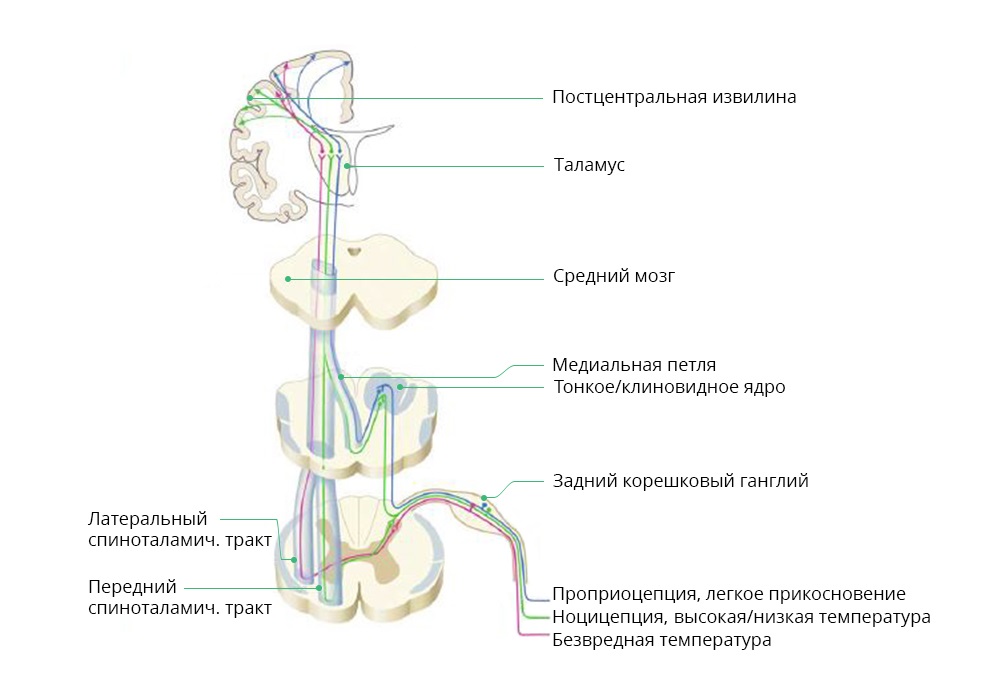
При онкологических заболеваниях ноцицептивная боль, чаще всего, является реакцией на саму опухоль или метастазы. Так, метастазы в позвоночнике могут давать прорывную, резкую боль при перемене положения тела пациентом. Нейропатическая боль. Ее причина – нарушение в работе нервных структур – нервов, спинного или головного мозга. Сочетает два фактора: с одной стороны, интенсивность – пациенту очень больно, иногда не помогают даже сильнодействующие анальгетики. С другой стороны – затруднена локализация. В отличие от острой ноцицептивной боли, пациент часто не может сказать, где именно у него болит. Такая боль бывает вызвана ростом опухоли или метастаза, когда они давят, например, на позвоночник или защемляют нервные корешки. Также причиной, к несчастью, могут быть и побочные эффекты противоопухолевого лечения. В таких случаях необходимо учитывать психологическое состояние пациента. Сильный стресс может заметно повлиять на изменения восприятия, вплоть до полностью психогенных болей. Для выбора адекватной анальгезии врач должен понимать, насколько человеку больно, постараться понять, где именно болит и как долго. От этого зависят назначения в рецепте на обезболивание. Кроме уточняющих вопросов о характере и локализации боли, врач обязательно оценивает ее интенсивность. Во всем мире для этого используют шкалы НОШ (нумерологическая оценочная шкала) и ВАШ (визуально-аналоговая шкала), либо гибридные варианты – в зависимости от возраста и состояния пациента. Совсем маленьким детям и очень пожилым людям, а также пациентам с когнитивными нарушениями бывает сложно ответить на стандартные вопросы. Иногда приходится работать с такими только по поведению и выражению лиц.
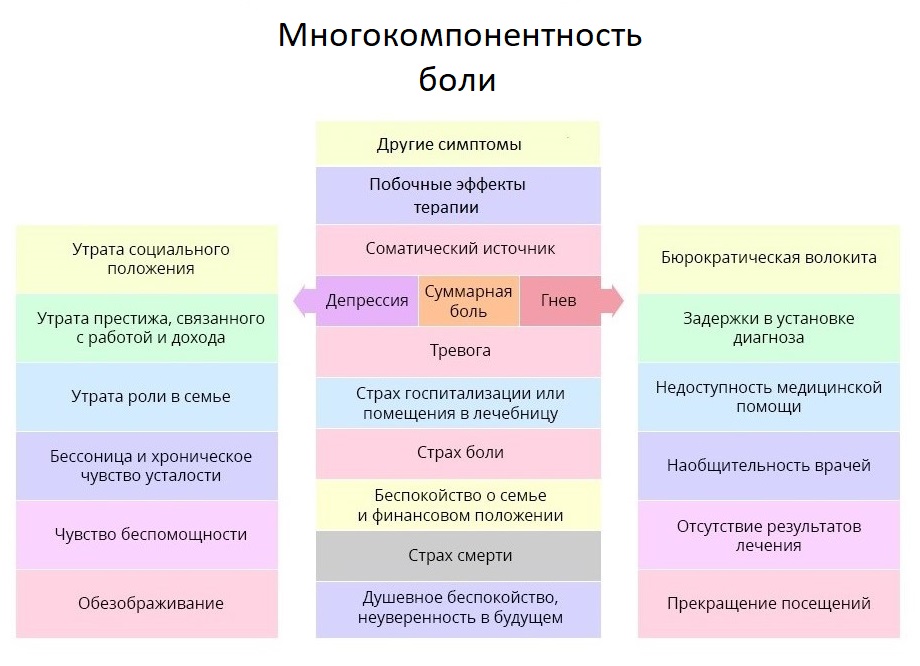
Важно при этом получить как можно больше дополнительной информации: если пациент считает, что терпеть – достойное занятие, а жаловаться – недостойное, или выяснится, что у пациента были периоды злоупотребления и зависимостей, это может внести коррективы в терапию болевого синдрома. Мы уже затронули тему работы с психологическим состоянием больного, и коснемся ее еще раз – об этом важно помнить и врачам, и близким пациента. ВОЗ даже ввела для этого специальное понятие: суммарная боль. Она охватывает не только физические раздражители, но и эмоциональные и социальные негативные аспекты жизни пациента.
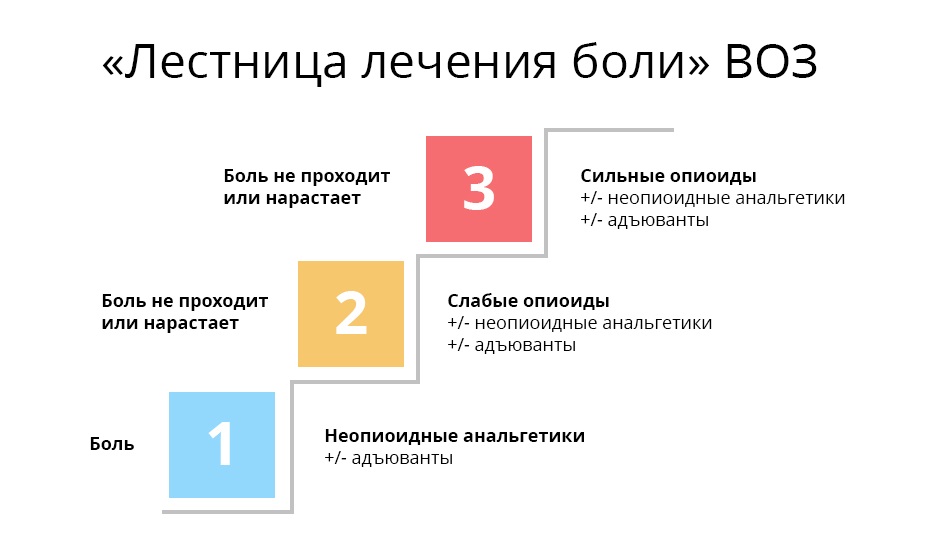
Наверное, каждый врач считает более правильными и удачными те препараты, которые оказались наиболее действенными в его личном практическом опыте. Но любой онколог, стремясь купировать болевой синдром, должен помнить про рекомендации ВОЗ для лечения онкологических болей.
Такие препараты не вызывают привыкания и зависимости, но в большой дозировке могут навредить ЖКТ, поэтому бесконечно и бесконтрольно дозу увеличивать нельзя, чтобы не усложнить ситуацию желудочным кровотечением. Эндорфины – нейромедиаторы, одна из функций которых – тормозить передачу слабых болевых импульсов из спинного мозга в головной. Это позволяет нам не плакать от боли каждый раз, когда мы ставим локти на стол или спрыгиваем с высоты полуметра. Но при интенсивной боли выработка эндорфинов уменьшается. Опиоидные рецепторы освобождаются, нервные импульсы не тормозятся, человек испытывает боль. Трамадол принимают вместе с анальгином, парацетамолом и другими медикаментами первой ступени – эффект получается комплексным: одновременное воздействие и на центральную, и на периферическую нервную систему. Важно, что трамадол, хотя и является опиатом – относится к ненаркотическим анальгетикам. Пациенту проще его получить и не нужно бояться потенциальной зависимости. Третья ступень. На этой ступени оказываются врач и его пациент, когда ему уже перестали помогать слабые опиаты. В дело вступают сильные опиаты, основной – морфин. Сильные опиаты связываются с опиоидными рецепторами гораздо надежнее слабых, поэтому действуют мощнее. Однако, такой эффект стоит дорого: эти препараты уже могут вызывать зависимость – но только, если употреблять их неправильно и бесконтрольно. Важно, что на каждой ступени может использоваться так называемая адъювантная, то есть вспомогательная, терапия. Адъювантные препараты не обезболивают самостоятельно, но в сочетании с основными анальгетиками либо усиливают их действие, либо нивелируют побочные эффекты. В эту группу входят антидепрессанты, кортикостероиды, противорвотные и противосудорожные, антигистаминные и т.д. Таким образом, ВОЗ дает основные принципы и рекомендации для плавного перехода со ступеньки на ступеньку, которые помогают избегать тупика в терапии – когда боль усиливается, а средств борьбы с ней уже не осталось. Такое случается, если онколог назначает опиоидные препараты раньше времени или в дозе больше необходимого. Если прыгнуть с кеторола на промедол (как, к сожалению, делают некоторые врачи – кто по неопытности, кто из-за отсутствия нужных препаратов), то сначала эффект может превзойти ожидания. Но затем получается, что боль станет требовать увеличения дозировки быстрее, чем предписано безопасным режимом. Ступеньки закончатся раньше, чем вы пройдете нужное количество шагов. В этом случае врач сам у себя отнимает средства лечения. Строго говоря, как раз уколы, сиречь инъекции, в современном обезболивании стараются не использовать. Выбирать для обезболивания самый болезненный метод введения как-то нелогично. Поэтому все популярнее сейчас Трансдермальный метод введения – в виде пластырей. В отличие от инъекций – максимально удобен для пациента. У него есть свои ограничения, конечно – по температуре тела, по количеству подкожно-жировой клетчатки, но в большинстве случаев он хорош:
 Фентаниловый пластырь – сильное, безопасное и комфортное обезболивание Эпидуральная анестезия. Да, ее делают не только беременным. Те же препараты, что при спинальной анестезии, вводят в полость между твердой мозговой оболочкой и стенками позвоночного канала. Эпидуральная анестезия используется на поздних стадиях, при метастатическом поражении костей, когда боль не снимается инъекциями и препаратами перорально. Паллиативная химио-, таргетная и лучевая терапия. Она используется не с целью разрушить опухоль, а с целью просто сделать ее меньше, чтобы освободить сдавленные нервные узлы, вызывающие боль. Нейрохирургические методы. Нейрохирург надрезает корешки спинномозговых или черепных нервов. Это не приводит к утрате двигательной активности (хотя может потребовать реабилитации), но мозг лишается возможности получать болевые сигналы по этому пути. Радиочастотная абляция (РЧА). В первом нашем посте, про паллиативную медицину, мы прикрепляли видео о том, как этот метод помог пациентке избавиться от болевого синдрома на последней стадии рака. Тогда РЧА применялась для того, чтобы разрушить метастазы, давившие на нервные корешки спинного мозга. В случаях же, когда разрушить метастазы или саму опухоль невозможно, РЧА можно использовать для разрушения проводящих нервных путей. Это похоже на предыдущий вариант, только хирург действует не скальпелем, а специальной иглой, разогретой радиочастотными колебаниями до высокой температуры. Нейролизис при помощи эндосонографии. Нейролизис – это разрушение нервного пути, проводящего боль, с помощью специальных химических растворов. Под контролем ультразвука эндоскоп подводят точно к чревному (солнечному) нервному сплетению через ЖКТ и разрушают часть нервных волокон. Обезболивающий эффект от процедуры наступает в 90% случаев при раке желудка или, например, поджелудочной железы. Сохраняется результат процедуры от месяца до года в редких случаях. Все зависит от скорости развития опухоли. При том, что в случае с применением препаратов-анальгетиков, их пришлось бы применять еженедельно. Вертебропластика. Этот способ можем пояснить на живом примере из собственной практики. Повреждение позвоночника метастазами приводит к разрушению тела позвонка. Костная структура позвонка деформируется, происходит компрессия (сдавливание) спинномозговых корешков. Возникает корешковый компрессионный сидром, который сопровождается сильными болями. Вертебропластика укрепляет тело пораженного позвонка, чтобы он перестал давить на нервные корешки. Операция малоинвазивная, ее проводят под местным обезболиванием и контролем компьютерной томографии. В тело позвонка вводится специальная игла-канюля, одновременно специальным инструментов восстанавливается высота позвонка. В полость позвонка вводится костный цемент. Результат вмешательства также контролируется КТ исследованием. В 98% случаев вертебропластика устраняет болевой синдром сразу же после окончания операции. Период реабилитации минимальный, через пару часов пациент может принимать вертикальное положение. Так что, вариантов помочь пациенту с болевым синдромом у хорошего онколога сегодня много. Мы убеждены, что вне зависимости от стадии его рака, человек может максимально долго иметь нормальное качество жизни, без ограничений и страданий. Проблема недостаточного обеспечения сильными анальгетиками больных с тяжелыми диагнозами – одна из самых, уж извините, больных проблем в российской онкологии в частности и паллиативной медицине в целом. После самоубийства контр-адмирала Апанасенко в 2014 начались какие-то подвижки, но далеко не все так радужно, как обещалось. Чтобы страха, а значит, и потенциальной ненужной боли, не осталось, давайте разъясним, какой порядок действий, нужный для получения наркотического препарата. Кто выписывает рецепт?
Сколько действует рецепт? Нужно ли сдавать ампулы? Нет. По закону, никто не вправе требовать от пациента или его родных сдавать использованные ампулы, пластыри и упаковки от наркотических анальгетиков. Может кто-то из родственников получить рецепт и препарат от имени больного?
Что делать, если возникли сложности с получением обезболивающего?
В заключение хочется как-то обобщить все сказанное по этой тяжелой теме: Читайте также:
|