Контроль боли паллиативная помощь при раке желудка
Паллиативные операции при раке желудка включают в себя симптоматические операции, временно облегчающие состояние пациентов, и направленные на устранение тех или иных тяжелых или опасных для жизни симптомов онкологического заболевания, а также циторедуктивные операции, которые существенно уменьшают размер первичной опухоли и метастазов, уменьшая степень опухолевой интоксикации.
В каких ситуациях проводятся паллиативные операции при раке желудка?
В лечении рака желудка главная роль до сих пор принадлежит хирургическому методу, однако, на поздних стадиях рака желудка при распространенных поражениях окружающих тканей с вовлечением регионарных лимфатических узлов и наличием отдалённых метастазов, тяжелом состоянии пациента, проведение радикальных операций невозможно. Радикальные операции при раке желудка (субтотальная резекция желудка, гастрэктомия, проксимальная резекция) – это всегда обширные операции, которые помимо вмешательства собственно на желудке сопровождаются удалением большого и малого сальника, а во время комбинированных операций одновременно удаляют полностью или частично пораженные раковым процессом соседние органы (поджелудочную железу, печень, поперечно-ободочную кишку, селезенку).
Радикальная операция при раке желудка является серьезным хирургическим вмешательством, которое требует существенной компенсации функций организма. Многим больным отказывают в операции из-за высокой степени операционного риска. Между тем при раке желудка на 4-й стадии на фоне специфической терапии 5-летняя выживаемость достигает 15-20%, а с развитием высокотехнологичных методов лечения можно рассчитывать и на большее продление жизни пациентов. Поэтому сейчас активно разрабатываются хирургические методики, позволяющие облегчить состояние и значительно улучшить качество жизни пациентов с раком желудка, радикальная операция у которых невозможна.
Выполнение паллиативных операций у пациентов с раком желудка делают возможным проведение лучевой и химиотерапии, введение индивидуальных противоопухолевых вакцин и моноклональных антител (SU11248), что позволяет добиться стойкой стабилизации течения заболевания и увеличить ожидаемую продолжительность жизни.
Когда необходимо паллиативное хирургическое вмешательство?
Диагноз 4 стадии рака желудка устанавливается при инвазивном поражении опухолью соседних органов, близлежащих лимфатических узлов, или при наличии метастазов в отдаленные органы и ткани. Хирургическое лечение в таких ситуациях применяется преимущественно для лечения жизнеугрожающих состояний – кровотечения из опухоли, прободения (перфорации) стенки желудка, стенозе желудка с развитием тяжелых водно-электролитных расстройств и невозможностью питания, желтухе при поражении опухолью печени и желчевыводящих путей.
В хирургическом стационаре лечение начинают с попытки остановки кровотечения с помощью кровоостанавливающих средств и установке зонда Блэкмора для прекращения желудочного кровотечения. Одновременно начинается инфузия препаратов плазмы крови с целью профилактики ДВС-синдрома, а при массивной кровопотере также проводится переливание эритроцитарной массы. Малоинвазивные вмешательства выполняются с целью поиска источника кровотечения и точечной ликвидации кровотечения, для чего проводится эндоскопическое вмешательство, позволяющее выполнить клипирование и прошивание кровоточащего сосуда, провести электро- или плазменную коагуляцию. Все эти методики остановки желудных кровотечений при раке желудка и других осложнениях онкологических заболеваний используются в Европейской онкологической клинике.
При неэффективности предпринятых мер по устранению желудочного кровотечения проводится экстренная хирургическая операция.
Желтуха - прямое противопоказание для проведения плановых химио- и лучевой терапии. Единственным радиальным методом снижения высокого уровня билирубина является восстановления оттока желчи из печени путем проведения рентгенохирургического вмешательства. Дренирование позволяет наладить временный отток наружу на поверхность кожи (наружный дренаж) или как наружу, так и в естественном направлении в кишечник (наружно-внутренний дренаж). В некоторых случаях, когда опухолевое сдавление изолирует несколько разных сегментов желчного дерева, например, как левую, так и правую доли печени, может потребоваться установка нескольких дренажей.
После снижения уровня билирубина до нормальных величин и уменьшения явлений холангита дренаж заменяется на стент или стенты – специальные эндопротезы, которые поддерживают желчный проток в открытом состоянии. Выполнение одномоментного дренирования и стентирования проводится только по строгим медицинским показаниям, чаще всего эти операции разделены по времени. В целом, дренирование и стентирование желчных протоков существенно улучшает качество жизни больных.

У 10-15% пациентов раком желудка развивается требующий хирургического вмешательства стеноз (сужение просвета) кардиального или пилорического отдела желудка. Симптомами этого состояния служат затруднение при проглатывании пищи при поражении верхних (кардиальных) отделов, тяжесть, чувство переполнения и рвота давно съеденной пищей при вовлечении перехода из желудка в 12-перстную кишку(пилоростеноз).
Стеноз при раке желудка чреват развитием опасных для жизни водно-электролитных расстройств и усугублением кахексии (истощения). Для восстановления прохождения пищи по желудочно-кишечному тракту, коррекции и профилактики водно-электролитных нарушений при иноперабельном раке желудка со стенозом пилорического отдела проводят операцию гастроэнтеростомии, т.е. наложение соустья между желудком и тощей кишкой.
C целью коррекции стеноза при неоперабельном раке проксимального (кардиального) отдела желудка c переходом на пищевод при нарушении прохождения пищи может использоваться стентирование желудка – установка специальных стентов, которые восстанавливают нормальное прохождение пищи через желудок в кишечник. Альтернативным способом хирургического лечения является наложение гастростомы – гастростомия - формирование отверстия в желудке и передней брюшной стенке, для обеспечения питания больного через зонд. В результате уменьшаются симптомы интоксикации и обеспечение питание больного.
Операции раке с метастазами
Рак желудка в большинстве случаев довольно рано дает метастазы. Из числа наиболее часто поражаемых метастазами органов следует указать печень, поджелудочную железу, легкие, яичники (метастаз Крукенберга), а также брюшину, которая покрывается множественными раковыми узелками, что сопровождается выпотом жидкости в брюшную полость (асцитом). Помимо того, что метастазы могут приводить к развитию острых осложнений, требующие экстренной хирургической помощи (сдавление нижней полой вены), они существенно нарушают функционирование пораженных органов, значительно ухудшают общее состояние, нередко сопровождаясь нестерпимыми болями, требующими постоянного обезболивания.
Как в ведущих, в т.ч. зарубежных клиниках, так и в Европейской онкологической клинике для лечения метастазов рака желудка, в частности в печень, используется чрескожная чреспеченочная радиочастотная абляция (РЧА) – методика, вызывающая контролируемый асептический некроз метастатического очага, без повреждения окружающих тканей. Результатом такого некроза становится полная гибель опухолевых клеток метастаза. При ее выполнении, которое проводится под общим обезболиванием, под ультразвуковым контролем сквозь кожу вводится монополярный радиоволновой электрод, разогревающий именно нужный участок печени и вызывающий локальный некроз метастаза. РЧА может также проводится во время открытой операции на желудке и органах брюшной полости. РЧА метастазов печени дает возможность надолго продлить жизнь пациента без возникновения рецидивов. У нас накоплен опыт неодократного проведения РЧА для полного устранения множества мелких метастазов печени, а также в случае появления новых метастатических очагов.
В отделении интервенционной онкологии и эндоваскулярной хирургии Европейской онкологической клиники выполняется химиоэмболизация артерий, питающих крупные метастазы, преимущественно в печени, с целью уменьшения негативного влияния метастазов рака на организм пациента. Прекращение кровотока в опухоли уже само по себе оказывает лечебное воздействие. Одновременная доставка в ткань опухоли химиопрепаратов разрушает ее изнутри, избавляя пациента от токсического действия лекарства на весь организм в целом.
В мире используется также такая методика лечения метастазов печени, как радиоэмболизация метастазов рака желудка в печень. Она проводится под контролем ангиографа с помощью внутрисосудистой селективной катеризации сосудов печени. В сосуд, питающий опухоль, вводятся эмболизирующие частицы с радиоактивным изотопом иттрий-90, которые в последующие после операции 64 часа продолжают изнутри воздействовать на опухоль. К сожалению, в нашей стране данная методика не доступна. Для этих целей мы направляем пациентов в клиники Израиля и Германии.
Малотравматичные резекции печени, включая радиочастотную аблацию метастазов рака в печень, в нашей клинике проводятся учеником профессора, д.м.н. Юрия Ивановича Патютко, заместителем главного врача клиники, к.м.н. Андреем Львовичем Пылёвым. Кроме того, наиболее сложные операции выполняются самим Юрием Ивановичем Патютко, руководителем хирургического отделения опухолей печени РОНЦ им. Н. Н. Блохина.
При распространении опухолевого процесса – диссеминации метастазов опухоли желудка по брюшине (т.н. канцероматоз брюшины) может происходить накопление жидкости в брюшной полости. Это состояние называется асцит, оно довольно мучительно для пациента. В основном, оно обусловлено механическим препятствием обратному всасыванию жидкости из брюшной полости, в норме происходящему очень интенсивно (до 1,5 л в сутки) и закупоркой лимфатических сосудов. При метастатическом поражении паренхимы печени, в основе развития асцита лежит, кроме того, препятствие венозному оттоку крови.
Когда жидкости становится больше 5 л и больше сдавление внутренних органов, нарушение экскурсии диафрагмы, повышение внутрибрюшного давления приводят к смещению органов вверх, в грудную полость, вызывают дыхательную недостаточность и нарушение нормального крово- и лимфотока. При этом создаются благоприятные условия для быстрого и обширного метастазирования опухоли. Однако одномоментное удаление большого количества асцитической жидкости может привести к возникновению тяжелых осложнений, поэтому в Европейской онкологической клинике для дренирования асцитов применяются современные методики лапароцентеза с использованием специальных помп для постепенного и дозированного удаления серозной жидкости.
Параллельно проводится инфузионная терапия для коррекции водно-электролитных нарушений, инфузии альбумина, коллоидов и объёмо-замещающих растворов. Для предотвращения возникновения асцита, после первичной эвакуации асцитической жидкости, мы активно используем цитостатические препараты, т.е. лекарственные вещества, способствующие уменьшению объема выпота и более медленному накоплению жидкости, в том числе внутриполостное введение лекарственных препаратов. Внутриполостная химиотерапия эффективна в 40-60% случаев и позволяет сохранить положительный эффект брюшинной пункции на срок более 2 месяцев. Лапароцентез производится под ультразвуковой навигацией и при необходимости завершается установкой дренажа для длительной эвакуации жидкости.
Применяемые в нашей клинике катетеры не ограничивают естественную двигательную активность и обеспечивают возможность возвращения пациента к привычной деятельности. При рефрактерных и массивных асцитах возможно проведение паллиативных операций (установка перитонеовенозного шунта, частичная деперитонизация стенок брюшной полости, оментогепатофренопексия и другие). При таком комплексном подходе процедуру лапароцентеза требуется делать в 2-3 раза реже, чем при классическом проведении пункции брюшинной полости.
Насколько оправданы вмешательства в 4 стадии рака желудка, ведь они не приводят к излечению?
Философия оказания медицинской помощи в Европейской онкологической клинике заключается в том, что пациенту надо стараться помочь всегда. Человеческая жизнь бесценна, и ее нужно продлить на максимально больший срок при поддержании максимально возможного качества жизни. Вмешательства на поздней стадии онкологического заболевания, включая 4-ю стадию рака желудка, должны предприниматься, поскольку они позволяют существенно улучшить качество жизни пациентов, уменьшить интоксикацию и выраженность болевого синдрома, продлить жизнь и возможность общения с родными и близкими на существенный срок. Например, проведение перитонэктомии в сочетании с гипертермической внутрибрюшной химиотерапией у больных с канцероматозом брюшины при раке желудка позволяет увеличить продолжительность жизни до 18 месяцев. При единичных изолированных метастазах рака желудка в печень ее резекция позволяет достичь 5-летней выживемости у 18–34% больных.
Для лечения 4 стадии рака желудка в отделении паллиативной и симптоматической терапии используются все возможные варианты лечения онкологических больных: все виды химиотерапии, лучевая терапия, которая позволяет уменьшать болевой синдром, а также выполняются паллиативные операции. С целью облегчения введения препаратов возможна имплантация венозных и артериальных инфузионных порт-систем для химиотерапии, проводится регионарная интраартериальная инфузия химиопрепаратов, местная терапия.
— Необходима ли какая-либо особая подготовка для проведения паллиативных операций?
Безусловно, из-за тяжести болезни наши пациенты требуют особенно тщательной подготовки и ведения послеоперационного периода. Обычно предоперационная подготовка заключается в общеукрепляющем лечении, инфузионной терапии белковыми препаратами, солевыми и коллоидными растворами, витаминами, в применении тонизирующих средств. Существуют методики предоперационной инфузионной подготовки, позволяющие уменьшить кровопотерю в процессе операции, они активно используются в нашей клинике. Как правило больные нуждаются в гипералиментации – введении питательных веществ высокой энергетической ценности.
В послеоперационном периоде на несколько дней исключают прием пищи и воды через рот. Необходимые количества жидкости и питательных веществ восполняют путём внутривенных вливаний питательных растворов с инсулином, витаминами, а также крови и белковых препаратов. Пациенту назначают антибиотики, сердечные средства, наркотики и кислород. Важным компонентом является тщательный уход, дыхательная гимнастика, внимательное наблюдение за течением послеоперационного периода. В дальнейшем огромное значение имеет правильное сбалансированное дробное питание, приём необходимых препаратов и уход за больным.
Болевой синдром при раке проявляется у 35-50% пациентов на ранних стадиях злокачественного процесса. По мере прогрессирования болезни уже до 80% чувствуют боль от умеренной до сильной. В терминальной стадии больно уже почти всем – 95% пациентов. Боль мешает спать, есть, двигаться, принимать осознанные решения, влияет на работу органов и систем.
Хорошая новость в том, что современная медицина научилась держать эту боль под контролем в 90% случаев. То есть либо купировать болевой синдром полностью, либо значительно уменьшать его интенсивность. Таким образом, на любых стадиях рака можно сохранять онкологическим пациентам нормальное качество жизни.
В России есть специфические проблемы, связанные как с получением анальгетиков, особенно наркотических, так и с несоблюдением в некоторых медучреждениях рекомендаций ВОЗ по обезболиванию.
Сегодня постараемся разобраться, какие же лекарства кому и когда нужны, и как еще современная медицина умеет бороться с болью.

Рефлекс отдергивания – здоровая биологическая реакция на острую боль
Но в нездоровом организме онкологического пациента (а также пациента с сердечно-сосудистым заболеванием или ВИЧ, или, например, туберкулезом) боль утрачивает свою полезную сигнальную функцию и наоборот, мешает как основной терапии, так и оказанию паллиативной помощи. Пациент впадает в депрессивное состояние, теряет силы, необходимые для борьбы с болезнью. Хронический болевой синдром превращается в самостоятельную патологию, которую нужно отдельно лечить.
Именно поэтому более чем миллиону человек в России ежегодно требуется обезболивание. Причем от 400 до 800 тысяч из них (по разным подсчетам) нуждаются в опиоидных анальгетиках.
Чтобы разобраться, какой подход нужен для купирования боли, врачу-онкологу нужно понять ее причину и происхождение.
Одна из больших трудностей диагностики ЗНО (злокачественных новообразований) – у пациента часто сначала вообще ничего не болит. Опухоль банально может быть пока слишком маленькой.
Еще такое случается, если опухоль растет в неплотных тканях (таких как молочная железа) или увеличивается внутри полости органа (например, желудка). Также без боли могут развиваться те виды рака, при которых нет солидных первичных опухолей – лейкозы, злокачественные заболевания системы кроветворения.
В нашей практике были случаи, когда бессимптомно протекали даже IV стадии онкологических процессов – вплоть до появления множественных метастазов пациенту не было больно.
Во всех остальных случаях, когда боль присутствует, врачу важно знать, из-за чего она появилась. По причинам возникновения выделим три основных группы.
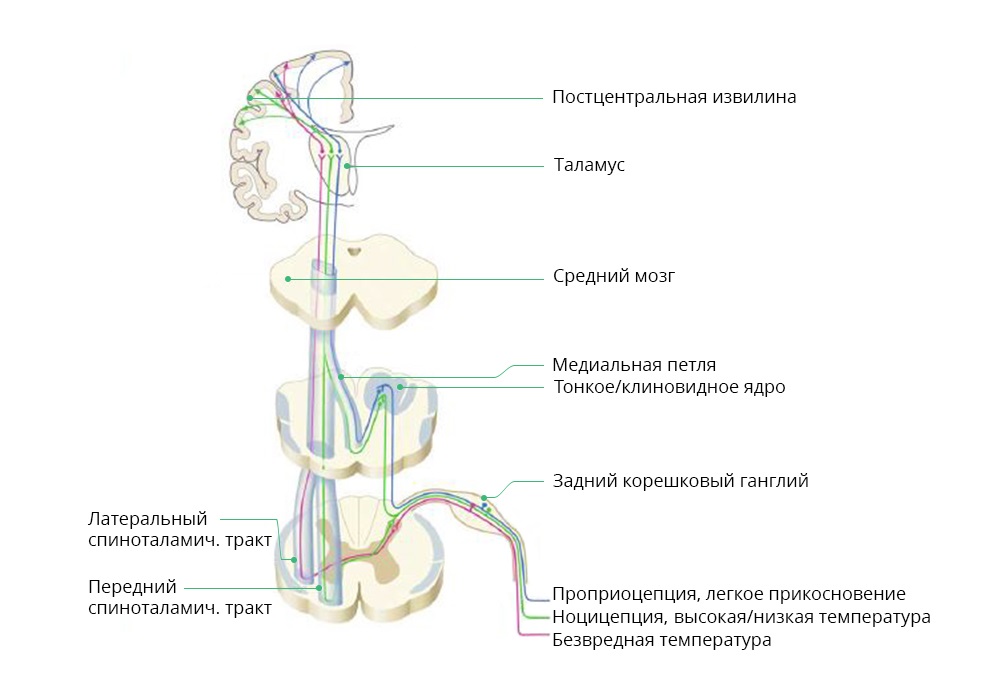
Схема прохождения ноцицептивного и других сигналов от внешних раздражителей
При онкологических заболеваниях ноцицептивная боль, чаще всего, является реакцией на саму опухоль или метастазы. Так, метастазы в позвоночнике могут давать прорывную, резкую боль при перемене положения тела пациентом. Нейропатическая боль. Ее причина – нарушение в работе нервных структур – нервов, спинного или головного мозга. Сочетает два фактора: с одной стороны, интенсивность – пациенту очень больно, иногда не помогают даже сильнодействующие анальгетики. С другой стороны – затруднена локализация. В отличие от острой ноцицептивной боли, пациент часто не может сказать, где именно у него болит.
Такая боль бывает вызвана ростом опухоли или метастаза, когда они давят, например, на позвоночник или защемляют нервные корешки. Также причиной, к несчастью, могут быть и побочные эффекты противоопухолевого лечения.
Дисфункциональная боль. Тот случай, когда органические причины боли отсутствуют, но она не уходит: например, опухоль уже удалили, заживление после операции прошло, а боль осталась. Бывает, что боль, по оценке самого пациента, гораздо сильнее, чем должна быть при его состоянии здоровья.
В таких случаях необходимо учитывать психологическое состояние пациента. Сильный стресс может заметно повлиять на изменения восприятия, вплоть до полностью психогенных болей.
Для выбора адекватной анальгезии врач должен понимать, насколько человеку больно, постараться понять, где именно болит и как долго. От этого зависят назначения в рецепте на обезболивание. Кроме уточняющих вопросов о характере и локализации боли, врач обязательно оценивает ее интенсивность.
Во всем мире для этого используют шкалы НОШ (нумерологическая оценочная шкала) и ВАШ (визуально-аналоговая шкала), либо гибридные варианты – в зависимости от возраста и состояния пациента. Совсем маленьким детям и очень пожилым людям, а также пациентам с когнитивными нарушениями бывает сложно ответить на стандартные вопросы. Иногда приходится работать с такими только по поведению и выражению лиц.

Шкала оценки боли от 0 (ничего не болит) до 10 (нестерпимо больно)
Важно при этом получить как можно больше дополнительной информации: если пациент считает, что терпеть – достойное занятие, а жаловаться – недостойное, или выяснится, что у пациента были периоды злоупотребления и зависимостей, это может внести коррективы в терапию болевого синдрома.
Мы уже затронули тему работы с психологическим состоянием больного, и коснемся ее еще раз – об этом важно помнить и врачам, и близким пациента. ВОЗ даже ввела для этого специальное понятие: суммарная боль. Она охватывает не только физические раздражители, но и эмоциональные и социальные негативные аспекты жизни пациента.
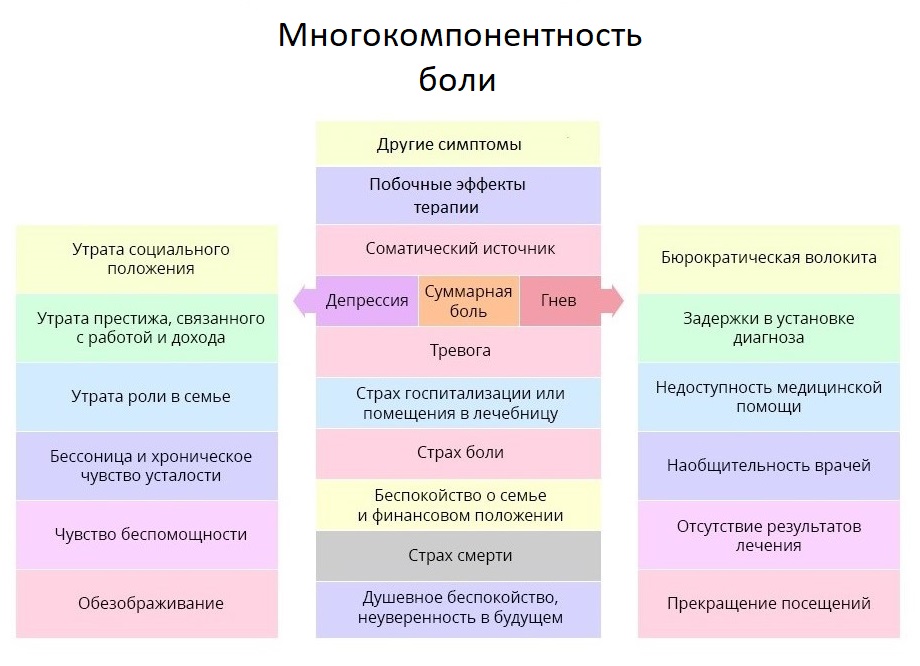
Боль онкопациента куда глубже и сложнее, чем кажется со стороны. Терапия боли – тот случай, когда врач должен относиться к субъективным оценкам пациента с особым вниманием.
Наверное, каждый врач считает более правильными и удачными те препараты, которые оказались наиболее действенными в его личном практическом опыте. Но любой онколог, стремясь купировать болевой синдром, должен помнить про рекомендации ВОЗ для лечения онкологических болей.
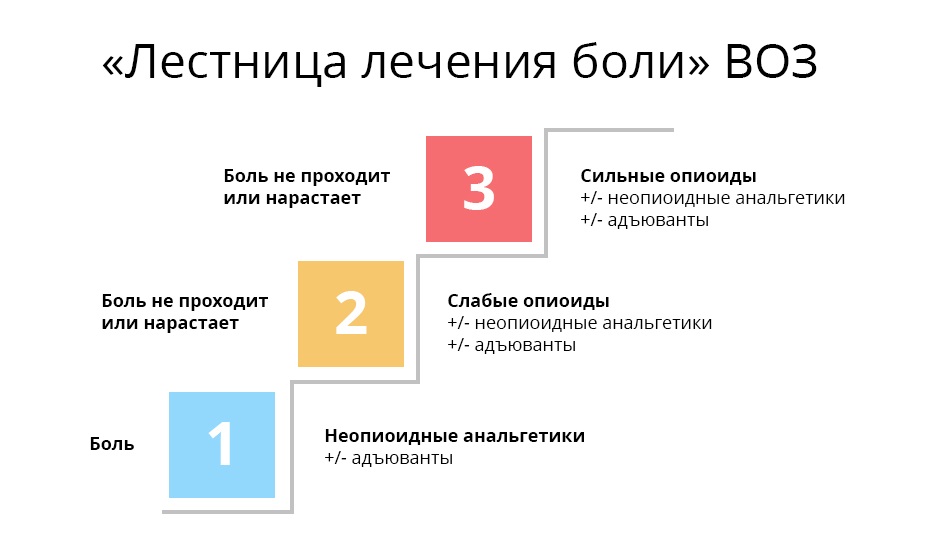
Первая ступень. При слабой боли начинают с ненаркотических анальгетиков и нестероидных противовоспалительных средств и препаратов (НПВС/НПВП). Это привычные безрецептурные парацетамол, ибупрофен, аспирин и др. При мышечной и суставной боли назначают диклофенак и др.

Схема действия НПВС – они блокируют фермент циклооксигеназу, снижая синтез простагландинов, тем самым уменьшая чувствительность болевых рецепторов.
Такие препараты не вызывают привыкания и зависимости, но в большой дозировке могут навредить ЖКТ, поэтому бесконечно и бесконтрольно дозу увеличивать нельзя, чтобы не усложнить ситуацию желудочным кровотечением.
Эндорфины – нейромедиаторы, одна из функций которых – тормозить передачу слабых болевых импульсов из спинного мозга в головной. Это позволяет нам не плакать от боли каждый раз, когда мы ставим локти на стол или спрыгиваем с высоты полуметра. Но при интенсивной боли выработка эндорфинов уменьшается. Опиоидные рецепторы освобождаются, нервные импульсы не тормозятся, человек испытывает боль.
Трамадол принимают вместе с анальгином, парацетамолом и другими медикаментами первой ступени – эффект получается комплексным: одновременное воздействие и на центральную, и на периферическую нервную систему.
Важно, что трамадол, хотя и является опиатом – относится к ненаркотическим анальгетикам. Пациенту проще его получить и не нужно бояться потенциальной зависимости.
Третья ступень. На этой ступени оказываются врач и его пациент, когда ему уже перестали помогать слабые опиаты. В дело вступают сильные опиаты, основной – морфин. Сильные опиаты связываются с опиоидными рецепторами гораздо надежнее слабых, поэтому действуют мощнее. Однако, такой эффект стоит дорого: эти препараты уже могут вызывать зависимость – но только, если употреблять их неправильно и бесконтрольно.
Важно, что на каждой ступени может использоваться так называемая адъювантная, то есть вспомогательная, терапия. Адъювантные препараты не обезболивают самостоятельно, но в сочетании с основными анальгетиками либо усиливают их действие, либо нивелируют побочные эффекты. В эту группу входят антидепрессанты, кортикостероиды, противорвотные и противосудорожные, антигистаминные и т.д.
Таким образом, ВОЗ дает основные принципы и рекомендации для плавного перехода со ступеньки на ступеньку, которые помогают избегать тупика в терапии – когда боль усиливается, а средств борьбы с ней уже не осталось.
Такое случается, если онколог назначает опиоидные препараты раньше времени или в дозе больше необходимого. Если прыгнуть с кеторола на промедол (как, к сожалению, делают некоторые врачи – кто по неопытности, кто из-за отсутствия нужных препаратов), то сначала эффект может превзойти ожидания. Но затем получается, что боль станет требовать увеличения дозировки быстрее, чем предписано безопасным режимом. Ступеньки закончатся раньше, чем вы пройдете нужное количество шагов. В этом случае врач сам у себя отнимает средства лечения.
Строго говоря, как раз уколы, сиречь инъекции, в современном обезболивании стараются не использовать. Выбирать для обезболивания самый болезненный метод введения как-то нелогично.
Поэтому все популярнее сейчас Трансдермальный метод введения – в виде пластырей.
В отличие от инъекций – максимально удобен для пациента. У него есть свои ограничения, конечно – по температуре тела, по количеству подкожно-жировой клетчатки, но в большинстве случаев он хорош:
- препарат (обычно фентанил) высвобождается постепенно, хватает на 72 часа;
- не требует контролировать время приема таблеток или введения препаратов;
- исключает передозировку (это важно для наркотического анальгетика).
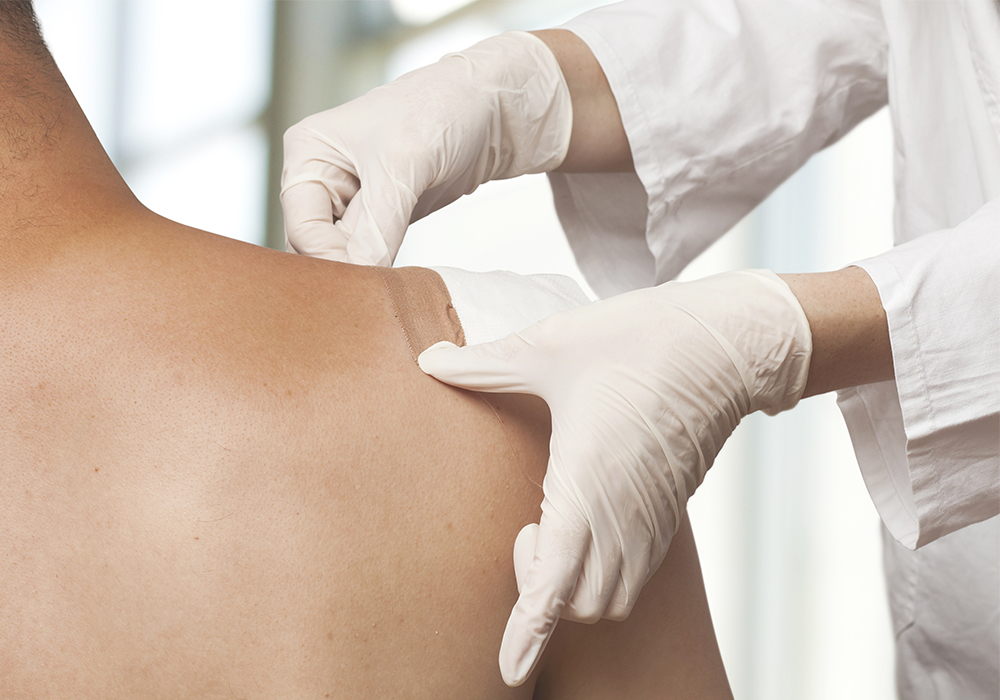
Фентаниловый пластырь – сильное, безопасное и комфортное обезболивание
Эпидуральная анестезия. Да, ее делают не только беременным. Те же препараты, что при спинальной анестезии, вводят в полость между твердой мозговой оболочкой и стенками позвоночного канала. Эпидуральная анестезия используется на поздних стадиях, при метастатическом поражении костей, когда боль не снимается инъекциями и препаратами перорально.
Паллиативная химио-, таргетная и лучевая терапия. Она используется не с целью разрушить опухоль, а с целью просто сделать ее меньше, чтобы освободить сдавленные нервные узлы, вызывающие боль.
Нейрохирургические методы. Нейрохирург надрезает корешки спинномозговых или черепных нервов. Это не приводит к утрате двигательной активности (хотя может потребовать реабилитации), но мозг лишается возможности получать болевые сигналы по этому пути.
Радиочастотная абляция (РЧА). В первом нашем посте, про паллиативную медицину, мы прикрепляли видео о том, как этот метод помог пациентке избавиться от болевого синдрома на последней стадии рака. Тогда РЧА применялась для того, чтобы разрушить метастазы, давившие на нервные корешки спинного мозга.
В случаях же, когда разрушить метастазы или саму опухоль невозможно, РЧА можно использовать для разрушения проводящих нервных путей. Это похоже на предыдущий вариант, только хирург действует не скальпелем, а специальной иглой, разогретой радиочастотными колебаниями до высокой температуры.
Нейролизис при помощи эндосонографии. Нейролизис – это разрушение нервного пути, проводящего боль, с помощью специальных химических растворов. Под контролем ультразвука эндоскоп подводят точно к чревному (солнечному) нервному сплетению через ЖКТ и разрушают часть нервных волокон. Обезболивающий эффект от процедуры наступает в 90% случаев при раке желудка или, например, поджелудочной железы. Сохраняется результат процедуры от месяца до года в редких случаях. Все зависит от скорости развития опухоли. При том, что в случае с применением препаратов-анальгетиков, их пришлось бы применять еженедельно.
Вертебропластика. Этот способ можем пояснить на живом примере из собственной практики. Повреждение позвоночника метастазами приводит к разрушению тела позвонка. Костная структура позвонка деформируется, происходит компрессия (сдавливание) спинномозговых корешков. Возникает корешковый компрессионный сидром, который сопровождается сильными болями. Вертебропластика укрепляет тело пораженного позвонка, чтобы он перестал давить на нервные корешки.
Операция малоинвазивная, ее проводят под местным обезболиванием и контролем компьютерной томографии. В тело позвонка вводится специальная игла-канюля, одновременно специальным инструментов восстанавливается высота позвонка. В полость позвонка вводится костный цемент. Результат вмешательства также контролируется КТ исследованием. В 98% случаев вертебропластика устраняет болевой синдром сразу же после окончания операции. Период реабилитации минимальный, через пару часов пациент может принимать вертикальное положение.
Так что, вариантов помочь пациенту с болевым синдромом у хорошего онколога сегодня много. Мы убеждены, что вне зависимости от стадии его рака, человек может максимально долго иметь нормальное качество жизни, без ограничений и страданий.
Проблема недостаточного обеспечения сильными анальгетиками больных с тяжелыми диагнозами – одна из самых, уж извините, больных проблем в российской онкологии в частности и паллиативной медицине в целом.
После самоубийства контр-адмирала Апанасенко в 2014 начались какие-то подвижки, но далеко не все так радужно, как обещалось.
Чтобы страха, а значит, и потенциальной ненужной боли, не осталось, давайте разъясним, какой порядок действий, нужный для получения наркотического препарата.
Кто выписывает рецепт?
- врач-онколог,
- участковый терапевт,
- врач любой специальности, который прошел обучение работе с наркотическими и психотропными веществами.
Сколько действует рецепт?
Нужно ли сдавать ампулы?
Нет. По закону, никто не вправе требовать от пациента или его родных сдавать использованные ампулы, пластыри и упаковки от наркотических анальгетиков.
Может кто-то из родственников получить рецепт и препарат от имени больного?
- Чтобы выписать рецепт, врач должен провести осмотр. Но если пациент не может добраться до больницы, он имеет право вызвать врача на дом.
- За печатью все же придется отправить кого-то из близких в поликлинику – печать лечебного учреждения на рецепте обязательна.
- Получить препарат в специально указанной аптеке может как сам пациент, так и его доверенное лицо (с паспортом и копией паспорта пациента)
Что делать, если возникли сложности с получением обезболивающего?
- Звонить на горячую линию Министерства здравоохранения: 8-800-200-03-89,
- Росздравнадзора: 8-800-500-18-35,
- В страховую компанию, у которой оформлен ваш полис ОМС.
В заключение хочется как-то обобщить все сказанное по этой тяжелой теме:
Читайте также:

