Клетки одной опухоли гетерогенный или гомогенный
Понятие вариабельности в отношении злокачественных новообразований можно рассматривать на различных уровнях. Опухоли различаются по широкому спектру признаков. Они вариабельны в зависимости от органного расположения и клеточного происхождения, от состояния организма, в котором опухоль развивается (гормональный статус, возраст и пр.) и др. Однако под термином опухолевой гетерогенности обычно понимают различия между клетками одной и той же опухоли. Каждая опухоль по своему строению может быть архитектурно сложна, участки опухоли также различны по васкуляризации, инфильтрации иммунными клетками "хозяина", соединительнотканными компонентами и другим характеристикам, которые могут менять фенотип идентичных клеток. Эти и другие факторы могут приводить к тому, что даже внутри одного клона клетки оказываются не идентичными ( Dexter, Calabresi, 1982 , Buick, 1984 ).
Доказательствами гетерогенности опухолей является то, что субпопуляции изолированы из опухолей самых разных по гистологии и типу органов, как из экспериментально полученных, так и из спонтанных опухолей человека. Они выделены как из опухолей, индуцированных химическими, физическими и вирусными агентами, из длительно пересеваемых малигнизированных линий клеток, так и из опухолей, недавно возникших ( Heppner, 1984 , H.Rubin, 1984 ). Клональная теория происхождения опухолей не исключает понятия об их гетерогенности. Любой организм начинается с одной клетки и затем становится гетерогенным; опухоли также развиваются, субпопуляции клеток опухоли могут дифференцироваться. Механизмы, ответственные за возникновение гетерогенности в нормальных и пренеопластических тканях, возможно, работают и в опухолях, но кроме того, не исключено существование опухолево- специфичных механизмов, исследованных мало.
Первым указал на гетерогенную природу опухолей L.Foulds. Он постулировал, что структура и поведение опухоли определяются целым рядом отдельных (единичных) характеристик, которые вариабельны в широких пределах, и могут комбинироваться различными способами и изменяться независимо (независимая прогрессия) ( Foulds, 1954 , Foulds, 1965 ).
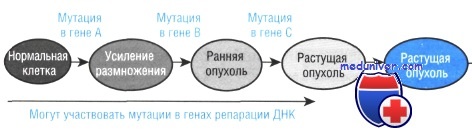
Прогрессия опухоли в настоящее время рассматривается как третья, конечная, стадия канцерогенеза , следующая за стадиями инициации и промоции , при этом независимые характеристики опухоли (скорость роста, инвазивность, метастатическая активность, морфологические проявления и пр.) являются характеристикой определенной стадии канцерогенеза и могут отражать генетическую гетерогенность клеточной популяции ( Pitot, 1989 ). Появляются новые факты, подтверждающие и дополняющие правила Фулдса, в том числе полученные на моделях клеточных линий ( H.Rubin, 1994 ).
Гетерогенность - один из важнейших факторов, благодаря которому сообщество опухолевых клеток высоко адаптивно к условиям среды и выживания. Под воздействием естественной и "искусственной" (терапия) селекции в опухоли появляются новые варианты клеток. Эти варианты могут взаимодействовать между собой, что помогает опухоли противостоять деструктивным влияниям. Гетерогенность опухоли появляется уже в процессе канцерогенеза. Опухоли могут быть поликлональными по своему происхождению - это изначально обеспечивает их гетерогенность.
Однако большинство опухолей моноклонально, происходят из одной клетки ( Fialkow, 1979 ) и, несмотря на это, содержат различные субпопуляции ( Ferguson et al., 1989 ; Soule et al., 1981 ; А.Rubin et al., 1992 ). Клональная эволюция популяции опухолевых клеток проходит через последовательную селекцию вариантов, происходящих от общего прародителя. Новые варианты могут возникать в любое время, многие из них имеют селективные ростовые преимущества. Клетка, которая случайно ст новится ведущей в эволюции опухоли, способна поддерживать себя и формировать новый фокус роста внутри развивающейся опухоли, перерастая и последовательно вытесняя другие клетки [ Nowell P., 1986 ]. Это объясняет гетерогенность опухолей , динамические черты опухолевой эволюции.
Генетическая нестабильность - один из важнейших механизмов, приводящих к появлению и нарастанию гетерогенности опухолей ( Nowell P., 1982 , Klein and Klein, 1985 ). Эта нестабильность ведет к увеличению числа ошибок в клеточной ДНК и т.о. ведет к фенотипической вариабельности. Непредсказуемость количества и качества мутаций и характера селективного отбора делают эволюцию каждой опухоли уникальной ( Heppner, 1984 , Klein and Klein, 1985 ). Как любое сообщество, опухоль не просто сумма слагающих ее субпопуляций, это взаимодействующая экосистема , каждая характеристика которой может влиять на другую. Для того, чтобы понять эту опухолевую "экологию", разрабатываются модельные системы, состоящие из отдельных субпопуляций, взаимодействия которых изучаются в различных комбинациях. См. также опухлевая гетерогенность при раке груди
Существуют три основные характеристики, присущие опухолевым клеткам. Во-первых, это бесконтрольный рост вне зависимости от клеточного окружения прилегающих тканей. Во-вторых, раковые клетки всегда находятся на той или иной стадии анаплазии, то есть теряют клеточную специализацию. В-третьих, раковые клетки способны метастазировать, то есть распространяться по организму и проникать в ткани далеко за пределы области развития первичной опухоли.
Эти три характеристики присущи клеткам большинства известных видов рака, однако существуют исключения. Действительно, в опухолевой ткани нарушены нормальные регуляторные механизмы контроля роста. Тем не менее обнаруживаются участки опухолевой ткани, где происходит контактное торможение роста неоплазии.
Более того, поскольку чаще всего именно метастазы становятся причиной смерти больных раком, изучение биологических механизмов метастазирования является одной из ключевых задач современных исследований в онкологии.
Большинство человеческих неоплазий по своей природе являются моноклональными. Это означает, что при канцерогенном воздействии на организм обычно первоначально поражается всего одна клетка и вся опухоль представляет собой результат размножения этой единственной клетки. Существуют две основные группы доказательств этой концепции.
Первая группа доказательств. Некоторые женщины бывают гетерозиготны по двум формам фермента глюкозо-6-фосфатдегидрогеназе (Г6ФД). Ген, кодирующий этот фермент, находится в Х-хромосоме, и женские гетерозиготы наследуют этот ген либо по отцовской, либо по материнской линии.
Если у женщины с гетерозиготным набором генов будет повреждена одна из Х-хромосом, каждая клетка ее тела будет содержать только одну из этих двух форм фермента. Обследования больных гематологическими видами рака, возникающими из гетерозиготности по гену Г6ФД, показали, что их раковые клетки всегда содержат только одну форму фермента. Это является сильным доказательством того, что рак развивается из одиночной клетки, несущей ту или иную форму гена.
При хронической гранулоцитарной лейкемии у больных обнаруживается рестрикция экспрессии ферментов в клетках гранулоцитарного ряда и, что особенно важно, в эритроцитах и тромбоцитах. Таким образом, процесс злокачественной трансформации поражает стволовые клетки.
Приведенный факт также подтверждает моноклональную теорию происхождения рака. Кроме того, в исследованиях было показано, что хотя делеция 9q участка хромосомы обязательно присутствует во всех раковых клетках, в некоторых клетках была также обнаружена потеря 17р и 18q участков, что предположительно связано с более поздними этапами развития опухоли. Это также говорит о том, что хотя возникновение и первичное развитие опухоли происходят из одной клетки, в процессе ее роста возможно возникновение и нарастание генетической изменчивости составляющих ее клеток.
Вторая группа доказательств моноклональной природы рака происходит из исследований лимфом и различных лимфоидных форм рака. Было показано, что иммуноглобулины, продуцируемые лимфоидными неоплазиями (и встроенные в мембрану, и выделяемые в кровяное русло, как в случае с миеломой), почти всегда являются моноклональными, принадлежащими к одному классу и обнаруживающими одинаковую рестрикцию экспрессии легких цепей.
Безоговорочное принятие теории моноклональности рака иногда заставляет исследователей приписывать раковым опухолям гораздо более предсказуемое поведение, чем это есть на самом деле. Реальное же положение вещей такое, что, несмотря на моноклональное происхождение, неоплазии в процессе своего развития обнаруживают все большую и большую гетерогенность. Этот факт необходимо всегда учитывать при лечении онкологических заболеваний и в оценке природы опухолевых метастазов.
Как же вообще возникает гетерогенность, если раковая опухоль первично моноклональна? Дело в том, что процесс злокачественной трансформации всегда сопровождается общей генетической нестабильностью, что вызывает многочисленные фенотипические изменения первоначально однородных клеток. Некоторые из мутирующих клеток выживают и дают начало новым линиям развития, некоторые погибают в результате мутации. Выживаемость мутировавших клеток зависит от их гормональной и биохимической стабильности, а также от возможности их распознавания иммунной системой.
Таким образом, зрелую опухоль можно рассматривать как конгломерат клеток моноклинального происхождения, но различающихся по способности к метастазированию, устойчивости к цитотоксическим препаратам и атакам иммунной системы организма.
Процесс постепенного накопления хромосомных изменений в ходе прогрессии опухоли показан на рисунке на примере развития рака толстой кишки из полипа толстой кишки. По мере роста опухоли и возрастания генетической нестабильности в ее клетках возникают многочисленные разрывы хромосом, делеции и редупликации генов. Морфологически это сопровождается изменчивостью клеточных ядер и ростом числа плеоморфных цитологических форм.
Опухолевые клетки многих видов рака содержат мутации по гену, кодирующему белок р53. Этот ген кодирует наработку ядерного фосфопротеина, который участвует в контроле клеточного цикла, запрещая вступление клетки в фазу G1, если обнаруживаются повреждения клеточной ДНК. В нормальных клетках под действием ультрафиолетового облучения или цитотоксических препаратов происходит резкое увеличение содержания р53, что связано со стабилизацией белка после трансляции.
Деактивация функций р53 в результате мутации приводит к тому, что клетка вступает в митоз даже с ошибками в своем генетическом коде. Мутации в гене р53 раковых клеток приводят к конформационным изменениям фермента и делают его неактивным. Мутантные формы фермента теряют способность связываться с молекулами ДНК. Таким образом, мутация белка р53 является ключевым моментом опухолевой профессии, когда злокачественные клетки вступают в клеточный цикл без предварительной репарации поврежденных участков ДНК. В дальнейшем происходит процесс все большего накопления мутационных изменений.
Популяция раковых клеток, выросшая как потомство одной единственной клетки, в ходе своего развития обнаруживает значительную изменчивость как по скорости роста отдельных субпопуляций, так и по их цитоплазматической организации, гормонально-рецепторному статусу, чувствительности к радиоактивному облучению и цитотоксическим препаратам. В качестве примера можно привести мелкоклеточный рак легкого.
При этом заболевании клетки первичной опухоли и отдаленных метастазов значительно отличаются друг от друга по уровню цитоплазматического кальцитонина, гистаминазы и L-дофаминовой декарбоксилазы. Обнаруживаются также кариотипические различия клеток первичных и вторичных опухолей.
Гетерогенность опухолей представляет собой громадную проблему для терапии рака. Если опухоль обнаруживает изменчивость клеточных фенотипов и антигенной экспрессии, становится очень трудно оценить, какой вид иммунотерапии может дать положительный лечебный эффект. Аналогично, наличие в единичной опухоли субпопуляций клеток с различной чувствительностью к тем или иным цитостатическим препаратам обусловливает ее резистентность к химиотерапии, которая часто выявляется в ходе проведения лечения.
С каждым годом человечество страдает от все большего количества всевозможных заболеваний. Конечно, медицина не стоит на месте, поэтому ученые разрабатывают лекарства от новых недугов, однако некоторые из них настолько опасны, что могут привести к летальному исходу. Каждый человек должен быть максимально осведомлен, в чем отличие злокачественной опухоли от доброкачественной, для того чтобы максимально себя обезопасить, а также вовремя начать лечение. В этой статье мы и поговорим об основных отличиях данных новообразований.
Введение
Как известно, кожа является самым большим органом человеческого организма и самым менее защищенным. Именно она подвержена максимальному воздействию со стороны окружающей среды, а также на ней отображается и общее здоровье всех органов и их систем. На эпидермисе вы можете обнаружить такие новообразования, как обычные родинки, бородавки и многие другие. Сами по себе они не несут серьезной угрозы, однако по стечению некоторых обстоятельств могут стать причиной возникновения серьезных раковых заболеваний.
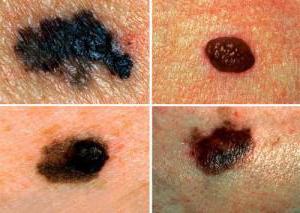
Однако не только кожные покровы являются подверженными возникновению раковых клеток. Онкологические заболевания могут коснуться любого органа вашего тела. Поэтому очень важно разобраться в отличиях злокачественной опухоли от доброкачественной.
Классификация отличий
Что представляет собой доброкачественная опухоль
Если вы узнаете основные отличия доброкачественной опухоли от злокачественной, то сможете выявить проблему на самой ранней стадии и вовремя начать лечение. В дальнейшем это может попросту спасти вам жизнь.
Доброкачественная опухоль – это новообразование, которое возникает вследствие неправильного роста и деления клеток. Из-за этого клеточная структура на определенном участке организма меняется, а, значит, меняются и все остальные явления, связанные с этой клеткой.
Основное отличие доброкачественной опухоли от злокачественной заключается в ее очень медленном росте. Нередко такое новообразование не меняет своего размера на протяжении всей жизни человека или же растет очень медленно. Через определенный временной промежуток такое новообразование может полностью исчезнуть или же, наоборот, перейти в злокачественную форму.
Также отличием доброкачественной опухоли от злокачественной является и то, что она не влияет на весь организм в целом.
Как определить, что опухоль является доброкачественной
Обычно доброкачественное новообразование подвижно и не имеет сочленения с соседними тканями. Если к такому месту прикоснуться, то это может доставлять боль и дискомфорт. Такое новообразование также может и кровоточить. Если опухоли находятся внутри организма, то иногда их наличие сопровождается болевыми ощущениями и общим плохим самочувствием. Однако чаще всего такие патологии не дают о себе знать вовсе. Поэтому обнаружить их можно только при проведении диагностики или при внимательном осмотре кожных покровов.
Причины возникновения доброкачественных опухолевых клеток
Основной причиной возникновения такого явления считается нарушение жизнедеятельности клеток. Как известно, клетки в нашем организме обновляются примерно 42-45 часов. Однако если по истечении этого строка клетка продолжает свой рост и жизнедеятельность, то и возникают опухолевидные образования.
К неправильному росту клеток могут привести такие факторы:
- ведение неправильного образа жизни;
- радиация;
- частое и долгое пребывание под ультрафиолетовыми лучами;
- неблагоприятные рабочие условия;
- неправильная работа гормональной системы;
- сбои иммунитета;
- наличие различных травм.
Согласно исследованиям ученых, доброкачественные образования могут возникать абсолютно у каждого человека. Отличие злокачественной опухоли от доброкачественной, симптомы – это очень важная информация, с которой должен ознакомиться каждый человек в этом мире, для того чтобы контролировать уровень своего здоровья.
Разновидности доброкачественных опухолей
Как известно, такой тип патологий присущ абсолютно для любой ткани. Довольно часто у пациентов замечено развитие таких доброкачественных опухолей, как миома, липома, папиллома, аденома, глиома, кисты и многие другие. Все они способны к очень быстрому росту, поэтому их состояние нужно постоянно контролировать.
Что представляет собой злокачественная опухоль
Как понять, что опухоль злокачественная
Отличия злокачественной опухоли от доброкачественной (фото онкологических заболеваний представлены в статье) заключаются в общем состоянии пациента. При наличии злокачественных образований страдает весь организм в целом. Человек начинает стремительно худеть, постоянно страдает от тошноты, рвоты, повышенной температуры тела, кашля, депрессий и слабости.

Обычно на самых ранних стадиях болезнь никак не проявляется, поэтому распознать заболевание в домашних условиях просто невозможно. Однако, чем больше недуг начинает прогрессировать, тем больше он дает о себе знать. Поэтому при первых же симптомах плохого самочувствия обращайтесь в больницу. Чем раньше вы начнете лечение, тем большей будет его результативность.
Причины возникновения
Классификация и отличие злокачественной опухоли от доброкачественной подробно описаны в денной статье, поэтому при наличии первых симптомов заболевания немедля обращайтесь к высококвалифицированным специалистам.
Если недуг был обнаружен еще на ранних стадиях, по словам врачей, его можно ликвидировать практически в ста процентах случаев.
К развитию данной патологии могут приводить как внутренние, так и внешние факторы. Рассмотрим, что же может привести к возникновению злокачественных образований:
- Очень часто к онкопатологии приводит употребление большого количества вредной и жирной пищи. По словам специалистов, неправильно питающиеся люди намного больше склонны к возникновению злокачественных опухолей. При этом не стоит также исключать и употребление чрезмерного количества алкогольной продукции и табака.
- Частое и длительное нахождение в состоянии стресса.
- Также к болезням приводит радиация и работа во вредных условиях.
- Не стоит исключать и частую смену половых партнеров, а также негативное воздействие окружающей среды.
Какими бывают злокачественные опухоли
Классификация злокачественных опухолей зависит от того, из каких клеток они формируются. К столь опасным недугам относятся саркома, лейкоз и многие другие. Основные отличия доброкачественной опухоли от злокачественной заключаются в том, что первый тип заболеваний является условно опасным, в то время как другой - крайне опасным.

Стоит учитывать, что болезни, вызванные опухолями, могут развиваться у пациентов абсолютно любого возраста. Поэтому бывают случаи, когда недуг начинает прогрессировать еще в младенчестве.
Отличие ki 67 доброкачественной опухоли от злокачественной
Индекс ki 67 подразумевает антиген раковой опухоли. Если анализ выявил увеличенный показатель, то недуг находится на стадии развития. Если же маркер не выявлен или минимален, то раковая клетка находится в стадии покоя.
На самом деле существует большое количество других отличий. В этой статье мы рассмотрим самые значительные из них.
Итак, первым и самым важным отличием доброкачественного от злокачественного образования является темп его роста. Чаще всего более опасные опухоли растут намного быстрее, чем менее опасные. Однако и в этом правиле существуют исключения. Все зависит от индивидуальных особенностей организма.
Также важным отличием доброкачественных образований является их способность к возникновению метастазов. Если доброкачественные образования способны распространяться только локально, то злокачественные затрагивают и другие органы организма.
Также стоит учитывать, что раковые клетки способны к рецидивам. Это говорит о том, что, если заболевание, возникшее, например, в желудке, вы ликвидировали, оно может возникнуть снова, но уже в другом органе.
Злокачественные клетки способны к инвазиям. Это говорит о том, что они могут наносить ущерб не только одному органу, но и соседним. Таким образом, раковые клетки очень быстро распространяются и на другие органы, не имея границ. А вот доброкачественные образования характеризуются наличием четких границ и контуров. Однако если они начнут увеличиваться в размерах, то это может оказать давление на другие органы. Поэтому состояние доброкачественных образований также нужно постоянно контролировать.
Отличие доброкачественной опухоли и злокачественной молочной железы (или любой другой части тела) также заключается и во внешнем виде клеток. Так, доброкачественные клетки являются более светлыми, в то время как злокачественные, наоборот, – темными.
Также отличие состоит и в методах лечения. Так, сравнительно безопасные новообразования чаще всего удаляются с помощью хирургического метода, в то время как опасные – с помощью химиотерапии или лучевого облучения.
Предраковые клетки
Отличие доброкачественной опухоли от злокачественной легкого или любого другого органа зависит от многих факторов. Доброкачественные опухоли не становятся злокачественными в одно мгновение. Существует также предраковая стадия, которая называется неоплазией. Именно на такой стадии лечение будем самым эффективным. Однако мало кто догадывается о том, что в организме начинают происходить отрицательные изменения, поэтому чаще всего такой этап развития болезни просто игнорируется.
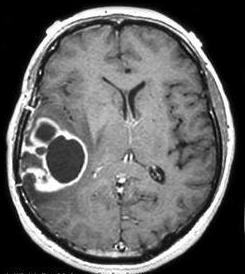
Отличие злокачественной опухоли от доброкачественной на МРТ
На самом деле помощью такого метода диагностики, как МРТ, можно определить тип опухоли. Если новообразование является доброкачественным, то оно будет иметь однородную структуру, а также четкие контуры. Так как при обследовании на наличие опухолей будет использоваться МРТ с контрастом, то в этом случае образование не будет накапливать большое количество контраста.
А вот если опухоль является злокачественной, то на снимке будет видно, что она не имеет четких клеток и врастется в здоровые ткани. Кроме этого, структура новообразования будет неоднородной. Довольно часто при злокачественных патологиях возникают отечности тканей. При этом такие образования очень хорошо накапливают контрастирующее вещество.
Выводы
Несмотря на то что доброкачественные образования являются условно опасными, нужно регулярно следить за их состоянием. Ведь и они могут нанести существенный вред вашему здоровью. Нередко такие клетки превращаются в злокачественные.
Не стоит думать, что рак – это приговор. Если вы будете вести правильный образ жизни, а также беречь себя, то сможете минимизировать риск развития такой опасной патологии. Не забывайте о том, что любое заболевание намного проще вылечить на самой ранней стадии, поэтому при первых жалобах на плохое самочувствие обращайтесь в больницу.
Знайте, даже злокачественные опухоли можно вылечить, особенно если вы начали лечение еще на самых ранних стадиях. Поэтому не запускайте свое здоровье, оно у вас одно. Берегите себя, занимайтесь собой, и тогда вы поймете, что жизнь прекрасна.
16 октября 2015
- 3940
- 3,2
- 2
- 4
![]()
Анна Петренко
- Биотехнологии
- Онкология
- Стволовые клетки
Клетки многоклеточного организма существуют не сами по себе, а в создаваемом ими самими тканевом окружении, подобно людям, являющимся элементами общества. Клеточная микросреда не только играет важнейшую роль в поддержании функционирования клетки, но и сама активно на него влияет. Реципрокные динамические взаимодействия между клеткой и ее окружением играют решающую роль в развитии онкологических заболеваний, ставших бичом нашего времени. Развитие современных технологий лабораторного изучения клеток и их микроокружения позволяет отследить эти процессы в беспрецедентных деталях и даже смоделировать в лаборатории микросреду по своему желанию.
Жизнь на Земле начиналась с простейших организмов, состоящих из одной клетки, которой приходилось быть самостоятельной и самодостаточной. Однако со временем начали появляться и более сложные существа. Клетки в них уже различались внешне и отвечали за разные функции организма, хотя всё еще могли быть не разнесены в пространстве. Что же касается современных многоклеточных организмов — тут уже не скроешь высокую сложность их устройства и сотни типов клеток, образующих ткани, складывающие всё тело: от носа до кончика хвоста. И здесь клетки должны работать особенно слаженно.

Специализированную физиологическую микросреду, в которой находится СК, называют тканевой нишей. Она поддерживает основные характеристики, отличающие стволовую клетку от всех остальных: плюрипотентность и способность самообновляться [1]. Начнет ли клетка делиться либо останется в покоящемся состоянии, тоже во многом зависит от среды вокруг нее [2, 3].

Более того, раковые клетки (РК), выделяя сигнальные молекулы, подготавливают специальные ниши для будущих метастазов. В этой связи крайне перспективной становится возможность манипулировать раковыми стволовыми клетками, влияя не на них самих, а на их микросреду или на окружение метастазов. Некоторые исследователи утверждают, что будущее противоопухолевой терапии — это разработка препаратов, направленных на РСК и метастатические ниши.
Структура микроокружения

Рисунок 3. Регуляция ниши стволовых клеток нормального кишечного эпителия и колоректального рака. Слева — Сигнальные молекулы, секретируемые кишечными субэпителиальными миофибробластами (ISEMFs) и клетками Панета (Paneth), способствуют обновлению пула СК и нормальной кишечной пролиферации. Справа — Состав микроокружения способствует размножению клеток колоректального рака (КРР) либо их переходу в состояние покоя, из которого они — под влиянием того же микроокружения — могут выйти и восстановить свой онкогенный потенциал. Рисунок из [17], адаптирован.
Роль воспалительных реакций
Микроокружение опухоли характеризуется постоянным воспалением. М2-макрофаги, нейтрофилы, тучные клетки, повышенная концентрация медиатора воспаления оксида азота (NO), многие провоспалительные цитокины — всё это способствует процветанию РК и увеличению агрессивности рака [19]. Поддерживают развитие опухоли также регуляторные Т-клетки и Т-хелперы 2 типа.
Среди сложнейшей сети сигнальных путей особое место по отношению к раку отводится двум системам, приводящим к активации генов, — NF?B и STAT3. Эти факторы транскрипции могут начать работу в ответ на многое: воспаление, бактериальные или вирусные антигены, стресс, свободные радикалы. Используя эти пути, опухоль образуется, пролиферирует, активирует процессы ангиогенеза и инвазии, метастазирует — в общем, делает практически всё для собственного развития. Как оказалось, активация NF?B задействована даже в формировании резистентности рака к химиотерапии и облучению. Эти виды лечения эффективно убивают дочерние раковые клетки, но редко уничтожают сами РСК [19], что обычно имеет печальные последствия в форме обострения болезни спустя какое-то время.
Однако иммунное микроокружение опухоли может оказывать и обратное влияние. Тогда в него включены другие клетки: M1-макрофаги, Т-хелперы 1 типа, цитотоксические Т-клетки, АПК и естественные киллеры [20]. Переключение с антиопухолевого режима на проопухолевый сейчас активно изучается. К примеру, недавно показано, как рак подавляет нормальные функции эффекторных Т-клеток [21].
Внеклеточный матрикс
Внеклеточный матрикс — это каркас микроокружения, формирующий его механическую структуру*. Его создают мезенхимальные клетки: фибробласты, хондроциты, остеобласты. Состав внеклеточного матрикса очень сложен и многообразен: в него входят коллагены — основные белки соединительной ткани (например, коллаген типа IV), протеогликаны, гликопротеины (фибронектин и ламинин-1) и другие компоненты. Ключевые ферменты матрикса — матриксные металлопротеиназы (ММП), разрушающие практически любой белок внеклеточного пространства и тем самым преобразующие его структуру. Двунаправленное влияние ВКМ и РК при некоторых условиях может способствовать прогрессированию опухоли, влиять на ее агрессивность и способность расселяться по всему организму [20]. Например, не только опухолевая клетка для своего роста ремоделирует матрикс, выделяя ММП, но их могут выделять и стромальные клетки микроокружения, облегчая инвазию РК.
Метастазирование и метастатические ниши

Модели изучения микроокружения
Сегодня существует множество моделей изучения того, как микросреда изменяет отдельные клетки и их ДНК, и сопутствующее оборудование становится всё более компактным, автоматизированным и многофункциональным.
Раньше для выращивания клеток в культуре преимущественно использовались двухмерные (плоские) матрицы. На них было показано, что ограничением формы или подвижности клетки можно спровоцировать деление, апоптоз или даже дифференцировку мезенхимальных СК человека. Сейчас к этим моделям добавились и трехмерные модели из синтетических гидрогелей и матриц, основанных на коллагеновых волокнах. С их помощью удалось обнаружить, что у клеток, культивируемых в 2D- или 3D-окружении, различаются* фенотип, клеточно-матриксная адгезия и даже экспрессия генов.
* — О том, как чипы различных размеров и разной архитектурной сложности направляют дифференцировку мышиных нейрональных клеток-предшественниц в нейроны либо глию, можно прочитать в статье [24].
Для более корректного сравнения клеток, выращенных в двух- и трехмерной среде, разработаны специальные микролунки: одиночная клетка контактирует с плоской поверхностью, на которую нанесены адгезивные лиганды. Так, изменяя упругость подложки, можно манипулировать формой клетки в пространстве [25].
На похожей модели другая группа исследователей показала, что фармакологическое ингибирование сигналинга киназ определенного семейства не дает спящим клеткам рака груди вновь начать делиться. Поскольку для пролиферации нужна также активация другого гена, то параллельная терапия двумя ингибиторами вызывает апоптоз и задерживает рост метастазов. Авторы указывают, что такое комбинированное лечение может предотвратить повторное развитие рака молочной железы [27].

Комбинированная система Polaris от Fluidigm Corp.
Микрофлюидика на службе исследователей клеточных ниш
Изучение единичных клеток с помощью биочипов на основе технологий микрофлюидики впервые было предложено в 2013 году, когда компания Fluidigm Corp. (США) анонсировала первый чип для профилирования гетерогенных популяций клеток [29]. Чип С1 TM позволил исследователю объединить захват отдельных клеток, лизис, обратную транскрипцию и амплификацию в единый автоматический протокол, тем самым решая большинство существующих проблем со скоростью эксперимента и надежностью и воспроизводимостью получаемых данных.
Довольно быстро биочипы заняли свою нишу во многих областях науки и медицины: изучении стволовых клеток, иммунологии, эпигенетике и, конечно, в онкологии. Так, с помощью биочипов была проведена одна из самых масштабных работ по определению клональности мутаций у пациентов с острым лимфобластным лейкозом. Результаты дали основания полагать, как именно происходило развитие заболевания в каждом конкретном случае [30].
В 2015 году Fluidigm Corp. анонсировала новую комбинированную систему Polaris TM , которая позволяла не только профилировать популяцию в целом, но и изучать влияние микроокружения на конкретные единичные клетки. На одном чипе теперь можно было выбрать клетки с интересующим иммунофенотипом, изолировать их в индивидуальных камерах и задать определенные параметры клеточной ниши.
Помимо манипуляций с потоками среды и газа, температурой и влажностью, в камеры клеток можно вводить дополнительные факторы, в том числе сигнальные молекулы, РНК, вирусы и бактерии. Такая свобода действий позволяет, во-первых, смоделировать практически любое клеточное состояние — апоптоз ли, пролиферацию, воспаление, гипоксию, дифференцировку или синтез специфических белков, а во-вторых, получать воспроизводимые и надежные результаты, гарантировать которые могут только приборы с высоким уровнем автоматизации. Более того, с того момента, как клетка попадает на чип, за каждым мгновением ее жизни ведется наблюдение, что позволяет напрямую соотносить изменения в микроокружении с фенотипом и экспрессией генов конкретной клетки.
Приборы типа Polaris TM открывают огромные перспективы в области изучения клеточного микроокружения, какую бы конечную цель не ставил перед собой исследователь — проверить эффективность нового лекарства, изучить новый сигнальный каскад или посмотреть, как меняется фенотип клетки в тех или иных условиях [31, 32].
Читайте также:


