Карбонил железа в онкологии
Карбонилы металлов представляют собой соединения окиси углерода с металлами: никелем, железом, кобальтом, вольфрамом. Карбонил никеля - бледно-желтая или бесцветная, легко подвижная жидкость, с запахом копоти. Обладает чрезвычайно высокой летучестью, испаряется при комнатной температуре, кипит при 42,3 С, пары взрывоопасны. ПДК - 0,0005 мг/м3. Карбонил железа или пентакарбонил железа - жидкость бурого или желтого цвета. Карбонил кобальта - оранжевые кристаллы. ПДК для кобальта гидрокарбонила и продуктов его распада - 0,01 мг/м3. Гексакарбонил вольфрама - бесцветные кристаллы. Наибольшее значение в промышленности имеют карбонилы никеля и железа.
Применяются при получении чистых металлов (никеля, железа), в производстве специальных сплавов и сталей (карбонил никеля), при синтезе органических и металлоорганических соединений. Карбонил кобальта применяется как катализатор при синтезе некоторых веществ, пентакарбонил железа - как антидетонатор в примеси к бензину. В производственных условиях при получении и применении карбонилов металлов имеется значительное загрязнение воздушной среды окисью углерода.
Наиболее типичным представителем этой группы является карбонил никеля. Последний (как и другие карбонилы металлов) поступает в организм преимущественно через легкие и неповрежденную кожу. Легко разлагается в организме на окись углерода и металл, однако может сохраняться и в неразложившемся состоянии в течение относительно долгого времени. Раздражает слизистые оболочки, легко всасывается, циркулирует в крови в виде коллоидного раствора металла, выводится почками и частично кишечником, поступая в него из печени.
Оказывает общетоксическое, раздражающее и сенсибилизирующее, а также канцерогенное действие (рак носовой полости, придаточных пазух носа и легких). Токсический эффект обусловлен целой молекулой. Карбонил никеля относится к числу так называемых тиоловых ядов - связывает тиоловые (сульфгидрильные) группы клеточных белков, нарушая активность основных ферментов, чем и объясняется его общетоксическое действие.
Острое отравление карбонилом
При остром отравлении карбонилом никеля ведущим является раздражающее действие, подобное действию окислов азота. Клиническая симптоматика острого отравления карбонилом никеля развивается после скрытого периода продолжительностью 6-12 ч. При легкой интоксикации появляются недомогание, головная боль, осиплость, кашель, одышка, стеснение в груди. Температура субфебрильная, лишь изредка поднимается до высокой и держится 1-2 сут. Проявления легкой острой интоксикации карбонилом никеля сходны с металлической лихорадкой, но отличаются значительно более выраженными явлениями общей интоксикации и более медленным обратным развитием.
Течение острых (средней тяжести и тяжелых) интоксикаций карбонилом никеля затяжное (2-3 нед. и более), волнообразное, часто осложняющееся токсической пневмонией. В крови - нейтрофильный лейкоцитоз, вплоть до высокого, резкий палочкоядерный сдвиг, выраженная эозинофилия, анемия.
Хроническая интоксикация
Токсические поражения печени (на субклиническом уровне) подтверждаются нарушениями белкового и липопротеидного обмена.
Диагноз хронической интоксикации устанавливается на основании динамического наблюдения при наличии сочетания описанных синдромов у рабочих со стажем не менее 5 лет. Усиленное выделение никеля с мочой подтверждает диагноз. Изолированное развитие диффузного пневмосклероза у лиц молодого возраста достаточно для установления диагноза хронической интоксикации карбонилом никеля.
Лечение
Экспертиза трудоспособности
После выраженной острой интоксикации - больничный листок на 2 мес. Санаторно-курортное лечение. Диспансерное наблюдение. При наличии стойких остаточных явлений или при хроническом отравлении - перевод на другую (постоянную) работу без воздействия пыли, токсических веществ. Возможна инвалидность.
Профилактика
Полная герметизация производственной аппаратуры и систематический контроль за ее состоянием. Термическая дегазация отходов. Систематический инструктаж рабочих, ознакомление с запахом карбонила. Предварительные и периодические медицинские осмотры.
Следует еще отметить пентакарбонил железа, который независимо от путей попадания в организм может вызвать токсический отек легких, и карбонил вольфрама, вызывающий при длительном контакте трофические нарушения ногтей и кожи (расслаивание, повышенная ломкость ногтей).
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Реферат. Анемия – одно из наиболее часто возникающих осложнений химиотерапии. У пациентов со злокачественными новообразованиями часто развивается дефицит железа. Эффективность терапии эритропоэтинами значительно повышается при использовании внутривенных препаратов железа. Карбоксимальтозат железа – высокоэффективный препарат для внутривенного введения с благоприятным профилем безопасности, применяющийся с целью коррекции железодефицита и анемии.
По данным исследования ECAS (2004), анемия развивается у 39–68% онкологических пациентов, при этом у 75% больных анемия развивается вследствие проведения химиотерапии [1]. Анемия при онкологических заболеваниях (АОЗ) определяется как снижение концентрации гемоглобина ниже нормальных значений, обусловленное как наличием самой опухоли, так и проводимым лечением.
Согласно критериям токсичности по шкале CTC v.4, 1 степень анемии представляет собой снижение концентрации гемоглобина от нормы до 10 г/дл, 2 степень – 8–10 г/дл, 3 степень – 6,5–8 г/дл, 4 степень – наличие жизнеугрожающих состояний.
Анемия у онкологических больных может развиваться вследствие различных причин, наиболее частыми являются:
– недостаток железа и витаминов (чаще всего);
– наличие опухоли (инфильтрация костного мозга, кровотечение, гиперспленизм, анемия хронических заболеваний);
– противоопухолевое лечение (обширная лучевая терапия, проведение химиотерапии и т.д.);
– сопутствующие заболевания (гемоглобинопатии, заболевания почек и др.).
АОЗ является результатом сложных патофизиологических и патохимических процессов, центральная роль в которых отводится синтезируемому в печени универсальному гуморальному регулятору метаболизма железа – пептиду гепсидину. В норме гепсидин, прежде всего, обладает ярко выраженными антибактериальными свойствами и является пептидом каскада реакций ответа острой фазы. Однако благодаря современным генно-инженерным технологиям удалось выяснить, что роль гепсидина в организме значительно многограннее. Так, например, было показано, что гепсидин является отрицательным регулятором захвата железа в тонкой кишке и блокирует железо в макрофагах [2]. Эти данные согласуются с результатами других исследований [3–5]. Е. Nemeth и соавт. исследовали уровень гепсидина и некоторых цитокинов у добровольцев с воспалением, вызванным введением липополисахарида (ЛПС). Было показано, что вскоре после введения агента воспаления происходит увеличение значений провоспалительного цитокина – интерлейкина (ИЛ)-6, а также резко повышаются уровни интерферона (ИФН), фактора некроза опухоли-альфа (ФНОα) и ИЛ-1β. Также отмечается повышение экспрессии мРНК гепсидина в несколько тысяч раз и снижение уровня железа в сыворотке.
В результате этих экспериментов E. Nemeth и соавт. предположили, что ИЛ-1 стимулирует синтез лактоферрина (ЛФ), который связывает железо с большей аффинностью, чем трансферрин, и железо, связанное с ЛФ, захватывается макрофагами и хранится в форме ферритина, тем самым затрудняя соединение железа с эритроидными клетками. Затем повышается уровень ИЛ-6, который активирует экспрессию гепсидина, что приводит к уменьшению абсорбции железа в кишечнике и увеличению его секвестрации в макрофагах. Та же ситуация наблюдается при опухолях: у пациента развивается анемия, повышаются уровни гепсидина, ферритина и ИЛ-6 [6]. Это еще раз подтверждает положение о том, что высокий уровень гепсидина подавляет эритропоэз путем истощения запасов железа. В отдаленном периоде это приводит к абсолютному железодефициту в организме вследствие нарушения его усваиваемости из пищи или применяемых внутрь препаратов. Если гепсидиновый блок существует недолго, то это может привести к функциональному железодефициту – состоянию, при котором железо не может быть эффективно мобилизовано из запасов в ретикулоэндотелиальной системе [7, 8]. По сравнению с ежедневным количеством высвобождаемого из макрофагов 25 мг железа у здоровых людей у пациентов с воспалением эта цифра снижается до
Роль железа у больных анемией, вызванной онкологическими заболеваниями
Патогенез анемии, которая определяется как снижение уровня гемоглобина 1 , обобщивших результаты крупнейшего исследования ECAS (European Cancer Anemia Survey -Европейское исследование анемии при раке), анемия диагностируется у 53% пациентов с лимфомой/ миеломой и лейкемией и у 25% пациентов с раком головы и шеи. Частота анемии находится в прямой зависимости от локализации, распространенности процесса и от проводимого лечения. Железодефицитная анемия отмечается у 40% онкологических больных, не получающих противоракового лечения. Однако химиотерапия увеличивает количество больных с анемией уже до 75%.
Будучи даже умеренной, анемия значительно снижает качество жизни онкологических больных. Основной симптом анемии - слабость - приводит к снижению толерантности к умственной и физической нагрузке. Именно повышенная утомляемость является одной из причин отказа пациентов от лечения. Между тем, как было показано в исследовании J. Crawford и соавт. (2002) 2 , изучавших связь между уровнем гемоглобина и качеством жизни пациентов, получавших химиотерапию, повышение содержания гемоглобина крови до 12-13 г/дл приводит к значительному улучшению качества жизни и выживаемости онкологических больных, по сравнению с пациентами, у которых уровень гемоглобина (Hb) составил 10-11 г/дл и ниже.
В ряде исследований было также показано, что у онкологических больных может варьировать степень дефицита железа. Согласно данным исследования, в котором приняли участие 1052 больных раком поджелудочной железы, у 46% пациентов выявлялось железодефицитное состояние, у 33% -анемия 3 . Известно, что 1/3 случаев анемии у взрослых обусловлена недостаточным питанием, дефицитом витаминов (фолиевой кислоты, витамина B 12), как, например, у больных раком легких. Безусловно, прежде чем приступить к лечению анемии, необходимо исключить нарушения нутритивного статуса у пациентов.
В настоящее время железодефицитные синдромы принято подразделять на три большие группы: абсолютный дефицит железа, который у онкологических пациентов чаще всего связан с хронической или острой кровопотерей; функциональный дефицит железа, который, прежде всего, связан с усилением эритропоэза - либо на фоне применения рекомбинантного человеческого эритропоэтина, либо на фоне значительного усиления эритропоэтической активности костного мозга; синдром, обусловленный депонированием железа в клетках моноцитарно-макрофагальной системы, связанный с различными воспалительными процессами. Наличие у пациента одного или комбинации из двух-трех железодефицитных синдромов приводит к развитию железодефицитного эритропоэза и анемии. Для такого состояния, как абсолютный дефицит железа, характерны истощение или полное отсутствие запасов железа и низкий уровень ферритина, а для функционального дефицита железа - недостаточное поступление железа в костный мозг, низкая степень насыщения трансферрина железом.
В заключение профессор В.Г. Демихов подчеркнул, что на сегодняшний день комбинированное применение внутривенных препаратов железа и рекомбинантного человеческого эритропоэтина является наиболее рациональной тактикой коррекции анемии у пациентов с онкологическими заболеваниями, однако применение рекомбинантного человеческого эритропоэтина должно проводиться под строгим контролем и только у тех пациентов, которые получают химиотерапию.
Таблица 1
Переносимость препаратов железа
| Осложнения на фоне приема препаратов железа | Железа полимальтозный комплекс (n = 52) | Железа сульфат (n = 51) | Значение p |
| Тошнота или боль в животе | 9 (17,3%) | 9 (17,6%) | - |
| Запоры | 4 (7,6%) | 4 (7,8%) | - |
| Тошнота или боль + запоры | 1 (1,9%) | 13 (15,4%) | - |
| Всего | 14 (26,9%) | 26 (50,9%) | 0,012 |
Инкапсулированные формы пероральных препаратов характеризуются меньшим количеством осложнений, но имеют сниженную эффективность. При пероральном применении препаратов железа осложнения могут проявляться как в виде тошноты, вздутия живота, запора или поноса, так и в виде некротизирующего гастроэнтерита, желудочно-кишечных кровотечений, отложения железа в сердце, печени, поджелудочной железе, метаболического ацидоза вплоть до комы, смерти от сердечной недостаточности. Еще одна важная проблема, связанная с применением пероральных препаратов, - как показывает опыт, далеко не все онкологические больные способны ежедневно и на протяжении нескольких лет принимать пероральные препараты железа, которые, к тому же, сопровождаются перечисленными выше побочными действиями. Приверженность к длительной терапии такими препаратами у пациентов невелика. Согласно данным ряда исследований, случаи запора, тошноты и диареи у пациентов при пероральном приеме препаратов железа встречаются в несколько раз чаще, чем при внутривенном применении. Низкая абсорбция, побочные действия со стороны желудочно-кишечного тракта и низкая приверженность к лечению являются причинами, ограничивающими использование пероральной ферротерапии 16, 17 .
Таблица 2
Препараты железа для парентерального применения (Британские рекомендации по лечению железодефицитной анемии, 2011)
Хотя окончательное подтверждение эффективности внутривенного применения железа как в комбинации с эритропоэтинами, так и в монотерапии - дело ближайшего времени, уже сейчас можно утверждать:
Международные рекомендации по применению рекомбинантных форм эритропоэтина и внутривенных препаратов железа в онкологии
По данным, представленным в докладе доцента кафедры онкологии с курсами по онкологии и патологической анатомии ИПО Башкирского государственного медицинского университета, заведующей отделением паллиативной помощи РКОД, главного внештатного онколога г. Уфы, к.м.н. Любови Николаевны КУДРЯШОВОЙ, анемия, ассоциированная с химиолучевым лечением, встречается в 54% случаев, при этом анемия слабой степени -в 39% случаев, анемия средней степени - в 14%, анемия тяжелой степени - в 1% случаев. По данным Европейского исследования раковой анемии ECAS (European Cancer Anemia Survey), анемия имела место у 39% онкологических больных 1 . Если на момент постановки диагноза у больных не было анемии, то с высокой вероятностью (62%) она развивалась в процессе лечения, а при проведении химиотерапии - в 88% случаев. Выделяют 4 степени анемии, причем 4-я степень, когда уровень гемоглобина составляет менее 6,5 г/дл, является угрожающей для жизни пациента. Анемия отрицательно сказывается на всех органах и системах. Доказано, что риск смерти у больных анемией в целом на 65% выше, чем у больных без анемии, при этом различие зависело от локализации опухоли и колебалось от 19% при раке легкого до 75% у больных с опухолями головы и шеи 19 . Гипоксия влияет на биологию опухоли. Клетка, находящаяся в состоянии кислородного голодания, с одной стороны, меняет пути метаболизма, а с другой стороны, включает компенсаторные механизмы, такие как активация генов семейства HIF (hypoxia inducible factor - факторы, индуцируемые гипоксией)-1, что способствует увеличению выработки сосудистого эндотелиального фактора роста (vascular endothelial growth factor, VEGF). VEGF отвечает за образование новых сосудов в опухоли, способствуя ее росту и метастазированию. Клетка, находящаяся в состоянии глубокой гипоксии, отличается увеличением частоты спонтанных мутаций и поломкой гена p53, определяющего апоптоз. Подавление апоптоза уменьшает чувствительность опухоли к цитостатической и лучевой терапии.
Рациональное лечение анемии необходимо, и оно может влиять как на эффективность лечения, так и на качество и продолжительность жизни пациента. Основными вариантами лечения анемии, индуцированной химиотерапией, являются переливание крови, терапия эритропоэтинами без препаратов железа, с пероральными препаратами железа и с внутривенными препаратами железа. Переливание крови обеспечивает быструю коррекцию анемии, но связано с целым рядом рисков, в первую очередь с реакцией на трансфузию. При исследовании 366 нежелательных реакций, связанных с переливанием крови, было установлено, что в 52% случаев осложнения были связаны с переливанием недоброкачественных компонентов крови, в 15% имела место острая трансфузионная реакция, в 14% случаев - отсроченная трансфузионная реакция. Гемотрансфузии также несут серьезную опасность риска передачи вирусов гепатита и ВИЧ-инфекции. Существенным недостатком такой коррекции гемоглобина является кратковременность эффекта. До 1987 г. трансфузии оставались наиболее распространенным методом коррекции анемии.
Новый этап в лечении анемии у онкологических больных начался с появлением эритропоэтинов. Эритропоэтины впервые были использованы у больных с терминальными заболеваниями почек и дали хорошие результаты. Это послужило толчком для исследования их эффективности у больных, получающих цитостатики. Анализ данных многочисленных контролируемых исследований показал, что применение эритропоэтинов у онкологических больных с анемией, индуцированной химиотерапией, способно повышать показатели гемоглобина, улучшать качество жизни и сокращать потребность в гемотрансфузии (Agency for Healthcare Research and Quality, 2006). Однако дальнейшие исследования продемонстрировали, что при этом могут развиваться нежелательные эффекты в виде тромбоэмболических осложнений, а также возможно уменьшение общей выживаемости у больных, получающих эритропоэтины 20 . В метаанализе H. Ludwig и соавт., включившем около 60 исследований, было показано, что наиболее часто осложнения развивались у тех онкологических больных, у которых уровень гемоглобина превышал 12 г/дл, а лечение продолжалось даже в отсутствие ответа на терапию эритропоэтинами, при этом проводились гемотрансфузии 1 . Эти данные нашли отражение в рекомендациях по лечению анемии при злокачественных опухолях. Они сводятся к следующему: если при назначении эритропоэз-стимулирующих агентов за 4 недели лечения происходит повышение уровня гемоглобина менее 1 г/дл, то доза вводимых препаратов должна быть увеличена, но при терапии эритропоэтином-альфа увеличение дозы не рекомендуется. Если уровень гемоглобина увеличился на 1 г/дл, дозу эритропоэз-стимулирующих агентов необходимо снизить на 25-50% или оставить прежней. В случае если уровень гемоглобина достиг 12 г/дл, дозу препарата необходимо снизить на 25-50%. При уровне гемоглобина 13 г/дл лечение эритропоэтинами необходимо приостановить, пока уровень Hb не снизится до 12 г/дл, после чего лечение необходимо возобновить, но при этом редуцировать первоначальную дозу на 25%. Если терапия эритропоэтинами была эффективной, необходимо повторить курс лечения в течение еще 4 недель после окончания химиотерапии. Лечение эритропоэз-стимулирующими агентами считается неэффективным в том случае, если в течение 8-9 недель терапии увеличение гемоглобина было менее 1 г/дл.
Учитывая, что 30-50% больных не дают ответа на лечение эритропоэтинами, в руководстве Европейской организации по изучению и лечению рака (European Organization for Research and Treatment of Cancer, EORTC) указано, что перед назначением эритропоэтина необходимо устранить железодефицитную анемию 21 . То же можно найти и в рекомендациях Американского общества клинических онкологов (American Society of Clinical Oncology, ASCO) и ESMO.
В руководстве Национальной онкологической сети 2010 (National Comprehensive Cancer Network, NCCN 2010) указано, что пероральные препараты железа распространены больше, чем внутривенные препараты железа, но они менее эффективны. Клинические исследования по применению рекомбинантных форм эритропоэтина в комбинации с внутривенными препаратами железа 4, 6-8 показали, что на фоне применения данной комбинации ответ на терапию в 1,5-2 раза выше, по сравнению с монотерапией эритропоэтинами или с пероральным приемом препаратов железа. Основываясь на данных клинических испытаний, в руководство NCCN в 2010 г. были внесены изменения. Новый алгоритм применения эритропоэтинов для лечения анемии, индуцированной химиотерапией, предполагает назначение гемотрансфузии только в случае необходимости в немедленной коррекции анемии. Эритропоэтины не показаны при терапии, направленной на излечение, их назначают только с паллиативной целью при уровне Hb 4-8, 22 23 .
В заключение Л.Н. Кудряшова кратко сформулировала выводы и обозначила основные международные рекомендации по применению рекомбинантных форм эритропоэтинов и внутривенных препаратов железа в онкологии (ESMO 2010; NCCN 2012):
эритропоэз-стимулирующие агенты (ЭСА) могут применяться только у больных с анемией, являющейся осложнением химиотерапии, при уровне Hb ЛИТЕРАТУРА

Показания:
профилактика железодефицитной анемии.
Противопоказания:
индивидуальная непереносимость.
Применение:
по одной таблетке в день во время еды.
Общие сведения о препарате:
Железо – минерал, играющий особую роль в поддержании здоровья человека. В древние времена железные доспехи обороняли рыцарей от смертельных ран. Времена изменились, но и для современного человека жизненно важен железный щит.
В организме здорового человека содержится приблизительно 4-5 граммов железа, которое необходимо для поддержания процесса кроветворения, иммунной системы и здоровья всего организма в целом. Железо является составной частью гемоглобина – компонента крови, снабжающего организм кислородом.
По данным Международной Организации Здравоохранения, дефицит железа в наши дни является самым распространенным видом нехватки нутриентов. Около 30% населения планеты страдают железодефицитной анемией.
Прежде всего, при железодефицитной анемии нарушается синтез гемоглобина – железосодержащего белка эритроцитов крови. В результате этого к органам и тканям поступает меньше кислорода, развивается кислородное голодание – гипоксия, которая негативно отражается на деятельности многих органов, отрицательно сказывается на качестве жизни человека.
Все проявления железодефицитной анемии развиваются постепенно. Симптоматика заболевания не слишком типична – и в этом состоит её опасность. При анемии больные бледны, вялы, ко всему безразличны. Первое время человек жалуется на головную боль, головокружение, потемнение в глазах. При значительном снижении уровня гемоглобина от гипоксии страдают клетки головного мозга – могут возникать обмороки. Характерны для этой болезни одышка и учащенное сердцебиение, появляющиеся или усиливающиеся при физическом напряжении. Может возникать боль в области сердца, мышечная слабость. Кожа становится сухой, ногти слоятся и ломаются, часто возникают проблемы с волосами – они начинают выпадать, секутся. Появляются изменения вкуса и обоняния.
Недостаточные запасы железа в организме не только ухудшают работу практически всех клеток, но и ограничивают функцию более чем 80 различных генов. Некоторые из этих генов запускают важные энергетические процессы в организме, контролируют старение клеток, защищают их от свободных радикалов.
Дефицит железа снижает иммунитет организма. Это связано с тем, что нехватка железа негативно сказывается на выработке ферментов (рибонуклеотидредуктазы), необходимых для нормальной функции Т-лимфоцитов. Нормальный уровень железа в организме способствует поддержанию клеточного иммунитета.
Некоторые исследования предполагают, что дети и подростки, страдающие дефицитом железа в организме, могут испытывать трудности в обучении, и что добавки, содержащие железо способны повысить их когнитивные способности. Возможно, роль железа в этом случае заключается в том, что оно участвует в синтезе нейротрансмиттеров, частности дофамина.
Поскольку уровень гемоглобина в крови падает постепенно, люди, как правило, успевают адаптироваться к проявлениям дефицита железа. Даже при значительном падении его уровня, быструю утомляемость часто связывают с нервными и физическими перегрузками, характерными для современного образа жизни.
Если Вы заметили у себя какие-либо из перечисленных нарушений здоровья – немедленно обратитесь к лечащему врачу! Возможно, это признаки железодефицитной анемии и ранняя диагностика поможет быстрее справиться с недугом.
Кто наиболее подвержен анемии?
Железодефицитная анемия ассоциируется с низким потреблением железа с пищей, недостаточным усвоением железа и обильными кровопотерями.
У молодых девушек повышается потребность в железе в связи с усиленным ростом, начинающимися физиологическими потерями крови, кроме того, они часто ограничивают себя в питании, стараясь похудеть.
У женщин зрелого возраста анемия может проявиться в период беременности и кормления ребенка грудью.
Распространенной причиной железодефицитной анемии являются болезни. Хронические воспаления кишечника, особенно 12-перстной кишки, препятствуют эффективному всасыванию железа. Плохо усваивается оно и при низкой кислотности желудочного сока. Медленную, но верную потерю железа вызывают кровоточащие язвы желудка и кишечника, а также обильные менструации.
Вегетарианцы, вследствие особенности диеты, часто обладают меньшим ресурсом железа.
Младенцы, особенно проживающие в центральной части крупных городов, подвержены риску развития железодефицитной анемии, в результате чего возможно их запоздалое развитие. Исследования показали, что добавление биологически активных добавок, содержащих железо в питание детей, предотвращает развитие железодефицитной анемии.
Дефицит железа невозможно восполнить с помощью одной только диеты – возникает необходимость принимать железосодержащие препараты.
Новый продукт компании Enrich Eurasia – BoostIron™ создан для профилактики железодефицитной анемии и содержит 10 мг железа в форме карбонила железа, а также витамины С, фолиевую кислоту и витамин В12, необходимые для его более полного усвоения.
Карбонил железа обладает целым рядом преимуществ по сравнению с другими формами железа:
- Содержит 98% элементарного железа.
- Не содержит солей железа.
- Не токсичен.
- В отличие от солей железа не оказывает побочного действия в виде запоров и диареи.
- Легко усваивается организмом.
Витамин С, являясь сильнейшим антиоксидантом, обеспечивает защиту клеток организма от разрушений, наносимых свободными радикалами, играет важную роль в укреплении иммунной системы, повышает сопротивляемость организма различного рода инфекциям.
Фолиевая кислота играет важную роль в процессах кроветворения (необходима для формирования эритроцитов), способствует лучшему усвоению витамина В12.
Витамин 12 обладает высокой биологической активностью, необходим для нормального кроветворения и функции иммунной системы. Витамин В12 в тесном взаимодействии с витамином С и фолиевой кислотой участвует в белковом, жировом и углеводном обмене.
Карбонил железа, карбонил никеля
Задача 1128.
Описать электронное строение карбонильных соединений железа и никеля. Для чего применяются эти соединения?
Решение:
Оксид углерода(II) соединяется со многими металлами, образуя карбонилы металлов, например, карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4. Эти два вещества представляют собой летучие, весьма ядовитые жидкости. Большинство карбонилов металлов - кристаллические вещества. Применяются для получения чистых металлов. Подлежащий очистке металл, например, никель нагревают в атмосфере СО, находящегося под давлением около 20 МПа. При этом никель взаимодействует с СО, образуя летучий тетракарбонил никеля Ni(CO)4 (температура кипения 42 0 С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся Ni(CO)4 отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением чистого металла в осадке и газообразного СО. При очистке железа аналогичным образом осуществляется процесс синтеза карбонила железа Fe(CO)5 (105 0 С). Карбонилы являются катализаторами важных химических реакций. Наибольшее значение имеют карбонилы никеля, кобальта и железа.
Химические связи в молекулах карбонилов металлов образованы по донорно-акцепторному механизму за счёт неспаренных электронных пар молекулы СО и свободных орбиталей возбуждённого атома металла. Например, у возбуждённого атома железа имеются пять незанятых орбиталей:
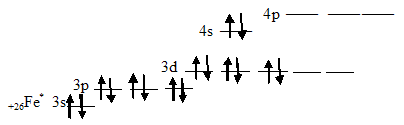
Поэтому молекула карбонила железа имеет состав, отвечающий формуле Fe(CO)5.
У возбуждённого атома никеля имеются четыре незанятых орбиталей:
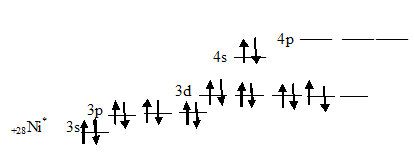
Поэтому молекула карбонила никеля имеет состав, отвечающей формуле Ni(CO)4.
Задача 1129.
Как изменяется устойчивость к окислению в ряду Fe(II) — Со(II) — Ni(II)? Как изменяется окислительная способность в ряду Fe(III) — Сo(III) — Ni (III)?
Решение:
а) Устойчивость к окислению в ряду Fe(II) — Со(II) — Ni(II) при переходе от железа к никелю увеличивается. Соединения железа(II) обладают восстановительными свойствами и малой устойчивостью из-за склонности к переходу в соединения железа(III) с более устойчивой степенью окисления. В связи с этим гидроксид железа(II) уже на воздухе быстро окисляется, превращаясь в красновато-коричневый осадок Fe(OH)3. В присутствии окислителей (пероксида водорода, гипохлоридов или хлора) окисление происходит мгновенно. Соединения Со(II) и Ni(II) более устойчивы. Гидроксид Со(OH)2 медленно окисляется на воздухе, быстрее под действием окислителей. Гидроксид никеля(II) окисляется только под действием сильных окислителей. Это можно объяснить тем, что с увеличением порядковых номеров элементов в триаде, с увеличением зарядов ядер атомов и числа электронов, усиливается притяжение электронов к ядру, что приводит к уменьшению радиусов ионов в ряду Fe(II) — Со(II) — Ni(II). При уменьшении радиусов ионов усиливается устойчивость к окислению.
б) Окислительная способность в ряду Fe(III) — Сo(III) — Ni (III) усиливается. В степени окисления +3 из элементов семейства железа наиболее устойчивы соединения железа. Из-
Известно небольшое число простых соединений Со(III) и Ni(III), так как они относительно неустойчивы, проявляют окислительные свойства, легко гидролизуются. Это можно объяснить тем, что с увеличением порядковых номеров элементов в триаде, с увеличением зарядов ядер атомов и числа электронов, усиливается притяжение электронов к ядру, что приводит к уменьшению радиусов ионов в ряду Fe(III) — Сo(III) — Ni (III). При уменьшении радиусов ионов с одинаковыми зарядами усиливается способность к присоединению электронов.
Читайте также:

