Какой препарат применяют при раке желудка толстой и прямой кишки
Злокачественное новообразование в толстой кишке сегодня не является приговором. Это заболевание можно победить и вернуться к полноценной жизни. Главное — вовремя распознать болезнь, поставить диагноз и сразу же приступить к лечению.
Толстая кишка включает в себя слепую кишку, все ободочные кишки (восходящая, нисходящая, поперечная, сигмовидная), прямую кишку и анус. Ее длина составляет от полутора до двух метров. Злокачественная опухоль может возникнуть в любом из отделов толстой кишки.
Диагноз — рак толстой кишки
Опасность заболевания заключается в том, что на начальном этапе опухоль обычно не дает о себе знать. Растет она тоже достаточно медленно: чтобы увеличиться в два раза, новообразованию требуется до трех лет. Если говорить о расположении опухоли, то в 60% зарегистрированных случаев она находится в прямой кишке, в 15–20% — в сигмовидной кишке, в 10% — в слепой кишке, остальная доля приходится на другие отделы толстой кишки. Опухоль, как правило, бывает одиночная, лишь в 2–3% случаев наблюдаются множественные новообразования.
Неутешительная статистика
Каждый год в мире диагностируют около 600 тысяч случаев образования злокачественных опухолей в кишечнике. В России зафиксировано 239 тысяч человек, имеющих этот диагноз. От этого заболевания в нашей стране умирает 36 тысяч человек в год. Часто причиной такого исхода становятся поздняя диагностика и упущенное время. Около 70% пациентов с диагнозом рак толстой кишки впервые обращается к врачу уже на последней стадии.
При подозрении на рак толстой кишки проводится целый ряд диагностических исследований.
Первичные данные могут быть получены после пальпации живота врачом на приеме, перкуссии брюшной полости, пальцевом исследовании прямой кишки, гинекологическом исследовании. К наиболее информативным методам диагностики относится колоноскопия (эндоскопическое исследование, позволяющее визуализировать с помощью камеры состояние всех отделов толстой кишки) и ирригоскопия (рентгенография брюшной полости с применением контрастного вещества). С целью оценки метастатического процесса выполняется УЗИ органов брюшной полости и позитронно-эмиссионная томография (ПЭТ-КТ).
Лабораторная диагностика рака толстой кишки предполагает исследование общего анализа крови, кала на скрытую кровь, определение раково-эмбрионального антигена (РЭА), мониторинг концентрации онкомаркера СА 19-9.
При типизации заболевания принято опираться на Международную классификацию опухолей кишечника, утвержденную в 1976 году.
Клеточное строение опухоли не всегда одинаково. Исходя из специфики клеток, определяют тип рака толстой кишки. Самый распространенный — аденокарцинома, она состоит из железистой ткани и встречается в 75–80% случаев. Разросшаяся ткань перекрывает просвет кишечника, вызывая непроходимость. В запущенной стадии крупная опухоль может разрушить стенку кишки и вызвать внутреннее кровотечение. При аденокарциноме диагностируют мукоидный, слизистый или коллоидный рак. В остальных 20–25% случаев фиксируют мукоцеллюлярный, или перстневидноклеточный, рак. Такое название возникло из-за сходства строения клеток с формой перстня: узкий ободок с клеточным ядром. Он часто встречается у молодых людей и склонен к быстрому метастазированию. В редких случаях отмечают недифференцированную и неклассифицируемую формы рака.
По форме выделяют следующие типы опухоли:
- Эндофитная — не имеет четких границ, растет в толще стенки кишки.
- Экзофитная — овальная или круглая, растет в просвет кишки.
- Блюдцевидная — сочетает особенности эндофитной и экзофитной опухолей и имеет форму опухоли-язвы.
Согласно Международной классификации опухолей кишечника в развитии рака толстой кишки выделяют четыре стадии.
- I стадия рака толстой кишки — опухоль очень мала (размером с узелок) и локализуется в пределах слизистой и подслизистой оболочек, не выходит за пределы толстой кишки. В 74% случаев больные вылечиваются.
- II стадия — новообразование увеличивается, но еще не дает метастазов. Опухоль прорастает в стенку кишечника, но не выходит за его пределы. Прогноз излечения — 60–70%.
- III стадия — опухоль значительно увеличивается и может распространиться на всю толщину стенки кишки. При этом на этапе А еще нет метастазов, возможность излечения в этот период достигает 74%. А вот на этапе В уже появляются метастазы и процент излечения снижается до 40%.
- IV стадия рака толстой кишки — опухоль имеет большие размеры и затрагивает ближайшие органы. Как правило, метастазы прорастают в печень, легкие, костную ткань, органы мочевыделительной системы. На этом этапе прогнозы плохие, выживает только около 6% пациентов.
Чаще всего рак толстой кишки метастазирует в печень. Это обусловлено особенностями венозного оттока от кишечника, который осуществляется через систему воротной вены печени. Пятилетняя выживаемость у пациентов с метастазами рака толстой кишки в печени без специфического лечения не превышает 2%.
В зависимости от размера и расположения опухоли, особенностей ее клеточного строения и общего состояния пациента подбирается метод терапии. Возможны три подхода к организации лечения. Первый — операция — к ней прибегают, если опухоль не распространилась за пределы толстой кишки. Второй — радиотерапия (если обнаружен метастаз в малом тазу). К химио- и таргетной терапии обращаются, когда опухоль вышла за пределы кишечника и дала множественные метастазы. Рассмотрим каждый из методов более подробно.
Хирургическое лечение — очень эффективно на первой и второй стадиях заболевания, а также в начале третьей, когда еще нет метастазов. Если на третьей стадии есть близко расположенные метастазы, то рекомендуется радиотерапия, после которой решается вопрос о целесообразности операции.
Опухоль удаляют вместе с пораженными тканями и регионарными лимфатическими узлами — для предупреждения метастазирования.
При проведении операций по удалению злокачественных опухолей прямой кишки в большинстве случаев используется малоинвазивный лапароскопический метод ТЭМ (трансанальная эндоскопическая микрохирургия), обеспечивающий щадящее вторжение в организм пациента. В ходе процедуры используется специальный операционный ректоскоп. Стоит отметить, что проведение подобной операции требует высочайшей квалификации хирурга.
Преимущества данного метода операции заключаются в точном иссечении тканей опухоли, низком проценте рецидивов, быстром выздоровлении (одна ночь в больнице — относительно семи дней госпитализации при проведении операции обычным способом, то есть через переднюю брюшную стенку).
В особых случаях (если удаляется прямая кишка и сфинктер) операцию делают в несколько этапов: сначала убирают опухоль, затем формируют колостому (выводят наружу участок толстой кишки). Хирургическое лечение может сочетаться с лучевой терапией и химиотерапией.
Радиотерапия — это метод, при котором используется ионизирующее облучение области малого таза. К такому воздействию очень чувствительна аденокарцинома. Наиболее эффективно лечение в случаях, когда опухоль имеет четкие границы. В результате облучения клетки гибнут и опухоль уменьшается, исключается вероятность воспаления тканей и распространения опасных клеток по организму. Лучевую терапию назначают и после операции — чтобы избавить организм от оставшихся раковых клеток. Курсы облучения обычно не повторяются из-за недопустимости повторного облучения.
Химиотерапия направлена на уменьшение размера и скорости роста злокачественной опухоли. Метод также применяют перед операцией или лучевой терапией, он эффективен и для уничтожения микрометастазов, появившихся до или после удаления опухоли. Химиотерапию используют после хирургического вмешательства во избежание рецидива болезни. Чаще всего процедура представляет собой капельное введение препаратов. Химиотерапия при данном заболевании успешно проводится с помощью фторурацила. Также при раке толстой кишки назначают иринотекан, который показывает свою эффективность даже в тех случаях, когда фторурацил не способен помочь. Хорошо себя зарекомендовали в борьбе с раком толстой кишки и такие действующие вещества, как капецитабин и фторафур. Подобрать нужный препарат и назначить необходимый курс лечения может только врач. Нужно быть готовыми к неизбежным последствиям терапии: тошноте, рвоте, повреждению слизистых оболочек желудочно-кишечного тракта (стоматит и диарея), гибели части клеток крови.
Жизнь продолжается!
После операции с выведением колостомы многим людям тяжело восстановиться — они испытывают серьезные психологические проблемы. Но нормальная жизнь с колостомой возможна. Главное — соблюдать правила ухода за ней, грамотно питаться и следовать рекомендациям врача.
После перенесенного рака прямой кишки организм пациента заметно ослабевает. Химиотерапия, лучевое лечение и хирургическое вмешательство также сказываются на общем состоянии больного. Поэтому во время восстановительного периода очень важно выполнять все предписания врача, соблюдать режим дня, диету, избегать физических и психологических нагрузок, обратить внимание на продолжительность и качество сна. Также важно принимать необходимые препараты и витамины, являться на плановые осмотры и вовремя сдавать назначенные анализы. Все это позволит как можно скорее вернуться к привычному образу жизни. Если же не соблюдать приведенные выше рекомендации, вероятность рецидива значительно возрастает.
Что касается профилактики рака толстой кишки, то ее методы довольно просты. Прежде всего, следует обязательно включать в свой ежедневный рацион свежие овощи и фрукты, причем необязательно экзотические — морковь, капуста, редька, репа, яблоки отлично подойдут. Они богаты витаминами, минеральными веществами и клетчаткой, что способствует очищению кишечника и предотвращает возникновение в нем застойных явлений. Также важно каждый день употреблять первые блюда, не переедать, регулярно опорожнять кишечник.
При возникновении воспалительных заболеваний толстой кишки (колитов) — их нужно вовремя лечить, а полипы — удалять. Если у кого-то из близких родственников диагностирован рак толстой кишки, необходимо наблюдаться у гастроэнтеролога, так как болезнь может носить наследственный характер. После 50 лет рекомендуется ежегодно посещать гастроэнтеролога в профилактических целях.
Таким образом, при внимательном отношении к состоянию кишечника патологических процессов можно избежать. Если же диагностирован рак толстой кишки — это не повод для отчаяния. Современный уровень медицины позволяет справиться с этим диагнозом.
На этот вопрос отвечает Анвар Йулдашев, врач-колопроктолог, хирург, онколог, кандидат медицинских наук:
«Эффективность лечения онкологических заболеваний зависит в первую очередь от оборудования и квалификации врачей. Высокий уровень оснащенности и качества медицинских услуг может предложить Институт онкологии Европейского медицинского центра (ЕМС).
Наше лечебное учреждение в настоящий момент является одной из крупнейших в России частных онкологических клиник. Мы выполняем лечение рака толстой кишки по европейским и американским стандартам, о чем свидетельствует наличие международной аккредитации JCI.
В штате Института онкологии — врачи России, Израиля, США и Западной Европы, имеющие большой опыт практической работы в ведущих европейских клиниках. Наши специалисты способны оказать помощь пациентам на любом этапе — при диагностировании, мониторинге и обнаружении процесса метастазирования. Решение о тактике лечения принимается совместно врачами смежных областей — онкологом, кардиологом, хирургом-онкологом, радиологом, колопроктологом, лучевым диагностом, патоморфологом. Это позволяет учесть все нюансы состояния пациента и подобрать щадящие методы лечения.
Мы оказываем весь комплекс диагностических и лечебных процедур пациентам с онкологическими заболеваниями:
- Клиническая лабораторная и инструментальная диагностика.
- Радионуклидная диагностика.
- Химиотерапия (используются новейшие противоопухолевые препараты).
- Хирургическое лечение любой сложности, включая роботассистированные операции.
- Лучевая терапия и радиохирургия опухолей толстой кишки и метастазов на новейшем оборудовании (США).
- Услуги по медицинской реабилитации пациента, перенесшего операцию, химиотерапию, лучевую терапию.
- Паллиативная медицинская помощь.
- Патронаж на дому.
Наша клиника оснащена современной системой (производства США) для проведения лучевой терапии, она позволяет проводить лечение злокачественных новообразований любого объема и формы в короткие сроки. Высокая точность на каждом этапе лечения помогает защитить здоровые ткани и дает возможность пациенту сразу же после сеанса вернуться к привычному образу жизни.
В Институте онкологии ЕМС проводятся различные виды операций на органах брюшной полости, включая высокотехнологичные операции с применением роботической системы. Оперативные вмешательства осуществляются как в плановом порядке, так и экстренно.
Экстренная госпитализация в клинику может быть выполнена в любое время суток, перевозка обеспечивается из всех регионов России и проходит в соответствии с мировыми стандартами комфорта (при необходимости может быть задействован воздушный транспорт). Наши автомобили обеспечены современным медицинским оборудованием, что делает возможным оказание неотложной помощи и проведение реанимационных мероприятий.
Уровень оснащенности отделения реанимации и интенсивной терапии Института онкологии ЕМС позволяет принимать пациентов с самыми сложными заболеваниями и даже в критическом состоянии.
Стационар нашей клиники обеспечивает комфорт европейского уровня и питание по индивидуальному меню с учетом медицинских показаний. Предусмотрена возможность круглосуточного посещения пациентов, в том числе и находящихся в реанимации.
- медицинскую деятельность — на основании лицензии ЛО-77-01-019876, выданной Департаментом здравоохранения города Москвы 10 апреля 2020 года;
- высокотехнологичную медицинскую деятельность — на основании лицензии ФС-99-01-009514, выданной Федеральной службой по надзору в сфере здравоохранения 25 апреля 2018 года.
- Необходимый объем исследований
- Противопоказания к химиотерапии
- Показания к химиотерапии
- Лечение рака прямой кишки по стадиям
- Виды химиотерапии
- Таргетная терапия при раке прямой кишки
- Осложнения и методы их предотвращения
Хотя ведущим методом лечения при раке прямой кишки является хирургическая операция, химиотерапия применяется в рамках комбинированного лечения при местнораспространенных и метастатических формах заболевания. Она преследует следующие цели:
- Системное воздействие на опухоль с целью уничтожения/уменьшения метастазов, в том числе микрометастазов, которые могут пока никак не обнаруживаться.
- Приостановить рост опухоли на максимальный период.
- Перевести неоперабельные опухоли в резектабельное состояние для последующей попытки радикального удаления.
Долгое время для химиотерапевтического лечения рака прямой кишки применялся 5-фторурацил. Он и сегодня не утратил своей актуальности, но применяют его совместно с препаратами других групп:
- Препараты платины третьего поколения — оксалиплатин.
- Антагонисты пиримидинов — капецитабин.
- Капмтотецины — иринотекан.
Необходимый объем исследований
Перед началом лечения необходимо установить стадию заболевания и тип злокачественного новообразования, поскольку от этого будет зависеть тактика ведения пациента. Необходимо проведение комплексного обследования, включающего в себя следующие процедуры:
- Тотальная колоноскопия, а при ее невозможности ректо- и сигмоскопия. Позволяют визуализировать опухоль, оценить риск развития осложнений (перфорация, кровотечение) и взять материал для гистологии. Без данных этого анализа не рекомендуется начинать планирование лечения.
- МРТ органов малого таза позволяет определить глубину инвазии опухоли и состояние регионарных лимфатических узлов. Данное исследование необходимо для планирования хирургического и химиолучевого лечения.
- КТ органов брюшной и грудной полости — поиск отдаленных метастазов.
- УЗИ брюшной полости, проводится с аналогичной целью.
- Определение уровня онкомаркеров СА 19-9 и РЭА. Необходимо для оценки эффективности лечения, контроля рецидива и прогрессирования заболевания.
Также полученный опухолевый материал подвергается иммуногистохимическому и молекулярно-генетическому исследованию для решения вопроса о необходимости назначения дополнительных таргетных препаратов.
Противопоказания к химиотерапии
- Гиперчувствительность к химиопрепаратам.
- Уровень лейкоцитов ниже 5*10 9 для 5ФУ и ниже 2 для оксалиплатина, количество тромбоцитов меньше 10*10 10 .
- Печеночная и почечная недостаточность.
- Сепсис и другие тяжелые системные инфекции.
- Беременность. И кормление грудью.
- Наличие периферической сенсорной нейропатии до начала химиотерапевтического лечения с помощью оксалиплатина.
Показания к химиотерапии
Химиотерапия проводится, когда необходимо решить следующие задачи:
- Уменьшение объема опухоли на предоперационном этапе.
- Уничтожение оставшихся злокачественных клеток после оперативного лечения, в том числе микрометастазов.
- Приостановление роста злокачественного новообразования.
- Снижение риска рецидива и прогрессирования рака прямой кишки.
Лечение рака прямой кишки по стадиям
При первой стадии рака прямой кишки проводятся органосохраняющие щадящие операции. Химиотерапия не показана.
При 2 стадии проводят хирургическое лечение в объеме резекции или экстирпации прямой кишки совместно с удалением параректальной клетчатки и регионарных лимфатических узлов. Если при последующем гистологическом исследовании обнаруживаются опухолевые клетки в краях отсечения и удаленных лимфатических узлах, лечение дополняют химиолучевой терапией с фторпиримидинами. Адъювантная (предоперационная) химиотерапия не показана.
Лечение рака прямой кишки 3 стадии начинается с адъювантной химиолучевой или лучевой терапии и только через 6-8 недель после окончания первого этапа решается вопрос о хирургической операции. При локализованных опухолях проводят радикальные операции. При изначально неоперабельных опухолях делается попытка радикального лечения, или проводят паллиативные операции, паллиативную химиотерапию или продолжают лучевую терапию.
Лечение 4 стадии рака прямой кишки будет зависеть от количества, размеров и места локализации отдаленных метастазов. При единичных резектабельных метастазах возможно проведение радикальной операции. В остальных случаях назначается химиотерапия и после нескольких курсов оценивается состояние опухоли и делается попытка ее удаления. Если это невозможно, проводят поддерживающее и симптоматическое лечение.
Виды химиотерапии
Адъювантная или профилактическая химиотерапия применяется после радикальной операции при местнораспространенных опухолях, а также при наличии регионарных метастазов. Продолжительность такого лечения должна составлять не менее 6 месяцев.
Минимальным вариантом адъювантной химиотерапии при раке прямой кишки являются схемы, включающие в себя фторпиримидины. В основном применяется схема клиники Мейо, которая предполагает применение лейковарина с фторурацилом. Препараты вводятся в течение 5 дней, после чего делают перерыв. Следующий курс начинают на 29 день. Также используются другие схемы лечения с увеличенным содержанием лейковарина и 5-фторурацина (Roswell Park, AIO, модификации LV5FU или De Gramont).
Оптимальным вариантом адъювантной химиотерапии является назначение оксалиплатина с фторпинимидинами по режимам FOLFOX (оксалиплатин, лейковарин, 5-фторурацил) или XELOX (оксалиплатин и капецитабин). Если на фоне данного лечения развиваются симптомы нейротоксичности, препараты платины отменяют и лечение продолжают монотерапией фторпиримидинами.
На этапе адъювантной химиотерапии таргетное лечение моноклональными антителами не проводится.
Неоадъювантная химиотерапия рака прямой кишки показана при лечении метастатических и диссеминированных форм заболевания. Хирургическое удаление метастазов существенно улучшает прогноз больных и увеличивает пятилетнюю выживаемость до 30-40%, а при радикальном удалении этот показатель увеличивается до 60%.
К сожалению, радикальные операции на 4 стадии можно провести лишь 10-20% больных, в остальных случаях процесс неоперабельный. Чтобы помочь таким пациентам, назначают неоадъювантную химиотерапию. Ее целью является повышение резектабельности опухоли и/или продление жизни больному. В рамках неоадъювантной химиотерапии используются комбинации FOLFOX, XELOX, FOLFIRI.
При изначально резектабельных опухолях используются следующие тактики:
- Хирургическое удаление метастазов с последующей химиотерапией по режиму FOLFOX или XELOX.
- Периоперационная химиотерапия. Сначала идет три месяца химиотерапии, затем удаление метастазов, а потом еще 3 месяца химии.
Если метастазы нерезектабельны, или потенциально резектабельны, проводится химиотерапия по режимам FOLFOX, XELOX, FOLFIRI (иринотекан, лейковарин, 5-ФУ) до перевода метастазов в резектабельное состояние. Если не выявлены мутации в гене RAS, к первым двум схемам возможно добавление таргетных анти-EGFR препаратов.
Также для улучшения качества лечения могут применяться следующие варианты:
- Добавление к двухкомпонентных химиотерапевтическим схемам бевацизумаба (без учета мутации RAS).
- Применение тройной комбинации FOLFOXIRI, в ряде случаев ее усиливают моноклональными антителами. Однако такой режим довольно токсичен и требует тщательного контроля.
Интенсивные курсы химиолучевой терапии (ХЛТ) могут стать альтернативой хирургической операции у пациентов с локализованной и местнораспространенной опухолью прямой кишки. Пока такое лечение не утверждено в протоколах, но ведутся клинические испытания (IWWD) направленные на изучение данного вопроса и расширение показаний для безоперационной терапии.
В настоящее время ХЛТ применяться в рамках комбинированного лечения, на дооперационном или послеоперационном этапе. Проводится дистанционная лучевая терапия в разовой дозе 2 Гр до суммарной очаговой дозы на зону регионарных метастазов 44 Гр, на опухоль 50-60 Гр, в зависимости от локализации и степени распространения опухоли. Облучение проводится курсами по 5 дней с перерывом в 2 дня. Параллельно с этим проводится химиотерапия фторпиримидинами (монотерапия), или совместно с оксалиплатином.
Таргетная терапия при раке прямой кишки
Таргетная терапия — это лечение, основанное на воздействии на молекулярные мишени, которые играют ключевую роль в патогенезе злокачественного новообразования. Таких мишеней известно очень много. В рамках лечения рака прямой кишки наибольший интерес представляют ингибиторы эпидермального фактора роста EGFR и сосудистого фактора роста.
Рецепторы EGFR располагаются на клеточных мембранах и при контакте с эпидермальным фактором роста запускают каскад химических реакций, которые регулируют процессы клеточного роста и размножения. Если блокировать этот рецептор с помощью антител, передача сигнала станет невозможной, и процесс пролиферации остановится.
Такими блокаторами при лечении рака прямой кишки выступают два препарата: цетуксимаб и панитумумаб. Их назначение улучшает ответ опухоли на химиотерапию и увеличивает время до прогрессирования рака.
Однако такое лечение показано не всем. Например, при мутации в гене KRAS, в большом количестве начинают синтезироваться сигнальные молекулы, которые занимают промежуточное положение при передаче сигнала от рецептора EGFR до ядра, поэтом его блокирование не приведет к улучшению ситуации. Поэтому при наличии данной мутации, лечение антителами к EGFR не показано.
Второй мишенью является сосудистый фактор роста. Опухоль стимулирует рост кровеносных сосудов за счет выделения большого количества эндотелиального фактора роста. Бевацизумаб блокирует его и нарушает рост новых кровеносных сосудов, тем самым лишает опухоль полноценного питания и способности к гематогенному метастазированию.
Осложнения и методы их предотвращения
- Тошнота и рвота. Для предотвращения и купирования этих проявления назначаются различные антиэметики, например, дексаметазон, блокаторы серотонина и др.
- Диарея. Для восполнения жидкости назначается регидратационная терапия, для купирования диареи применяются препараты, действующие на моторную функцию кишечника (лоперамид, аттапульгит), для уменьшения болевого синдрома используются спазмолитики и анальгетики.
- Мукозит — специфическое воспаление полости рта. Для его устранения используются дезинфицирующие растворы местного действия, обволакивающие и ранозаживляющие средства, а также анальгетики.
- Миелотоксичность. При существенном угнетении кроветворения необходима коррекция доз цитостатиков.
- Дерматотоксичность, которая проявляется в виде очагов сыпи, гиперпигментации или зуда. Также может быть ладонно-подошвенный синдром, с покраснением, отеком и зудом кожи рук и стопы. При развитии такого осложнения требуется снижение дозы химиотерапевтических препаратов или их отмена.
Критериями эффективности химиотерапии является уменьшение размеров опухоли по данным объективного обследования: КТ, МРТ, УЗИ.
В настоящее время химиотерапия является краеугольным камнем в лечении различных форм рака. Существует большое количество химиопрепаратов с широким спектром механизмов действия, однако число препаратов, применяемых при колоректальном раке, обычно ограничено. Выбор того или иного препарата, схемы, путей введения, времени и продолжительности лечения зависят от нескольких факторов, связанных с пациентом и опухолевым процессом.
а) Категории механизма действия:
• Антиметаболиты: 5-фторурацил (+лейковорин), капецитабин, гемцитабин.
• Алкилирующие препараты на основе платины: оксалиплатин, карбоплатин, цисплатин.
• Ингибиторы топоизомеразы: иринотекан.
• Таргетная иммунотерапия (моноклональные антитела): бевацизумаб, цетукси-маб, панитумумаб.
• Цитотоксические/противоопухолевые антибиотики: митомицин С.
• Ингибиторы тирозинкиназы: иматиниб, сунитиниб.
б) Отдельные препараты:
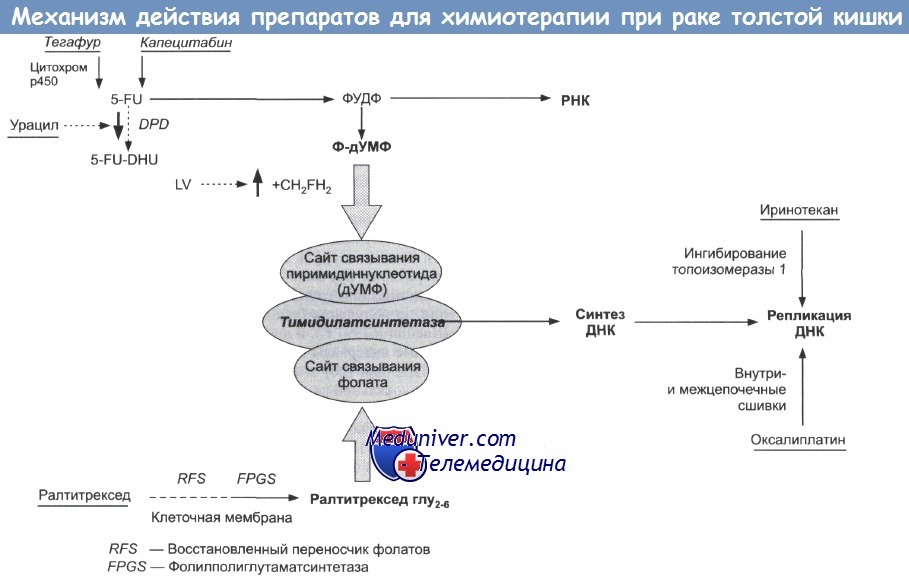
• 5-фторурацил (+ лейковорин). Антиметаболит (аналог пиримидина).
Механизм действия. Внутриклеточное преобразование в активные метаболиты =>комбинированный цитотоксический эффект в результате ингибирования тимидилатсинтетазы и включения в клеточную РНК и ДНК.
Лейковорин (LV; фолиниевая кислота): повышение сниженного клеточного уровня фолатов => усиление действия 5-FU.
Схемы. Назначение: в качестве адъюванта и при метастазах колоректального рака (КРР). 5-FU/LV остается основой в современных схемах химиотерапии: непрерывная инфузия, в целом, более эффективна и лучше переносится, чем болюсное введение.
Токсичность и побочные эффекты. Подавление активности костного мозга (максимум через 9-14 дней), гастроинте-стинальная (анорексия, тошнота/рвота, диарея, стоматит = признаки угрожающей токсичности —> необходимость прерывания лечения), дерматологическая (обратимая макуло-папулезная сыпь, ладонно-подошвенный синдром, алопеция, фотосенсибилизация, гиперпигментация), неврологическая токсичность (головная боль, нарушения зрения, мозжечковая атаксия).
Коррекция дозы. Период полувыведения из плазмы 10-20 минут, распадается в печени на двуокись углерода и метаболиты => выводится с мочой. Отмена перед операцией за 3-4 недели.
Осложнения. Семейный дефицит дигидропиримидин дегидрогеназы (DPD) => риск тяжелой токсичности.
• Капецитабин (Кселода). Антиметаболит (аналог пиримидина).
Механизм действия. Пероральный предшественник 5-FU: всасывание в кишечнике => накопление в клетках опухоли => внутриклеточный трехступенчатый метаболизм в активный 5-FU => цитотоксический эффект как у 5-FU.
Схемы. Назначение: в качестве адъюванта и при метастазах КРР. Удобство назначения: назначение per os в моно- или в комбинированном режиме.
Токсичность и побочные эффекты. Как у 5-FU, но в целом переносится лучше.
Коррекция дозы. Дисфункция почек. Отмена перед операцией за 3-4 недели.
Осложнения. Семейный дефицит DPD => риск тяжелой токсичности.
• Оксалиплатин (Элоксатин). Алкилирующий препарат на основе платины.
Механизм действия. В деталях неизвестен: неспецифическое цитотоксическое действие, синергизм с 5-FU.
Схемы. Назначение: в качестве адъюванта и при метастазах КРР. Внутривенное введение: FOLFOX4, FOLFOX6, FOLFOX7, САРЕОХ, IROX.
Токсичность и побочные эффекты. Нейропатия (острая/обратимая и хроническая/необратимая), нейтропения, анорексия, тошнота/рвота, диарея, утомляемость.
Ототоксичность и нефротоксичность выражены в меньшей степени, чем у цисплатина и карбоплатина.
Коррекция дозы. Период полувыведения 15-30 минут. Отмена за 4 недели до и после плановой операции.
Осложнения:
- Фебрильная нейтропения.
- Усиление токсичности в комбинации с болюсным введением 5-FU.
• Иринотекан (Кампто, СРТ-11). Ингибитор топоизомеразы I.
Механизм действия. Внутриклеточное преобразование в активный метаболит SN-38 => ингибирование внутриклеточной топологии (за которую отвечает фермент топоизомераза)/ разрыва сверхспирализованной двойной спирали ДНК во время транскрипции/ репликации => подавление релаксации и раскручивания спирали, необходимые для репликации и транскрипции => смерть клетки.
Схемы. Назначение: метастазы КРР, не применяется при адъювантной терапии. FOLFIRI, IFL.
Токсичность и побочные эффекты. Диарея, дегидратация, миелосупрессия, алопеция.
Коррекция дозы:
- Период полувыведения примерно 6-12 часов (инактивируется энзимом UGT1A1), но биологический эффект более продолжителен => отмена за 4 недели до и после плановой операции.
- Больные с полиморфизмом гена UGT1А1 => сниженная инактивация => необходимость в уменьшении дозы.
Осложнения. Тяжелая дегидратация, вызванная диареей, нейтропения.
• Бевацизумаб (Авастин). Моноклональное антитело => таргетная иммунотерапия.
Механизм действия. Моноклональное антитело против фактора роста эндотелия сосудов (VEGF) —> блокада ангиогенеза в опухоли. Для наилучшего эффекта необходима комбинация с цитотоксическими химиопрепаратами (например, 5-FU).
Схемы:
- Назначение: метастазы КРР, не применяется (пока) при адъювантной терапии.
- Внутривенное введение каждые 14 дней в комбинации со схемами химиотерапии (с 5-FU/LV, оксалиплатином, иринотеканом).
Токсичность и побочные эффекты. Увеличение риска кровотечения 3-4 степени, тромбоэмболии, гипертензии. Перфорация толстой кишки. Отрицательное влияние на заживление анастомозов и ран.
Коррекция дозы. Период полувыведения около 20 дней (от 10 до 50) => отмена за 4 недели до и на 4 недели после планового оперативного вмешательства.
Осложнения. Перфорация ЖКТ (1-2%), кровотечение (3%), артериальная эмболия (2-3%), обратимая лейкоэнцефалопатия ( таргетная иммунотерапия.
Механизм действия. Химерическое моноклональное антитело к рецептору эпидермального фактора роста (EGFR): высокоаффинное специфическое связывание с внеклеточной частью человеческого EGFR => блокирование EGF/трансформирующего альфа-фактора роста, связанного с EGFR, что препятствует активации внутриклеточной тирозинкиназы и EGFR-зависимого сигнального каскада => нарушение роста и пролиферации клеток.
Синергический противоопухолевый эффект в комбинации с традиционными химиопрепаратами и облучением.
Схемы. Назначение: метастазы КРР, комбинация с иринотеканом.
Токсичность и побочные эффекты. Кожная: угреподобная сыпь, сухость и трещины кожи.
Коррекция дозы. Период полувыведения примерно 4-5 дней => отмена за 2-3 недели до и после плановой операции.
Осложнения. Тяжелые высыпания на коже => боль, суперинфекция.

• Панитумумаб (Вектибикс). Моноклональное антитело => таргетная иммунотерапия.
Механизм действия. Полностью гуманизированное моноклональное антитело к EGFR.
Схемы. Назначение: метастазы КРР. Внутривенное назначение при EGFR-экспрессирующем метастатическом КРР, прогрессирующим, несмотря на химиотерапию.
• Иматиниб (Гливек) и Сунитиниб. Ингибиторы тирозинкиназы.
• Митомицин С. Противоопухолевый антибиотик.
Механизм действия. Выделен из Streptomyces caespitosus: in vivo активируется в алкилирующий агент => связывается с ДНК с образованием сшивок => нарушение синтеза и транскрипции ДНК, независимое от клеточного цикла.
Схемы. Назначение: рак анального канала. Внутривенно.
Токсичность и побочные эффекты. Миелосупрессия, сердечная и легочная токсичность, нефротоксичность.
Коррекция дозы. Период полувыведения 15-20 минут, метаболизируется в печени.
Осложнения. Миелосупрессия (кумулятивный эффект), почечная недостаточность и гемолитический уремический синдром (10%), легочная токсичность (летальность в 40%).
• Гемцитабин (Гемзар). Пиримидиновый антиметаболит.
Механизм действия. Антиметаболит, имеющий структурное и метаболическое сходство с цитарабином: внутриклеточный метаболизм ди/трифосфатных иуклеозидов => ингибирование синтеза ДНК в S-фазу/G1-фазу => апоптоз.
Схемы. Назначение: метастазы КРР, внутривенно.
Токсичность и побочные эффекты. Миелосупрессия, сыпь, гриппоподобные симптомы, отеки, гемолитический уремический синдром.
Коррекция дозы. Период полувыведения 1-10 часов (50% выводится с мочой) => отмена за 4-6 недель до и после плановой операции.
• Цисплатин (платинол). Алкилирующий препарат.
Механизм действия. В деталях неизвестен: связывание с ДНК с образованием сшивок приводит к неспецифическому цитотоксическому действию.
Схемы. Альтернатива стандартной схеме Nigro при плоскоклеточном раке анального канала.
Токсичность и побочные эффекты:
- Дозозависимая кумулятивная нефротоксичность, нейро- и ототоксичность, подавление костного мозга.
- Коррекция дозы.
- Период полувыведения до 3(!) дней.
Осложнения. Острая нефротоксичность. Усиление токсичности в комбинации с радиотерапией.
• Ралтитрексид (Томудекс). Антиметаболит.
Механизм действия. Ингибитор тимидилатсинтетатзы: истощение внутриклеточных запасов тимидина трифосфата (необходимого для синтеза ДНК/РНК) => фрагментация ДНК/РНК => смерть клетки.
Схемы. Назначение: метастазы КРР. Внутривенное введение.
Токсичность и побочные эффекты. Гастроинтестинальная токсичность (тошнота, рвота, анорексия), миелосупрессия (нейтропения, анемия, тромбоцитопения), кожная токсичность, лихорадка и т.д.
Коррекция дозы. Период полувыведения около 8 дней (50% выводится с мочой) => отмена за 4-6 недель до и после плановой операции. Редукция дозы при гастроинтестинальных и гематологических побочных эффектах.
Осложнения. Сочетание лейкопении/тромбоцитопении с гастроинтестинальной токсичностью -жизнеугрожающее осложнение.
Экспериментальные (незарегистрированные) препараты:
• РТК787: мультиингибитор рецептора роста эндотелия сосудов (VEGFR).
• BAY 43-9006: двойной ингибитор RAF киназы и VEGFR.
Читайте также:

