Какая связь между натрием и хлором
Химия - "волшебная" наука. А где вы еще получите безопасное вещество, соединив два опасных? Речь идет об обыкновенной поваренной соли - NaCl. Рассмотрим подробнее каждый элемент, опираясь на ранее полученные знания об устройстве атома.
Натрий - Na, щелочной металл (группа IA).
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 1
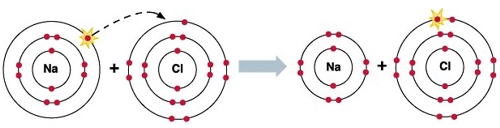
Как видим, натрий имеет один валентный электрон, который он "согласен" отдать, чтобы его энергетические уровни стали завершенными.
Хлор - Cl, галоген (группа VIIA).
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 5
Как видим, хлор имеет 7 валентных электронов и ему "не хватает" одного электрона, чтобы его энергетические уровни стали завершенными.
Теперь догадываетесь, почему так "дружны" атомы хлора и натрия?
Ранее говорилось, что полностью "укомплектованные" энергетические уровни имеют инертные газы (группа VIIIA) - у них полностью заполнены внешние s и p-орбитали. Отсюда они так плохо вступают в химические реакции с другими элементами (им просто не надо ни с кем "дружить", поскольку ни отдавать, ни принимать электроны они "не хотят").
| Главный закон химической реакции - заполнение валентного энергетического уровня |
Когда валентный энергетический уровень заполнен - элемент становится стабильным или насыщенным.
Инертным газам "повезло", а что же делать остальным элементам периодической таблицы? Конечно же, "искать" себе пару, подобно дверному замку и ключу - определенному замку соответствует свой ключ. Так и химические элементы, пытаясь заполнить свой внешний энергетический уровень, вступают с другими элементами в реакции, создавая устойчивые соединения. Т.к. заполняются внешние s (2 электрона) и р (6 электронов) орбитали, то данный процесс получил название "правило октета" (октет = 8)
| Любой атом может получить или отдать не более трех электронов |
Натрий: Na
На внешнем энергетическом уровне атома натрия находится один электрон. Для перехода в стабильное состояние, натрий должен: либо отдать этот электрон, либо принять семь новых. Исходя из вышесказанного, натрий будет отдавать электрон. При этом у него "исчезает" 3s-орбиталь, а количество протонов (11) будет на один превосходить количество электронов (10). Поэтому, нейтральный атом натрия превратится в положительно заряженный ион - катион.
Электронная конфигурация катиона натрия: Na + 1s 2 2s 2 2p 6
Особо внимательные читатели справедливо скажут, что такая же электронная конфигурация и у неона (Ne). Так что же, натрий превратился в неон? Вовсе нет - не забывайте о протонах! Их по-прежнему; у натрия - 11; у неона - 10. Говорят, что катион натрия является изоэлектронным неону (поскольку их электронные конфигурации одинаковы).
- атом натрия и его катион отличаются одним электроном;
- катион натрия имеет меньший размер, поскольку он теряет внешний энергетический уровень.
Хлор: Cl
У хлора ситуация прямо противоположная - на внешнем энергетическом уровне у него находится семь валентных электронов и ему надо принять один электрон, чтобы стать стабильным. При этом произойдут следующие процессы:
- атом хлора примет один электрон и станет отрицательно заряженным анионом (17 протонов и 18 электронов);
- электронная конфигурация хлора: Cl - 1s 2 2s 2 2p 6 3s 2 3p 6
- анион хлора является изоэлектронным аргону (Ar);
- поскольку внешний энергетический уровень хлора "достроился", то радиус катиона хлора будет немного больше, чем у "чистого" атома хлора.
Поваренная соль (хлорид натрия): NaCl
Исходя из вышесказанного, видно, что электрон, который отдает натрий, становится электроном, который получает хлор.
В кристаллической решетке хлорида натрия каждый катион натрия окружен шестью анионами хлора. И наоборот, каждый анион хлора окружен шестью катионами натрия.
В результате перемещения электрона образуются ионы: катион натрия (Na + ) и анион хлора (Cl - ). Поскольку противоположные заряды притягиваются, то образуется устойчивое соединение NaCl (хлорид натрия) - поваренная соль.
В результате взаимного притяжения противоположно заряженных ионов, образуется ионная связь - устойчивое химическое соединение.
Соединения с ионными связями называют солями. В твердом состоянии все ионные соединения являются кристаллическими веществами.
| Ионная связь - химическая связь между катионами и анионами (заряженными частицами, в которые превращаются атомы после отдачи или присоединения электронов). |
Следует понимать, что понятие ионной связи довольно относительно, строго говоря к "чистым" ионным соединениям можно отнести только те вещества, у которых разность в электроотрицателности атомов, которые образуют ионную связь, равна или более 3. По этой причине в природе существует всего с десяток чисто ионных соединений - это фториды щелочных и щелочно-земельных металлов (например, LiF; относительная электроотрицательность Li=1; F=4).
Чтобы не "обижать" ионные соединения, химики договорились считать, что химическая связь является ионной, если разность электроотрицательностей атомов, образующих молекулу вещества равна или более 2. (см. понятие электроотрицательности).
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
- элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1 + ;
- элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2 + ;
- элементы группы IIIA отдают три электрона и образуют катион с зарядом 3 + ;
- элементы группы VIIA (галогены) принимают один электрон и образуют анион с зарядом 1 - ;
- элементы группы VIA принимают два электрона и образуют анион с зарядом 2 - ;
- элементы группы VA принимают три электрона и образуют анион с зарядом 3 - ;
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA | Литий Натрий Калий | Катион лития Катион натрия Катион калия | Li + Na + K + |
| IIA | Бериллий Магний Кальций Стронций Барий | Катион бериллия Катион магния Катион кальция Катион стронция Катион бария | Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+ |
| IB | Серебро | Катион серебра | Ag + |
| IIB | Цинк | Катион цинка | Zn 2+ |
| IIIB | Алюминий | Катион алюминия | Al 3+ |
Распространенные одноатомные анионы
| Группа | Элемент | Ион | Обозначение |
| VIIA | Фтор Хлор Бром Йод | Анион фтора Анион хлора Анион брома Анион йода | F - Cl - Br - I - |
| VIA | Кислород Сера | Анион кислорода Анион серы | O 2- S 2- |
| VA | Азот Фосфор | Аниона азота Анион фосфора | N 3- P 3- |
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
- Cr 2+ - ион двухвалентного хрома; хром (II)
- Mn 3+ - ион трехвалентного марганца; марганец (III)
- Hg2 2+ - ион двухатомной двухвалентной ртути; ртуть (I)
- Pb 4+ - ион четырехвалентного свинца; свинец (IV)
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Ионы не всегда бывают одноатомными, они могут состоять из группы атомов - многоатомные ионы. Например, ион двухатомной двухвалентной ртути Hg2 2+ : два атома ртути связаны в один ион и имеют общий заряд 2 + (каждый катион имеет заряд 1 + ).
Примеры многоатомных ионов:
- SO4 2- - сульфат
- SO3 2- - сульфит
- NO3 - - нитрат
- NO2 - - нитрит
- NH4 + - аммоний
- PO4 3+ - фосфат
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Как семейные узы успокоили две буйные натуры
Несмотря на первую часть названия, повествование наше будет не о скучных химических веществах и их взаимодействиях. Наш рассказ — о страстной любви. У истории будет счастливый финал — образование крепкой семьи.
В рамках этого повествования мы побываем на свадьбе, будем наблюдать встречу и развитие отношений между натрием и хлором — двумя влюбленными с очень непростыми характерами. Еще мы увидим пиротехническое действо, побываем на берегу Мертвого моря, выучим стихотворение всего из двух слов, откроем тайну раствора, спасающего жизнь людей, и многое другое.
В химии всё, как в жизни людей: встречи, расставания, воссоединения. Представьте себе: вокруг цветы, музыка. Мы присутствуем на брачной церемонии: соединить свои судьбы решили натрий и хлор. Говоря химическим языком, два вещества вступают в реакцию соединения.
Для начала давайте познакомимся поближе с брачующимися.
Натрий: физические и химические свойства
Итак, познакомимся поближе с женихом — натрием. Обычно родственники невесты интересуются, откуда жених родом. А он имеет вполне определенное место проживание в периодической таблице Менделеева: I группа, порядковый номер 11, группа щелочных металлов.
Натрий — простое вещество. Это серебристо-белый металл. Он легкий, мягкий, на воздухе быстро окисляется, с водой реагирует бурно, со взрывом. Как видим, характер у жениха непростой, взрывной.
Кроме того, натрий взаимодействует:
- с кислородом;
- со многими неметаллами (за исключением азота, йода, благородных газов);
- с кислотами (разбавленными и концентрированными);
- с жидким и газообразным аммиаком;
- со ртутью;
- с некоторыми органическими соединениями.
Хлор: физические и физические и химические свойства
А кто же у нас невеста?
Хлор — элемент 3-го периода, VII А-группы, порядковый номер 17. Это простое вещество, неметалл, входит в группу галогенов. Желто-зеленый ядовитый газ с резким удушливым запахом, термически устойчив, не горит на воздухе, смесь с водородом взрывается на свету.
Кроме водорода, хлор взаимодействует:
- с неметаллами;
- почти со всеми металлами;
- вытесняет бром и йод из их соединений с водородом и металлами;
- при растворении в воде или щелочах образует хлорноватистую, хлорноватую или соляную кислоту либо их соли;
- с гидроксидом кальция, образуя хлорную известь;
- с органическими веществами.
Как видим, у жениха и невесты те еще характеры. Как натрий, так и хлор, вступают в реакцию с различными веществами и соединениями.
Натрий хоть и металл, но мягкий и податливый: его можно резать ножом, как масло. Хлор тоже совсем непрост: ядовитый удушливый газ, он был первым отравляющим веществом, примененным на войне.
Исходя из таких данных, кажется, что альянс этих двоих будет просто чудовищным. Однако давайте не будем спешить с выводами. Рассмотрим, какова же реакция натрия и хлора, как они взаимодействуют.
2Na + Cl₂ = 2NaCl + Q
Визуально реакция натрия и хлора между собой напоминает пиротехническое действо. В колбу, наполненную хлором, опускают небольшие кусочки натрия. Появляются вспышки, огонь, а затем густой белый дым! Очень зрелищно! А ведь этот белый дым и есть мельчайшие кристаллики поваренной соли. Вот какие страсти горят между нашими влюбленными! Куда там мексиканским сериалам!
А теперь охарактеризуем реакцию взаимодействия натрия и хлора с разных позиций.
- С одной стороны, это реакция соединения. Одно простое вещество присоединилось к другому простому веществу — получилось соединение.
- С энергетической точки зрения, реакция экзотермическая, поскольку проходит с выделением энергии — световой и тепловой (в количестве 819 кДж).
- По агрегатному состоянию, это гетерогенная реакция, то есть твердое вещество вступило в реакцию с газом и в результате получилось твердое вещество.
- Реакция необратимая, так как идет до конца с образованием стабильного продукта.
- Кроме того, эта реакция окислительно-восстановительная.
Рассмотрим подробнее последний пункт, поскольку он объясняет побудительные мотивы соединения (почему именно реагирует натрий с хлором.
Дадим определение, что такое окислительно-восстановительная реакция. Реакции, сопровождающиеся передачей электронов от одного атома к другому, называются окислительно-восстановительными. Окислителем называется тот атом, который в ходе реакции принял электроны. А восстановителем — тот, который их отдал. Чтобы запомнить, кто окислитель, а кто — восстановитель, и не путаться в терминологии, есть очень простое стихотворение. Оно состоит всего из двух слов, но выучив его, вы никогда не будете путать, кто отдает, а кто принимает электроны:
Электронное строение атомов натрия и хлора
Порядковый номер элемента в периодической таблице Менделеева определяет заряд ядра, а следовательно, и количество электронов.
Рассмотрим электронное строение натрия и хлора, или образно говоря, имущество жениха и невесты.
Из электронной формулы натрия видно, что на внешнем электронном подуровне у него 1 электрон, который он легко может отдать. С другой стороны, хлору, чтобы достроить р-подуровень, не хватает одного электрона, который он и забирает у натрия. А если следовать нашей сюжетной линии, невеста присваивает часть имущества жениха, который охотно им делится, лишь бы она была рядом.
Надо отметить, что хлор — один из наиболее сильных окислителей. Натрий с хлором легко вступают в реакцию, так как один легко отдает электроны, а другой легко их принимает. Семья при этом получилась крепкая, в виде прекрасного соединения — хлорида натрия. Без поваренной соли ведь никуда: в кулинарии ее применяют сплошь и рядом как вкусовую добавку; в медицине — для лечебных растворов, снимающих отеки; в коммунальной службе — против гололеда; в водоподготовке — для смягчения воды; используется хлорид натрия и в химической промышленности. Кстати, всем известный физраствор, который спас жизнь многим людям, представляет собой 0,9%-ный водный раствор хлорида натрия.
Добывают поваренную соль путем выпаривания соляных растворов. Мировой лидер по производству поваренной соли — Китай. В природе она встречается в виде залежей галита и сильвинита, рапы соляных озер, минеральных примесей морей. Чаще всего это кристаллы белого цвета, но в природе встречаются месторождения соли, окрашенной в голубой, желтый, серый цвет и даже с красным оттенком.
Давайте мысленно перенесемся на Мертвое море.
Не тонуть в нем позволяет высокая концентрация растворенных в нем солей (35 г на 1 литр воды), в том числе и хлорида натрия.
Итак, подытожим: воссоединились такие бурные, непредсказуемые и местами ядовитые натрий и хлор; реакция же дала в результате безобидное и даже полезное соединение — поваренную соль. Как мы говорили вначале, семейные узы обуздали две бурные натуры и сделали их счастливыми и безопасными для окружающих. Такой вот счастливый финал у нашей истории.

( Натрий хлор , поваренная соль , каменная соль ) NaCl . Получают из природных источников , соляные озёра , в лабораторных условиях путём взаимодействия натрия с хлором при температуре ( 100 — 150°С ) :
2Na + 2Cl = 2NaCl
Реакцией натрия с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
Реакцией гидроксида натрия с соляной кислотой :
NaOH + HCl = NaCl + H2O
Реакцией на соли более слабых кислот :
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Взаимодействием гидроксида натрия с хлоридом аммония причём в ходе нагревания выделяется газообразный аммиак , подобные реакции используют ( как качественную реакцию для проверки на нахождения аммиака в солях ) :
NaOH + NH4Cl = NaCl + NH3↑ + H2O
Обменная реакция между солью щелочью с образованием новой соли и нерастворимого гидроксида :
FeCl3 + 3NaOH = Fe( OH )3↓ + 3NaCl
Применение хлорида натрия
Хлорид натрия неотъемлемая часть жизнедеятельности всех живых организмов , он участвует в обмене веществ в организмах , а в растениях как минеральная соль без которой они погибают , у животных и людей нехватка хлорида натрия приводит к нарушению работы всего организма , так как в основном его свойства используются для выведения из организма через пот вредных веществ .
В производстве неорганических удобрений , получении натрия , хлора , водорода , в химической промышленности , для получения гидроксида натрия и всех его соединений . Большое количество используется в производстве мыла .
Действием на хлорид натрия более сильных кислот получают соляную кислоту и гидросульфат натрия , для выделения её из раствора нагревают ( 50 °С ):
NaCl + H2SO4 =NaHSO4 + HCl↑
Кипячение приводит к полному образованию сульфата натрия и соляной кислоты :
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
В лабораторных условиях при взаимодействии хлорида натрия , серной кислоты и оксида свинца получают газообразный хлор ( который в свою очередь можно использовать как окислитель для получения золота и платины , метод Миллера ) :
2NaCl + 4H2SO4 + PbO2 = Cl2↑ + Pb( HSO4 )2 + 2NaHSO4 + 2H2O
Аналогично ведёт себя оксид марганца :
2NaCl + 2H2SO4 + MnO2 = Cl2↑ + MnSO4 + Na2SO4 + 2H2O
Реакцию с перманганатом калия , хлоридом натрия и концентрированной серной кислотой проводят только добавлением серной кислоты в хлорид натрия , а затем перманганат калия . Если поменять вещества местами то произойдёт мгновенное выделение оксида марганца которое приведёт к воспламенению и взрыву , поэтому подобную реакцию проводят крайне редко :
10NaCl + 8H2SO4 + 2KMnO4 = 5Cl2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
Реакция хлорида натрия с солями серебра приводит к осаждению солей серебра из их растворов в качестве белого творожистого осадка ( качественная реакция на ионы серебра ) :
NaCl + AgNO3 = NaNO3 + AgCl↓
NaCl + AgNO2 =NaNO3 + AgCl↓
В водных растворах при пропускании газообразного аммиака и оксида углерода образуются две новых соли хлорид аммония и гидрокарбонат натрия :
NaCl + H2O + NH3 + CO2 = NaHCO3 + NH4Cl
При нагревании до температуры ( 300°С ) хлорида натрия и хлорида алюминия образуется соединение тетрахлоралюминат натрия :
NaCl + AlCl3 = NaAlCl4
Статья на тему хлорид натрия
Кемеровский государственый университет
- Главная
- О факультете
- Абитуриенту
- Учебный процесс
- Студенту
- Научная работа
- Студенческая жизнь
- Поздравления
- КемГУ
- Наши выпускники
Материалы
Тема 3. Химическая связь. Задания
1.Валентность хрома в соединениях CrO, Cr2O3, CrO3 равна соответственно:
- II, III, VI
- I, II, III
- во всех соединениях II
- во всех соединениях I
2. Степень окисления -3 азот проявляет в соединении:
3. В соединении HClO3 степень окисления хлора равна:
- -1
- +5
- +3
- +7
4. Свою максимальную степень окисления бром проявляет в соединении:
- NaBr
- HBrO
- BrF5
- KBrO4
5. В каком соединении углерод проявляет низшую степень окисления:
6. Высшая положительная степень окисления марганца равна:
- +2
- +4
- +7
- +8
7. Вещество с ионной связью имеет формулу:
- HCl
- CF4
- SO2
- KBr;
8. Только ковалентная связь имеет место в соединении с формулой:
9. Ковалентная неполярная связь наблюдается в следующем веществе:
- аммиак
- алмаз
- углекислый газ
- хлороформ;
10. Ковалентная связь отличается от ионной:
- большей длиной
- меньшей энергией
- общими электронными парами между атомами
- меньшей длиной;
11. Только ионные связи имеют место в веществе:
- пероксид натрия
- гашеная известь
- медный купорос
- сильвинит.
12. Химическая связь наиболее прочна в молекуле:
- йодоводорода
- кислорода
- хлора
- азота;
13. Наиболее выражен характер ионной связи в соединении:
- хлорид кальция
- фторид калия
- фторид алюминия
- хлорид натрия;
14. Длина связи увеличивается в ряду веществ, имеющих формулы:
15. Длина связи увеличивается в ряду:
- H2O – H2S – H2Se,
- HBr – HCl – HI,
- NH3 – H2O – HF,
- H2Se – H2S – HCl;
16. Вещество, имеющее молекулу с кратной связью, - это:
- углекислый газ
- хлор
- аммиак
- этанол;
17. Число π – связей в молекуле пропеновой кислоты равно:
- одной
- двум
- трем
- четырем;
18. Образование водородной связи между молекулами веществ не оказывает влияния на физическое свойство:
- электропроводность
- плотность
- температура кипения
- температура плавления;
19. Наиболее прочные водородные связи образуются между атомом водорода и атомом:
- азота
- кислорода
- хлора
- серы;
20. Прочность водородной связи зависит:
- от величины избыточного положительного заряда на атоме водорода,
- от электроотрицательности атома элемента, образующего такую связь с атомом водорода,
- от величины поляризации связи водород – гетероатом,
- все выше перечисленные ответы верны;
21. В молекуле этилена атомы углерода находится в состоянии:
- sp-гибридизации
- sp 2 -гибридизации
- sp 3 -гибридизации
- не гибридизованы
22. Вещество, в молекуле которого все атомы углерода находится в sp 3 -гибридном состоянии:
- ацетон
- пропаналь
- фенол
- этанол;
23. Неполярная молекула с ковалентной полярной связью – это молекула:
- аммиака
- диэтилового эфира
- тетрахлорметана
- оксида серы (IV)
24. Число σ - связей в молекуле уксусной кислоты равно:
- четырем
- пяти
- шести
- семи;
25. Линейное строение имеет молекула:
- аммиака
- воды
- метанола
- хлорида бериллия
26. В ряду NH3 → PH3 происходит увеличение:
- основных свойств
- прочности связи
- длины связи
- полярности связи;
27. Установите соответствие между формулой вещества и степенью окисления хрома в нем.
| Формула вещества: | Степень окисления Cr: |
| 1) CrO3 | A) +2 |
| 2) KCrO2 | Б) +3 |
| 3) K2Cr2O7 | В) +4 |
| 4) K3[Cr(OH)6] | Г) +5 |
| Д) +6 | |
| Е) +7; |
28. Установите соответствие между формулой вещества и степенью окисления марганца в нем.
| Формула вещества: | Степень окисления Mn: |
| 1)K2MnO4 | A) +1 |
| 2) Mn(OH)4 | Б) +2 |
| 3) MnO2 | В) +4 |
| 4) MnS | Г) +5 |
| Д) +6 | |
| Е) +7 | |
| Ж) +8; |
29. Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
| Название элемента: | Степени окисления: |
| 1) хлор | A) -2, -1, 0, +2 |
| 2) фтор | Б) -2, 0, +4, +6 |
| 3) фосфор | В) -3, 0, +3, +5 |
| 4) сера | Г) -1, 0 |
| Д) -1, 0, +1, +3, +5, +7 | |
| Е) -4, -2, 0, +2, +4 |
Реакция взаимодействия натрия и хлора.










Уравнение реакции взаимодействия натрия и хлора:
Натрий взаимодействует с хлором . Реакция взаимодействия натрия и хлора представляет собой сгорание натрия в атмосфере хлора.
Реакция натрия и хлора протекает при обычных условиях.
В результате реакции происходит образование хлорида натрия .
В ходе реакции натрия и хлора при стандартных условиях выделяется тепловая энергия (теплота) 822,2 кДж .
Термохимическое уравнение этой реакции имеет следующий вид:
2Na + Cl2 → 2NaCl + 822,2 кДж; ΔH = -411,1 кДж/моль.
Таким образом, реакция натрия и хлора носит экзотермический характер.










- ← Реакция железа с хлоридом меди
- Реакция железа и кремния →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 884)
- Экономика Второй индустриализации России (101 439)
- Программа искусственного интеллекта ЭЛИС (22 605)
- Метан, получение, свойства, химические реакции (15 881)
- Мотор-колесо Дуюнова (15 088)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 441)
- Природный газ, свойства, химический состав, добыча и применение (13 918)
- Крахмал, свойства, получение и применение (13 492)
- Прямоугольный треугольник, свойства, признаки и формулы (13 043)
- Целлюлоза, свойства, получение и применение (11 894)
- Пропилен (пропен), получение, свойства, химические реакции (11 635)
- Этилен (этен), получение, свойства, химические реакции (11 153)
- Бутан, получение, свойства, химические реакции (9 833)
- Оксид алюминия, свойства, получение, химические реакции (9 355)
- Оксид железа (III), свойства, получение, химические реакции (9 130)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Читайте также:

