Как восстановить днк в раковых клетках
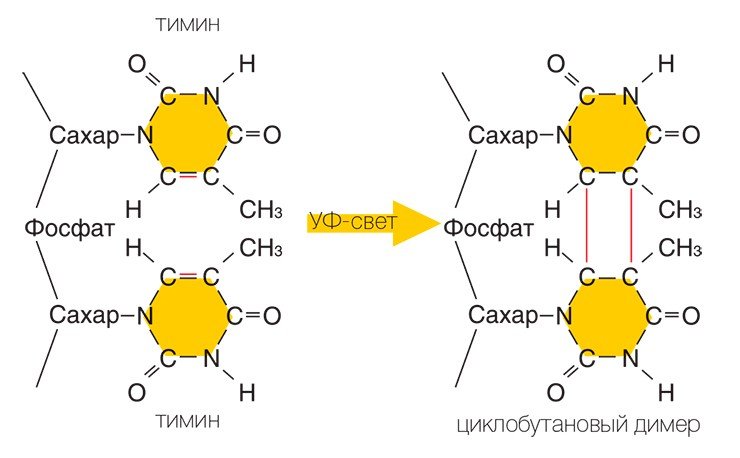
Удивительно, что, несмотря на ключевую роль, которую играет нить ДНК в работе клеток, она является очень нежным образованием, и повредить ее ничего не стоит. Даже обычный солнечный свет представляет для ДНК серьезную угрозу. Чаще всего это происходит следующим образом: квант света — фотон, — столкнувшись с ДНК, может передать свою энергию одному из ее структурных элементов — азотистому основанию, — который при этом переходит в возбужденное состояние. Дальше все зависит от того, с каким конкретно основанием это произошло. Если это аденин или гуанин, то энергия возбуждения быстро переходит в тепловую — и структура ДНК не меняется. Если же порцию дополнительной энергии получили тимин или цитозин, то последствия могут быть весьма серьезными.
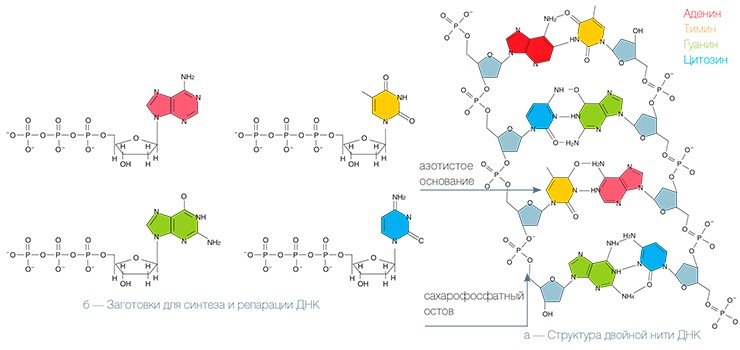
Довольно жестким ударом для любого организма является радиационное облучение, в несколько раз превышающее фоновый уровень радиации, необходимый для существования всех живых существ. Действие ионизирующей радиации вызывает различные повреждения ДНК, включая разрывы обеих цепей, что наиболее опасно для клетки, поскольку репарация таких повреждений особенно сложна. Этот принцип, собственно, положен в основу радиотерапии, когда с помощью ионизирующей радиации уничтожаются раковые клетки; сходным действием обладают и некоторые лекарственные препараты, также используемые при лечении рака. Следует заметить, что даже единственный неисправленный разрыв обеих цепей ДНК может вызвать гибель клетки.
Повреждения ДНК могут быть вызваны и некоторыми антропогенными загрязнениями окружающей среды, такими как продукты сгорания бензина, табачный дым. Однако самые многочисленные, но в то же время и наиболее легко исправляемые повреждения, вызваны агентами, которые возникают в процессе нормальной жизнедеятельности самой клетки: при дыхании, окислении липидов (жиров), а также при воспалительных реакциях. Сейчас известно всего более ста типов подобных окислительных повреждений ДНК.
Заплатки короткие и длинные
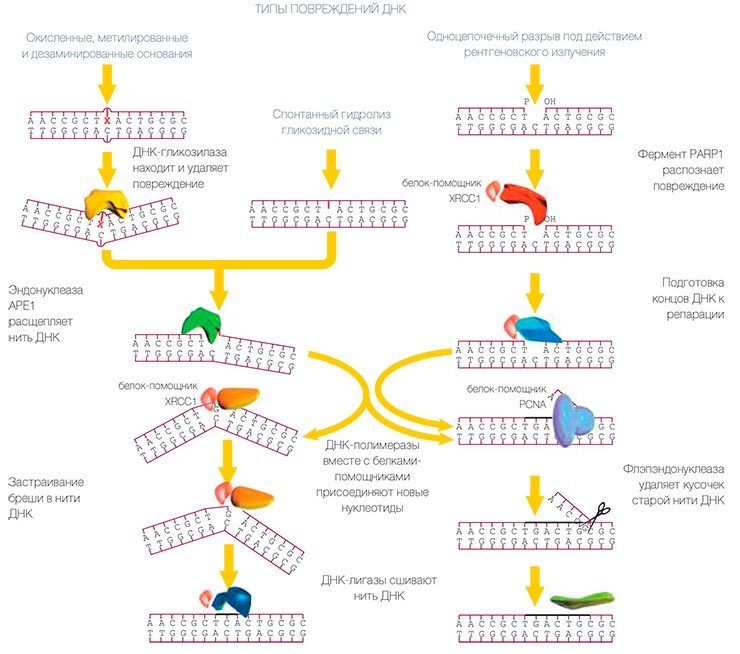
Плохо — когда очень мало или очень много
Считается, что за опознавание повреждения ответственность несет белок, который обозначается буквами XPC-HR23B. (Характерно, что многие из белков этого ансамбля имеют обозначения, начинающиеся буквами XP. Происхождение этих обозначений связано с пигментной ксеродермой (xeroderma pigmentosum), которая проявляется в повышенной чувствительности к действию солнечного света, что связано с отсутствием одного из белков ЭРН.)
Работы еще двух систем, специализирующихся на репарации двуцепочных разрывов в ДНК, мы не будем касаться — это тема другого разговора.
Для правильной и своевременной репарации ДНК важно не только наличие в клетке всех белков, участвующих в этих процессах, но и их количество: опасны как недостаток (или отсутствие) белков, так и их избыток. Чем же грозят человеку дефекты в системах репарации ДНК? Подобные заболевания протекают, как правило, тяжело (самое известное из них — вышеупомянутая пигментная ксеродерма), но встречаются они достаточно редко.
Заболевания человека, однозначно связанные с функциональной неактивностью какого-либо из белков системы ЭРО, на сегодня вообще не известны. Это может быть обусловлено высокой значимостью описанного пути репарации, выражающейся в нежизнеспособности организмов с подобными дефектами.
Пришиваем этикетку к белку
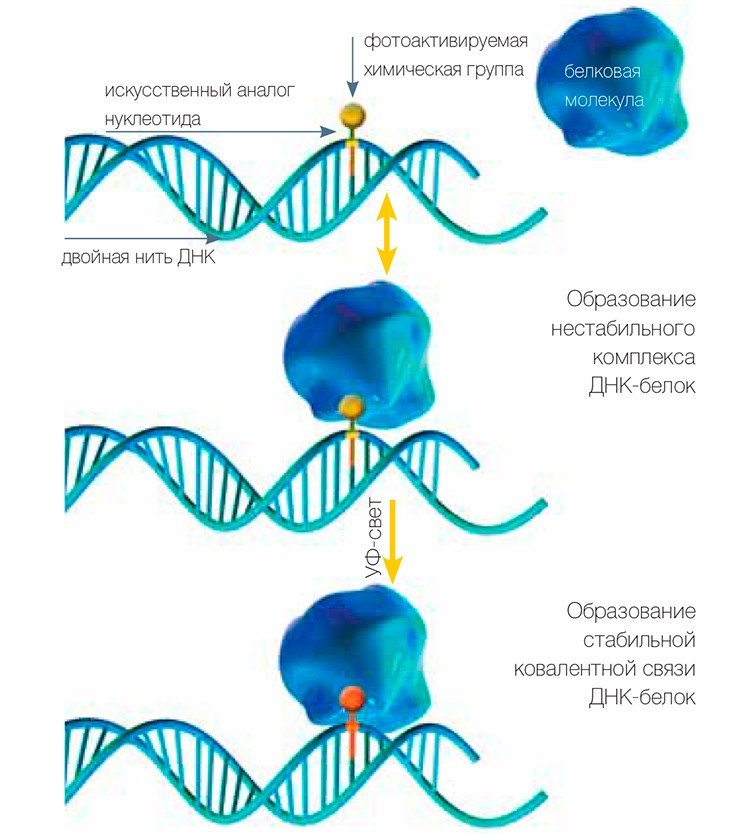
В результате исследователи убивают сразу двух зайцев. Во-первых, поскольку в состав ДНК входят атомы фосфора, мы можем ввести в ее состав радиоактивную метку (обычно это изотоп фосфора 32 Р), что дает возможность легко следить за этой меткой при последующем анализе. Радиоизотопные метки регистрируются с высокой чувствительностью, что позволяет работать с очень маленькими количествами белков. Во-вторых, присутствие этикетки на белке свидетельствует о том, что этот белок способен взаимодействовать с определенными структурными образованиями ДНК, характерными для того или иного этапа процесса репарации.
*См. в: НАУКА из первых рук. — 2006. — № 6 (12). — С. 24—35.
**См. в: НАУКА из первых рук. — 2006. — № 6 (12). — С. 46—53.
Как уже неоднократно бывало в последние десятилетия, лауреаты Нобелевской премии по химии 2015 года могли бы получить премию и в области физиологии и медицины. В этому году премия присуждена за исследование репарации ДНК – механизмов устранения повреждений в этой молекуле. Лауреатами стали Томас Линдаль (Tomas Lindahl) шведский ученый, работающий сейчас в Институте Фрэнсиса Крика в Великобритании, американец Пол Модрич (Paul Modrich) из Медицинской школы Университета Дьюка и Азиз Санджар (Aziz Sancar), гражданин Турции и США, который работает в Университете Северной Каролины.
Следует помнить, что в репарации ДНК задействовано большое количество клеточных механизмов, выяснением которых долгие годы занимается много ученых. Например, премия Ласкера в этом году тоже была присуждена за исследования в этой области, но другим ученым: Эвелин Уиткин и Стивену Элледжу. Есть немало и других исследователи, которые внесли свой вклад в понимание этих механизмов.
Способность устранить неполадки в ДНК жизненно важна для клетки. Причем этот ремонт клетка должна производить самостоятельно и непрерывно. Изменения в цепочке ДНК возникают в ней каждый день. Более того, согласно опубликованным в 2000 году данным, повреждение ДНК под воздействием факторов окружающей среды, а также происходящих в клетке процессов обмена веществ происходит с частотой от нескольких сотен до тысячи случаев в час. Может порваться одна или обе цепочки в двойной спирали, может возникнуть соединение цепочек, может оказаться поврежденным какой-то нуклеотид или несколько нуклеотидов. Причин таких поломок множество: ультрафиолетовое излучение, свободные радикалы, радиация, сбои во время удвоение ДНК при делении клетки.
С механизмом эксцизионной репарации связаны исследования Азиза Санджара. В 1970-х годах Санджар заметил любопытное явление: бактерии, получившие смертельную дозу ультрафиолетового излучения, выживают, если их осветить синим светом. Выяснение биохимической природы этого чудесного спасения бактерий стало предметом исследований Санджара в Техасском университете. В 1976 году он сумел клонировать ген, который отвечает за синтез фермента фотолиазы, восстанавливающего повреждения ДНК, нанесенные ультрафиолетом. Также Санджар сумел получить бактерий, которые усиленно продуцировали этот фермент. Как выяснилось, ДНК-фотолиаза действительно активируется видимым светом и использует для работы его энергию.

Репарация ДНК после повреждения ультрафиолетом - образец эксцизионной репарации
Увы, докторская диссертация Санджара, посвященная фотолиазе, тогда не вызвала особого интереса, и три его заявки на должность исследователя в разных университетах были отклонены. Тогда Азиз Санджар стал работать лаборантом в Медицинской школе Йельского университета. Там он смог продолжить свои работы по изучению того, как ДНК бактерий восстанавливается после ультрафиолетового облучения. Санджар и его коллеги поняли, что у бактерий есть две системы восстановления. Одна работает на свету (она основана на фотолиазе), а другая действует и в темноте. За несколько лет работы Санджар смог определить бактериальные ферменты, кодируемые тремя генами uvrA, uvrB и uvrC. Он экспериментально показал, как эти ферменты идентифицируют поврежденный участок ДНК, а затем делают два разреза в цепочке, удаляя кусок из 12-13 нуклеотидов, содержащий поврежденную часть. Затем в дело вступают уже упоминавшиеся ДНК-полимераза и ДНК-лигаза, достраивая недостающий фрагмент и сшивая цепочку.
После публикации своей работу в 1983 году Азиз Санджар был приглашен в Университет Северной Каролины, где продолжил исследования механизмов репарации. Параллельно с работами Томаса Линдаля он перешел от бактериальной ДНК к ДНК человека. Как оказалось, там функционируют пусть несколько более сложные, но в целом сходные механизмы. Специфический фермент определяет тот тип повреждения ДНК, за который он отвечает. Поврежденный участок вырезается, синтезируется участок на замену, затем разрезы зашиваются.
Третий лауреат, Пол Модрич, в начале своей карьеры исследовал ДНК-полимеразы и ДНК-лигазы, а в дальнейшем обратил внимание на другой класс ферментов, задействованных в репарации ДНК. Работа этих ферментов, получивших название ДНК-метилтрансферазы, заключается в присоединении метильной группы (CH3-) к цепочки ДНК. Как установил Пол Модрич, эти метильные группы могут служить указателями, помогающими другим ферментам разрезать цепочку ДНК в нужном месте. В дальнейних исследованиях Пол Модрич совместно с молекулярным биологом Мэтью Мезельсоном (Matthew Meselson) открыл особый механизм репарации ДНК – репарацию ошибочно спаренных нуклеотидов (DNA mismatch repair). Она требуется, когда в процессе удвоения ДНК при клеточном делении возникают неправильные пары нуклеотидов, например, аденин может соединиться с цитозином, а не с тимином. В этом случае клетке важно заменить именно ошибочно возникший нуклеотид, а не его напарника на соседней цепочке, который стоит на своем месте. Как установили ученые, здесь также используется метилирование ДНК. У большинства бактерий ошибочные нуклеотиды, как правило, содержатся на одной из двух цепочек ДНК – дочерней, которая была только что достроена. При этом исходная цепочка содержит присоединенные к ней метильные группы, а дочерняя пока неметилирована. Поэтому ее можно отличить, а дальше использовать уже известный механизм: вырезать, заменить, сшить.
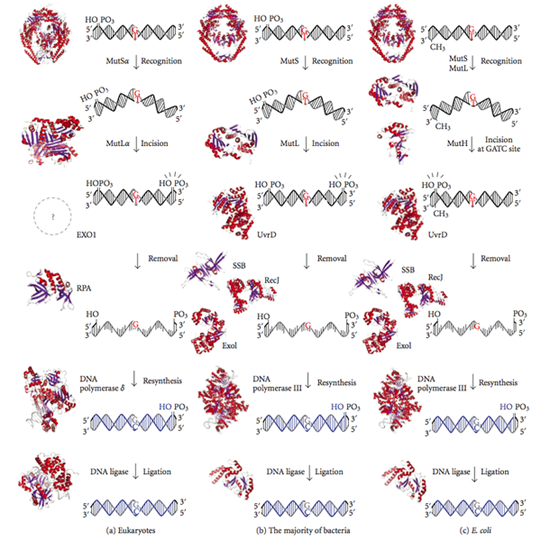
Репарация ошибочно спаренных нуклеотидов у эукариот, большинства бактерий и у бактерии E. coli
Подробное исследование этого механизма заняло у Пола Модрича десять лет. В 1989 году он опубликовал статью, где было показано и подтверждено экспериментами, какие ферменты участвуют в исправлении ошибочно спаренных нуклеотидов.
Помимо описанных систем за последние годы открыты и другие способы репарации ДНК, используемые в живых клетках. Установлена связь нарушений в работе систем ремонта ДНК со многими формами рака. Как выяснили ученые, часто плохая работа систем репарции играет на руку раковым клеткам: они начинают значительно чаще мутировать, и по этой причине могут стать устойчивыми к химиотерапии. Но биологи научились использовать этот механизм и при разработке новых лекарств от рака. Если им удается подавить оставшиеся у раковых клеток механизмы репарации, это приводит к замедлению или полной остановке роста опухоли. Примеров такого лекарства – Olaparib, который ингибирует один из ферментов, задействованных в репарации ДНК.
Результаты нового исследования помогут изменить ваш взгляд на питание и выбор продуктов.
Ученые теперь знают, что у нашего тела есть пять естественных защитных систем, которые чрезвычайно эффективны для предотвращения самых страшных болезней. Однако есть одна загвоздка. Эти защитные системы работают правильно только тогда, когда они питаются здоровой пищей.
Развитие и защита кровеносных сосудов
Сбалансированный микробиом
Это может звучать немного грубо, но триллионы живых бактерий называют наш кишечный тракт домом. Вид бактерий и их количество составляют очень сложную экосистему, которая называется микробиом. Доктор Ли говорит, что сбалансированный микробиом приводит к хорошему физическому и психическому здоровью.
Доктор Ли говорит, что ферментированные продукты, такие как кефир и йогурт, содержат полезные бактерии, также известные как пробиотики. Богатые клетчаткой продукты, такие как брокколи, которые называются пребиотиками, играют важную роль, поскольку они питают полезные бактерии. Некоторые люди удивляются, узнав, что хлеб из закваски повышает наш микробиом.
Мы все знаем, что ДНК содержит генетический код, который мы унаследовали от наших родителей. ДНК дает команды всему нашему телу, сообщая ему, что делать. К сожалению, - это хрупкая система, которая постоянно подвергается атакам со стороны окружающей среды. Естественные враги, такие как ультрафиолетовое излучение от воздействия солнца, могут ослабить ДНК, а также токсины, такие, как дым из выхлопной трубы автомобиля и пары бензина. (Доктор Ли рекомендует уйти от этих испарений при заправке наших автомобилей).
Продукты, которые восстанавливают и укрепляют наш ДНК: киви, шпинат и чечевица. А также усиливают ДНК более 100 различных типов устриц, особенно тихоокеанские устрицы. Исследование показало, что устрицы уменьшили повреждение ДНК на целых 90 процентов
Стволовые клетки
Только недавно ученые открыли защитные свойства наших собственных стволовых клеток, которые имеют жизненно важное значение для роста и поддержания наших органов. Исследователи теперь говорят нам, что эти основополагающие жизненные единицы могут фактически восстанавливать наши тела на протяжении всей нашей жизни.
Последние исследования показывают, что темная фасоль и темный шоколад могут быть супер топливом для стволовых клеток.
Иммунная система
Наша иммунная система является одной из самых известных систем защиты здоровья, однако ученые продолжают все больше узнавать о том, как она работает. Он защищает нас от заражения после воздействия бактерий, борьбы с вирусами и многого другого. Короче говоря, сильная иммунная система обеспечивает защиту от любого патогена, пытающегося причинить нам вред.
В дополнение к раку, десятки других болезненных состояний могут быть следствием слабой иммунной системы: такие, как аллергия, целиакия, псориаз, даже диабет.
Продукты, которые стимулируют иммунную систему: грибы, чеснок и особенно оливковое масло.
Доктор Ли говорит, что некоторые оливковые масла содержат больше целительного гидрокситирозола и полифенолов, чем другие. Он рекомендует покупать оливковое масло из оливок Коронейки, Пикуаль или Морайоло.
Доктор Уильям Ли говорит, что если немного задуматься над тем, что мы едим, это может принести дивиденды, когда речь идет о нашем здоровье.
Как увеличить продолжительность человеческой жизни? Этот вопрос давно волнует ученых. Насколько продвинулись в решении проблемы старения современные генетики? Об этом Pravda. Ru рассказывает сотрудник Института биологии Коми Уральского отделения РАН, лауреат премии президента РФ в области науки и инноваций для молодых ученых Екатерина Прошкина.
Исследование генов дрозофилы
— Екатерина, в чем суть вашей работы? За какое исследование вы получили премию президента РФ в области науки и инноваций для молодых ученых за 2015 год?
— Свои лабораторные исследования мы, в основном, проводим на дрозофиле, ее гены очень хорошо известны, и последовательность генома уже изучена практически полностью. На настоящей момент доступно очень большое количество линий, буквально тысяча линий разных дрозотов с какими-то изменениями последовательности ДНК. То есть у них изменены определенные гены.
И используя линии подобных мушек, мы можем посмотреть, как повышенная активность того или иного гена, или выключение этого гена будут влиять на интересующие нас параметры — продолжительность жизни, показатели качества жизни, например, активность, поведение, устойчивость к разным видам повреждающих воздействий.
Суть открытия была в том, что мы рассматривали, как определенный ген влияет на старение дрозотов, и рассмотрели такой механизм, как восстановление повреждений ДНК. Повреждениями могут быть воздействия высоких температур и радиации, ультрафиолета, которым подвергается человек, например, при интенсивном влиянии солнца.
И когда эти все факторы влияют на организм, то возможно повреждение молекул ДНК. Чем более эффективно справляется организм и клетки с этим повреждением, тем более жизнеспособен организм и тем больше его продолжительность жизни.
Мы попробовали активизировать эти механизмы путем изменения в генах, и эта активация защитных механизмов позволила впервые продлить жизнь мушек почти в два раза.
— А сколько живет эта мушка?
— И вы продлили ее жизнь до полугода?
— Не до полугода, немножко меньше, но в принципе почти четыре месяца они жили благодаря тому, что мы изменяли количество генов, которые отвечают за восстановление повреждений ДНК. В принципе, мы пытаемся найти способ стимуляции защитных механизмов, но не с помощью каких-то манипуляций с ДНК, а с помощью применения разных фармакологических веществ.
Пока вот активации генных восстановлений ДНК нам удалось достичь с помощью применения препаратов растительного происхождения, например, как ксантин. Это пигмент, который содержится в бурых водорослях и который действительно приводил к активации гена, отвечающего за восстановлении ДНК, за устранение активных радикалов.
Долголетие и здоровый образ жизни
— То есть обеспечить долголетие можно правильным питанием?
— Да. Я думаю, что вполне возможно. Либо какие-то лекарства придумать, либо скорректировать образ жизни.
— Насколько можно быть уверенным, что эти исследования на мушке будут верны применительно к человеку?
— Конечно же, исследования на мушке вряд ли будут верны для человека на 90-80 процентов.
— В одном из интервью, если верно цитируют ваши слова, вы сказали, что через 20 лет удастся достичь 200-летнего рубежа в продолжительности жизни человека.
— Это скорее громкий заголовок. Но в течение 20 лет удастся получить и выявить какие-то вещества, которые в будущем при разумном применении, при правильной концентрации позволят продлить жизнь человека, в том числе и до 200 лет.
— В будущем, как вы считаете, что все-таки будет больше работать на долголетие — хорошие гены, здоровый образ жизни либо возможность обращаться к дорогостоящей медицине?
— Мы все-таки делаем ставку, наверное, на второй вариант — здоровый образ жизни. Но, естественно, этот здоровый образ жизни нужно подкреплять какими-то дополнительными стимулирующими средствами, а подбор этих средств должен основываться на отслеживании состоянии организма, в том числе отслеживании генетики организма, чтобы можно было выявить слабые стороны. И тогда эти бреши в геноме, этот недостаток каких-то механизмов, противостоящих старению, можно будет устранить.
Фармакология
— В настоящий момент в мире очень многое зависит от фармакологических компаний. То есть сложность не только в том, чтобы что-то изобрести, но едва ли не большая сложность заключается в том, чтобы это запустить в серийное производство. Как вы полагаете, фармакологические компании готовы профинансировать разработки в области продления жизни?
— Я думаю, что вполне. По крайне мере, они активно идут на сотрудничество, если такое сотрудничество предлагается. И я думаю, что большинство фармакологических компаний с радостью согласится какой-то новый препарат разработать и выпустить его в продажу. Кроме того, мы надеемся, что в будущем в поликлиниках либо в каких-то специализированных клиниках будет более распространено решение проблемы старения.
И я думаю, что на это может повлиять развитие понимания, что старение — это не есть естественный процесс, который обязательно должен происходить, а это именно болезнь, с которой имеет смысл бороться, если разумно подходить к этой проблеме.
— Что вы намерены делать дальше? Какие ближайшие цели стоят перед вами?
— Непосредственно в ближайшем будущем мы планируем расширять спектр генов, на которые можно повлиять, чтобы продлить жизнь. Также мы собираемся протестировать новые вещества, в том числе новые вещества растительного происхождения, и какие-то лекарственные препараты, чтобы посмотреть, как они повлияют на продолжительность жизни организма и на качество жизни.
И, возможно, попробуем провести исследование, скорее всего, в рамках коллаборации с другими институтами, в том числе с зарубежными. Это и институты США, и Канады, и разные другие организации.
Подготовила к публикации Мария Сныткова
Беседовала
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
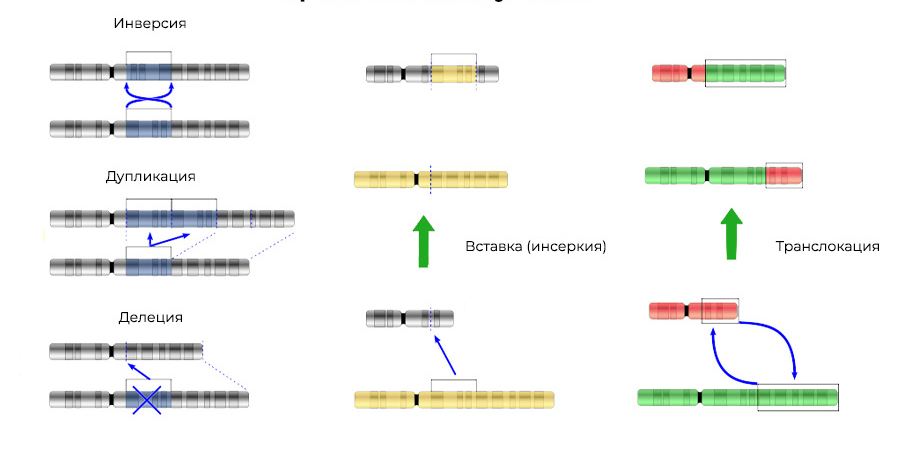
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
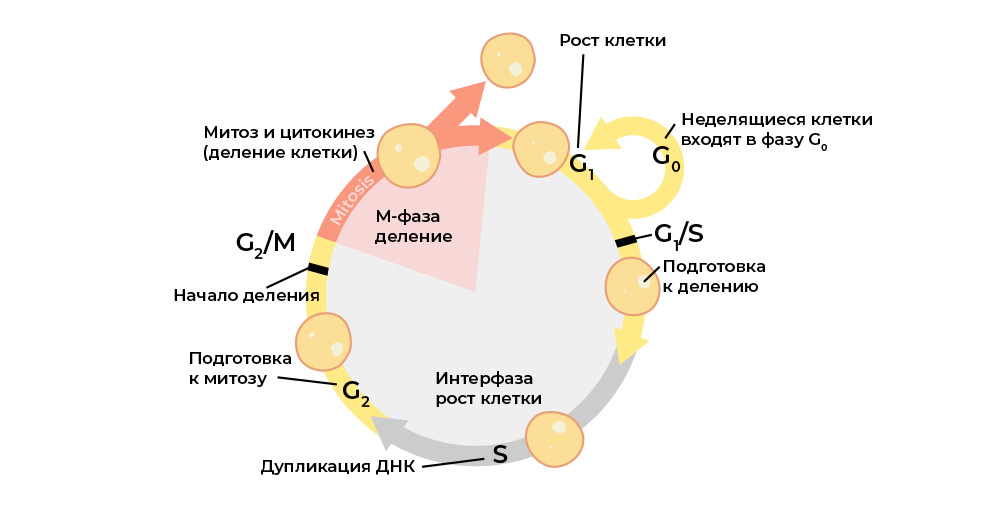
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
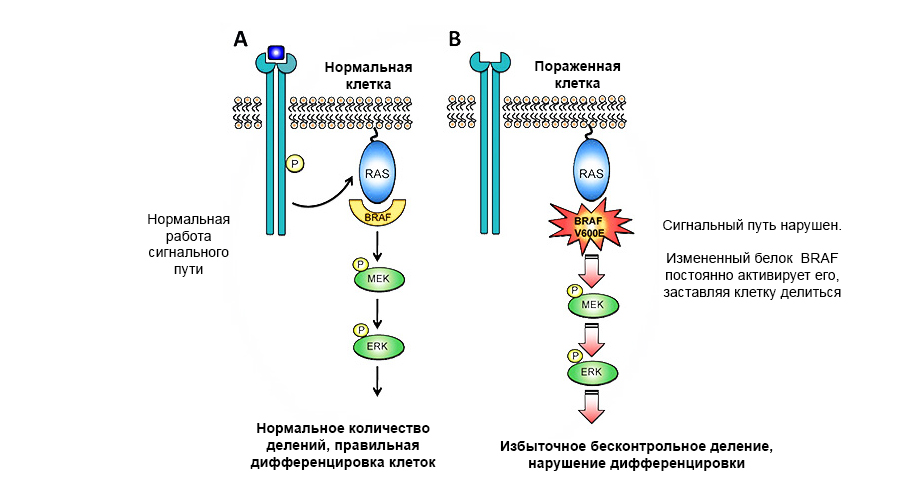
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
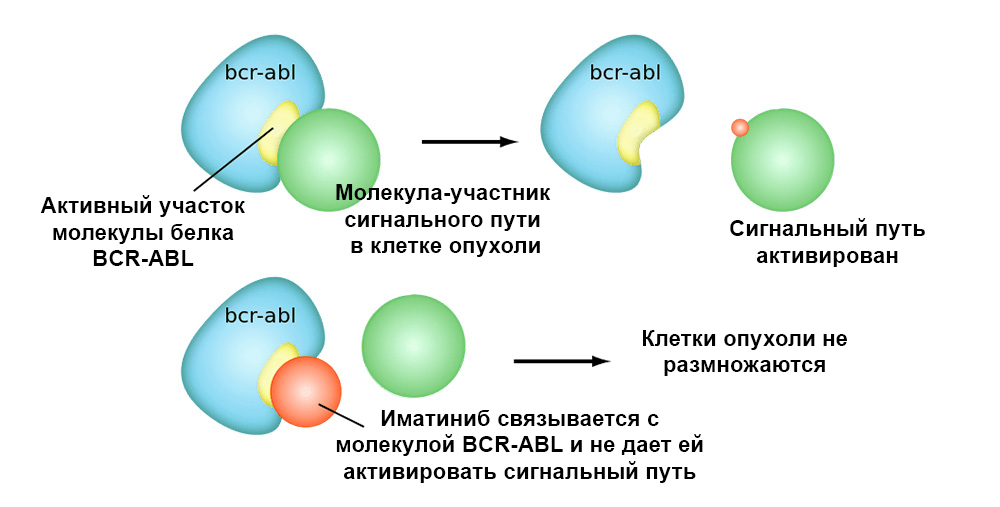
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
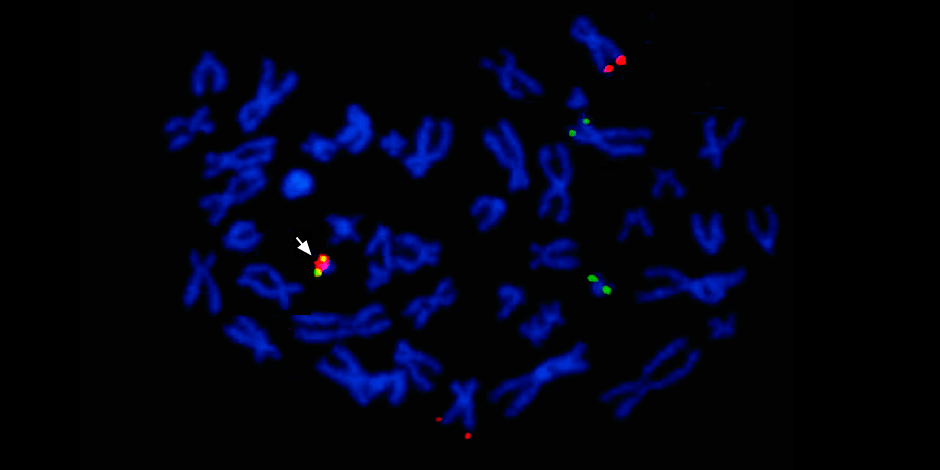
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:

