Экономика инноваций в онкологии

Борьба с онкологическими заболеваниями - одно из ключевых направлений нацпроекта "Здравоохранение", на него до 2024 года выделяется почти 1 трлн руб. За счет этих средств к 2024 году планируется снизить смертность от онкологических заболеваний в России на 8%. Достичь цели по снижению смертности сложно без внедрения в медицинскую практику передовых методов диагностики и разработки эффективных лекарственных средств. Здесь необходимы разработки инновационного бизнеса и значительные частные инвестиции. На примере РОСНАНО можно увидеть, каких реальных изменений в диагностике, лечении и фармакологии можно достичь, если поддерживать перспективные инновационные проекты в частном бизнесе.
Опорной инфраструктурой нацпроекта в части онкологии станут 420 центров амбулаторной онкологической помощи во всех регионах России, 160 региональных больниц для пациентов с онкологическими заболеваниями, оснащенных медицинским оборудованием, и 18 референс-центров для специализированных исследований. Обеспечить в них качественную диагностику и лечение смогут только специалисты, обученные передовым современным методам. Помимо инвестиционной поддержки, Группа РОСНАНО занимается подготовкой и переподготовкой кадров в онкологии, которые будут востребованы в строящихся медицинских учреждениях.
О наиболее важных инвестиционных и образовательных проектах РОСНАНО в борьбе с онкологией - в материале ТАСС.
Изотопы для диагностики и лечения
"Мы первыми в стране инициировали создание региональной сети центров ядерной медицины, которая занимается диагностикой в области онкологии", - отмечает председатель правления УК "РОСНАНО" Анатолий Чубайс.
РОСНАНО удалось осуществить трансфер в Россию передовых медицинских технологий диагностики и терапии онкологии. Компания "ПЭТ-Технолоджи", из которой РОСНАНО успешно вышло в 2018 году, создала первую в стране национальную сеть центров ядерной медицины - на сегодняшний день работают 14 диагностических центров ПЭТ/КТ-диагностики, где 90% высокоточных исследований проводятся бесплатно по полису ОМС. Метод ПЭТ/КТ сочетает в себе позитронно-эмиссионную и компьютерную томографию, что позволяет диагностировать рак на раннем этапе развития и назначить точное лечение. В рамках проекта действуют два производства радиофармпрепаратов - в Уфе и Ельце, которые оборудованы циклотронными комплексами, лабораториями синтеза радиофармпрепаратов, а также применяется терапевтическая установка радиохирургического лечения "Кибер-нож".

Биотех против рака
Другое важное технологическое направление инвестиций РОСНАНО в онкологии - клинические исследования, локализация зарубежных биотехнологических препаратов и разработка собственных. В Ленинградской области РОСНАНО открыло производственный комплекс "Фармсинтез", который выпускает препарат отечественной разработки для лечения опухолей головного мозга на основе гидразина сульфата. Препарат имеет паллиативное действие, нацелен на улучшение качества жизни онкобольных. Кроме того, компания работает в одном из самых многообещающих направлений в лечении онкологии - персонализированной CAR-T терапии (XCART). Планируется использование платформы XCART для разработки клеточной терапии для лечения В-клеточных неходжкинских лимфом. Также "Фармсинтез" выпускает онкопрепарат на основе молграмостима, сопровождающий химиотерапию.
На мощностях биофармацевтической компании "Нанолек" (создана при участии РОСНАНО, в 2019 году реализован выход) в Кировской области планируется развернуть совместный с Janssen (подразделение группы Johnson & Johnson) выпуск в России препарата с действующим веществом даратумумаб, применяемого в терапии множественной миеломы. Запуск лекарства ожидается в 2021 году, на российском рынке нет его аналогов. "Проект расширит доступ к современной и эффективной терапии для пациентов с трудноизлечимой формой рака - множественной миеломой", - говорит президент "Нанолек" Владимир Христенко.

Стартапы тестируют и реконструируют
Другая часть Группы РОСНАНО - инвестиционная сеть наноцентров Фонда инфраструктурных и образовательных программ - занимается созданием новых бизнесов. Среди почти 800 стартапов есть работающие над проблемой диагностики редких и онкологических заболеваний, а также помогающие онкобольным вернуться к нормальной жизни.
Важный проект наноцентров в области реконструктивной онкологии - TEN MedPrint (входит в группу компаний "ТехноСпарк"). Стартап проектирует и изготавливает индивидуальные эндопротезы под конкретного пациента в случаях, когда серийные медицинские изделия невозможно применить: при восстановлении формы челюсти и черепа, в том числе после онкологических удалений кости. В 2019 году было произведено более 500 индивидуализированных 3D-печатных имплантатов, из которых около 10% заказов пришлось на реконструктивную онкологию.
Стартап ульяновского наноцентра Ulnanotech "ТестГен" занимается производством и внедрением генетических тестов для определения рака простаты по моче. Онкомаркер ранее был недоступен в России, в то время как рак предстательной железы (РПЖ) - одно из самых распространенных злокачественных новообразований у мужчин старше 40 лет.

Компания Pepric из наноцентра "СИГМА.Новосибирск" разработала спектрометр для исследования проб крови и тканей с помощью измерения концентрации частиц методом электронного парамагнитного резонанса. Анализы, полученные данным методом, показывают точный и быстрый результат при низкой себестоимости.
Геномный центр ReadSense, входящий в группу компаний "ТехноСпарк", стал основной лабораторией российского проекта по изучению причин наследственных раков OncoBRCA. Специализированный банк данных формируется на основе уникальных клинических выборок, характеризуемых с использованием методов таргетного секвенирования. Полученные данные будут использованы для проведения эффективного скрининга наследственных онкологических заболеваний, выявления групп риска и совершенствования стратегии лечения.
Также Фонд инфраструктурных и образовательных программ участвует в международном проекте по созданию компактного протонного терапевтического комплекса для лечения онкологических заболеваний. Его разработкой занимаются компания "Протом" из г. Протвино Московской области и израильский партнер P-Cure. Проект призван сделать широкодоступной протонную терапию, ключевым преимуществом которой является возможность точечного воздействия непосредственно на опухоль с минимизацией негативного влияния на здоровые ткани. Завершаются испытания протонного комплекса, подана заявка в FDA.

Переподготовка онкологов
Фонд инфраструктурных и образовательных программ разработал 11 учебных программ, предназначенных для специалистов, профессиональная деятельность которых связана с диагностикой и лечением различных онкологических заболеваний. Всего к началу 2020 года обучение по ним завершили около 12 тысяч профессионалов.
Пять образовательных программ, сделанных при поддержке фонда, касаются высокотехнологичных методов ранней диагностики онкологических заболеваний - позитронно-эмиссионной и компьютерной томографии, использования омиксных данных, наномолекулярных методов диагностики меланомы, высокотехнологичных методов анализа клинических данных в области наследственных заболеваний, применения молекулярно-генетических маркеров для ранней диагностики рака предстательной железы. Передовым методам лечения посвящены четыре программы: в области онкологических заболеваний репродуктивной системы на основе таргетных препаратов, лучевой терапии, лазерных медицинских систем, методов локальной деструкции опухолей паренхиматозных органов. Две программы предполагали повышение квалификации специалистов, занятых одновременно диагностикой и лечением рака: в сфере ядерной медицины и флуоресцентной диагностики и фотодинамической терапии.
Программа по омиксным данным для врачей-онкологов, созданная при поддержке ФИОП, стала одной из наиболее востребованных на платформе, доступной через портал непрерывного медобразования Минздрава РФ. Отдельные модули программы были использованы практикующими врачами около пяти тысяч раз.
Анализ омиксных данных - так называют генетические, протеомные, липидомные и другие медицинские данные - позволяет реализовать персонализированный подход в лечении злокачественных образований. Одинаковые симптомы двух пациентов могут отражать разные пути развития заболевания и требовать различных терапевтических методов. Омиксные технологии дают возможность использовать в клинической диагностике комплексные данные и позволяют исследовать организм на самых разных уровнях - начиная с ДНК, - а также учитывать эффективность и побочные явления используемых пациентом лекарственных препаратов.
Николенко добавила, что за две недели после открытия доступа к ресурсу на портале непрерывного медобразования Минздрава РФ прошли обучение более 800 онкологов, причем каждый из них освоил в среднем по пять-шесть модулей.

Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
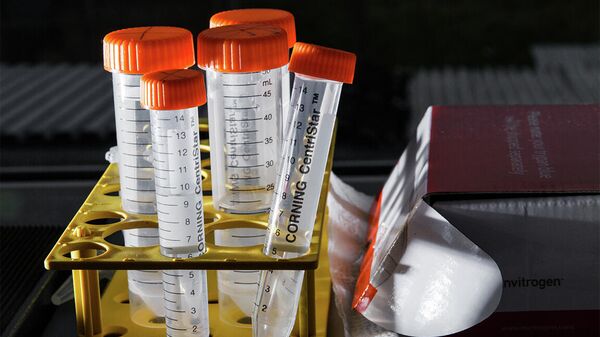
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
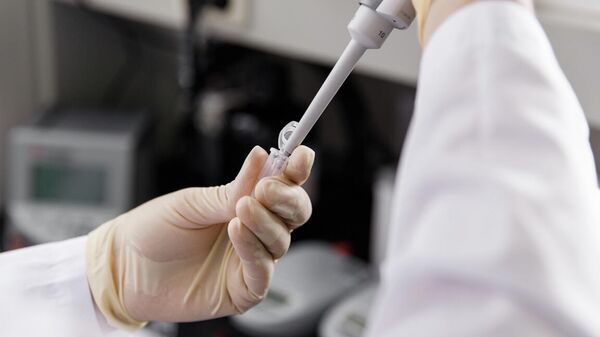
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

По мнению директора Национального медицинского центра онкологии, главного онколога СЗФО Алексея Михайловича Беляева, статистике особо доверять не стоит, поскольку настоящие раковые регистры в стране лишь начинают создаваться, и только там, где они уже применяются, статистика получает более-менее правдивые цифры.
- Показатель высокой заболеваемости чаще всего говорит о том, что в регионе хорошо выявляют онкологические заболевания, - отметил Алексей Михайлович, - а для расчета показателя смертности у нас вообще нет единой методики. Между тем, когда мы ставим задачу расчета экономической эффективности лечения рака, нужно четко понимать цель нашего анализа. Посчитать затраты в деньгах довольно просто, а как определить стоимость спасенной жизни? Что делать с тем фактом, что, продлевая жизнь онкологическому больному, мы получим у него новые недуги и это потребует новых затрат? У нас вообще пока никто не считал, сколько в России стоит лечение одного случая рака!

С главным онкологом СЗФО согласился и главный химиотерапевт Петербурга, директор городского онкоцентра Владимир Михайлович Моисеенко:
- Мы недавно посчитали, сколько необходимо ежегодно выделять средств на лекарственное лечение больных, и получилось, что нам нужно для закупки препаратов, как минимум, 6 млрд руб.. Реально мы получим в будущем году 2 млрд, и при этом в списке ЖНВЛП появятся новые дорогостоящие лекарства, которые пациенты будут вправе требовать от нас. Эти препараты действительно у некоторых больных показывают высокую эффективность, но, например, у нас в городе около 300 горожан с меланомой, и только на их лечение введенными в перечень препаратами потребуется 1 млрд руб. Половина всех выделенных нам на год денег!
По мнению эксперта, именно врачи становятся заложниками данной ситуации: страдающему от рака человеку невозможно объяснить, что в бюджете нет средств на его лечение. Выход Владимир Михайлович видит прежде всего в диалоге с производителями дорогостоящих препаратов с целью добиться от них реальных скидок на лекарства.

О таких методах сотрудничества с производителями рассказал подробнее Александр Кириакович Хаджидис, главный клинический фармаколог Санкт-Петербурга, руководитель Ассоциации клинических фармакологов Санкт-Петербурга. Помимо принудительного снижения цен, существуют другие способы снижения затрат на лекарства и оптимизации лекарственного обеспечения - референтное ценообразование, схемы "гарантия результатов", "покрытие с получением доказательств", финансовые механизмы разделения риска с оценкой результатов и пр. Важное значение в существующих условиях приобретает фармакоэкономика и оценка медицинских технологий - однако исследования и анализы должны быть основаны на локальных данных, с учетом реалий российской экономики, особенностей отечественной медицины.


К концу лета 2018 г. Минздрав должен закончить работу над национальной онкологической программой. О необходимости такой программы говорится в майском указе
Президента РФ Владимира Путина. По расчетам правительства, на ее реализацию необходимо выделить один триллион рублей. От эффективности расходования этих средств будет зависеть, удастся ли обеспечить повышение доступности современных методов диагностики и лечения для онкопациентов.
Что же касается финансирования программы, то возможны четыре источника: государственные деньги (увеличение тарифов ОМС, повышение акцизов на табак), средства работодателей (корпоративные соплатежи, производственная медицина), средства населения и смешанные формы (страхование онкологических рисков за счет работодателей, лекарственное страхование, благотворительность).
Юрий Крестинский привел пример Татарстана, где диспансеризация проходит за счет работодателей. Производственные расходы на эти цели в республике в 2017 г. составили
800 млн руб. Если тиражировать этот опыт на всю страну, то ежегодно на эти цели надо будет тратить примерно 15 млрд руб. Зато таким образом можно снизить нагрузку онкослужбы и сэкономить деньги за счет раннего выявления заболеваний.
Правда, регионов, имеющих крупных работодателей, способных выделить деньги на эти цели, всего примерно четверть. Кроме того, прежде чем масштабировать такой опыт надо решить проблемы недостаточной онконастороженности медицинского персонала и отработать схему передачи сотрудника с выявленной патологией в онкологическую службу.
Кроме того эксперты Центра здравоохранения полагают, что необходимо дифференцированное налогообложение и обязательное страхование онкологических рисков персонала для предприятий, вносящих высокий вклад в онкологическую заболеваемость населения.
Повысить доступность инновационных препаратов можно на счет увеличения количества международных многометровых клинических исследований (ММКИ) в нашей стране. Россия в этом плане пока далека от многих стран. Специалисты Центра развития здравоохранения приводят статистику о числе разрешенных ММКИ на 1 млн населения в 2016 г. Первое место у Швейцарии (35,1 на 1 млн населения), второе – у Бельгии (34,2), третье – у Израиля (33,5). В России показатель равен 2,1 ММКИ.
Другим инструментом повышения доступности новых технологий может стать внедрение государственно-частного партнерства. Директор НИИ медицинской радиологии Департамента здравоохранения Москвы Сергей Морозов согласен, что ГЧП необходимо для онкологии.
Г-н Морозов назвал еще один источник финансирования: избавление системы здравоохранения от неэффективных затрат. Например, радиотерапия проводится амбулаторно, но у нас до сих пор сохраняются койки в стационарах.
По его словам, деньги в отрасли есть, надо только найти те средства, которые тратятся неэффективно, и перенаправить их на другие цели.
Столь низкие темпы говорят лишь о том, что существующих мер борьбы с онкопатологией недостаточно. Какие меры смогут стать по-настоящему эффективными, способствовать снижению смертности и увеличению продолжительности жизни онкобольных, обсудили эксперты круглого стола "Доступность инноваций в онкологии", прошедшего в медиацентре "Российской газеты".
Президент Владимир Путин поставил задачу снизить смертность от онкологических заболеваний на шесть процентов к 2024 году. На эти цели из бюджета выделяются дополнительные средства. Особое внимание будет уделено обеспечению полноценного доступа к терапии эффективными и безопасными противоопухолевыми препаратами, в том числе инновационными.
По мнению экспертов онкологического сообщества, снизить смертность, продлить жизнь и улучшить ее качество возможно за счет повышения доступности инновационных лекарственных препаратов благодаря выделяемому финансированию, а также включению их в перечни ЖНВЛП и ОНЛС.
"Анализируя статистику обращений пациентов на горячую линию, мы отмечаем, что около 70% звонков посвящено проблемам доступности лекарственных препаратов, и при этом нет четкой связи с финансовым состоянием регионов, - говорит президент Ассоциации онкологических пациентов "Здравствуй!" Ирина Боровова. - Но весьма заметна роль перечней, особенно ЖНВЛП. Если нужный препарат там присутствует, то намного легче получить лечение. Если же препарат отсутствует, то его назначение и закупка сильно задерживаются или вообще не происходят".
"Большая надежда возлагалась на профилактику и раннюю диагностику. Но как бы мы ни старались на ранних стадиях, многие опухоли, увы, дают рецидивы и переходят в метастатическую форму. Ключевым методом лечения таких пациентов является лекарственная терапия, - говорит Илья Тимофеев. - Поэтому внедрение инновационных методов лекарственного лечения абсолютно необходимо для повышения выживаемости онкобольных, и это будет частью усилий по увеличению средней продолжительности жизни населения России. Как известно, поставлена цель достигнуть отметки в 80 лет к 2024 году".
Кроме того, существуют нозологии, а также определенные группы онкологических пациентов, при лечении которых могут быть эффективны только современные таргетные противоопухолевые лекарства. К такой категории, в частности, относятся пациенты, страдающие раком почки. Ряд ключевых препаратов второй и последующих линий, которые давно вошли в клинические рекомендации RUSSCO и АОР, пока не включены в федеральные перечни. А это значит, что пациенты часто не получают необходимое лечение или получают его слишком поздно. При этом рак почки является одной из самых быстрорастущих нозологий - прирост количества таких пациентов составляет около четырех процентов ежегодно.
Другая нозология обращает на себя внимание тем, что является одной из основных причин смертности от рака среди женщин. Это рак молочной железы. Эксперты сообщили, что уже зарегистрированы новые прорывные схемы терапии, которые могут значительно продлить ремиссию и улучшить качество жизни, но они пока не представлены в перечнях. Важнейшая задача - поскорее сделать их более доступными.
"Онкогематология особенно нуждается в доступных инновациях, - уверена президент Всероссийского общества онкогематологии "Содействие" Лилия Матвеева. - Потому что раннее выявление в онкогематологии бессмысленно без своевременного получения лекарственных препаратов. При некоторых заболеваниях, таких как хронический миелолейкоз, проблема заключается в том, что если больной перестал отвечать на проводимую терапию, ему требуются препараты 3-4-й линий. Такие инновационные препараты есть и могут быть назначены вовремя, но вот получить их крайне сложно из-за отсутствия в перечнях".
По мнению эксперта, в то же время у больных, получающих весь арсенал современной терапии, заболевание переходит в разряд хронических, а продолжительность жизни приближается к таковой у относительно здорового населения. Поскольку у ранее включенных в перечни препаратов уже вышли аналоги, сравнение новых препаратов идет уже со стоимостью дженериков, что ставит блок для добавления в перечни необходимых инноваций. Сама система пересмотра перечней непрозрачна не только для пациентского сообщества, но и для самих специалистов. Голосуя за пересмотр, члены комиссии опираются на экономические факторы, которые не должны быть решающими. Поэтому заниматься этим должны все же специалисты с медицинским образованием.
"Речь идет о том, что люди борются за собственную жизнь или за жизнь своих близких, и каждая минута на счету, - напоминает Юрий Жулев, президент Всероссийского союза пациентов. - И все разговоры о перечнях, тарифах, стандартах до пациента не доходят, потому что конкретный препарат нужен ему немедленно. Однако сейчас готовится целый пакет поправок к соответствующему постановлению Правительства, которое регулирует деятельность комиссии по формированию перечней. Если они будут приняты, комиссия многократно будет заседать в течение года, вследствие чего частично повысится доступность препаратов и работа станет более ритмичной".
Уже в начале сентября состоится пересмотр существующих перечней на следующий 2019 год. Профессиональные врачебные и пациентские сообщества надеются, что обновленные перечни упростят доступ как к базовой терапии, так и к необходимым инновациям, чтобы продлить жизнь миллионам наших граждан и достигнуть целей, поставленных президентом РФ.

Традиционные методы постепенно уступают место инновационным технологиям в лечении рака, которые стали более персонализированными, эффективными и безопасными.
Традиционные методы, такие как химиотерапия и лучевая терапия, остаются основой лечения, но во многих случаях отсутствует целенаправленный подход, поэтому больные оказываются жертвами лекарственной устойчивости рака.
В последние годы появились новые концепции для улучшения традиционных вариантов лечения, характеризующихся низкими показателями выживаемости.
Инновационные терапевтические стратегии, затрагивающие энергетические процессы раковых клеток, внеклеточные везикулы и синтез белка, а также достижения иммунотерапии и наномедицины, открывают путь следующему поколению методов лечения рака.
Развитие таких областей, как тераностика в наномедицине, также создает основы для адресной доставки лекарств и нановизуализации. Предлагаем несколько многообещающих открытий, презентованных на съезде Ирландской ассоциации исследований рака (IACR).
В своих высокопроизводительных исследованиях геномика, протеомика, метаболомика, транскриптомика используют новые технологии для создания огромных наборов данных, которые разрабатываются с еще большей специфичностью и ценностью.
Потенциал рутинных диагностических технологий, включая магнитно-резонансную томографию (МРТ), компьютерную томографию, позитронно-эмиссионную томографию (ПЭТ) и иммуногистохимический анализ, полностью раскрывается благодаря распространению современной радиомики и патомики.
Наномедицина использует возможности нанотехнологий для улучшения доставки лекарств, фармацевтических свойств, визуализации и диагностики, закладывая основы тераностики.
Способность выделять, характеризовать и функционально фенотипировать внеклеточные везикулы в нанометровом масштабе открывает новые возможности для терапевтического и диагностического использования межклеточных РНК, ДНК и белковых носителей.
Обработка тканей и высокопроизводительная автоматическая флуориметрия лежат в основе новых инструментов, таких как BH3-профайлинг, для прогнозирования клеточного ответа на химиотерапевтические агенты.
Концепция сенсибилизации раковых клеток к радиотерапии рассматривается в течение почти 50 лет: были созданы эффективные малые молекулы (имитаторы кислорода), макромолекулы (miRNA, siRNA, пептид) и радиосенсибилизаторы на основе наноматериалов.
Наномедицина в лечении рака
В последние годы развитие наномедицины продемонстрировало большие перспективы как для получения высококачественных изображений, так и для лечения онкозаболеваний.
Наномедицина — это форма нанотехнологии, применяемых в биомедицинской области, где сконструированные наночастицы (НЧ) с размерами менее 100 нм используются для лечения заболеваний, прежде всего злокачественных опухолей.
Что касается традиционной терапии рака, такие умные и высокотехнологичные НЧ обеспечивают преимущества в пассивном или активном нацеливании лекарств с высокой растворимостью, биодоступностью, биосовместимостью и многофункциональностью.
Эти наночастицы могут быть использованы в мультимодальной терапии. Было разработано несколько видов интеллектуальных НЧ для адресной доставки лекарств-ингибиторов важных клеточных мишеней и в качестве инструментов для получения наноизображений.
Только недавно европейскими исследователями было предложено использовать комбинацию как терапии, так и диагностики с использованием одной и той же наночастицы, что позволило ввести понятие тераностики в область наномедицины.
Основная концепция заключается в том, чтобы получить многофункциональную наночастицу, способную выполнять визуализацию и диагностику на месте работы (внутри организма пациента), то есть самостоятельно искать раковые клетки, а затем убивать их.
Лечение, возможно, будет проводиться в рамках мультимодального подхода. Например, комбинируя доставку лекарств и генов с внешними стимулами, такими как гипертермальная, фототермическая или фотодинамическая (ФДТ) терапия, таким образом воздействуя на раковые клетки одновременно с нескольких сторон.
Высокая коллоидная стабильность в биологических жидкостях, способность селективного нацеливания и полное биоразложение — это важнейшие особенности, присущие для новых высокотехнологичных наноплатформ тераностики.

Интеллектуальные наночастицы в онкологии
Профессор Валентина Кауда и ее коллеги из Отделения прикладной науки и технологии Политехнического университета Турина (Италия) пару лет назад сообщили подробности в отношении интеллектуальных наночастиц, которые были способны эффективно визуализировать и убивать раковые клетки in vitro.
Сначала были даны сведения о наночастицах кремнезема с высокопористыми структурами и крошечными нанопорами диаметром 3–4 нм, то есть наночастиц мезопористого кремнезема.
Этим частицам (MSN) можно придать требуемые химические свойства, чтобы демонстрировать коллоидное и антитромбогенное поведение в биологических жидкостях, предотвращая нежелательную агрегацию или раннюю биодеградацию, и направляя на злокачественные клетки.
Кроме того, MSN способны нести противораковые лекарственные средства или репортеры флуоресцентных молекул как для доставки лекарств, так и для молекулярной визуализации требуемых участков ткани без проведения биопсии.
Особое внимание ученые уделяют новой многофункциональной наночастице на основе плотного нанокристаллического ядра из оксида металла (цинка), защищенного липидным бислоем. Она является очень стабильной в биологических средах в долгосрочной перспективе, что позволяет вводить препарат в кровоток.
Сообщалось, что терапевтические возможности этих наночастиц зависят не от доставки лекарств, а от механизма реагирования на внешние стимулы.
Стимуляция ультрафиолетовым светом в течение нескольких секунд (фотодинамическая терапия) может возбуждать нанокристаллические частицы и генерировать внутриклеточно высокотоксичные активные формы кислорода (АФК) для лечения рака.
Первые тесты на цитотоксичность "бессмертных" клеток Hela показали, что процент гибели раковых клеток составляет 65–80%, когда наночастицы стимулируются с помощью света.
Не наблюдалось влияния на жизнеспособность опухолевых клеток после самостоятельного воздействия УФ-излучения или использования наночастиц без стимуляции.
Эти результаты показывают многообещающую роль высокотехнологичных и функционализированных наночастиц для лечения и молекулярной визуализации.
Однако глобальный успех лечения на основе инструментов наномедицины может быть достигнут только при глубоких знаниях биологии опухолей, маркеров и микросреды.
Радиомика и патомика
Традиционная биология обычно пытается анализировать заболевания на молекулярном уровне и изучать их по частям, полагая, что сумма знаний по частям поможет объяснить болезнь в целом. Данная стратегия редко оказывалась успешной, когда дело доходило до причин и способов лечения сложных онкозаболеваний.
Поэтому системный подход представляется лучшей стратегией для изучения и понимания комплексной сущности.
Этот подход учитывает множество взаимосвязанных переменных:
• как профиль экспрессии генов
• опухолевая клеточная архитектура
• особенности опухолевой микросреды (гистология)
• трехмерная архитектура ткани и васкуляризация (МРТ с контрастным усилением)
• метаболические особенности (наблюдаемые при МР-спектроскопии или ПЭТ).
Только полный набор этих сложных и многогранных данных позволяет исследователям идентифицировать конкретный фенотип заболевания.
Профессор Анант Мадабхуши, директор Центра вычислительной визуализации и персонализированной диагностики (CCIPD) в Университете Кейс Вестерн Резерв, представил ряд инструментов для интеграции и сопоставления биологических данных, охватывающих различные пространственные и временные масштабы, модальности и функциональность.
Ученые применяли компьютеризированные методы анализа признаков для извлечения субвизуальных атрибутов и характеристики внешнего вида и поведения заболевания на рентгенограммах (радиомика) и оцифрованных изображениях (патомика).
На съезде IACR в 2018 профессор Мадабхуши представил ряд примеров применения радиомики и патомики для прогнозирования исхода заболевания, рецидива, прогрессирования и ответа на терапию, о которых сообщается ниже.

Группа профессора Мадабхуши разрабатывает компьютеризированные инструменты оценки риска на основе цифровых микрофотографий тканей для прогнозирования результатов и стратификации риска рака простаты, рака молочной железы и р16 + рака ротоглотки.
В частности, полученные при анализах оцифрованных изображений биомаркеры рака молочной железы, положительных по эстрогеновым рецепторам (ER +), коррелировали с Oncotype DX, тестом за $4000 для стратификации риска рака молочной железы.
Следовательно, этот подход может дополнить – а в некоторых случаях устранить – необходимость в дорогих молекулярных анализах для персонализации лечения.
Дескриптор CoLlAGe успешно применяется для выявления радиационного некроза (доброкачественного эффекта лучевой терапии) и рецидива рака по обычному МРТ.
В настоящее время рентгенологи не могут выявить эти проблемы с помощью МРТ. В результате тысячи пациентов с радиационным некрозом вынуждены пройти ненужные биопсии черепа, чтобы подтвердить отсутствие рака.
В минувшем году Мадабхуши презентовал новый биоинформационный алгоритм, чтобы объединить паттерны заболевания (выявленные путем гистологической визуализации) с протеомными данными. Это приводит к лучшим показателям стратификации риска заболевания и более точной оценке реакции на лечение.
Эти методы были успешно применены для прогнозирования рецидива у мужчин с раком предстательной железы. Было показано, что комбинированный предиктор изображений и омических данных является более точным по сравнению с другими опциями.
Усовершенствованная лучевая терапия рака
Лучевая терапия является основным методом лечения для 50% больных раком, и уступает только хирургии. Однако биологические механизмы, обеспечивающие радиорезистентность межклеточного и внутриклеточного типа недостаточно изучены.
Важность митохондрий и их связи с радиационной стойкостью опухолей актуальны в литературе. В течение последнего десятилетия продемонстрировано, что многочисленные подходы, которые избирательно нацеливаются на раковые клетки благодаря их митохондриальным дефектам, оказывают противоопухолевое действие.
Гипотетически, наиболее эффективными методами митохондриальной терапии будут те, которые действуют на процессы в митохондриях, связанные с ключевыми особенностями неопластического фенотипа.
Повреждение митохондрий находится на пересечении между нормальным метаболизмом и регуляцией апоптоза, являясь направлением разработки новых методов борьбы с раком.
Вещества, которые регулируют функцию и метаболизм митохондрий и повышают чувствительность к индукции апоптоза, могут стать противоопухолевыми агентами.
Группа профессора О'Салливана из Института трансляционной медицины Тринити (Дублин) уделяет особое внимание пониманию роли митохондрий и энергетического обмена в моделях радиационной устойчивости рака пищевода.
Мультимодальный подход к лечению этого заболевания включает неоадъювантное лечение (перед хирургическим вмешательством) с использованием химиотерапии и комбинированной химиолучевой терапии для локально распространенных опухолей.

К сожалению, только 30% пациентов демонстрируют положительный ответ; 70% пациентов получают высокотоксическую терапию без заметного клинического результата. Эти больные неоправданно поздно подвергаются хирургической операции, что может отрицательно сказываться на показателях выживаемости.
Используя изогенную модель радиорезистентности рака пищевода, ирландские ученые показали, что стойкость к радиации связана с изменением структуры и размера митохондрий.
Случайные митохондриальные мутации и изменение метаболического профиля отличается определенной пластичностью, поэтому раковые клетки эффективно переключаются между путями энергетического метаболизма при помощи гликолиза и окислительного фосфорилирования с повышением клоногенной выживаемости.
Уровни случайных митохондриальных мутаций и измененные метаболические профили продемонстрировали метаболическую пластичность, эффективно. In vivo, используя образцы пациентов, врачи могут оценить энергетический метаболизм раковых клеток по уровню субъединицы бета-АТФ-синтазы F1 (ATP5B) и определить вероятность ответа на неоадъювантную химиолучевую терапию.
В рамках программы по поиску лекарств для желудочно-кишечного тракта профессор О'Салливан выявил и запатентовала новый радиосенсибилизатор с двойной антиметаболической и антиангиогенной активностью.
Используя модель рыбок данио in vivo и модели аденокарциономы пищевода человека ex vivo, они показали, что этот низкомолекулярный ингибитор может значительно снизить как метаболическую, так и антиангиогенную активность параллельно с увеличением радиочувствительности злокачественной опухоли.
Важно отметить, что действие этой новой небольшой молекулы также эффективно в условиях гипоксии. В настоящее время продолжаются испытания радиосенсибилизатора в схемах неоадъювантной терапии желудочно-кишечных злокачественных новообразований.
Применение клеточного стресса в борьбе с опухолями
Клеточный стресс необходим для подавления злокачественных опухолей.
Ответы на стресс, опосредованные контрольными точками в сложных сигнальных путях, позволяют клеткам вовремя восстанавливать повреждения, вызванные серией потенциально опасных событий (включая нарушение пролиферации и дефицит нутриентов).
Если повреждение не может быть восстановлено, клетки могут инициировать остановку клеточного цикла или активировать механизмы апоптоза в качестве защитной меры.
Использование этих клеточных стрессовых реакций в противоопухолевой терапии может замедлить рост, а также вызвать массовую гибель раковых клеток.
Эндоплазматический ретикулум (ER) является основным местом складывания и "контроля качества" белка в клетке. Опухолевые клетки должны преодолеть мощные стрессовые реакции эндоплазматического ретикуллума, чтобы получить шанс на выживание.
Но даже когда это происходит, опухолевая клетка может оставаться уязвимой для современных методов лечения. Доктор Эрик Шевет из Центра борьбы с раком Университета Ренна продемонстрировали, что стресс ER и реакция несвернутых белков (UPR) играют ключевую роль в развитии мультиформной глиобластомы (GBM).
Мультиформная глиобластома — тяжелая форма первичного рака мозга, на которую приходится более 15% всех опухолей головного мозга. Несмотря на агрессивное лечение, включающее хирургическую резекцию и лучевую или химиотерапию, выживаемость пациентов после постановки диагноза в среднем 15 месяцев.

Доктор Шевет обнаружил, что ER стресс-сенсор IRE1-альфа (именуемый IRE1) способствует прогрессированию GBM, влияя как на инвазию тканей, так и на васкуляризацию опухоли.
Соматические мутации в гене IRE1 были выявлены при глиобластоме и других формах рака.
Используя преимущества специфической РНК-азы IRE1, вовлеченной в различные мутации, связанные с глиобластомой, ученые нашли уникальные сигнатуры экспрессии, которые затем были изучены в контексте транскриптомов GBM человека.
Этот подход позволил Шевету продемонстрировать антагонистическую роль сплайсинга мРНК XBP1 и RIDD в исходах заболевания. Оказалось, что ось IRE1 / XBP1 обеспечивает секрецию провоспалительных хемокинов опухолевыми клетками, тем самым способствуя привлечению макрофагов, клеток микроглии и нейтрофилов.
Исследование впервые демонстрирует двойную роль передачи сигналов IRE1 при раке и открывает новое терапевтическое окно для остановки прогрессирования глиобластомы.
Стрессовые реакции эндоплазматического ретикулума, а также механизм сигналинга UPR и IRE1 могут быть ценными мишенями для разработки терапевтических средств, однако до их полного изучения и практического применения потребуется немало времени.
Внеклеточные везикулы как терапевтическая стратегия
Профессор Клотильде Тери (Институт Кюри, Франция) сообщает о ярком молекулярном и функциональном разнообразии экзосом и других внеклеточных везикул, которые образуют сложные связи между опухолью и иммунной системой.
Клетки выделяют различные типы внеклеточных везикул (EV) в свою среду. Каждая везикула наделена особыми свойствами в зависимости от их внутриклеточного места происхождения.
Экзосомы являются подтипом везикул со средним диаметром менее 150 нм, которые образуются внутри мультивезикулярных компартментов эндоцитарного пути.
Было показано, что экзосомы, секретируемые дендритными клетками, несут молекулы главного комплекса гистосовместимости (МНС) класса I и II, способные активировать родственные Т-лимфоциты и индуцировать противоопухолевый иммунный ответ.
Эти результаты мотивировали ученых на использование полученных из дендритных клеток экзосом в клиническим испытаниях по лечению рака, хотя и со скромными результатами.
Другие EV также несут иммунные молекулы и могут представлять собой альтернативные инструменты иммунотерапии рака, но для определения терапевтической роли необходимо провести сравнение их биохимических и функциональных свойств.
Обширный протеомный анализ выявил вещества, которые применяют для идентификации экзосом (MHC, flotillin, HSP70) в качестве общих маркеров внеклеточных экзосом.
Эти и другие инновационные технологии в лечении рака, такие как РНК-интерференция, помогут в ближайшие годы совершить прорывы борьбе с трудноизлечимыми опухолями.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Читайте также:

