Как уничтожить метастазы и раковые опухоли








































Отправить другу X

Питание играет важную роль, как в профилактике рака, так и в способствовании росту опухоли и метастаз. Проведенные исследования в США показали, что 75%-85% случаев диагностики рака вызваны нездоровым образом жизни и могли быть предотвращены с помощью изменения пищевых привычек.
Исследователи считают, что 30% смертей, вызванных раком, сегодня могли бы быть предотвращены только с помощью правильного питания.
Связь растительных продуктов с хорошо известными хемопротективными (противоопухолевыми) свойствами очевидна. Фитохимические вещества, которые в них содержатся, воздействуют на межклеточную коммуникацию, которая вызывает воспаление и стимулирует развитие рака в организме.
8 питательных веществ, которые помогают блокировать метастазы рака:
8 самых лучших питательных веществ, которые вы можете употреблять ежедневно для задержки развития рака. Включение в рацион продуктов, содержащих эти вещества, поможет подавить рост, значительно снизить риск развития и даже повернуть вспять прогрессирование рака.
- Урсоловая кислота
- Витамин D
- Куркумин
- ЭГКГ
- Сульфорафан
- Кверцетин
- Апигенин
- Лютеолин
№ 1. Урсоловая кислота
Урсоловая кислота – это растительное масло и фитонутриент. Содержится в травах – таких как базилик священный, орегано, в яблочной кожуре и чернике.
Одной из ключевых характеристик раковых клеток является их способность нарушать механизм апоптоза клеток. Эта запрограммированная смерть клетки может рассматриваться как самоубийство клетки в целях предотвращения внутриклеточных нарушений. Нарушение апоптоза ведет к активизации метастазирования и росту опухоли.
Увеличение потребления урсоловой кислоты входит в курс лечения рака поджелудочной железы, шейки матки, легких, толстой кишки, кожи и груди.
Доказано, что урсоловая кислота разрушает механизмы выживания раковых клеток. В частности, урсоловая кислота запускает апоптоз, тем самым сдерживая репродукцию поврежденных ДНК и метастаз.
№ 2. Витамин D
ФАМ (фактор активации макрофагов- белок, связывающий витамин D) – еще один белок, связанный с понижением раковой активности. Он непосредственно стимулирует ответ иммунной системы, подавляя рост кровеносного сосуда (ангиогенез), требуемый для миграции раковой клетки и роста опухоли. ФАМ нуждается в витамине D для транспортировки по кровеносным сосудам.
Витамин D эффективно подавляет рост и развитие опухоли и метастаз при раке простаты, груди, толстой и прямой кишки и меланоме. Увеличивайте уровень витамина D, ежедневно бывая на солнце, не пользуясь при этом защитными средствами от загара. Включайте в свой рацион продукты, богатые витамином D, включая промысловый лосось, органик и домашние яйца, грибы, ферментированные (непастеризованные) молочные продукты или цельное молоко от домашних коров.
Однако, наиболее здоровой диетой мы считаем диету без продуктов животного происхождения, – примечание от проекта МедАльтернатива.инфо
№ 3. Куркумин
Куркумин входит в состав куркумы, придавая ей желтый цвет. Это мощный антиоксидант, который может предотвращать и лечить заболевания, связанные с хроническим воспалением, включая рак. Куркумин традиционно применялся в качестве лекарственного средства в китайской и индийской медицине для лечения различных заболеваний.
В качестве терапевтического средства куркумин входит в состав многочисленных медицинских препаратов для поддержания иммунной системы, поскольку он регулирует апоптоз и подавляет рост раковых клеток. Исследования показали, что куркумин действует как мощный антиоксидант. Он также блокирует выработку ФНО (фактора некроза опухолей), который усиливает про-воспалительные сигналы и стимулирует рост опухоли.
Клинические исследования показали, что куркумин подавляет пролиферацию раковых клеток и метастазы при различных видах рака, включая рак груди, легкого, матки, яичников, почек, мочевого пузыря, мозга, печени, поджелудочной железы, крови, ободочной и прямой кишок, неходжкиновской лимфоме.
№ 4. Эпигаллокатехин-3-галлат
Противораковое действие ЭГКГ (эпигаллокахетин-3-галлат) пристально изучается уже более трех десятилетий. ЭГКГ – это известное полифенольное соединение, высокая концентрация которого присутствует в зеленом чае. Это одно из целебных веществ, которое использовалось еще в древней китайской медицине. Считается, что употребление ЭГКГ подавляет рост опухоли в различных органах, таких как простата, мочевой пузырь, печень, кишечник, поджелудочная железа, легкие и ротовая полость.
Несмотря на то, что биологические механизмы, с помощью которых этот нутриент подавляет раковые клетки, еще не понятны, недавно было обнаружено, что ЭГКГ связывает рецептор белка 67LR, ответственного за раковую активность. Присоединяясь к канцерогенному белку, ЭГКГ подавляет метастазы, предотвращая ангиогенез, который ответчает за миграцию раковых клеток. ЭГКГ также стимулирует апоптоз, поддерживая разрушение раковых клеток.
Высокое содержание ЭКГК в зеленом чае способствует поддержанию здоровья тела. Исследования показывают, что ежедневное употребление зеленого чая улучшает кишечную микрофлору, что, в свою очередь, очень важно для оптимизации работы иммунной системы. Как минимум одна чашка зеленого чая ежедневно в сочетании с цельными продуктами и растительной диетой сможет поддержать организм в борьбе с хроническими заболеваниями и предотвратить рак.
№ 5. Сульфорафан
Сульфорафан является одним из лучших хемопротективных веществ, которые предотвращают формирование свободных радикалов и рост опухоли. Он уменьшает воспаление и защищает от роста опухоли, поддерживая естественную детоксификацию, направленную на уничтожение токсинов и усиление иммунной реакции. Сульфорафан показал свою способность бороться с распространением рака путем подавления активации раковых клеток. Он сдерживает метастазы при раке селезенки, толстой кишки, простаты, желудка и груди. Капуста брокколи – один из самых эффективных продуктов, которые подавляют распространение рака в вашем теле. Капусту, брюссельскую капусту, брокколи, цветную капусту и другие крестоцветные овощи также следует включать в свое меню. Эти продукты имеют высокое содержание хемопротекторов – глютатионов, аминокислот, хлорофилла, различных витаминов и питательных веществ.
№ 6. Кверцетин
Кверцетин – это супер антиоксидант, который стимулирует естественную детоксификацию организма и демонстрирует естественные антираковые свойства. Высокое содержание кверцетина в вашем питании подавляет разрастание раковых клеток, снижает повреждения, вызванные окислением, и сдерживает активность мутирующего гена Р53, связанного с ростом опухоли.
Данный флавоноид показывает многообещающие результаты при лечении рака груди, крови, легких, кишечника, при нейробластоме.
Кверцетин содержится в больших количествах в луке, каперсах, ежевике, малине, черном и зеленом чае, в темной вишне, какао-порошке, капусте, яблоках и травах – шалфее и петрушке.
№ 7. Апигенин
Этот флавоноид демонстрирует хемопревентивные свойства, подавляя разрастание раковых клеток в новые ткани и рост опухоли. Апигенин понижает активность свободных радикалов и помогает выводить токсины из организма. Используется для поддержания здоровья желудка, почек, печени и крови.
Апигенин препятствует миграции раковых клеток, тем самым предотвращая метастазирование. Исследователи обнаружили, что местное лечение, включающее экстракты апигенина, эффективно в подавлении роста рака кожи и уменьшении повреждения кожи в результате УФ облучения.
Апигенин содержится во многих фруктах и овощах – грейпфруктах, апельсинах и луке. Он также имеется в напитках из растений, включая ромашковый чай. Одним из лучших пищевых источников апигенина, который вы легко можете добавить в свой рацион, является петрушка. Добавляйте петрушку в качестве приправы в салаты и в ваши любимые блюда.
№ 8. Лютеолин
Лютеолин – еще один антиопухолевый флавоноид, входящий в растительную диету. Лютеолин содержится в зеленом перце, ромашковом чае и сельдерее. Доказано, что его антиоксидантные свойства защищают ткани легкого, печени и сердца от воспаления, а также борются против дегенеративного влияния раковой активности.
Несмотря на многочисленные исследования хемозащитных свойств лутеолина, не все его полезные свойства еще известны. Ученые убеждены в том, что эти цитрусовые флавоноиды – лютеолин и апигенин – несмотря на низкие концентрации в продуктах, оказывают более значительный профилактический антираковый эффект, чем обычные продукты.
Лютеолин препятствует активации раковых клеток, подавляя прораковые энзимы, блокируя скопление канцерогенов в новых тканях и помогая уничтожению токсичных агентов. Следовательно, лютеолин является эффективным антиоксидантом, оказывающим на организм человека антипролиферативное и анти-метастатическое действие.
Вывод
Важнейшим для здоровья является отказ от обработанной пищи, сахара, мяса и молочных продуктов, которые разрушают защитные свойства иммунной системы. Продукты питания должны подавлять раковые клетки. Употребляйте перечисленные выше 8 продуктов, которые стимулируют апоптоз раковых клеток, предотвращают ангиогенез и, соответственно, подавляют формирование раковой опухоли и распространение метастаз в другие части тела.
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
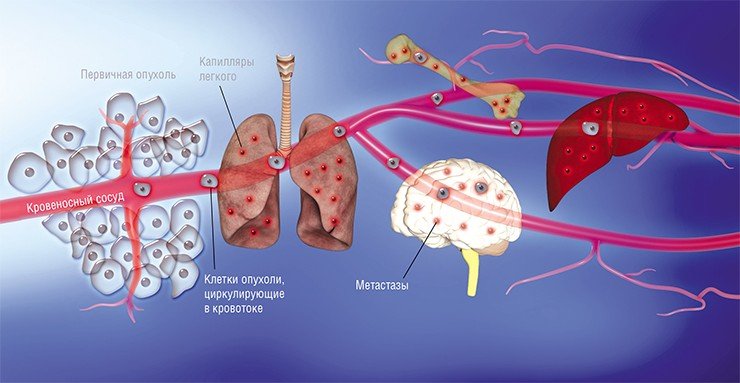
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
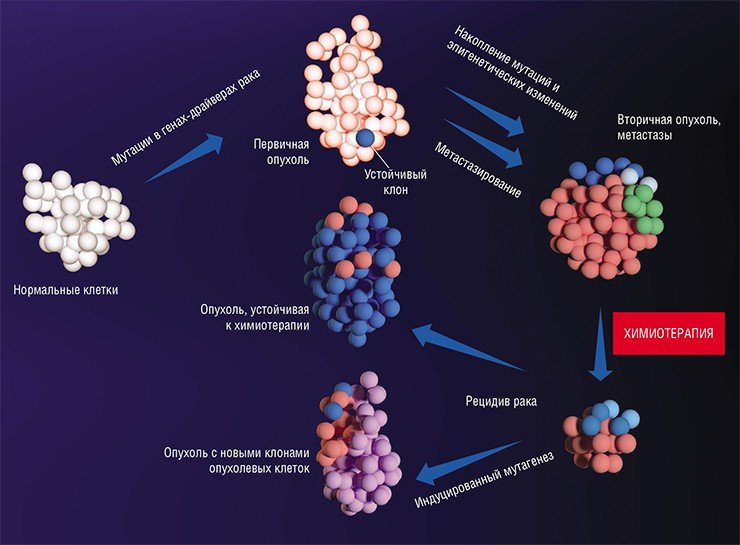
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
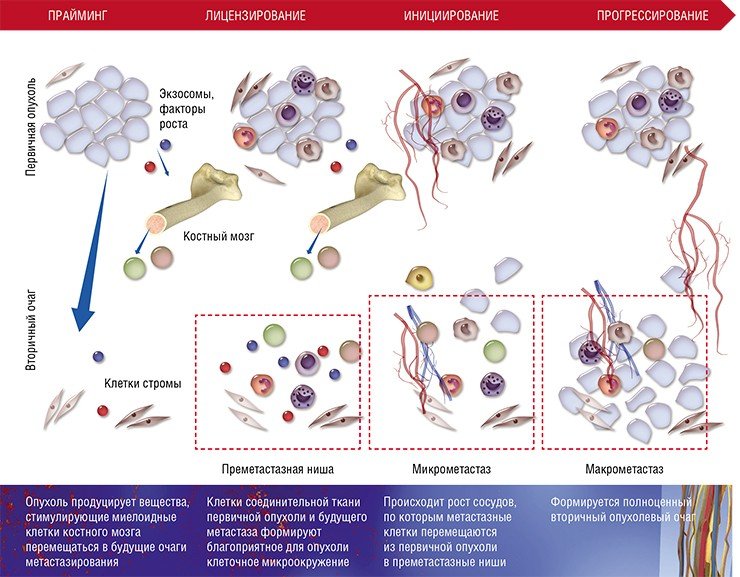
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
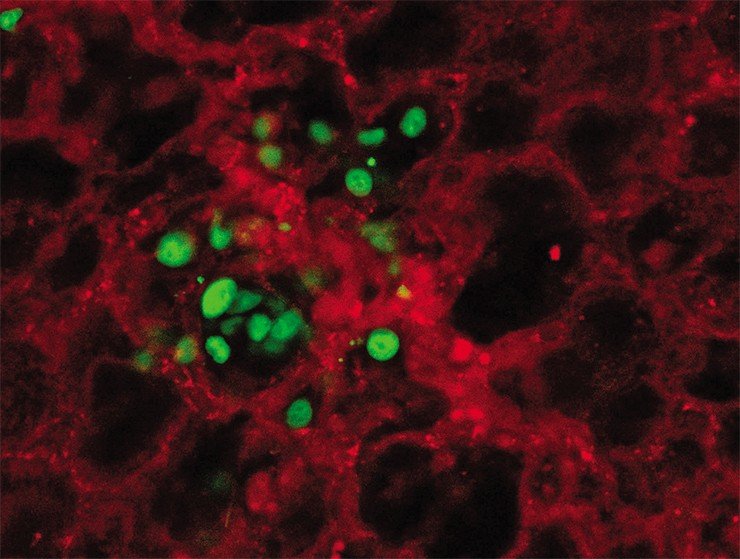
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7

Особенностью большинства злокачественных опухолей является их склонность к лимфогенному и гематогенному метастазированию — отсеву опухолевых очагов с током лимфы или крови. Одни новообразования делают это раньше, другие позже. Некоторые виды рака, например, папиллярный рак щитовидной железы крайне редко дают метастазы, другие, например, саркомы или рак яичников, метастазируют очень быстро.
Основным методом лечения солидных опухолей является хирургическая операция, которая направлена на радикальное удаление новообразования. Однако при наличии метастазов этого недостаточно, даже если их можно удалить хирургическим путем, поскольку в организме с большой долей вероятности присутствуют другие, скрытые микрометастазы, которые пока не определяются имеющимися методами диагностики. Для борьбы с ними необходимо системное воздействие, которое оказывает химиотерапия.
- Показания к химиотерапии
- Противопоказания к химиотерапии
- Эффективность химиотерапии при метастазах
- Виды химиотерапии при метастазах
- Подготовка к лечению
- Процесс восстановления после лечения
- Осложнения
Показания к химиотерапии
- Лечение высокочувствительных к химиотерапии опухолей. В этом случае хорошие результаты достигаются даже при 4 стадии заболевания с метастазами в отдаленных органах, когда можно уменьшить объем опухоли и вернуть ее в состояние, при котором эффективно другое лечение. Например, при некоторых видах рака молочной железы эффективно гормональное лечение, но со временем опухоль вырабатывает к нему резистентность и начинает прогрессировать. Несколько курсов химиотерапии могут вернуть ее в состояние, когда она опять станет чувствительна к гормонам. Это не радикальное лечение, но в определенных ситуациях оно вполне эффективно.
- Проведение комбинированного лечения. В ряде случаев химиотерапия назначается на дооперационном этапе для лечения местно распространенных или метастатических новообразований. ХТ позволит уменьшить объем опухоли и метастазов и в последствии провести его радикальное хирургическое удаление, тем самым улучшив качество лечения и прогнозы течения болезни.
- Паллиативное лечение. Паллиативная химиотерапия призвана улучшить качество жизни больных, уменьшив проявления действия опухоли. Ее назначают для уменьшения болевого синдрома, при лечении асцита и некоторых других осложнений.
Противопоказания к химиотерапии
- Беременность. Большинство химиотерапевтических препаратов обладают тератогенным и токсическим действием на плод, поэтому их нельзя использовать во время беременности, но есть препараты, которые не проникают через плацентарный барьер. Их применяют при лечении некоторых видов рака у беременных.
- Тяжелая, декомпенсированная недостаточность внутренних органов — сердца, легких, печени и почек.
- Тяжелые анемии, лейкопении и тромбоцитопении. Химиотерапевтические препараты губительно действуют на костный мозг, вызывая угнетение всех ростков кроветворения. Те или иные препараты действуют на него в разной степени, соответственно показатели крови, при которых нужно отменять лечение, будут определяться индивидуально с учетом используемой схемы ХТ.
- Химиотерапия не назначается, если конкретная опухоль нечувствительна к данному виду лечения.

Эффективность химиотерапии при метастазах
Существует множество групп химиопрепаратов. Все они различаются механизмами действия, но в общем их можно свести к двум аспектам:
- Цитотоксическое действие — разрушение опухолевых клеток.
- Цитостатическое действие — блокировка процессов размножения опухолевых клеток. Они перестают размножаться и со временем погибают.
Эффективность химиотерапии определяется несколькими моментами:
- Тип опухоли и ее молекулярно-генетический профиль.
- Стадия заболевания.
- Применяемые виды лечения. Большинство опухолей вырабатывают резистентность к химиотерапии первой линии, поэтому при прогрессировании или развитии рецидива, схему лечения необходимо менять.
- Возраст и общее состояние больного. Например, ослабленным больным невозможно проведение высокодозной химиотерапии, которая могла бы преодолеть химиотерапевтическую резистентность рака и добиться лучших результатов лечения.
Виды химиотерапии при метастазах
При метастазах могут использоваться все известные методы химиотерапии:
- Неоадъювантная. Применяется перед облучением или операцией. Позволяет уменьшить объем опухоли и метастазов и провести их радикальное удаление.
- Адъювантная. Она применяется после операции, для уничтожения оставшихся опухолевых клеток. Обязательно проводится при обнаружении метастазов в регионарных лимфатических узлах.
- В рамках монотерапии используется для лечения высокочувствительных опухолей.
- Локальная химиотерапия. Хорошо зарекомендовала себя при лечении метастазов в печени, головном мозге, серозных полостях и других органах.
- Паллиативная ХТ, она проводится для облегчения состояния больного.
Подготовка к лечению
Подготовка к химиотерапии заключается в проведении комплексного обследования, которое, во-первых, позволит подобрать необходимую схему лечения, а во-вторых, выявить наличие противопоказаний к нему.
Для подбора химиотерапии необходимо морфологическое, иммуногистохимическое и, в ряде случаев, молекулярно-генетическое исследование злокачественного новообразования. Дело в том, что рак одного и того же органа может быть представлен совершенно разными видами опухолей, которые по-разному реагируют на лечение. Более того, один и тот же вид рака может иметь разный молекулярный профиль, что также влияет на его чувствительность к химиотерапии и другим видам лекарственного лечения. Определить эти особенности помогают вышеперечисленные методы лабораторной диагностики.
Процесс восстановления после лечения
После проведения курса химиотерапии, пациент опять сдает анализы, чтобы оценить токсическое действие лечения. При необходимости, назначается сопроводительная терапия, которая помогает справиться с ожидаемыми осложнениями или предотвратить их развитие. Если имеются показания, при дальнейших курсах ХТ может быть изменена дозировка препаратов или они могут заменяться на менее токсичные. При развитии тяжелых осложнений, лечение может быть полностью отменено.
Осложнения
Основная проблема химиотерапии заключается в ее токсическом действии не только на злокачественные клетки основной опухоли и ее метастазов, но и на весь организм, что приводит к развитию целого комплекса осложнений. Их можно разделить на несколько групп.
- Местнотоксическое действие. Сюда относят дерматиты, циститы, ректиты, плевриты, перитониты, некрозы подкожной клетчатки и др.
- Системные осложнения, которые вызваны неспецифическим действием химиотерапии, которое направлено на подавление жизнедеятельности быстро размножающихся клеток. Сюда относят угнетение кроветворения (анемии, иммунодефициты, тромбоцитопении), диспепсические явления (тошнота, рвота, диареи из-за нарушения эпителиального покрова ЖКТ), поражение кожи и слизистых (алопеция, стоматиты, вульвовагиниты и др), нарушение репродуктивной функции (бесплодие, химическая кастрация, климакс).
- Относительно специфические побочные реакции. Они связаны с токсическим действием на отдельные органы и системы: нервную систему, печень, поджелудочную железу, сердце, почки и др. Также химиотерапия может приводить к хромосомным и генетическим поломкам, что может спровоцировать образование вторичной опухоли.
- Иммунодефициты, на фоне которых развиваются тяжелые грибковые, бактериальные и паразитарные инфекции, или происходит активация хронических инфекционных процессов.
- Аллергические реакции — анафилаксии, токсические дерматиты, пульмониты и др.
- Аутоиммунные реакции — васкулиты.
В настоящее время разработаны эффективные методы профилактики и борьбы с данными осложнениями. Например, для устранения изнуряющей рвоты, применяют эметики. Они действуют непосредственно на мозговой центр, отвечающий за данное ощущение.
Для компенсации миелодепрессивного действия, применяют колониестимулирующие факторы роста, которые активируют гемопоэтические стволовые клетки и восполняют кроветворение. Для предотвращения инфекционных осложнений, применяются антибиотики, противогрибковые и антипаразитарные препараты.
Мощный арсенал современных методов во многих случаях позволяет проводить эффективную химиотерапию при метастазах и добиваться удовлетворительных результатов лечения.
Читайте также:

