Как этан взаимодействует с хлором
Задание 17. Этан взаимодействует
1) с хлороводородом
4) с оксидом углерода(IV)
Этан относится к алканам. Известно, что алканы подвергаются реакции радикального замещения с галогенами (здесь это хлор) и горят в кислороде (взаимодействие с кислородом).
Ответ: 25.
- Все задания варианта
- Наша группа Вконтакте
- Наш магазин
- Наш канал
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 1
- Вариант 1. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 2
- Вариант 2. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 3
- Вариант 3. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 4
- Вариант 4. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 5
- Вариант 5. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 6
- Вариант 6. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 7
- Вариант 7. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 8
- Вариант 8. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 9
- Вариант 9. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 10
- Вариант 10. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 11
- Вариант 11. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 12
- Вариант 12. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 13
- Вариант 13. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 14
- Вариант 14. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 15
- Вариант 15. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 16
- Вариант 16. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 17
- Вариант 17. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 18
- Вариант 18. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 19
- Вариант 19. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 20
- Вариант 20. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 21
- Вариант 21. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 22
- Вариант 22. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 23
- Вариант 23. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 24
- Вариант 24. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 25
- Вариант 25. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 26
- Вариант 26. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 27
- Вариант 27. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 28
- Вариант 28. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 29
- Вариант 29. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 30
- Вариант 30. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
Для наших пользователей доступны следующие материалы:
- Инструменты ЕГЭиста
- Наш магазин
- Наш канал

На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Характеристики и физические свойства этана
Не имеет вкуса. Не растворим в воде. Проявляет слабое наркотическое действие.
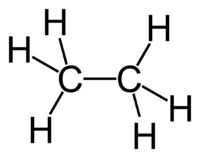
Рис. 1. Строение молекулы этана.
Таблица 1. Физические свойства этан.
Плотность (20 o С), кг/м 3
Температура плавления, o С
Температура кипения, o С
Получение этана
В больших объемах этан получают из попутного нефтяного газа и газов нефтекрекинга.
В лабораторных условиях этан получают следующими способами:
— гидрированием непредельных углеводородов
— по реакции щелочного плавления солей одноосновных органических кислот
— взаимодействием галогеналканов с металлическим натрием (реакция Вюрца)
Химические свойства этана
В обычных условиях этан не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Для этана наиболее характерны реакции, протекающие по радикальному механизму. Энергетически более выгоден гомолитический разрыв связей C-H и C-C, чем их гетеролитический разрыв.
Все химические превращения этана протекают с расщеплением:
- cвязей C-H
- галогенирование (SR)
- дегидрирование
- связей C-H и C-C
- окисление
Применение этана
Этан используется как сырье в химической промышленности в основном для получения этилена.
Примеры решения задач
| Задание | Определите массу хлора, необходимого для хлорирования по первой стадии 4,5 л этана. |
| Решение | Запишем уравнение реакции хлорирования этана: |
Найдем количество вещества этана:
Согласно уравнению реакции n(C2H6) : n(Cl2) = 1:1, значит,количество моль хлора равно:
Тогда, масса хлора будет равна (молярная масса – 71 г/моль):
| Задание | Рассчитайте объемы хлора и этана, приведенные к нормальным условиям, которые потребуются для получения дихлорэтана массой 10,5 г. |
| Решение | Запишем уравнение реакции хлорирования этана до дихлорэтана (реакция происходит под действием УФ-излучения): |
Рассчитаем количество вещества дихлорэтана (молярная масса равна – 99 г/моль):
По уравнению реакции найдем количество вещества хлора. n(C2H4Cl2) : n(Cl2) = 1:2, т.е. n(Cl2) = 2 × n(C2H4Cl2) = 2 × 0,12 = 0,24 моль. Тогда объем хлора будет равен:
Этан, получение, свойства, химические реакции.










Этан, C2H6 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Образуется также при крекинге нефтепродуктов.
Этан, формула, газ, характеристики:
Этан (лат. ethanum) – органическое вещество класса алканов , состоящий из двух атомов углерода и шести атомов водорода.
Химическая формула этана C2H6, рациональная формула H3CCH3. Изомеров не имеет.

Этан – бесцветный газ, без вкуса и запаха.
В природе содержится в природном газе , добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе . Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов ., в т.ч. сланцевой нефти.
Пожаро- и взрывоопасен.
Не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Этан по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Физические свойства этана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,2601 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,342 |
| Плотность (при температуре кипения и атмосферном давлении 1 атм.), кг/м 3 | 544 |
| Температура плавления, °C | -182,81 |
| Температура кипения, °C | -88,63 |
| Температура самовоспламенения, °C | 472 |
| Критическая температура*, °C | 32,18 |
| Критическое давление, МПа | 4,8714 |
| Критический удельный объём, м 3 /кг | 4891·10 -6 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 3,2 до 12,5 |
| Удельная теплота сгорания, МДж/кг | 47,5 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,018 |
| Коэффициент теплопроводности (при 20 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0206 |
| Молярная масса, г/моль | 30,07 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этана:
Этан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства этана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование этана:
- 2. галогенирование этана:
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы этана, отрывая у них атом водорода, в результате этого образуется свободный этил CH3-CH2·, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома :
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH3 + Br· → CH3-CH2· + HBr; – рост цепи реакции галогенирования;
CH3-CH2· + Br· → CH3-CH2Br; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование этана проходит поэтапно – за один этап замещается не более одного атома водорода.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода .
- 3. нитрование этана:
- 4. окисление (горение) этана:
При избытке кислорода:
Горит бесцветным пламенем.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод (в различном виде, в т.ч. в виде графена , фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование этана:
- 6. сульфоокисление этана:
Получение этана в промышленности и лаборатории. Химические реакции – уравнения получения этана:
Так как этан в достаточном количестве содержится в природном газе (до 30 % и более), попутном нефтяном газе и выделяется при крекинге нефтепродуктов , его не получают искусственно. Его выделяют при очистке и сепарации из природного газа , ПНГ и нефти при перегонке.
Этан в лабораторных условиях получается в результате следующих химических реакций:
- 1. гидрирования непредельных углеводородов , например, этилен (этен):
- 2. восстановления галогеналканов:
- 3. взаимодействия галогеналканов с металлическим щелочным металлом , например, натрием (реакция Вюрца):
Суть данной реакции в том, что две молекулы галогеналкана связываются в одну, реагируя с щелочным металлом .
- 4. щелочного плавления солей одноосновных органических кислот
Применение и использование этана:
– как сырье в химической промышленности для производства в основном этилена (этена).










как получить этан этилен реакция ацетилен этен 1 2 вещество хлорэтан этанол кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этана
напишите уравнение реакций этан
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот; Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки.
1. И анилин, и диметиламин реагируют с
3) серной кислотой
5) гидроксидом натрия
6) раствором перманганата калия
2. С аминоуксусной кислотой реагирует
4) сульфат натрия
5) гидроксид натрия
6) гидроксид меди( II )
3. О глицине можно сказать, что это вещество
1) жидкое при обычных условиях
2) обладает амфотерными свойствами
3) имеет резкий запах
4) хорошо растворимо в воде
5) образует сложные эфиры
6) не реагирует с кислотами
4. Об анилине можно сказать, что это вещество
1) более сильное основание, чем аммиак
2) хорошо растворяется в воде
3) образует соли в реакции с кислотами
4) окисляется на воздухе
5) реагирует со щелочами
6) обесцвечивает бромную воду
5. С метиламином взаимодействует
1) аммиачный раствор оксида серебра
2) фосфорная кислота
3) гидроксид калия
6. О хлориде фениламмония можно сказать, что это вещество
1) имеет молекулярное строение
2) обесцвечивает бромную воду
3) реагирует с соляной кислотой
4) взаимодействует со щелочами
5) хорошо растворимо в воде
6) сильное основание
7. С раствором гидроксида натрия взаимодействует
6) хлорид метил аммония
8. Про метиламин можно сказать, что это вещество
1) газообразное при обычных условиях
2) вступает в реакцию «серебряного зеркала"
3) не горит на воздухе
4) более сильное основание, чем аммиак
5) с хлороводородом образует соль
6) не растворяется в воде
9. И анилин, и метиламин реагируют с
4) азотной кислотой
5) гидроксидом калия
6) аммиачным раствором оксида серебра
10. Про диметиламин можно сказать, что это вещество
1) сгорает на воздухе
2) хорошо растворяется в воде
3) имеет немолекулярное строение
4) более сильное основание, чем анилин
6) реагирует со щелочами с образованием солей
11. Этиламин взаимодействует с
3) азотной кислотой
12. Метилэтиламин взаимодействует с
2) бромоводородной кислотой
4) гидроксидом калия
13. Этиламин взаимодействует с
14. Анилин взаимодействует с
1) гидроксидом натрия
2) бромной водой
1) имеет специфический запах
2) относится к третичным аминам
3) является жидкостью при комнатной температуре
4) содержит атом азота с неподеленной электронной парой
5) реагирует с кислотами
6) является более слабым основанием, чем аммиак
16. Диметиламин взаимодействует с
1) гидроксидом бария
3) оксидом меди(П)
5) уксусной кислотой
17. Пропиламин взаимодействует с
2) муравьиной кислотой
18. Метиламин взаимодействует с
2) бромоводородной кислотой
4) гидроксилом калия
19. Метиламин может быть получен при взаимодействии
20. Этиламин получают при взаимодействии веществ:
21. Аминоуксусная кислота взаимодействует с
1) оксидом кальция
22. И метиламин, и фениламин
1) хорошо растворяются в воде
2) имеют сильно щелочную среду водного раствора
3) реагируют с азотной кислотой
4) взаимодействуют с Са(ОН) 2
5) горят в атмосфере кислорода
6) относятся к первичным аминам
23. Практически нейтральную среду имеют водные растворы:
24. Фенолфталеин изменяет окраску в растворе
25. С аминоуксусной кислотой реагируют:
2) гидроксид натрия
3) перманганат калия
1 ) является твердым веществом
2) растворим в воде
3) относится к первичным аминам
4) взаимодействует с серной кислотой
5) взаимодействует с хлоридом натрия
6) взаимодействует с хлорметаном
27. Аланин взаимодействует с
28. С аминоуксусной кислотой реагируют
2) гидроксид натрия
3) перманганат калия
29. Водный раствор аминоуксусной кислоты взаимодействует с
Читайте также:

