Изменения приводящие к раку
Рак — это чума XXI века и один из главных кошмаров современного человека.
Лечение рака, за исключением немногих ситуаций, остается не слишком эффективным.
Поэтому понимание причин и профилактика онкозаболеваний видится единственным разумным подходом.

В западном мире с 1980-х годов большинство врачей четко осознали важность рациона питания в профилактике рака.
Благодаря нашим новым знаниям можно существенно снизить угрозу и продлить жизнь себе, своим родным и близким. Хотя экология стремительно ухудшается, мы верим: эти знания и забота победят все возможные болезни.
Наверняка среди вас, ваших друзей или врачей есть скептики, которые не придают особого значения диете в профилактике рака. Мол, ешь не ешь — все под Богом ходим. Такой точки зрения придерживались в мире полвека назад. Но время менять представления.
В 1977 в США на правительственном уровне рак был впервые причислен к заболеваниям, вызываемым неправильным питанием. Он занял место рядом с атеросклерозом и сахарным диабетом II типа. Эксперты впервые предположили, что причина рака — в диете с недостаточным содержанием клетчатки и избытком жиров.
Но рак — это сложная, многофакторная, многомерная болезнь.
В ее развитии играют роль диета, экологические воздействия, физиологическое состояние вашего организма, социальные, эмоциональные и психологические факторы. Профилактика рака должна охватывать все аспекты жизни, а не только содержимое тарелки.
Почему возникает рак?
Процесс старения увеличивает риск опухолей — это неизбежно. Риск увеличивается многократно, если стареющий человек не заботится о себе.
Неправильное питание вызывает массу функциональных проблем, таких как снижение иммунитета и замедленное восстановление поврежденных клеток.
Мы более чем уверены: вы хотите не такой профилактики.
Профилактика рака — это гораздо больше, чем просто раннее выявление опухолей.
Если не подходить к своему здоровью комплексно, каждый год в организме будут накапливаться острые и хронические проблемы. Нарушения гормональной регуляции, воспалительные процессы, хронические инфекции, дисфункция иммунной системы — буквально все это является благодатной почвой для опухолей.
Рак, как и большинство болезней, можно рассматривать как недостаток гармонии с окружающей средой и невнимательность к собственному здоровью.
Профилактика онкозаболеваний важна для каждого, но особенно при дополнительных факторах риска. Для мужчин и женщин после 40 лет. Для людей с отягощенной семейной историей, для курильщиков, любителей спиртного и фастфуда. Для тех, кто ранее подвергался воздействию радиации и других канцерогенов.
Что на самом деле вызывает рак?
Вирус или генетический код, влияние канцерогенов на клеточный аппарат или ослабленная иммунная система?
Может, неправильное питание и недостаток физической активности?
Или стресс, неврастения, депрессия?
Мы точно не знаем, как рассчитать вероятность рака. Это не простое математическое уравнение, куда можно свободно вписывать все известные факторы риска. Дискуссия о причинах онкозаболеваний может занять целую книгу — и не закончится.
Ниже мы перечислили двенадцать главных факторов риска рака. Мы подробно обсудим каждый из них, чтобы вы защитили от смертельной болезни себя и своих близких. Мы сознательно не включили в это список генетику, отвечающую за 5-10% случаев рака. Давайте сосредоточимся на том, что реально изменить нашими скромными силами.
12 вещей, которые приводят к раку
Одним из препятствий при изучении причин рака является время.
От воздействия канцерогена до развития опухоли может пройти 30-40 лет, и онкологи физически не в состоянии отследить тысячи людей на протяжении всей жизни.
Что они ели в школьной столовой?
Какие инфекции перенесли в младенчестве?
Сколько рентгеновских снимков им сделали?
Подобные исследования — титанический труд.
Но этот труд позволил очертить круг виновников и подозреваемых в возникновении рака. Каждый из вас должен ознакомиться и запомнить навсегда этот список.
Если вы хотите прожить долгую и здоровую жизнь, вырастить здоровых детей и порадоваться внукам, избегайте перечисленных факторов риска:
1. Табакокурение и марихуана
Курение усиливается такими вредными факторами, как радон, асбест, алкоголь и другие канцерогенные вещества из воздуха, воды и пищи. Регулярное курение марихуаны приводит к раку, хотя исследования в этой области продолжаются.
2. Ожирение и гиподинамия
Ожирение – это научно доказанная причина рака толстого кишечника и прямой кишки, предстательной железы, молочной железы, рака шейки матки, яичников и мочевого пузыря.
В Соединенных Штатах ожирение отвечает за 14-20% всех смертей от рака.
Никто достоверно не знает, возникает болезнь из-за лишнего жира, иммунных нарушений или сопутствующих факторов (например, психологических – полные люди более склонны к депрессии и другим расстройствам).
3. Жирная пища
Избыток жиров в рационе определенно не на пользу вашему организму. Жирная пища ассоциируется с такими заболеваниями, как рак груди, опухоли толстого кишечника и прямой кишки, рак предстательной железы и др.
Больше всего врачей беспокоят насыщенные жиры животного происхождения – мясные и молочные продукты, а также пережаренные и прогорклые растительные масла.
Прогорклые масла и продукты, приготовленные с их применением, содержат пероксиды жиров – активные молекулы, которые действуют как мутагены и канцерогены. Некоторые исследования показывают, что избыток белка в рационе коррелирует с заболеваемостью раком. Возможно, дело в том, что большинство белковых продуктов одновременно содержат много жира. А может здесь кроется что-то еще?
4. Дефицит питательных веществ
Нехватка нутриентов при строгих диетах и голодании также вредна.
Недостаточное употребление клетчатки, столь характерное для современного человека, связывают с колоректальным раком. Объясняется это просто: медленный транзит пищи через кишечник и запоры увеличивают время контакта с канцерогенными отходами.
Дефицит витамина А и бета-каротина может привести к раку легких, предстательной железы, мочевого пузыря, шейки матки, толстого кишечника, пищевода, желудка. Тревожит нехватка селена, которая ассоциируется с раком простаты, легких, раком поджелудочной железы и кишечника, кожи, груди и некоторыми видами лейкоза.
Аскорбиновая кислота нейтрализует нитрозамины и целый ряд других потенциально опасных продуктов. Дефицит витамина С может обернуться опухолями желудка и пищевода, шейки матки, мочевого пузыря и других внутренних органов.
Дефицит витамина Е нарушает способность нашего организма инактивировать пероксиды и другие агрессивные молекулы. В результате повреждения клеток нарастают, увеличивается риск мутаций. Нехватку токоферола связывают со многими онкозаболеваниями.
Наконец, цинк участвует в синтезе жизненно важного гормона иммунной системы – тимулина. Он регулирует активность иммунной системы, регенерацию клеток и тканей. Дефицит цинка ассоциируется с раком простаты, кишечника, пищевода и легких.
Нехватку молибдена называют причиной рака желудка и пищевода.
Под подозрением онкологов – дефицит йода и железа.
5. Канцерогенные вещества на производстве
Многие из нас половину жизни проводят на своем рабочем месте, поэтому канцерогенные вещества, излучения и другие факторы на производстве – это очень важно.
Только в Соединенных Штатах ежегодно диагностируется 48-50 тысяч онкозаболеваний, связанных с профессиональными вредностями – это 3% всех случаев рака. По нашей стране отсутствуют объективные цифры, которым можно доверять. Остается догадываться.
Наиболее распространенные канцерогены на производстве:
• Древесная пыль
• Выхлопные газы
• Выбросы коксовых печей
• Средства для химической чистки
• Каменноугольная смола и ее производные
• Бензин, нефтепродукты и другие углеводороды
• Сырье для производства косметики
• Анилиновые красители
• Динитротолуолы
• Поливинилхлорид
• Пестициды
• Хроматы
• Бензол
• Асбест
• Мышьяк
• Никель и др.
Полный список промышленных канцерогенов сегодня насчитывает тысячи химических веществ и постоянно расширяется благодаря новым исследованиям. Среди производств, которые вызывают рак: деревообработка, химчистка, выплавка алюминия и стали, нефтепереработка, добыча угля и др. Воздействие вредных веществ на рабочем месте ослабляет организм и вызывает онкогенные мутации.
6. Пищевые канцерогены
Пищевые канцерогены представляют наибольшую угрозу для нашего здоровья.
Потенциально опасные вещества добавляются в продукты при выращивании, производстве, готовке. Некоторые сами образуются в пище во время ее хранения, при контакте с воздухом, упаковкой, окружающими продуктами или микроорганизмами.
Возможные пищевые канцерогены:
• Сахар: может ослаблять иммунную систему
• Пестициды, распыляемые до и после сбора урожая
• Гормоны: DES, IGF и другие факторы роста для животных
• Добавки: пищевые красители, ароматизаторы, нитраты и нитриты
• Сахарин: возможная причина возникновения рака мочевого пузыря
• Картофель: зеленые и поврежденные части корнеплода канцерогенны
• Маринованные или соленые продукты: причина рака желудка и пищевода
• Кофе без кофеина: возможная причина опухолей мочевого пузыря. Декофеинизированный напиток обрабатывают трихлорэтиленом и метилхлоридом.
• Афлатоксин: продукт плесневых грибков, паразитирующих на арахисе и чечевице; вероятная причина гепатоцеллюлярной карциномы – рака печени
• Нитраты и нитриты: содержатся в консервированном и копченом мясе, таком как ветчина, салями, солонина, хот-доги и бекон; могут превращаться в нитрозамины
• Жареное мясо: обугленные части мяса содержат бензопирен, легкий канцероген. Аналогичные риски несут подгоревшие тосты и выпечка
• Грибы: некоторые виды могут содержать токсичные гидразины
• Другие продукты: хлопковое масло, какао, горчица, черный перец, хрен, фавола, петрушка, сельдерей, побеги люцерны, пастернак и инжир.
7. Загрязнение воздуха и воды
Водные источники безнадежно загрязнены деятельностью человека: даже на необитаемом острове вдали от цивилизации запросто можно встретить пластиковую бутылку. Но гораздо опаснее невидимое загрязнение воды на молекулярном уровне. Соли тяжелых металлов, пестициды, винилхлорид, тетрахлорметан, фосфаты – все это плещется в чашке вашего утреннего кофе, откладываясь в печени, костях, жировой ткани.
Зловонное дыхание промышленных городов насыщает легкие и кровь канцерогенными микрочастицами пыли, выхлопными газами, соединениями серы, азота, металлов.
8. Избыток солнечного света
Солнце – наш друг. Под его лучами расцветают бесчисленные формы жизни, наливается соками долгожданный урожай, образуется бесценный для нашего роста витамин D. Но с этим другом следует быть осторожными. Избыток ультрафиолетового излучения увеличивает риск меланомы и базалиомы – основных типов рака кожи.
Бледная кожа, отбеливающая косметика, дефицит нутриентов, разрушение озонового слоя планеты – все это усиливает канцерогенный потенциал солнечных лучей.
Антибактериальный препарат метронидазол (трихопол) также увеличивает риск онкозаболеваний, как и гексахлоран (линдан) – средство от чесотки. Противогрибковый препарат гризеофульвин предрасполагает к нескольким видам рака.
Стероидные гормоны, которые способны радикально изменять нашу физиологию, несут колоссальный канцерогенный потенциал. Особенно при бесконтрольном приеме off label.
10. Алкоголь вызывает рак
Спиртное непосредственно повреждает клетки слизистых, с которыми контактирует при попадании в организм. Алкоголь – причина рака полости рта, гортани, пищевода, желудка и поджелудочной железы. Этот риск умножается в сочетании с курением и плохим питанием.
11. Канцерогенные вирусы
О роли вирусных инфекций в развитии рака люди узнали сравнительно недавно. На протяжении многих лет генитальный герпес считается причиной рака шейки матки, а сегодня известно имя другого виновника – папилломавирус человека (ВПЧ).
Но почему одни живут с ВПЧ десятилетиями, а у других развивается болезнь?
Цитомегаловирус и вирус Эпштейша-Барр (ЭБВ) также считаются факторами риска рака. Они вызывают клеточные мутации, участвуя в возникновении лимфомы и лейкозов.
12. Психологические факторы рака
Пожалуй, наиболее противоречивая часть нашего списка. Тем не менее эта область обрастает все новыми исследованиями. В очевидных случаях тяжелая потеря или стресс происходит буквально за 1-2 года до диагноза рак. В других случаях для развития болезни требуются десятилетия, что дает ученым серьезную работу.
Есть данные, что на фоне психоэмоционального стресса увеличивается вероятность возникновения агрессивных опухолей. Считается также, что заболеваемость раком выше у людей одиноких, которым сложно создавать межличностные связи или выражать чувства.
Проблема одиноких и замкнутых людей – невозможность поделиться эмоциями.
Если жизнь ставит перед ними тяжелое испытание – потерю работы, развод, смерть близкого человека – переполняющее чувство беспомощности и безнадежности может вызвать ослабление иммунной системы. Мы уже знаем, что за этим следует…
Исследования показывают, что злобные и жесткие люди, которые с удовольствием изрыгают негативные эмоции на других, намного лучше справляются с раком, восстанавливаются быстрее и чаще по сравнению с пассивными, сдержанными и замкнутыми людьми.
Вместо послесловия
Из всего вышесказанного можно понять, что рак – сложная болезнь. Сложная для исследований, понимания, диагностики и лечения. Человек, который боится рака, должен бояться буквально всего на свете – каждая опухоль имеет свои причины и факторы риска.

Среди причин рака есть много общего – то, что вызывает неконтролируемый рост аберрантных клеток и подвергает опасности здоровые ткани. Но каждый случай болезни индивидуален, и каждый вызван сочетанием сразу нескольких факторов.
Помня о 12 причинах рака, вы сведете к минимуму угрозу, которая сегодня настигает каждого четвертого жителя Земли и затрагивает практически каждую семью:
1. Больше двигайтесь и контролируйте свой вес.
2. Не курите и не позволяйте другим курить рядом с собой.
3. Избегайте канцерогенных химикатов на производстве и в быту.
4. Живите там, где можно дышать чистым воздухом и пить чистую воду.
5. Не пользуйтесь соляриями и берегитесь палящего солнца.
6. Не летайте, если можно воспользоваться наземным транспортом.
7. Делайте рентген и компьютерную томографию только при необходимости.

Рак – не рок. Вопреки распространённому мнению, развитие злокачественных процессов в организме лишь на 15% зависит от наследственности. С помощью здорового образа жизни можно предотвратить значительную часть раковых заболеваний.
К таким факторам относятся
Курение – около 50% мужчин в России курят, а это основная причина развития рака лёгких, пищевода, желудка, языка, губы и глотки.
Малоподвижный образ жизни – в сочетании с избыточным питанием приводит к лишнему весу и ожирению, которые нарушают гормональный фон и обмен веществ. Это приводит к клеточным мутациям, повышающим риск развития 12 видов рака (пищевода, щитовидной железы, желудка, печени, почки, головного мозга, поджелудочной и молочной желёз, желчного пузыря, эндометрия, яичников и толстой кишки).

Жирная, острая и копчёная пища – регулярное употребление острых и солёных блюд с обилием острых приправ может привести к возникновению язвы желудка, которая считается предшественницей рака желудка.
Избыток красного мяса в рационе – одна из причин возникновения колоректального рака.
Избыточное воздействие ультрафиолета – главного виновника развития меланомы (одного из самых агрессивных злокачественных новообразований, которое быстро даёт метастазы). Ультрафиолет имеет 2 спектра, один из них повреждает клетки ДНК, что может привести к развитию меланомы. Особенно опасно пребывание на солнце для людей с большим количеством родинок или с гигантскими пигментными пятнами (невусами более 20 см в объёме), с наследственной предрасположенностью (у них могут быть мутации в генах, увеличивающие риск развития этого рака) и детей до 3 лет (солнечные ожоги в таком возрасте повышают риск болезни в будущем).
Вирус папилломы человека – самая распространённая вирусная инфекция половых путей, которая в 70% случаев вызывает рак шейки матки. Для предотвращения риска развития этого заболевания в мире всё чаще проводят вакцинацию от ВПЧ. Обычно прививку делают девочкам в возрасте с 9 до 15 лет. Но есть вакцины, которыми можно прививать до 45 лет.
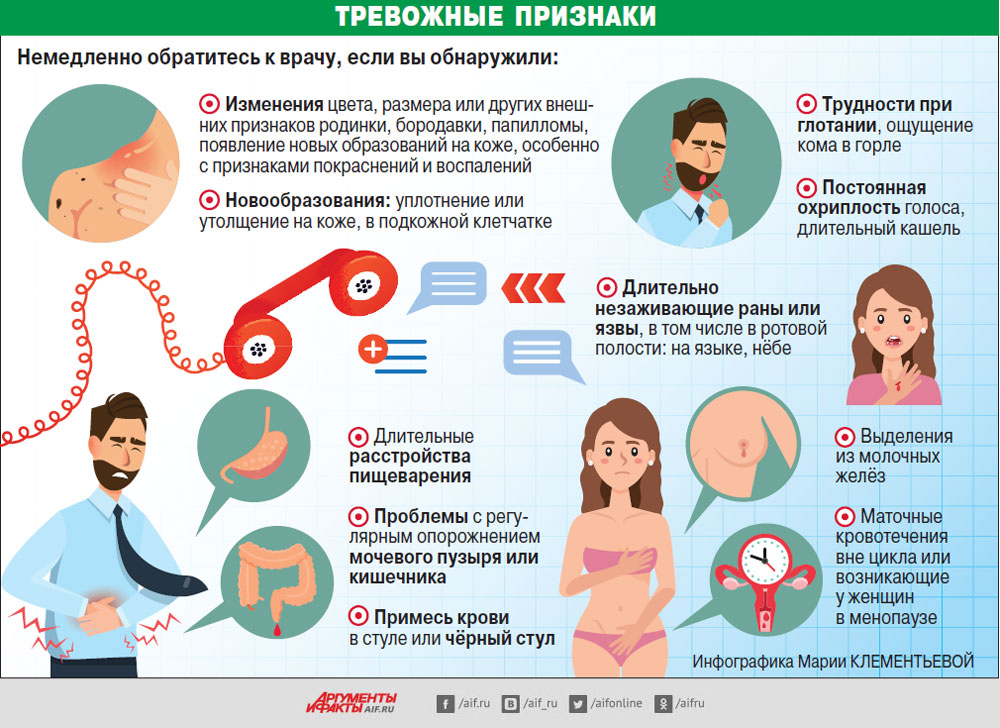
Настороженность превыше всего!
Существует ряд заболеваний, которые требуют регулярного посещения врача (см. Кстати).
Строго по графику
Чтобы выявить онкологические заболевания на ранней стадии (когда лечение максимально эффективно), необходимо проходить все скрининги и исследования, включённые в программу диспансеризации.
Первый этап диспансеризации
1. Шейка матки (у женщин): осмотр врачом-гинекологом (от 18 лет и старше – 1 раз в год), взятие мазка, цитологическое исследование (от 18 до 64 лет – 1 раз в 3 года).
2. Молочные железы (у женщин): маммография (от 40 до 75 лет – 1 раз в 2 года).
3. Предстательная железа (у мужчин): определение простатспецифического антигена в крови (в возрасте 45, 50, 55, 60 и 64 лет).
4. Толстый кишечник и прямая кишка: исследование кала на скрытую кровь (от 40 до 64 лет – 1 раз в 2 года, от 65 до 75 лет – 1 раз в год).
5. Пищевод, желудок и двенадцатиперстная кишка – эзофагогастродуоденоскопия в возрасте 45 лет.
6. Осмотр на выявление визуальных и иных локализаций онкологических заболеваний, включающий осмотр кожных покровов, слизистых губ и ротовой полости, пальпацию щитовидной железы, лимфатических узлов.

Второй этап диспансеризации (проводится при наличии показаний, по назначению врача)
1. Лёгкие: рентгенография лёгких или компьютерная томография лёгких.
2. Пищевод, желудок и двенадцатиперстная кишка: эзофагогастродуоденоскопия.
3. Толстый кишечник и прямая кишка: ректороманоскопия, колоноскопия.

Кстати
Заболевания, требующие регулярного врачебного наблюдения:
- Хронические воспалительные заболевания полости рта
- Хронический бронхит
- Анацидный хронический гастрит, полипы, язва желудка
- Воспалительные заболевания почек и мочевого пузыря
- Периодические запоры, воспалительные заболевания прямой кишки
- Миомы матки, эндометриоз, нарушения менструального цикла
- Мастопатии
- Хронический панкреатит
- Хронические заболевания печени и желчного пузыря
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.

Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
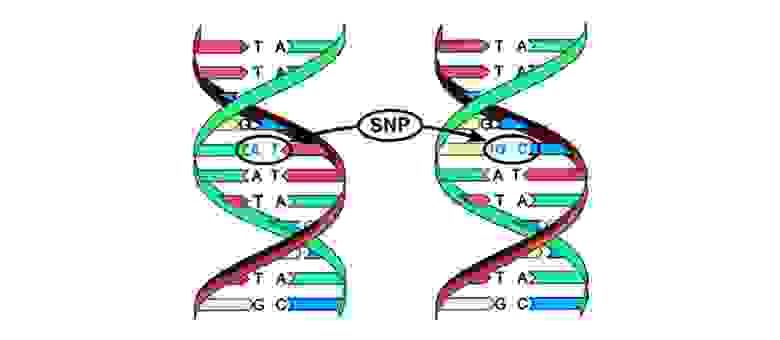
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
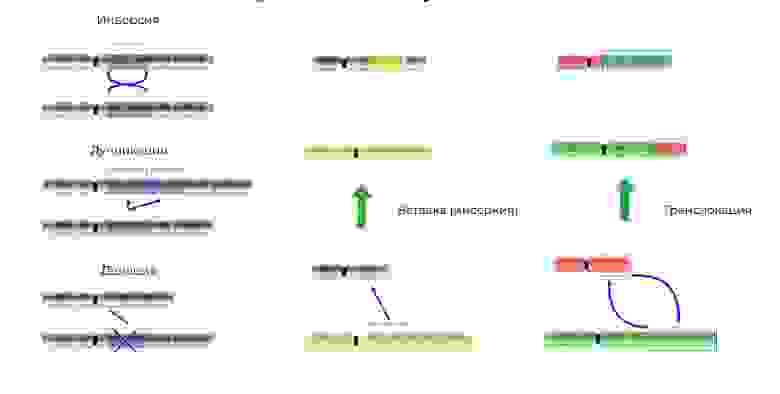
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
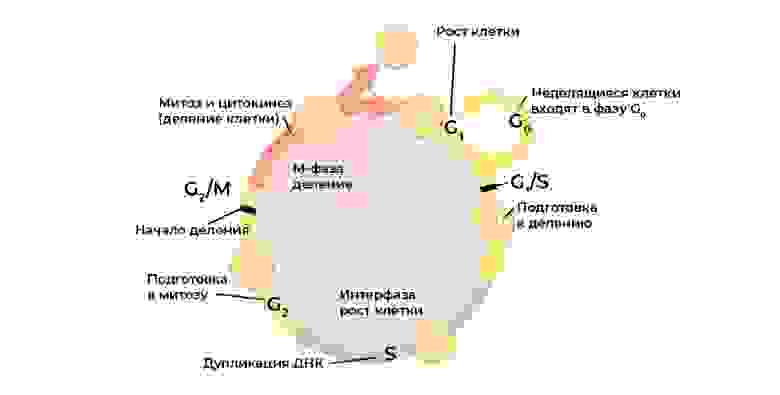
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
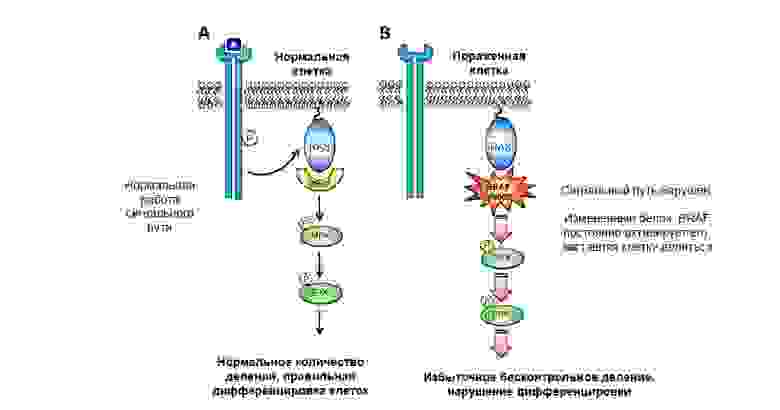
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
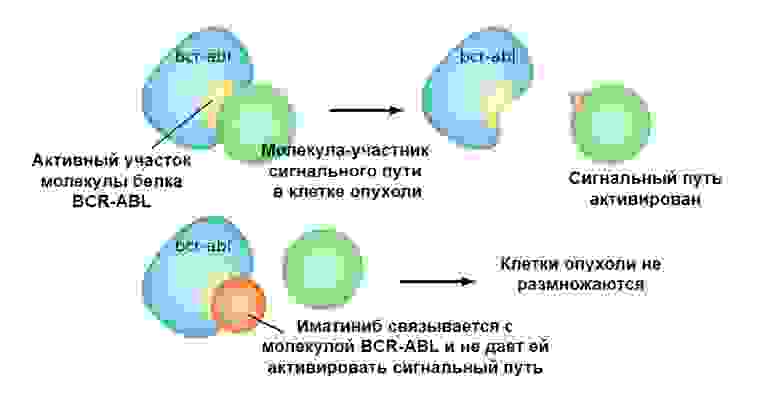
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:

