Истинная полицитемия с исходом в миелофиброз
ПОЛИЦИТЕМИЯ
Полицитемия, впервые описанная в начале XIX столетия, характеризуется увеличением числа эритроцитов, уровня гемоглобина и общего объема эритроцитов (ООЭ). Существует две основные формы полицитемии — истинная и относительная (табл. 47). Масса эритроцитов увеличивается только при истинных полицитемиях. Это явление наблюдается в двух ситуациях: при первичной истинной полицитемии и при вторичной полици темии. Последняя обычно возникает в результате повышения активности эритропоэтина, что может быть следствием как соответствующей физиологической реакции на сниженное насыщение крови кислородом, так и неадекватной продукции гормонов. При относительной полицитемии масса эритроцитов не превышает нормальный уровень, а увеличение ООЭ является следствием аномального снижения объема плазмы или же увеличения числа эритроцитов и снижения объема плазмы в пределах нормальных значений этих параметров.
Таблица 47. Классификация полицитемий
· хроническое заболевание легких
· заболевание почек — например, опухоли, кисты (единичные или множественные), гидронефроз
· опухоли — например, гемангиома мозжечка, фиброма матки
· другие причины — например, подъем на высоту, аномальные гемоглобины, курение
Относительная полицитемия (называется также ложной, стрессовой, псевдоцитемией, синдромом Гайсбека)
Истинная полицитемия — хроническое прогрессирующее миелопролиферативное заболевание, которое характеризуется абсолютным увеличением массы эритроцитов; у 2/3 больных наблюдается также увеличение числа лейкоцитов и тромбоцитов.
Заболевание возникает в результате мутации полипотентной стволовой клетки. Исследования костного мозга in vitro , а также изучение вариантов глюкозо-6-фосфатдегидрогеназы у женщин, больных истинной полицитемией, указывают на присутствие при этом заболевании двух популяций эритроидных клеток-предшественников. Клетки одной из популяций автономны и пролиферируют даже в отсутствие эритропоэтина, тогда как другая популяция ведет себя нормально, оставаясь эритропоэтинзависимой. Таким образом, первая популяция скорее всего представляет собой автономный мутантный клон [ Adamson , 1970; Golde , 1977].
Уровни эритропоэтина в моче и плазме больных истинной полицитемией колеблются от нормальных величин до нуля, увеличиваясь соответствующим образом после кровопускания. Низкие уровни эритропоэтина обусловлены ингибицией его выработки по типу обратной связи вследствие увеличения эритроцитарной массы.
Распространенность
Истинная полицитемия — редкое заболевание. Американские исследователи показали, что ежегодно регистрируется 4—5 новых случаев на 1 млн населения [ Modan , 1965]. Болезнь поражает людей среднего и пожилого возраста, пик заболеваемости приходится на возрастную группу 50—60 лет. Средний возраст впервые заболевших постепенно увеличился с 44 лет в 1912 г. до 60 лет в 1964 г. Мужчины болеют несколько чаще, чем женщины (1,5: 1). Влияние расовых факторов спорно. Modan (1965) обнаружил, что среди евреев заболеваемость выше ожидаемой, а среди негров ниже, однако эти наблюдения не были подтверждены.
Клинические проявления
Симптомы этой болезни обусловлены отчасти избыточной продукцией эритроцитов и тромбоцитов, что приводит к увеличению вязкости крови и сосудистым тромбозам, а отчасти увеличением объема циркулирующей крови, которое приводит к повышению кровенаполнения различных органов.
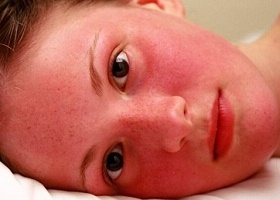
Болезнь развивается исподволь, причем настолько медленно, что диагноз может быть поставлен случайно при обследовании пациента по поводу совсем другой болезни. Симптомы часто неспецифичны, например головная боль, головокружения, шум в ушах, рассеянность, раздражительность, ухудшение зрения, их легко можно объяснить преклонным возрастом или другими, чаще встречающимися у пожилых заболеваниями. Однако полицитемия может быть заподозрена по внешнему виду пациента — красный цвет кожи и слизистых оболочек с цианотичным оттенком в холодную погоду, телеангиэктазии на лице, гиперемия склер и сетчатки. Селезенка в большинстве случаев умеренно увеличена, печень, как правило, увеличена незначительно. Иногда отмечается болезненность в области грудины.
Основные признаки болезни проявляются при возникновении тромбозов или, что бывает реже, кровотечений. Чаще всего поражаются сосуды центральной нервной системы, что приводит к возникновению транзиторных ишемических нарушений, цереброваскулярных катастроф и нарушений зрения в виде скотомы, диплопии и временной слепоты. В результате поражения сердечно-сосудистой системы могут возникать одышка при физической нагрузке, стенокардия и инфаркт миокарда. Поражения периферических сосудов проявляются эритромелалгией, артериальными и венозными тромбозами, феноменом Рейно и даже гангреной. При нарушении кровоснабжения желудочно-кишечного тракта возникают изменения пищеварения, метеоризм, а у 1 из 10 больных — пептические язвы. Тромбоз системы порталь ных вен приводит к портальной гипертензии и кровотечениям из варикозных вен пищевода.
Примерно у 1 из 10 больных, обычно мужчин, обнаруживаются клинические признаки подагры, тогда как гиперурикемия наблюдается у 1/3 всех больных и обусловлена усиленным синтезом и разрушением нуклеопротеидов. Частота этих осложнений возрастает по мере увеличения длительности заболевания. В почках могут образовываться камни, а в суставах — подагрические отложения. В семейном анамнезе таких больных подагра отмечается редко.
Примерно 2/3 больных страдают генерализованным зудом, который возникает, по-видимому, в результате выделения гистамина из базофильных гранулоцитов. Особенно мучителен зуд кистей рук и стоп, он усиливается после мытья и в теплой постели.
Лабораторные данные
Число эритроцитов увеличено до 6,5—7,5 · 10 12 /л. Уровень гемоглобина повышен до 180—240 г/л. ООЭ обычно выше 0,52. Поскольку на основании измерения гемоглобина, ООЭ и числа эритроцитов точно рассчитать массу эритроцитов невозможно, ее следует измерять прямым способом с применением радионуклидной метки. Масса эритроцитов, превышающая 36 мл/кг у мужчин и 32 мл/кг у женщин указывает на наличие полицитемии.
В мазке периферической крови эритроциты имеют нормальную морфологию, однако из-за часто встречающегося дефицита железа, обусловленного повторными кровопусканиями или кровоточивостью, может наблюдаться микроцитоз. Число лейкоцитов увеличено до 12—30 · 10 9 /л примерно у 2/3 больных, более высокий лейкоцитоз встречается на поздних стадиях болезни.
Иногда наблюдается незначительный сдвиг лейкоцитарной формулы влево, изредка в периферической крови обнаруживаются метамиелоциты, миелоциты или даже клетки более ранних стадий.
Активность щелочной фосфатазы лейкоцитов (ЩФЛ) увели чена. У 70—90 % больных активность ЩФЛ достигает 100—350, однако в некоторых случаях, особенно на ранних стадиях болезни, она остается в пределах нормы.
Содержание тромбоцитов в момент постановки диагноза по вышено у 65 % больных и достигает 400—800 · 10 9 /л. Очень редко наблюдаются и гораздо более высокие величины. Иногда обнаруживаются морфологические и функциональные аномалии. Тромбоциты могут быть увеличены в размерах и иметь причудливую форму; иногда наблюдаются фрагменты мегакариоцитов. Функциональные нарушения тромбоцитов, вероятно, являются основной причиной геморрагических осложнений, встречающихся при этой болезни. Содержание витамина Bj 2 в сыворотке и ее способность связывать этот витамин часто повышены.
Костный мозг гиперплазирован. Эритропоэз нормобластный. Края нормобластов могут быть зазубрены, а цитоплазма вакуолизирована, что особенно часто встречается у пациентов, леченных кровопусканиями, и свидетельствует о дефиците железа. Выявляемое методами окраски свободное железо может совершенно отсутствовать. Иногда обнаруживается гиперплазия и предшественников гранулоцитарного ряда, а также увеличение числа мегакариоцитов. Основные гематологические признаки истинной полицитемии суммированы в табл. 48.
Таблица 48. Гематологические изменения при истинной полицитемии
У больных истинной полицитемией описаны хромосомные аномалии, которые, однако, встречаются нечасто. Кроме того, многие пациенты получают миелодепрессивную терапию, и поэтому трудно определить, в какой мере эти аномалии обусловлены лечением и в какой — самой болезнью.
Течение и прогноз
В течении заболевания различают три фазы. В начальной фазе, длящейся несколько лет, симптомы отсутствуют или выражены слабо. В следующей эритремической фазе развиваются классические симптомы и основные осложнения. Именно в этой фазе, которая также может продолжаться несколько лет, умирает большая часть больных. Затем наступает третья фаза, характеризующаяся возникновением миелосклероза или реже — лейкоза. Частота лейкозов выше среди больных, получавших алкилирующие препараты, и, возможно, также у леченных радиоактивным фосфором.
Срок выживаемости при адекватном лечении значительно удлинился, особенно это касается молодых пациентов. Средняя продолжительность жизни от момента постановки диагноза составляет 13 лет. Основной причиной смерти остаются сосудистые осложнения. Независимо от вида терапии прогноз наиболее неблагоприятен у больных пожилого возраста, а также в случаях возникновения тяжелых осложнений.
Целью лечения является уменьшение вероятности возникновения сосудистых осложнений путем снижения ООЭ и поддержания его на оптимальном уровне, а также борьбы с сопутствующим тромбоцитозом. Существующие способы достижения этой цели противоречивы и будут оставаться таковыми до тех пор, пока не удастся решить вопрос о том, что в картине заболеваний обусловлено самим его течением, а что является следствием ранее проводившегося лечения.
Быстрое симптоматическое улучшение достигается в результате кровопускания. Эту процедуру у больных пожилого возраста следует проводить с большой осторожностью, помня о том, что такие больные часто страдают цереброваскулярными и сердечно-сосудистыми болезнями. Рекомендуется дважды в неделю удалять по 200—300 мл крови до тех пор, пока ООЭ не снизится до желаемого уровня. Поскольку риск возникновения сосудистых поражений сохраняется и при незначительном увеличении ООЭ, следует добиваться снижения этого показателя до 0,45. В тех случаях, когда уменьшение объема крови представляется опасным, вместо удаленной крови можно ввести равный объем высокомолекулярного декстрана. Проведя начальный курс лечения, необходимо наблюдать за скоростью роста ООЭ. Если она невелика, и больной лишь изредка нуждается в кровопусканиях, то вплоть до возникновения проблем, связанных с тромбоцитемией, никакого иного лечения не требуется. Следует иметь в виду, что кровопускания приводят к развитию железодефицитной анемии, которая сама по себе сопровождается соответствующими симптомами и увеличением содержания тромбоцитов.
Поддерживать на необходимом уровне количество эритроцитов с помощью кровопусканий удается не всегда, поскольку они не подавляют продукцию этих клеток в костном мозге. В таких случаях приходится прибегать к миелодепрессивной терапии. К сожалению, проведение лекарственной терапии у пожилых может быть связано со значительными трудностями практического порядка, а также с проблемами, касающимися соблюдения больными назначенного лечения. В связи с этим желательно начинать лечение с внутривенного введения 32 Р в дозе 185— 259 МБк. Для достижения максимального эффекта такого лечения требуется от 2 до 3 мес, поэтому в этот промежуточный период необходимо бывает делать кровопускания. Иногда для достижения полной ремиссии спустя 3 мес приходится вводить вторую, меньшую, дозу 32 Р . Лечение с помощью 32 P позволяет удовлетворительно контролировать состояние более чем 75 % больных, а ремиссия может продолжаться 2 года или даже дольше.
Применение радиоактивного фосфора является методом выбора при лечении пожилых пациентов, однако больных, длительно находящихся в лечебных учреждениях закрытого типа, можно лечить и алкилирующими препаратами; в этих условиях проще решать проблемы, связанные с соблюдением назначенного лечения и наблюдением за состоянием больного. Используют разные препараты, в том числе миелосан, хлорбутин и циклофосфан, причем препаратом выбора является хлорбутин, поскольку он вызывает меньше побочных эффектов. Миелосан способен снижать уровень тромбоцитов, благодаря чему его целесообразно применять у больных с выраженным тромбоцитозом. Его вводят в дозах 4—6 мг/сут до тех пор, пока содержа ние лейкоцитов и (или) тромбоцитов не снизится на 50 %. После этого дозу уменьшают вдвое, а затем, при падении числа тром боцитов до 250-10 9 /л или лейкоцитов до 10 · 10 9 /л, миелосан во обще отменяют. ООЭ снижается медленнее, поэтому в начале курса химиотерапии необходимо проводить регулярные кровопускания. Миелосан может вызывать необратимые повреждения стволовых клеток и как следствие этого — стойкую тяжелую нейтропению и тромбоцитопению, поэтому его следует применять с большой осторожностью. Лечение миелосаном сопровождается большой смертностью. Достигнутая ремиссия может длиться несколько месяцев и даже лет. Курс миелосана не должен быть слишком длительным, иначе могут возникнуть необратимые панцитопения, кожная пигментация и пневмофиброз. Мельфалан в первые 5 дней назначают в дозе 4—8 мг, затем дозу снижают до 2 мг трижды в неделю в течение 4 нед. Если спустя 1 мес от начала лечения уровни лейкоцитов и тромбоцитов остаются высокими, месячный курс повторяют, и такую терапию продолжают до нормализации уровней тромбоцитов и лейкоцитов. При лечении мельфаланом рецидив часто возникает в течение 5—6 мес, т. е. гораздо быстрее, чем после лечения миелосаном. Хлорбутин используют в дозе 2—4 мг/сут, продолжая курс до нормализации содержания клеток крови.
Больным с симптомами гиперурикемии назначают аллопуринол в дозе 300 мг/сут. Его следует также назначить с профилактической целью после лечения 32 Р или химиотерапии. Острый приступ подагры следует лечить нестероидными противовоспалительными препаратами.
Особенно сложна борьба с зудом. Обычно он стихает, когда удается взять под контроль полицитемию. Антигистаминные вещества не очень эффективны, а ответ на другие препараты, на пример холестирамин и циметидин, непостоянен и скорее не удовлетворителен. Однако при мучительном зуде имеет смысл прибегнуть к этим лекарствам. Больным с зудом рекомендуется избегать воздействий, усиливающих его, например высоких температур.
Как только удается поставить полицитемию под контроль, транзиторные симптомы поражений периферических сосудов быстро стихают, что позволяет избежать хирургических вмешательств. Необходимость в операции возникает при стойком характере симптомов, даже если достигнут надежный контроль гематологических параметров.
Вторичные полицитемии обычно являются следствием повышения активности эритропоэтина, что в свою очередь обусловлено либо соответствующей реакцией на сниженное насыщение крови кислородом, либо неадекватно высокой продукцией этого гормона. Причины этих явлений довольно многочисленны (табл. 47), однако большинство из них очень редко встречается у пожилых.
Наиболее частой причиной возникновения вторичной полицитемии у лиц старших возрастных групп является хроническое заболевание легких. Однако полицитемия возникает не во всех случаях хронической гипоксии. У многих больных с заболеванием легких и снижением парциального давления кислорода в артериальной крови ООЭ находится в пределах нормы, причем у большинства из них повышен уровень эритропоэтина. Удовлетворительного объяснения этому факту нет. Высказывалось предположение, что эритропоэз может быть снижен вследствие хронической инфекции. Спленомегалия отсутствует. Показано, что кровопускание способствует улучшению состояния больных с хроническим легочным заболеванием, имеющих чрезвычайно высокий ООЭ (выше 0,70). Вместе с тем лечение должно определяться причиной, обусловившей развитие вторичной полици темии. Отличительные признаки полицитемии, вторичной полицитемии, вызванной гипоксией, и относительной полицитемии представлены в табл. 49.
Семейная полицитемия встречается редко и обычно обусловлена присутствием аномального гемоглобина с высоким аффинитетом к кислороду. Нормальная величина Р5о составляет 3,3— 3,6 кПа. Для аномальных гемоглобинов этот показатель равняется примерно 1,6 кПа.
Таблица 49. Типичные признаки истинной полицитемии, вторичной полицитемии при гипоксии и относительной полицитемии
Общие сведения
Патогенез
Истинная полицитемия – это клональная неопластическая болезнь, основой которой является процесс трансформации кроветворной стволовой клетки. Вследствие дефекта такой клетки происходит соматическая мутация в гене янускиназы рецепторов цитокинов. Это приводит к пролиферации миелоидных ростков кроветворения, в основном эритроцитарного, что повышает риск развития тромбозов и тромбоэмболий.
Продолжительная пролиферация гемопоэтических клеток провоцирует развитие фиброза и замещение костного мозга коллагеновыми волокнами, вследствие чего развивается вторичный постполицитемический миелофиброз. В некоторых случаях прогрессирование болезни продолжается, и она переходит в фазу бластной трансформации.
Характерным симптомом заболевания является наличие скоплений полиморфных мегакариоцитов, как небольших, так и гигантских.
В ходе развития заболевания отмечается повышение массы циркулирующих эритроцитов, увеличивается гематокрит, становится выраженной вязкость крови, существенно возрастает уровень гемоглобина. Вследствие перечисленных факторов и тромбоцитоза нарушается микроциркуляция и происходят тромбоэмболические осложнения. К процессу присоединяется миелоидная метаплазия селезенки.
У достаточно существенной части больных на стадии миелофиброза определяются хромосомные аномалии.
Классификация
Отмечается две формы полицитемии – истинная и относительная.
Истинная эритремия, в свою очередь, может быть первичной и вторичной.
Относительная форма болезни отмечается, если уровень эритроцитов нормальный, но понижается объем плазмы. Это состояние также называют ложной или стрессовой полицитемией.
Причины
До сих пор причины эритроцитоза точно не определены. В настоящее время ученые подтвердили, что причины развития заболевания связаны с наследственным фактором.
Кроме того, спровоцировать развитие этой болезни могут такие внешние факторы:
- Воздействие на организм токсических веществ — лаков, красок, химических инсектицидов.
- Продолжительный прием некоторых лекарств – антибиотиков, препаратов золота.
- Перенесенный туберкулез, некоторые вирусные заболевания.
- Влияние радиоактивного излучения.
Симптомы полицитемии
По мере развития заболевания симптомы болезни Вакеза видоизменяются. Симптомы истинной полицитемии зависят от стадии заболевания. Медики выделяют четыре стадии болезни, отображающие те патологические изменения, которые происходят в селезенке и в костном мозге.
- Первая стадия – начальная. Она может продолжаться пять и больше лет. В этот период отмечается умеренный эритроцитоз и умеренная плетора, селезенка на этой стадии не пальпируется. В костном мозге отмечается панмиелоз. Есть невысокая вероятность сосудистых и тромботических осложнений. Внешне проявляется акроцианоз, плетора, эритромелалгии (парестезии и жжение в кончиках пальцев), зуд кожи после мытья. Когда увеличивается общий объем циркулирующей крови, развивается артериальная гипертензия. При этом лечение гипотензивными средствами людей, которые ранее не страдали гипертензией, является неэффективным. Постепенно развиваются проявления церебрального атеросклероза, ишемической болезни сердца. Больные жалуются на головные боли, болезненность в пальцах при движении.
- Вторая стадия – развернутая, эритремическая. Может отмечаться на протяжении 10-15 лет. Если эта стадия протекает без миелоидной метаплазии селезенки, то у больного нарушается общее состояние, отмечается выраженная плетора, панмиелоз. Высока вероятность тромботических осложнений – некрозовкончиков пальцев, инсульта, инфаркта. Больного могут беспокоить боли в костях, руках и ногах. Если у больного отмечается миелоидная метаплазия селезенки, наблюдаются гепатоспленомегалия и панмиелоз. Умеренно выражена плетора, повышена кровоточивость. Вероятны тромботические осложнения. Кожные покровы становятся багрово-синими, беспокоят жгучие боли в кончиках пальца, мочках ушей. Возможно нарушение чувствительности. Могут беспокоить боли в подреберье вследствие увеличения печени и селезенки, вероятна кровоточивость десен, боли в суставах, язвенные нарушения ЖКТ.
- Третья стадия – анемическая. Это терминальный период, в котором развивается анемический синдром, выраженный миелофиброз. Увеличивается печень, селезенка. Нарастает коллагеновый миелофиброз в костном мозге. Нарастают кахексия и спленомегалия, отмечаются проявления плеторы, а также осложнения, спровоцированные тромбозом. Происходят кровоизлияния в разных органах, усугубляется выраженность общих симптомов.
Таким образом, истинная эритремия может провоцировать следующие симптомы:
Анализы и диагностика
Для установления диагноза проводят лабораторный анализ крови и дополнительные обследования (УЗИ, КТ). Чтобы правильно установить диагноз, врачи оценивают показатели анализа крови. Эритремия определяется, если в наличии есть определенные показатели, основные и дополнительные. Подозрение на эритремию возникает, если в общем анализе крови есть отклонения, в частности, повышен гемоглобин (больше 18,5 г/дл у мужчин, больше 16,5 г/дл у женщин). Обращается внимание и на ряд других показателей (эритроцитоз, тромбоцитоз, иногда – панцитоз).
Главными критериями для установления такого диагноза являются:
- Увеличение количества эритроцитов (у мужчин — выше 36 мл/кг, у женщин — выше 32 мл/кг).
- Нормальное насыщение кислородом артериальной крови (более 92%).
- Спленомегалия.
Дополнительными критериями являются:
- Лейкоцитоз (выше 12 х 109/л без признаков инфекции).
- Тромбоцитоз (выше 400 х 109/л).
- Повышенный уровень витамина В12 (выше 900 пг/мл).
- Активность щелочной фосфатазы.
Анализируются также другие лабораторные показатели. Для подтверждения диагноза оценивают гистологическую картину головного мозга.
Кроме того, важное значение при установлении диагноза имеют такие факторы:
- Характерная внешность пациента – наличие специфической окраски кожи и слизистых.
- Увеличенная селезенка, печень.
- Склонность к образованию тромбов.
- Наличие общих симптомов, характерных для истинной полицитемии.
Дифференциальную диагностику проводят с вторичными эритроцитозами.
Лечение полицитемии
Лечение проводят так, чтобы снизить вязкость крови у больного и максимально уменьшить риск серьезных осложнений – образования тромбов и кровотечений.
Наиболее часто истинная полицитемия завершается развитием миелофиброза с миелоидной метаплазией (МММ) селезенки. Частота этого исхода составляет 15—20 %, но у проживших более 20 лет она увеличивается до 30 % и более. МММ завершает эритремическую стадию истинной полицитемии. Это естественная эволюция заболевания для всех больных, если они не умирают от тромбозов сосудов, острого лейкоза, других неоплазий, сопутствующих заболеваний и висцеральных осложнений. Продолжительность эритремической стадии в среднем составляет 10—15 лет, но не являются редкостью и более короткие, и более продолжительные ее сроки (в отдельных собственных наблюдениях до 20—25 лет).
Патоморфодинамика этого исхода хорошо изучена с помощью прижизненной трепанобиопсии подвздошной кости и пункции селезенки, патофизиология — с помощью радиологических методов исследования.
Миелоидная метаплазия селезенки (ММС) развивается еще в эритремической (2Б) стадии заболевания и со временем приводит к значительной сплено-мегалии. Обычно она носит трехростковый характер с преобладанием эритропоэза. ММС по времени возникновения опережает развитие миелофиброза.
Развитию коллагенового, определяемого при окраске гематоксилин-эозином миелофиброза предшествует ретикулиновый, для обнаружения которого используются методы импрегнации серебром по Футу и Гомори. На стадии ретикулинового миелофиброза клеточный костный мозг еще весьма гиперплазирован. Коллагеновый миелофиброз вначале сосуществует с клеточной пролиферацией, а потом подавляет ее. Дополнительное развитие остеомиелосклероза наблюдается реже, чем при ХИМФ. Патоморфологическая картина этого периода напоминает изменения костного мозга, наблюдаемые при ХИМФ в 3—4-й стадии его развития.
Это относится и к резко измененному состоянию микро- и макрососудов, мелких артерий и артериол, синусов и синусоидов стромы костного мозга.
При миелофиброзе с миелоидной метаплазией (МММ), развивающемся после истинной полицитемии, значительно меняется топография гемопоэза, что имеет диагностическое значение. Наблюдается падение захвата коллоидного 99mТс осевым скелетом и усиление захвата изотопа эпифизами трубчатых костей, селезенкой и печенью. Возможны различные варианты в степени этих изменений.
Развитие постэритремического миелофиброза происходит под влиянием фиброгенных цитокинов, главным источником которых являются патологические мегакариоциты, тромбоциты и моноциты.
Общность происхождения постполицитемического и ХИМФ отражают и данные цитогенетического исследования.

По данным A. Tefferi и соавт., частота нарушений кариотипа составила 62 % на момент первого исследования, 73 % в динамике заболевания, 90—100 % в период развития острого лейкоза. Характер выявленной цитогенетическои патологии при постполицитемическом МММ был таким же, как и при ХИМФ: 13q-, 20q-, +8, +9. В динамике любого МММ частота 13q- и 20q- значительно возрастает.
Авторы пришли к выводу, что 13q-, 20q- и +8 цитогенетическая патология не имеет плохого прогностического значения. Появление другой цитогенетическои патологии и новых субклонов обычно индуцировано предшествующей цитостатической терапией и имеет плохое прогностическое значение: определены связь между частотой развития острого лейкоза при МММ и обнаружением 5q- в 50 %, 7q- - в 30 %, 12р- — в 25 %, нарушения в хромосоме 1 — в 25 %. Случаев развития острого лейкоза у имевших 13q- не обнаружено.
Клиническая и гематологическая динамика процесса развития миелофиброза с миелоидной метаплазией (МММ) характеризуется прогрессирующим увеличением селезенки, а часто и печени (в единичных случаях гепатомегалия выходит на передний план), потерей массы тела вплоть до кахексии, нередко — появлением субфебрилитета и более высоких подъемов температуры телы у отдельных больных, повышением частоты инфекционных осложнений, проявлениями уратового диатеза, портальной гипертонии, сохранением склонности к тромбозам сосудов и экхимозам.
Большая величина селезенки определяет симптом компрессии желудка и дисфункцию кишечника, смещение левой почки. Возникновение острых болей в области селезенки определяется инфарктами селезенки с возможным развитием периспленита.
Показатели красной крови в процессе развития миелофиброза с миелоидной метаплазией (МММ) постепенно нормализуются, а затем возникает анемия с морфологическими изменениями в эритроцитах, присущими ХИМФ: пойкилоцитоз с грушевидной формой эритроцитов, анизоцитоз и нормобластемия. Характерно нарастание числа лейкоцитов и левого сдвига в лейкоцитарной формуле крови; у отдельных больных развивается лейкопения. Число тромбоцитов варьирует от высоких до низких значений.
На поздних этапах миелофиброза с миелоидной метаплазией (МММ) нередко возникает макроцитарная анемия с токсигенной зернистостью в эритроцитах, шизоцитами и кольцами Кэбота. Причиной ее развития является относительный дефицит фолиевой кислоты, а не витамина В12.
Основные причины развития анемии при постполицитемическом МММ — повышенный гемолиз эритроцитов в резко увеличенной селезенке, неэффективный эритропоэз с гибелью части эритроидных предшественников и коммитированных клеток в костном мозге, доказанной радиологическими исследованиями, подавление эритропоэза диффузным миелофиброзом и лейкемизированным миелопоэзом. К ним добавляются такие факторы, как гидремия, дефицит железа, оставшийся от эритремической стадии, относительный дефицит фолиевой кислоты. Отдельные причины часто сочетаются у одного и того же больного.
В зависимости от причин развития анемический синдром имеет различную тяжесть и прогноз от вполне благоприятного при железодефицитной до тяжелого при рефрактерной анемии и миелодисплазии, одним из вариантов которой является сидеробластная анемия.
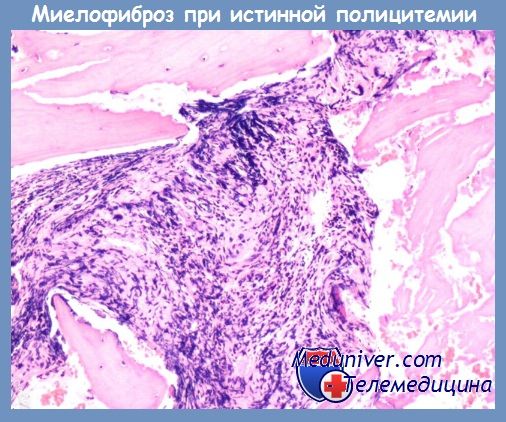
Течение постэритремической миелоидной метаплазии селезенки и миелофиброза необычайно вариабельно. У некоторых больных оно вполне доброкачественное с медленными темпами роста размеров селезенки и печени, нормальными показателями красной крови, умеренным лейкоцитозом и тромбоцитозом или без них. Подобную многолетнюю благополучную динамику заболевания можно обозначить как период стабилизации. У других больных отмечается быстрое прогрессирование спленомегалии, анемический синдром, нарастающий лейкоцитоз с малопроцентной бластемией.
Эти варианты лейкоцитоза, зрелоклеточного или напоминающего хронический миелолейкоз, с высокой вероятностью предвещают развитие миелодисплазии или острого лейкоза. Это стандартный исход истинной полицитемии, протекающей с лейкоцитозом выше 30•109/л.
Плохое прогностическое значение имеет и лейкопения меньше 3•10 9 /л, особенно если она сочетается с выраженной анемией и омоложением лейкоцитарной формулы. Подобного рода состояние, как и лейкоцитозные формы при наличии рефрактерной к лечению анемии, сопровождающееся повышением температуры тела и/или появлением геморрагического синдрома, рассматривается как миелодиспла-зия, предстадия острого лейкоза. Так же трактуются и случаи сидеробластной анемии. В этих случаях можно ожидать прогностически неблагоприятных цитогенетических находок.
Итальянские авторы рассматривают всю стадию постполицитемического МММ как предостролейкозную с вероятностью развития острого лейкоза через 3 года после ее диагностики. Если с первым положением условно можно согласиться, то это не относится к обозначенному авторами сроку, поскольку у многих больных он достаточно высокий, а часть больных и не доживает до его развития.
Манифестации острого лейкоза предшествует помимо рефрактерной анемии и нарастающего лейкоцитоза ряд признаков:
• асептическая лихорадка, продолжительность которой до диагностики острого лейкоза может составить 1—2 года;
• глубокая цитопения, в том числе и тромбоцитопения, немотивированная большой величиной селезенки и предшествующей цитостатической терапией;
• быстрый рост размеров селезенки, особенно если он сочетается с лихорадочным синдромом.
• тромбоцитемия на позднем этапе заболевания, если ее раньше не было (2 собственных наблюдения).
Манифестации острого лейкоза могут предшествовать трудно квалифицируемые дерматиты лица, глосситы, резистентность к прежде адекватному лечению. Подозрение на острый лейкоз возникает и в случаях захвата осевым скелетом 99mТс при наличии выраженного миелофиброза в гистоморфологическом препарате.
Развитие острого лейкоза возможно как в эритремической стадии заболевания, так и в стадии постэритремической ММС и миелофиброза. В последнем случае преобладают лейкоцитозные варианты с частичным вызреванием, в крови встречаются эритрокариоциты, осколки ядер мегакариоцитов. Чаще всего имеет место миелобластный вариант острого лейкоза, но возможны и наблюдались нами эритромиелоз, миеломоноцитарный и лимфобластный варианты. Для клинических проявлений острого лейкоза во всех случаях были характерны мучительные оссалгии.
К настоящему времени уже нет сомнений в том, что естественные тенденции к завершению заболевания острым лейкозом при истинной полицитемии имеются, но они выражены незначительно. У леченных цитостатическими препаратами частота развития острого лейкоза существенно возрастает, как и заболеваемость раком и злокачественными лимфомами.
По мере получения доказательств лейкозогенности цитостатической терапии стимулировались поиски новых методов лечения.
Читайте также:

