Ионная связь между хлором и водородом
Ковалентная связь, которая образуется по донорно-акцепторному механизму, называется донорно-акцепторной связью. При образовании донорно-акцепторной связи один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором):
Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от атома-донора к атому-акцептору: А→В
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой атома-донора и свободной орбитали атома-акцептора:
Донорно-акцепторная связь имеет такие же свойства, как и обычная ковалентная связь, а отличается от нее только происхождением общей электронной пары. Образование донорно-акцепторной связи рассмотрим на примере иона аммония NH4 + . Этот сложный ион образуется в результате присоединения иона водорода Н + к молекуле аммиака NH3:
Три неспаренных электрона, которые находятся на 2р-подуровне, участвуют в образовании трех ковалентных связей с атомами водорода в молекуле NH3. Это обычные связи, образованные по обменному механизму. Неподеленная электронная пара, которая находится у атома азота на 2s-подуровне, может участвовать в образовании донорно-акцепторной связи, т. е. атом азота в молекуле аммиака может быть донором электронной пары. Ион водорода вообще не имеет электронов, но имеет свободную 1s-орбиталь, поэтому он может быть акцептором электронов:

Все четыре связи N—H в ионе аммония являются равноценными. Это обусловлено тем, что в момент образования связи в атоме азота происходит гибридизация 2s-орбитали и трех 2р-орбиталей, т. е. sp 3 -гибридизация. В результате возникают четыре одинаковые гибридные орбитали, которые направлены к вершинам тетраэдра. Таким образом, ион аммония, как и молекулы типа АВ4, имеет тетраэдрическую форму.
Обратите внимание, что валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи.
Следовательно, если элемент образует ковалентные связи и по обменному, и по донорно-акцепторному механизму, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. К ним относятся: а) орбитали с неспаренными электронами; б) орбитали с неподеленными электронными парами; в) свободные орбитали.
Для азота валентность IV является максимальной, потому что внешний электронный слой атома азота (второй энергетический уровень) состоит из четырех орбиталей. Такую валентность азот имеет и в таких соединениях, как N2О5, HNО3, NaNО3 и т. п. Например, в молекуле азотной кислоты три ковалентные связи N—O образуются неспаренными электронами атома азота, а одна связь N—О образуется неподеленной парой электронов атома азота:
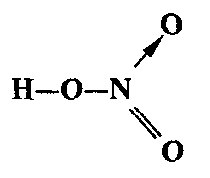
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ДЭО > 1,7), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование частиц, имеющих электрические заряды. Эти Частицы называются ионами:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионную связь можно рассматривать как крайний случай ковалентной полярной связи.
Как вы уже знаете, наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны: Поэтому ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов.
При отдаче электронов атомы металлов превращаются в положительно заряженные ионы, которые называются катионами, например:
Na 0 — 1ē→Na + — катион натрия;
Ca 0 — 2ē→Ca 2+ — катион кальция.
При присоединении электронов атомы неметаллов превращаются в отрицательно заряженные ионы, которые называются анионами, например:
Cl 0 + 1ē→ Cl — — хлорид-анион;
O 0 + 2ē→O 2- — оксид анион.
Например, образование ионной связи при взаимодействии атомов натрия и хлора схематично можно показать так:
Как видно из этого примера, ионы имеют завершенные электронные конфигурации, т. е. при образовании ионной связи, как и при образовании ковалентной связи, атомы переходят в более устойчивое состояние.
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щелочи и многие соли. Так, в молекулах гидроксида натрия NaOH и сульфата натрия Na2SО4 связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в NaОН и между атомами кислорода и серы в Na2SО4) — ковалентные полярные.
Как известно, атомы металлов более или менее легко отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых веществ-металлов.
Простые вещества, которые образуют элементы-металлы, при обычных условиях представляют собой твердые кристаллические вещества (кроме ртути Hg). В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами — электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке.
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической связью.
Металлическая связь обусловливает важнейшие физические свойства металлов.
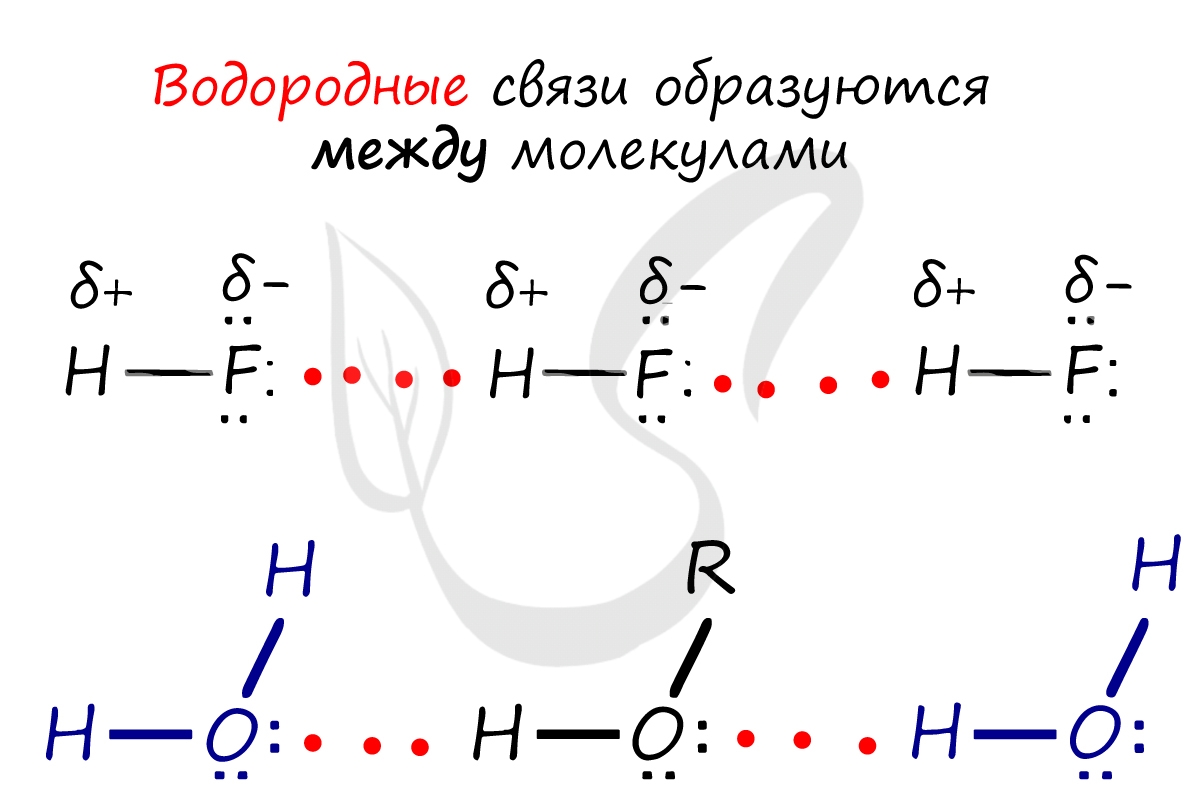
Водородная связь является особым видом химической связи. В образовании этой связи участвует атом водорода, который в данной молекуле уже связан обычной ковалентной связью с атомом какого-либо элемента, имеющего большую электроотрицательность (например, с фтором, кислородом, азотом). Ковалентные связи H—F, Н—О, H—N являются сильно полярными (большая разность ЭО!). Поэтому атом водорода имеет избыточный положительный заряд +5, а на атомах фтора, кислорода и азота находятся избыточные отрицательные заряды:

Это примеры образования межмолекулярных водородных связей. (Водородные связи обозначаются точками). Образование межмолекулярных водородных связей является причиной существования ассоциатов молекул типа (HF)n, (H2O)n и др.
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы —ОН и атомом кислорода группы >С=О:
Внутри- и межмолекулярные водородные связи существуют в молекулах белков, ДНК и др.
Таким образом, при образовании водородной связи атом водорода находится между двумя атомами с высокой ЭО; с одним из них он связан обычной ковалентной связью, а с другим — водородной связью.
Энергия водородной связи приблизительно в десять раз меньше энергии обычной ковалентной связи и варьируется в пределах 15 — 40 кДж/моль. Тем не менее, водородные связи играют важную роль во многих физико-химических и биологических процессах.
Межмолекулярная водородная связь является одним из видов межмолекулярных взаимодействий.
Существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти силы называются ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Одним из видов ван-дер-ваальсовых сил является ориентационное взаимодействие. Такое взаимодействие возникает между дипольными молекулами; противоположно заряженные концы диполей притягиваются друг к другу.
Если рядом находятся полярная и неполярная молекулы, то под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу. Такой вид взаимодействия называется индукционным:

Рефераты по другим темам можно скачать здесь
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 
(ион калия), Fe 2 
(ион железа), NH4 
(ион аммония), [Cu(NH3)4] 2 
(ион тетраамминмеди).
Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 
(хлорид-ион), N 3 
(нитрид-ион), PO4 3 
(фосфат-ион), [Fe(CN)6] 4 
(гексацианоферрат-ион).
По значению заряда ионы подразделяются на:
- однозарядные (K
![]()
, Cl![]()
, NH4![]()
, NO3![]()
и т. п.); - двухзарядные (Са 2
![]()
, O 2![]()
, SО4 2![]()
и т. д.); - трёхзарядные (Аl 3
![]()
, РО4 3![]()
и т. п.).
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.

Для ионной связи характерно:
- ненаправленность – электростатическое взаимодействие может осуществляться в любом направлении;
- ненасыщаемость – одна заряженная частица может взаимодействовать с любым число других заряженных частиц.
Пример. Схема образования ионного соединения:

,

,

,
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
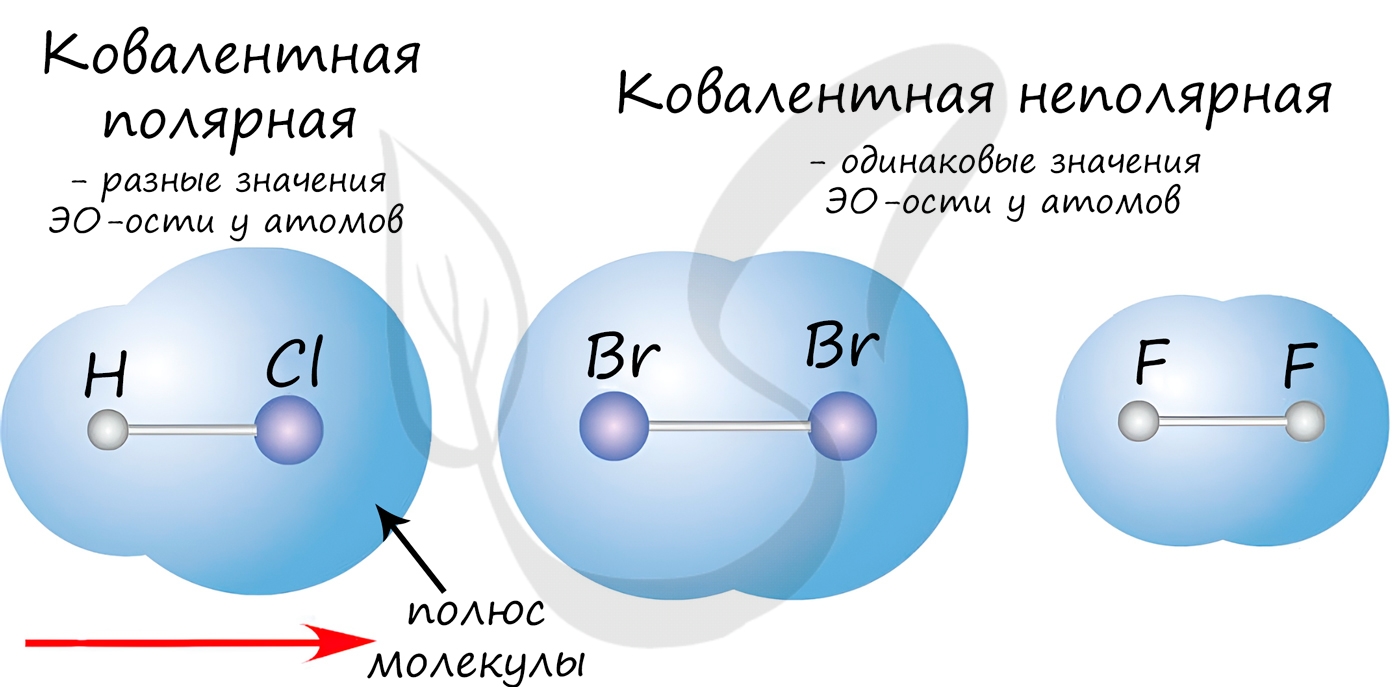
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму

Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.

Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.

Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму

Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.

Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.

Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.

Рис. 2. Ионная химическая связь.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
Пример: поваренная соль, хлорид натрия NaCl:

Рис. 3. Схема ионной химической связи хлорида натрия.
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
- взаимодействие кальция и фтора
– кальцию легче отдать два электрона, чем получить недостающие.
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2. 4.
Составим формулу ионной химической связи:
- взаимодействие натрия и кислорода
– натрий находится в главной подгруппе первой группы. Он с легкостью может отдавать один электрон.
– кислород находится в главной подгруппе шестой группы. Естественно, что ему легче получить два электрона, чем отдать шесть.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2 : 1 = 2. Определим число атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Составим схему образования ионной связи:
Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь – связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.
Читайте также:










