Индукция ремиссии острого лейкоза включает в себя
Независимо от того, по какой программе будет осуществляться индукция ремиссии острого лейкоза, необходимо следовать некоторым общим правилам:
1) нужно проводить интенсивную терапию возникших у больного инфекционных осложнений, купировать геморрагический синдром;
2) больному должен быть установлен катетер в центральную вену;
3) с целью профилактики блокады почечных канальцев солями мочевой кислоты на фоне массивного распада опухоли необходимо проводить массивную гидратацию (3 л/м2) с форсированным диурезом, применять аллопуринол в дозе 600 мг/сут, корригировать водно-электролитный баланс;
4) при числе лейкоцитов более 50•10 9 /л и особенно 100•10 9 /л перед основным лечением следует проводить предфазу, рассчитанную на уменьшение числа лейкоцитов периферической крови (меньше 50 • 10 9 /л).
Это позволяет понизить раннюю летальность, связанную с развитием у больных синдрома массивного лизиса опухоли (легочный дистресс-синдром, блокада функции почек). Обычно при ОМЛ в качестве предфазы применяют гидроксимочевину в дозе 100— 150 мг/кг в день и более (меньшие дозы неэффективны), у больных ОЛЛ — преднизолон или дексаметазон (в течение 5 дней).

При наличии клинических симптомов, обусловленных лейкостазами (спутанность сознания, легочная недостаточность, почечная недостаточность), на фоне приема гидроксимочевины целесообразно проводить лейка- и плазмаферезы.
Всем больным с лейкоцитозом выше 30•10 9 /л, особенно выше 100•10 9 /л следует проводить профилактику нейролейкемии.
Необходимость консолидации, даже самой простой, была со всей очевидностью доказана в начале 80-х годов XX в.: выживаемость больных, которым был проведен хотя бы один курс консолидации, фактически в 2 раза выше, чем больных, которым консолидацию не проводили. В настоящее время существует два похода к данному этапу противоопухолевой терапии: курс консолидации осуществляют аналогично курсу индукции или выполняют интенсивную консолидацию с использованием цитарабина в высоких дозах, митоксантрона и других ци-тостатических препаратов.
Считается доказанным тот факт, что интенсивная консолидация может быть альтернативой обычной консолидирующей терапии с последующим длительным проведением поддерживающего лечения. Так, результаты исследования итальянских авторов по изучению роли поддерживающей терапии (4 курса DAT с увеличением дозы цитарабина в каждом последующем курсе) после интенсивной консолидации дают основания полагать, что ни обычная поддерживающая терапия (цитарабин + 6-ТГ), ни интенсивная постконсолидационная терапия (6 курсов цитарабина в полных стандартных дозах в сочетании с вепезидом, 6-ТГ, даунорубицином) не увеличивают продолжительность жизни больных, у которых достигнута ремиссия и которым проведено 4 курса DAT.
К такому же выводу об отсутствии выраженного влияния поддерживающей терапии, проведенной после интенсивной индукции, пришли и другие авторы. Для интенсификации консолидации в большинстве случаев используют высокие дозы цитарабина. В настоящее время доказан их избирательный эффект при различных вариантах ОМЛ. Так, выживаемость больных ОМЛ, у которых обнаружена t(8;21) или inv(16), увеличивается практически в 2 раза (70 % в течение 5 лет) по сравнению с таковой при использовании стандартных доз цитарабина. При этом имеет значение, сколько курсов цитарабина в высоких дозах применяли в консолидации: один или более трех.
Целесообразность проведения длительной поддерживающей терапии всегда подвергалась сомнению, и данные различных центров по этому вопросу довольно противоречивы. При оценке эффективности поддерживающего лечения нужно иметь в виду, какая консолидация была проведена — интенсивная или обычная (аналогичная индукции). Доказано, что в том случае если консолидация соответствует индукционной программе, поддерживающая терапия приводит к значительному (в 2 раза) увеличению продолжительности ремиссии и существенному — безрецидивной выживаемости (4—5 лет живут 24—25 % больных при использовании поддерживающего лечения, 10 % — без него).
При сравнении результатов 10 больших многоцентровых исследований также очевидно преимущество тех программ, в которых используют поддерживающую терапию. Однако после проведения интенсивной консолидации, как уже подчеркивалось, дальнейшая поддерживающая терапия преимуществ не дает. Поддерживающая терапия и особенно ее продолжительность имеют принципиальное значение для выживаемости пожилых пациентов с острым миелоидным лейкозом (ОМЛ), поскольку ее результаты существенно лучше полученных при проведении очень интенсивного, но кратковременного лечения.
Прежде чем представить конкретные рекомендации относительно лечения больных острым миелоидным лейкозом (ОМЛ), нужно обсудить ряд вопросов, касающихся биологических особенностей острого лейкоза (например, цитогенетические аномалии) и принципов проведения клинических исследований, на результатах которых мы основываемся при создании протоколов лечения острого миелоидного лейкоза.
На рис.2 указаны стадии Т-клеточной дифференцировки и связанные с ними лимфопролиферативные заболевания человека:
ЛЛ - лимфобластная лимфома,
Т-ЛЛВ - Т-клеточный лейкоз/лимфома взрослых,
КТЛ - кожный Т-клеточный лейкоз,
ПТЛ - периферический Т-клеточный лейкоз,
Ту-ЛПЗ-Ту - лимфопролиферативное заболевание.
Острые Т-клеточные микробластные лейкозы указаны в табл.2; все они имеют плохой прогноз, составляют 15-20% от всех лимфолейкозов.
Миелолейкозы человека характеризуются появлением лейкозных клеток, имеющих общие антигены с клетками миеломоноцитарного, эритроидного или мегакариоцитарного
ростков кроветворения. Стадии дифференцировки клеток крови миелоидного ряда и связанные с ними миелолейкозы указаны на рис.3.
Острые миелолейкозы характеризуются большей гетерогенностью иммунологических маркеров, чем острые лимфолейкозы. В табл.3 представлена иммунофенотипическая классификация ОМЛ.
Лечение острых лейкозов
Основные принципы современной терапии этого заболевания - максимально полное уничтожение (эрадикация) лейкозных клеток на всех этапах течения болезни.
Лейкозные клетки образуют две популяции: пролиферирующую и непролиферирующую.
Пролиферирующая популяция находится в митотическом цикле и может разрушаться полихимиотерапией, которая действует на отдельные фазы цикла. Часть антилейкозных препаратов активна в какой-то определенный период митоза - это фазово- и циклоспецифические препараты: 6-меркаптонурин, цитозар, метатрексат. Другие действуют в течение всего митотического цикла - это циклонеспецифические препараты: циклофосфан, винкристин, преднизолон.)
Другая популяция - непролиферирующая - может долго пребывать в стадии митотического покоя, но, активизируясь, она пополняет пролиферирующую популяцию по мере уничтожения ее цитостатиками.
Отсюда и особенности противолейкозной терапии: она должна быть интенсивной и длительной, сочетать фазово- и циклоспецифические препараты с циклонеспецифическими.
Стабильная длительная ремиссия — это свыше 5 лет; такие ремиссии расцениваются как практическое выздоровление.
Этапы лечения острых лейкозов:
1) индукция ремиссии - начинается сразу после установления диагноза острого лейкоза по программе, соответствующей форме лейкоза. Достижение ремиссии характеризуется следующими показаниями, которые должны сохраняться не менее 1 мес.:
а) в костном мозге
- количество бластных клеток не превышает 5%,
- лимфоцитов - не более 30%,
- соотношение других ростков приближается к норме,
- б) в крови
- гемоглобин не менее 100 г/л,
- гранулоцитов не менее 1000 в 1 мкл - 1,0 х 10 9 /л,
- тромбоцитов не менее 100 х 10 9 /л,
- бластные клетки не обнаруживаются.
в) отсутствуют симптомы, связанные с лейкозом, т.е. у больного нормальные размеры лимфатических узлов, печени, селезенки;
г) нет клинических признаков нейролейкемии, состав спинномозговой жидкости нормальный.
2) Консолидация или укрепление ремиссии и профилактика нейролейкемии: дополнительно проводится интенсивная терапия по схеме и санация оболочек головного
и спинного мозга проведением краниоспинального облучения и интраспинальным введением метатрексата.
3) Терапия поддержания ремиссии: непрерывный приемцитостатиков в период ремиссии по определенным схемам.
4)Реиндукция ремиссии- периодическое проведение коротких курсов интенсивной полихимиотерапии на фоне полной ремиссии.
Общая продолжительность всего курса такой терапии не менее 3-5 лет при условии сохранности полной ремиссии, контролируемой регулярными пункциями костного мозга.
Протокол лечения острого лимфобластного лейкоза прилагается как пример.
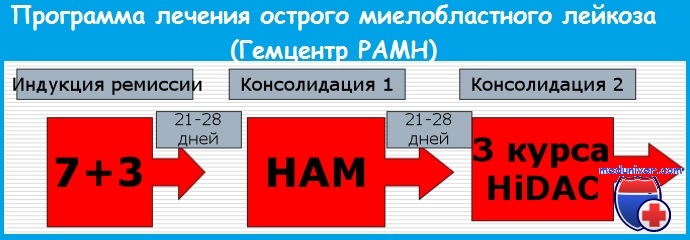
При остром миелобластном лейкозе для индукции и консолидации ремиссии используется программа 7 + 3 — это :
- цитозар по 100 мг/м 2 2 раза в день внутривенно капельно в течение часа в течение 7 дней
- рубомицин по 45/60 мг/м 2 в течение 15 мин внутривенно на 100 мл физ. р-ра в первые 3 дня курса через 2 часа после введения цитозара.
Основные группы препаратов, используемые в период индукции ремиссии при острых лейкозах:
• алкилизующие соединения (нарушают синтез нуклеиновых кислот): циклофосфан 'Щ-амп. 200 мг;
• антиметаболиты - антагонисты метаболитов, предшественников нуклеиновых кислот •
- нарушают их синтез и жизнедеятельность клеток: метатрексат амп. 5 мг; И-меркаптопурин табл. 50 г;
• антимитотические средства (блокируют митоз в стадии метафазы путем денатурации тубулина - белка микротрубочек): винкристин амп. 0,5 мг.
Чтобы распечатать файл, скачайте его (в формате Word).
При ОЛ терапию делят на периоды: индукция ремиссии, консолидация, поддерживающее лечение с периодическими курсами активной терапии (в частности, профилактика поражений ЦНС). Существует несколько программ терапии, изложить которые в учебнике нет возможности, о которых следует читать в дополнительной литературе.
Основным принципом современной педиатрической онкогематологии является разделение пациентов с ОЛ на группы риска и отсюда разная интенсивность терапии как в остром периоде так и при достижении ремиссии.
ОнЛЛ. Программа лечения, предложенная проф. Г. А. Шеллонгом в ОМЛ-БФМ-87, включает:
Индукция ремиссии — цитозар (цитозин-арабинозид) внутривенно в течение 48 ч, в дозе 100 мг/м2 в сутки, с утра 1-го дня до утра 3-го дня и далее 12-кратное введение цитозара в дозе 100 мг/м2 в течение 30 мин, с утра 3-го дня до вечера 8-го дня; даунорубомицин внутривенно в течение 30 мин, в дозе 30 мг/м2 каждые 12 ч, дни 3-5-й; вепезид внутривенно в течение 1 ч утром в дозе 150 мг/м2, дни 6-8-й; эндолюмбально цитозар в 1-й день (до 1 года — 20 мг; 1-2 года — 26 мг; 2-3 года — 34 мг; старше 3 лет — 40 мг). На 15-й день выполняют стернальную пункцию и при резком угнетении гемопоэза (бластов менее 5%) лечение прекращают до восстановления гемопоэза.
Консолидация — преднизолон внутрь ежедневно в дозе 40 мг/м2 с 1-го по 28-й день с последующей отменой в течение 9 дней; 6-тиогуанин внутрь 60 мг/м2, 1-28-й дни; винкристин внутривенно струйно в дозе 1,5 мг/м2 в 1-й, 8-й, 15-22-й дни; адриамицин внутривенно в течение ч в дозе 30 мг/м2 в 1-й, 8-й, 15-й, 22-й дни; цитозар внутривенно струйно 75 мг/м2 в 3-6-й, 10-13-й, 17-20-й, 24-27-й дни; цитозар эндолюмбально в возрастных дозировках в 1-й, 15-й дни. Это I фаза консолидации и после короткого (несколько дней) перерыва начинается фаза II — 6-тиогуанин в дозе 60 мг/м2 внутрь ежедневно с 29-го по 43-й дни; цитозар внутривенно струйно 75 мг/м2 в дни 31-41-й; циклофосфан внутривенно капельно в течение 1 ч в дозе 200 мг/м2 в дни 29-43-й; цитозар в возрастных дозировках эндолюмбально на 29-й и 43-й день. Интенсификация I и II включает 3-часовое введение цитозара в дозе 3 г/м2 каждые 12 ч с утра 1-го дня до вечера 3-го дня; вепезид внутривенно в течение 1 ч 125 мг/м2 в сутки, за 1 ч до введения цитозара в дни 2-5-й.
Поддерживающая терапия начинается после окончания блока интенсификации II и включает: 6-тиогуанин — 40 мг/м2 внутрь ежедневно, цитозар — 40 мг/м2 подкожно каждые 4 нед в течение 4 дней подряд (при числе лейкоцитов более 2000 в мкл — 100% дозы, от 1000 до 2000 в мкл — 50% дозы, а при менее 1000 в мкл — не назначают). В этот период рассматривают вопрос о трансплантации костного мозга.
Осложнения цитостатической терапии можно разделить на специфические и неспецифические. Некоторые цитостатические препараты вызывают характерные осложнения: винкристин — нейротоксичность (невриты, параличи, атаксия, слепота), синдром неадекватной секреции антидиуретического гормона, алопецию; рубомицин — кардиотоксичность (кардиомиопатия —тахикардия, трофические изменения ЭКГ, одышка, падение артериального давления); аспарагиназа — аллергические реакции вплоть до анафилактического шока, поражения печени (липидоз), поджелудочной железы, в том числе кетоацидоз; циклофосфан — геморрагический цистит, токсический гепатит, синдром неадекватной секреции антидиуретического гормона.
Неспецифические осложнения цитостатической терапии могут быть инфекционные и неинфекционные. Неинфекционные осложнения объединяют термином цитостатическая болезнь. Важнейшими признаками ее являются угнетение нормального кроветворения (тяжелые гранулоцитопении, тромбоцитопении и анемии), поражения желудочно-кишечного тракта (стоматит, вызванный как цитостатиком, так и грибами, вирусами, бактериями), цитотоксическая энтеропатия (с преобладанием явлений энтерита или колита), поражения печени (токсико-аллергический гепатит, гепато- дистрофия), сердца (кардиомиопатия), легких (цитостатическая пневмопатия, пневмоцистная пневмония), почек (интерстициальные поражения, обтурация канальцев мочевой кислотой), нервной системы (энцефалопатия, проявляющаяся в виде синдрома апатии, возможно также развитие отека мозга), повышенный риск развития злокачественных опухолей.
Для профилактики синдрома лизиса опухоли в момент начала интенсивной цитостатической терапии проводят жидкостную терапию (суточный объем водной нагрузки с учетом выпиваемой жидкости достигает полутора возрастных потребностей) в сочетании с аллопуринолом (суточная доза 10 мг/кг, разделенная на три приема внутрь) и назначением бикарбоната натрия, ибо мочевая кислота лучше растворяется в щелочной среде.
Отдаленными последствиями облучения черепа могут быть трудности в учебе, эндокринопатии, включая гипотиреоз, задержку роста, а облучения яичек — нефертильность, которая может потребовать в перспективе даже назначения тестостерона.
Симптоматическая терапия. Гемотрансфузии применяют при агранулоцитозе, сочетающемся с тромбоцитопенией. В этих случаях кровь переливают ежедневно. Оптимально подбирать донора по антигенной системе HLA.
Инфекционные осложнения типичны для больных ОЛ. Оптимально в стационаре следует помещать детей в отдельные боксы или палаты при строжайшем соблюдении правил асептики и антисептики. Любое повышение температуры тела рассматривают как признак инфекции. Антибиотики до выделения возбудителя назначают исходя из установленного фактора широкого распространения у больных условно-патогенной флоры. Профилактическое назначение системных антибиотиков не рекомендуют.
Терапия больных с МДС может быть поддерживающей (переливания эритроцитной массы при анемии, тромбоцитной массы при тромбоцитопении, применение хелатов у больных, получивших многочисленные трансфузии эритроцитной массы), низкой интенсивности (разные комбинации — рекомбинантный эритропоэтин при анемиях, гранулоцитарные колониестимулирующий факторы при нейтропениях, ИЛ-11 и даназол при тромбоцитопении; иммуносупрессивная терапия антитимоцитарным или антилимфоцитарным глобулинами, циклоспорином А, талидомидом; а также дополнительное назначение к различным схемам пентокситфилли- на, 5-азацитидина и др.), высокоинтенсивной (трансплантация костного мозга, стволовых клеток, сочетания иммуносупрессивных препаратов).
Новые методы лечения больных ОЛ, прежде всего, касаются различных аспектов трансплантации костного мозга, что особенно важно для больных ОнЛЛ, у которых часто в процессе лечения возникает аплазия костного мозга. Трансплантируют аллогенный костный мозг с удаленными
Т-лимфоцитами или очищенный аутологичный костный мозг. Аллогенный костный мозг, совместимый по основным HLA-антигенам, пересаживают сразу по достижении первой ремиссии. Аутогенный костный мозг больного забирают сразу по достижении ремиссии, обрабатывают его моноклональными антителами с иммуноцитотоксинами (например, с рицином) и фармакологическими препаратами (например, гидропероксицик- лофосфамидом) и вводят больному.
Разрабатывают методы сочетания химиотерапии и трансплантаций костного мозга или стволовых кроветворных клеток с предварительным введением колониестимулирующих факторов — гранулоцитарного (Г-КСФ) или грануломакрофагального (ГМ-КСФ). ГМ-КСФ, введенный за два дня до начала химиотерапии и далее вводимый в момент ее проведения, способствует увеличению числа и длительности ремиссий при ОЛЛ. Г-КСФ и ГМ-КСФ эффективны и при цитостатической болезни, агранулоцитозе. Самой сложной задачей при трансплантации костного мозга (ТКМ) остается поиск НLA-совместимого донора (наиболее рационален донор-сибс, то есть брат-сестра больного). В конце прошлого (XX) века было доказана целесообразность трансплантации вместо костного мозга стволовых кроветворных клеток (СКК). В среднем в костном мозге содержится 1 СКК на 105 клеток. Из одной СКК образуется около 1000 клеток-предшественниц и 106 зрелых клеток [Новик А. А. и Богданов А. Н., 2001]. Разработаны методы получения СКК из костного мозга и периферической крови. Наибольшее количество стволовых клеток в костном мозге находится у плода, а в периферической крови человека имеется при рождении. Количество СКК, полученное из плацентарной крови при рождении — достаточно для трансплантации ребенку до 40 кг. Поэтому в настоящее время нередки случаи запланированной беременности для помощи в источнике СКК для старшего ребенка в семье, которому необходима ТКМ.
Согласно А. А. Новику и А. Н. Богданову (2001), ТКМ и ТСКК существенно улучшает прогноз при лечении лейкозов, особенно ОМЛ и ХМЛ (табл. 204). Согласно данным этих же авторов, в мире ежегодно производят около 50 000 ТКМ и ТСКК.
Разрабатываются и иммунологические методы лечения: введение а-ин- терферона (эффективно лишь при волосато-клеточном ОЛ), интерлейкина-2, вакцинация BCG (по схеме!).
Диета больным острым лейкозом необходима высококалорийная с полуторным по сравнению с возрастными нормами количеством белков, витаминизированная, богатая минеральными веществами (стол 10а). При назначении глюкокортикоидов рацион обогащают продуктами, содержащими много солей калия и кальция.
Деонтологические аспекты очень важны при ведении ребенка, больного ОЛ, и беседах с его родителями. При ребенке никогда не следует называть диагноз. Учитывая психологическую и физическую травматичность современных схем лечения, важно подготовить ребенка и родителей к тем или иным процедурам.
Родителям следует сообщить диагноз, как только он станет бесспорным, но одновременно вселять в них оптимизм, разъяснив возможности современной терапии. Необходимо быть очень внимательным к родителям, их вопросам, просьбам. Режим больного определяется его состоянием и гематологическими данными.
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
Некоторые очень редкие разновидности ОМЛ не включены в этот список. Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, наиболее характерного для детского возраста, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний), иногда – случаи заболевания ОМЛ среди ближайших родственников, что говорит об определенной роли генетической предрасположенности.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и некоторые другие состояния.
Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, чаще всего избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии может понадобиться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
- Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
- Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные изменения хромосом 5 и 7 связаны с ухудшением прогноза.
- Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
- С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также резко повышается при рецидиве лейкоза.
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота, третиноин).
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток и у пациента нет других проявлений болезни (в том числе признаков нейролейкемии), то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у подавляющего большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, часто в высоких дозах; в разных сочетаниях используются также даунорубицин, 6-меркаптопурин, ифосфамид, митоксантрон, этопозид и др.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Чаще всего она встречается при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала. Изредка может использоваться также облучение головы (краниальное облучение). У детей риск распространения лейкоза в центральную нервную систему выше, чем у взрослых, поэтому профилактическая химиотерапия для его предотвращения используется чаще.
Для снижения вероятности рецидива пациентам из группы высокого риска может быть показана трансплантация костного мозга. Показаниями к трансплантации могут служить, например,
- транслокации и другие цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
- рецидив лейкоза,
- развитие ОМЛ на фоне миелодиспластического синдрома или другой болезни крови, а также после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии. Переливания донорских лейкоцитов (гранулоцитов) нужны только в случаях тяжелых инфекционных осложнений.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до 2-3 лет.
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретной разновидности миелолейкоза, цитогенетических особенностей (т.е. хромосомной структуры лейкемических клеток), возраста, общего состояния больного и других факторов.
В настоящее время порядка 50-60% детей, заболевших ОМЛ, выздоравливают. В среднем и пожилом возрасте, к сожалению, результаты хуже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Всего у 5-15% пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для некоторого продления жизни и улучшения ее качества.
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

