Гомогенная структура что это при раке
Существуют три основные характеристики, присущие опухолевым клеткам. Во-первых, это бесконтрольный рост вне зависимости от клеточного окружения прилегающих тканей. Во-вторых, раковые клетки всегда находятся на той или иной стадии анаплазии, то есть теряют клеточную специализацию. В-третьих, раковые клетки способны метастазировать, то есть распространяться по организму и проникать в ткани далеко за пределы области развития первичной опухоли.
Эти три характеристики присущи клеткам большинства известных видов рака, однако существуют исключения. Действительно, в опухолевой ткани нарушены нормальные регуляторные механизмы контроля роста. Тем не менее обнаруживаются участки опухолевой ткани, где происходит контактное торможение роста неоплазии.
Более того, поскольку чаще всего именно метастазы становятся причиной смерти больных раком, изучение биологических механизмов метастазирования является одной из ключевых задач современных исследований в онкологии.
Большинство человеческих неоплазий по своей природе являются моноклональными. Это означает, что при канцерогенном воздействии на организм обычно первоначально поражается всего одна клетка и вся опухоль представляет собой результат размножения этой единственной клетки. Существуют две основные группы доказательств этой концепции.
Первая группа доказательств. Некоторые женщины бывают гетерозиготны по двум формам фермента глюкозо-6-фосфатдегидрогеназе (Г6ФД). Ген, кодирующий этот фермент, находится в Х-хромосоме, и женские гетерозиготы наследуют этот ген либо по отцовской, либо по материнской линии.
Если у женщины с гетерозиготным набором генов будет повреждена одна из Х-хромосом, каждая клетка ее тела будет содержать только одну из этих двух форм фермента. Обследования больных гематологическими видами рака, возникающими из гетерозиготности по гену Г6ФД, показали, что их раковые клетки всегда содержат только одну форму фермента. Это является сильным доказательством того, что рак развивается из одиночной клетки, несущей ту или иную форму гена.
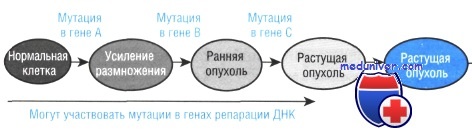
При хронической гранулоцитарной лейкемии у больных обнаруживается рестрикция экспрессии ферментов в клетках гранулоцитарного ряда и, что особенно важно, в эритроцитах и тромбоцитах. Таким образом, процесс злокачественной трансформации поражает стволовые клетки.
Приведенный факт также подтверждает моноклональную теорию происхождения рака. Кроме того, в исследованиях было показано, что хотя делеция 9q участка хромосомы обязательно присутствует во всех раковых клетках, в некоторых клетках была также обнаружена потеря 17р и 18q участков, что предположительно связано с более поздними этапами развития опухоли. Это также говорит о том, что хотя возникновение и первичное развитие опухоли происходят из одной клетки, в процессе ее роста возможно возникновение и нарастание генетической изменчивости составляющих ее клеток.
Вторая группа доказательств моноклональной природы рака происходит из исследований лимфом и различных лимфоидных форм рака. Было показано, что иммуноглобулины, продуцируемые лимфоидными неоплазиями (и встроенные в мембрану, и выделяемые в кровяное русло, как в случае с миеломой), почти всегда являются моноклональными, принадлежащими к одному классу и обнаруживающими одинаковую рестрикцию экспрессии легких цепей.
Безоговорочное принятие теории моноклональности рака иногда заставляет исследователей приписывать раковым опухолям гораздо более предсказуемое поведение, чем это есть на самом деле. Реальное же положение вещей такое, что, несмотря на моноклональное происхождение, неоплазии в процессе своего развития обнаруживают все большую и большую гетерогенность. Этот факт необходимо всегда учитывать при лечении онкологических заболеваний и в оценке природы опухолевых метастазов.
Как же вообще возникает гетерогенность, если раковая опухоль первично моноклональна? Дело в том, что процесс злокачественной трансформации всегда сопровождается общей генетической нестабильностью, что вызывает многочисленные фенотипические изменения первоначально однородных клеток. Некоторые из мутирующих клеток выживают и дают начало новым линиям развития, некоторые погибают в результате мутации. Выживаемость мутировавших клеток зависит от их гормональной и биохимической стабильности, а также от возможности их распознавания иммунной системой.
Таким образом, зрелую опухоль можно рассматривать как конгломерат клеток моноклинального происхождения, но различающихся по способности к метастазированию, устойчивости к цитотоксическим препаратам и атакам иммунной системы организма.
Процесс постепенного накопления хромосомных изменений в ходе прогрессии опухоли показан на рисунке на примере развития рака толстой кишки из полипа толстой кишки. По мере роста опухоли и возрастания генетической нестабильности в ее клетках возникают многочисленные разрывы хромосом, делеции и редупликации генов. Морфологически это сопровождается изменчивостью клеточных ядер и ростом числа плеоморфных цитологических форм.
Опухолевые клетки многих видов рака содержат мутации по гену, кодирующему белок р53. Этот ген кодирует наработку ядерного фосфопротеина, который участвует в контроле клеточного цикла, запрещая вступление клетки в фазу G1, если обнаруживаются повреждения клеточной ДНК. В нормальных клетках под действием ультрафиолетового облучения или цитотоксических препаратов происходит резкое увеличение содержания р53, что связано со стабилизацией белка после трансляции.
Деактивация функций р53 в результате мутации приводит к тому, что клетка вступает в митоз даже с ошибками в своем генетическом коде. Мутации в гене р53 раковых клеток приводят к конформационным изменениям фермента и делают его неактивным. Мутантные формы фермента теряют способность связываться с молекулами ДНК. Таким образом, мутация белка р53 является ключевым моментом опухолевой профессии, когда злокачественные клетки вступают в клеточный цикл без предварительной репарации поврежденных участков ДНК. В дальнейшем происходит процесс все большего накопления мутационных изменений.
Популяция раковых клеток, выросшая как потомство одной единственной клетки, в ходе своего развития обнаруживает значительную изменчивость как по скорости роста отдельных субпопуляций, так и по их цитоплазматической организации, гормонально-рецепторному статусу, чувствительности к радиоактивному облучению и цитотоксическим препаратам. В качестве примера можно привести мелкоклеточный рак легкого.
При этом заболевании клетки первичной опухоли и отдаленных метастазов значительно отличаются друг от друга по уровню цитоплазматического кальцитонина, гистаминазы и L-дофаминовой декарбоксилазы. Обнаруживаются также кариотипические различия клеток первичных и вторичных опухолей.
Гетерогенность опухолей представляет собой громадную проблему для терапии рака. Если опухоль обнаруживает изменчивость клеточных фенотипов и антигенной экспрессии, становится очень трудно оценить, какой вид иммунотерапии может дать положительный лечебный эффект. Аналогично, наличие в единичной опухоли субпопуляций клеток с различной чувствительностью к тем или иным цитостатическим препаратам обусловливает ее резистентность к химиотерапии, которая часто выявляется в ходе проведения лечения.
Статьи
Особенности кистозно-солидных образований
- Солидное образование (рак) – это самое опасное состояние, при котором шансы излечиться от недуга минимальны; оно имеет твердую оболочку и заполнено тканью.
- В отличие от него, кистозное новообразование легко поддается лечению, оно мягкое, может расти и уменьшаться.
- Кистозно-солидное образование является промежуточным звеном между ними. Оно может появиться в любом органе, меняться в размерах или оставаться неизменным, а также содержать в себе как ткань, так и жидкую субстанцию.
Классификация солидных образований
Любое солидное образование (онкология) относится к одной из следующих категорий: доброкачественное или злокачественное.
Медленно растет, может самостоятельно уменьшаться без дополнительного вмешательства. Отсутствуют метастазы.
Основная проблема, которую несет данное солидное образование (рак) – это сдавливание собой соседних органов или тканей.
Состоит из неустанно делящихся клеток, изменивших свой вид и структуру, может дорасти до немалых размеров.
Явление проявляет себя крайне агрессивным образом, распространяет метастазы даже на самых ранних стадиях недуга.
Основные причины возникновения солидных образований при раке
Солидное образование – это рак, который может появиться практически в любой системе организма. Однако существует ряд причин, которые, по заявлениям специалистов, являются своеобразными провокаторами и стимулируют появление и распространение метастазов.
Солидное образование (рак) может возникнуть вследствие следующих явлений:
- неблагоприятная экологическая обстановка, в особенности, в густонаселенных мегаполисах и городах с крупными заводами и фабриками;
- обилие стрессов и чрезмерная психологическая нагрузка;
- алкоголизм и табакокурение;
- плохая наследственность;
- слабая иммунная система;
- частые переломы и иные травмы.
Порядок диагностики солидных образований
Диагностируется любое солидное образование (рак) посредством нескольких методов. Они могут быть задействованы как в комплексе, так и по отдельности.
- УЗИ внутренних органов – дает возможность определить точную локализацию, размеру, структуру и форму образования. Сообщает о разновидности опухоли, что позволяет подбирать схему лечения.
- Биопсия – осуществляется с помощью тонкой иглы, вводимой в область образования и использующей его частички. Определяет степень злокачественности и уровень агрессии опухоли.
- Общий анализ и биохимия крови – рассказывают о наличии воспалительных процессов, сбоев в работе гормонов и патологий в организме.
- Компьютерная томография – самый востребованный вид диагностики. Солидное образование – это рак, лечение которого подбирается индивидуально, в зависимости от ряда показателей. КТ дает возможность выявить точное расположение опухоли и сообщить предельно точные данные о ней.
Лечение солидного онкологического заболевания
Солидное образование – это рак, крайне серьезный недуг, требующий основательного подхода и высочайшего уровня квалификации. Только действительно опытные специалисты в состоянии осуществить точную диагностику и подобрать наиболее подходящее лечение, которое зависит от локализации, размеров и иных особенностей конкретной опухоли.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению — сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента — не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют тестирование — определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида
2. Хромосомные аберрации.
Делеция — утрата участка хромосомы. Происходят обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё — этот ген в хромосоме больше не экспрессируется.
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы — в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Каждый этап клеточного цикла контролируется
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) — две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF — немелкоклеточный рак легкого;
- BRAF — меланома;
- HER2 — рак молочной железы (РМЖ);
- KRAS — колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
опухоли (антионкогены) — напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация в результате мутации — резко увеличивает вероятность появления злокачественной опухоли.
- мутации BRCA1, BRCA2 — рак молочных желез, яичников;
- мутации p53 — до 50% различных видов раковых опухолей, саркомы;
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Иматиниб связывается с активным участком молекулы белка , и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, , иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Кому это нужно?
В этом случае исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.

Опухоли — это патологические образования, которые образуются из-за нарушения роста и дифференцировки клеток. Они могут развиваться практически из любой ткани: эпителиальной, нервной, соединительной, кроветворной и др. В зависимости от того, из какой ткани развилось новообразование выделяют солидные опухоли и гемобластозы.
- Как диагностируют солидный рак
- В каких органах чаще всего развивается солидный рак
- Способы лечения солидного рака
- Химиотерапия при раке
- Иммунотерапия
- Чем опасен солидный рак
- Прогнозы на выздоровление при солидном раке
К группе гемобластозов относят лейкозы, лимфомы и миеломы. Их особенностью является повсеместное распространение по организму, без образования локализованных очагов.
Солидные опухоли могут быть доброкачественными и злокачественными.
- Доброкачественные опухоли состоят из высокодифференцированных зрелых клеток, растут относительно медленно, не прорастают в окружающие ткани, не дают метастазов и чаще всего не представляют смертельной опасности, за исключением опухолей головного и спинного мозга. Иногда они могут самопроизвольно исчезать. Некоторые доброкачественные опухоли могут озлокачествляться (малигнизироваться) и превращаться в рак.
- Злокачественные солидные опухоли (саркомы, карциномы, глиомы) состоят из низко или умеренно дифференцированных клеток. Они быстро увеличиваются в размерах, прорастают окружающие ткани, разрушая их, а также могут давать метастазы (очаги отсеивания, расположенные вдали от первичного новообразования) и оказывают системное воздействие на организм. Они опасны для здоровья и несут смертельную угрозу.
Как диагностируют солидный рак
Методы диагностики солидного рака можно разделить на несколько групп:
Методы, позволяющие обнаружить наличие образования. В некоторых случаях, если рак располагается поверхностно, его можно увидеть во время осмотра или пропальпировать. В остальных случаях на помощь приходят методы медицинской визуализации — УЗИ, КТ, МРТ, рентгенологическое исследование, ПЭТ, эндоскопическое исследование и другие. В некоторых случаях обнаружить рак помогают лабораторные анализы, в частности определение онкомаркеров — особых молекул, количество которых повышается при возникновении той или иной формы новообразования.

Методы, позволяющие верифицировать диагноз. Окончательный диагноз можно поставить только после морфологического исследования опухолевой ткани. Для этого фрагмент новообразования изучают под микроскопом после специального окрашивания. В ряде случаев для уточнения диагноза и определения молекулярно-генетического профиля образования проводят дополнительное тестирование, например, иммуногистохимическое исследование, молекулярно-генетическое тестирование. Это позволит подобрать оптимальную схему лечения, учитывая прогностические особенности рака.
После постановки диагноза необходимо определить стадию заболевания. Здесь на помощь приходят методы лучевой диагностики (то же УЗИ, КТ, МРТ), которые позволяют верифицировать размеры рака, его взаимоотношения с рядом расположенными тканями, вовлечение в процесс лимфатических узлов и наличие метастазов.
В каких органах чаще всего развивается солидный рак
Солидный рак может развиться в любом органе, в котором есть эпителиальные ткани. Чаще всего диагностируются опухоли молочной железы, легких, предстательной железы, желудочно-кишечного тракта.
Способы лечения солидного рака
В рамках лечения солидного рака применяются те же подходы, которые используются во всей онкологии. Ключевыми методами является хирургия, лучевая терапия и химиотерапия.
Хирургические операции в онкологии делятся на две большие группы — радикальные и паллиативные.
Радикальные вмешательства предполагают полное удаление опухоли в пределах здоровых тканей и зоны возможного метастазирования. Здесь выделяют:
- Типовые операции — удаление ткани пораженного органа в оптимальном объеме для достижения радикальности. Также выполняется необходимая лимфодиссекция.
- Комбинированные радикальные вмешательства — удаляется первично пораженный орган, и проводится частичная резекция соседних органов и тканей, на которые распространился рак.
- Расширенные операции — помимо затронутых органов и стандартных групп лимфатических узлов, на которые распространяется рак, удаляют дополнительные группы лимфатических узлов.
Раньше проведение обширных радикальных операций зачастую приводило к инвалидизации больного. Сейчас же идет тенденция не только к его излечению, но и сохранению приемлемого качества жизни. Поэтому совершенствуются хирургические технологии органосохраняющих методик и реконструктивных операций после удаления рака.
- Паллиативные вмешательства. Они проводятся при наличии отдаленных метастатических очагов. На первом этапе предполагается удаление первичного опухолевого очага в радикальном объеме. Вторым этапом проводятся попытки лечения метастазов, если это возможно. В целом такие операции не подразумевают полного излечения и проводятся для улучшения состояния больного и облегчения тягостных симптомов.
- Симптоматические паллиативные операции. Они выполняются по жизненным показаниям, при развитии осложнений рака. Ликвидации опухоли они не предусматривают и направлены восстановление жизненно важных функций, например, дыхания, отведение кишечного содержимого, возобновление пассажа желчи, остановку кровотечения и др.
Лучевая терапия предполагает использование ионизирующего излучения в дозировках, приводящих к гибели раковых клеток. Все методы можно разделить на три большие группы — дистанционная лучевая терапия, контактная лучевая терапия и системная лучевая терапия.
При дистанционной лучевой, терапии источник ионизирующего излучения находится за пределами тела пациента на определенном расстоянии. При таком лечении используется сложное высокотехнологичное оборудование, которое генерирует определенный вид ионизирующего излучения (ИИ). При помощи специальных технологий производят распределение его дозы таким образом, чтобы максимально полно облучить рак и минимально затронуть не вовлеченные в процесс ткани.
При контактной лучевой терапии ИИ располагается либо непосредственно возле раковой опухоли, либо в ее толще. Здесь выделяют:
- Аппликационную ЛТ. Таким методом лечатся поверхностно расположенные опухоли, например, рак кожи, рак вульвы или рак влагалища.
- Внутриполостная ЛТ — ИИ вводят в полость полого органа (матка, желудок, мочевой пузырь и др) с помощью специального аппликатора, заполненного радиоактивным материалом. Таким методом лечится рак полых органов.
- Внутритканевая ЛТ — ИИ вводят непосредственно в раковую опухоль с помощью игл или трубочек, заполненных радиоактивным материалом. Таким методом может лечиться рак простаты, рак тела матки, рак шейки матки, рак желудка и др.
Как правило, контактную лучевую терапию сочетают с дистанционной ЛТ, что позволяет максимально сфокусировать воздействие ионизирующего излучения на раковой опухоли, при этом минимально затронув окружающие ткани.
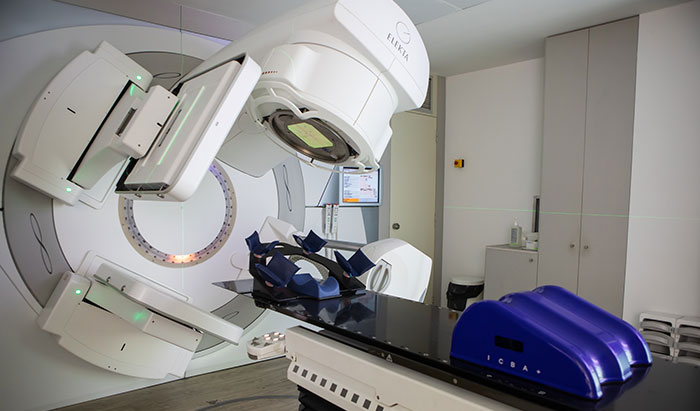
Эффективность этого метода лечения основана на том, что опухоли захватывают определенные молекулы и используют их для своего дальнейшего роста. Если на эти молекулы присоединить радиоактивные изотопы, они избирательно накопятся в опухолевой ткани и разрушат ее. Как правило, таким образом проводят лечение отдаленных метастазов.
Химиотерапия при раке
Для лечения рака разработано большое количество химиотерапевтических препаратов. По оказываемому эффекту их разделяют на цитостатические и цитотоксические препараты. Цитостатики нарушают процессы размножения раковых клеток, что в конечном итоге приводит к их гибели. Цитотоксические препараты направлены на непосредственное уничтожение клеток. Химиотерапия при раке предполагает несколько курсов лечения, которые чередуются с перерывами. Это связано с двумя моментами:
- Раковые клетки имеют жизненный цикл, который состоит из активной фазы и фазы покоя. Химиотерапия действует только на активные клетки.
- Химиотерапия оказывает токсическое действие на организм, поэтому нужно время для его восстановления.
Химиотерапии солидного рака проводится в рамках комбинированного лечения совместно с хирургией или лучевой терапией. Ее преимуществом является системное воздействие на организм, что помогает уничтожить как злокачественные клетки, которые остались в первичном очаге после удаления опухоли, так и метастазы.
Иммунотерапия
Иммунотерапия является одним из новых методов лечения солидного рака. Суть метода заключается в коррекции противоопухолевого иммунного ответа, что позволит организму уничтожить рак с помощью собственных ресурсов. Вторым направлением иммунотерапии является работа с самой опухолью, которая вырабатывает определенные вещества, делающие ее незаметной для иммунной системы. Если рак демаскировать, иммунитет его уничтожит.
Чем опасен солидный рак
Солидный рак зачастую характеризуется агрессивным течением и, за редким исключением, метастазированием. При отсутствии лечения, первичная опухоль будет разрастаться, захватывая новые ткани и нарушая работу вовлеченных органов. Это чревато самыми разнообразными осложнениями, начиная от кровотечений и заканчивая кишечной непроходимостью, нарушением дыхания, болевым синдромом, неврологическими проявлениями.
По мере нарастания опухолевой массы, рак оказывает системное воздействие на организм — развивается истощение и слабость. В конце концов при отсутствии специальной помощи человек погибает.
Прогнозы на выздоровление при солидном раке
Прогноз на выздоровления при солидных опухолях определяется видом рака, степенью его дифференцировки и стадией на момент установки диагноза. Чем раньше начато лечение, тем более благоприятный прогноз.
Читайте также:





