Кислородные соединения с хлором
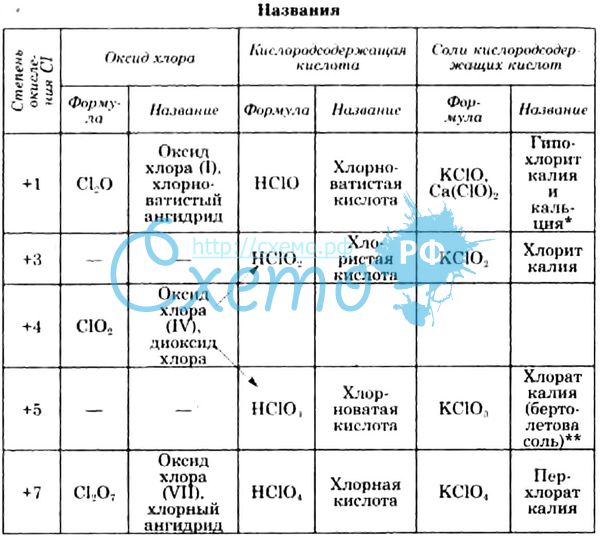
Хлор образует 4 кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорнотистая кислота (HClO) образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода:
В присутствии водоотнимающих веществ образуется оксид хлора (I):
Cl2О можно считать ангидридом хлорноватистой кислоты. При нагревании хлорноватистая кислота разлагается с образованием 2-х кислот - соляной и хлорноватой:
3 НСlO = 2 НСl + НСlO3.
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот:
6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О.
Соли хлорноватистой кислоты - гипохлориты - очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоде. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлорноватая кислота (НСlO3) образуется при действии на ее соли - хлораты - серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах.
При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается с взрывом.
Разложение с взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
Соли хлорноватой кислоты образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты - довольно сильные окислители:
Хлораты применяются для производства взрывчатых веществ, а также для получения кислорода в лабораторных условиях и солей хлорной кислоты - перхлоратов. При нагревании бертолетовой соли в присутствии диоксида марганца (МnО2), играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
Это самая сильная кислота. Она наиболее устойчива из всех кислородсодержащих кислот хлора, однако, безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться с взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли:
2 Н + + 2 е - = Н2↑(на катоде);
СlО3 - - 2 е - + Н2О = СlO4 - + 2 Н + (на аноде).
Хлористая кислота (НСlO2) образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
Хлориты натрия используются для получения диоксида хлора, при обеззараживании воды, а также как отбеливающий агент.
Хлорная, или белильная, известь (СаОСl2), или СаСl(СlO), образуется при взаимодействии хлора с порошкообразным гидроксидом кальция - пушенкой:
Качество хлорной извести определяется содержанием в ней гипохлорита. Она обладает очень сильными окислительными свойствами и может окислять даже соли марганца до перманганата:
Под действием углекислого газа, содержащегося в воздухе, она разлагается с выделением хлора:
Хлорная известь применяется как отбеливающее и дезинфицирующее вещество.
Кислородные соединения хлора получают косвенным путем. Наиболее устойчивыми являются соли кислородных кислот, наименее – сами кислоты и оксиды.
| Кислота | +1 HClO хлорноватистая | +3 HClO2 хлористая | +5 HClO3 хлорноватая | +7 HClO4 хлорная |
| Соли | гипохлориты | хлориты | хлораты | перхлораты |
При взаимодействии хлора с водой образуется соляная и хлорноватистая кислоты:
Cl2 + H2O HCl + HClO (хлорная вода)
Это реакция самоокисления-самовосстановления хлора.
Хлорноватистая кислота неустойчивая и разлагается HClO HCl + О, атомарный кислород обладает отбеливающим и дезинфицирующим действием. Хлорноватистая кислота диссоциирует: HClO H + + ClО - гипохлорит-ион. Большое практическое применение находят раствор хлора в водном растворе Ca (OH)2 (гашеная известь). Эта смесь называеся хлорной (белильной) известью:
или в молекулярно-ионной форме:
Cl2 + 2 OH - = Cl - + OCl - + H2O т.е.,
хлорная известь – это смешанная соль соляной и хлорноватистой кислот:
Хлорную известь используют для дезинфекции помещений, различных источников распространения болезнетворных бакьерий:
Ca (OCl)2 Ca 2+ + 2 OCl -
2 ClO - + 2 HOH 2 HClO + 2 OH -
Хлорную известь добавляют в побелку (отбеливающее действие).
2 HClO = 2 HCl + 2 O
ХЛОРИСТАЯ кислота HClO2 неустойчива, по силе и окислительной способности она занимает промежуточное положение между хлорноватистой и хлорноватой кислотами.
ХЛОРНОВАТАЯ кислота HClO3 существует только в растворах, сильная кислота и энергечный окислитель, хотя ее соли в растворах не обладают окислительными свойствами. Все соли HClO3 (хлораты) – ядовиты).
Окислительные свойства хлората калия KClO3 (бертолева соль) позволяют широко применять его в пиротехнике и в спичечном производстве. Применяют в качестве гирбицида. Сильно ядовит, действует на красные кровавые тельца.
ХЛОРНАЯ кислота HClO4 самая устойчивая из всех кислородных кислот хлора. Относится к сильным кислотам. Окислительные сойства ее выражены слабее, чем у хлорноватой кислоты, а кислотные – сильнее.
Водные растворы HClO4 устойчивы при хранении, а безводная HClO4 малоустойчива, и взрывается даже при сотрясении. Большинство солей хлорной кислоты – перхлораты хорошо растворимы в воде (иск. KClO4).
Т.О., Сравнивая выводы по свойствам кислородных кислот хлора, можно сделать следующие выводы:
1) С увеличением степени окисления хлора устойчивость его кислородных кислот в ряду HClO, HClO2, HClO3, HClO4 растет, а их окислительные свойства ослабевают. Самым сильным окислителем является хлорноватистая кислота HClO.
2) Сила кислородных кислот возрастает с увеличением степени окисления в этом же ряду. Самая слабая кислота хлорноватистая, самая сильная – хлорная.
Увеличение силы и устойчивости кислот
Увеличивается окислительная активность кислот
Усиление кислотных свойств в указанном ряду может быть объяснено ослаблением связи Н – О, вызванным увеличением положительного эффективного заряда атома хлора и, следовательно, большим его притяжением к атомам кислорода. Кроме того, с ростом заряда атома усиливается взаимное отталкивание одноименно заряженных атомов водорода и хлора. Эта общая закономерность ослабления связи Н – О с увеличением положительного эффективного заряда центрального атома (серы, азота, и др. элементов) наблюдается у всех кислородсодержащих кислот.
1.Кислородные соединения хлора получают косвенным путем. Наиболее устойчивыми являются соли кислородных кислот, наименее – сами кислоты и оксиды.
| Кислота | +1 HClO хлорноватистая | +3 HClO2 хлористая | +5 HClO3 хлорноватая | +7 HClO4 хлорная |
| Соли | гипохлориты | хлориты | хлораты | перхлораты |
2.Сравнивая выводы по свойствам кислородных кислот хлора, можно сделать следующие выводы:
1) С увеличением степени окисления хлора устойчивость его кислородных кислот в ряду HClO, HClO2, HClO3, HClO4 растет, а их окислительные свойства ослабевают. Самым сильным окислителем является хлорноватистая кислота HClO.
2) Сила кислородных кислот возрастает с увеличением степени окисления в этом же ряду. Самая слабая кислота хлорноватистая, самая сильная – хлорная.
Увеличение силы и устойчивости кислот
Увеличивается окислительная активность кислот
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее - оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO - бромноватистая кислота (соли гипобромиты), HIO - иодноватистая кислота (соли гипоиодиты).
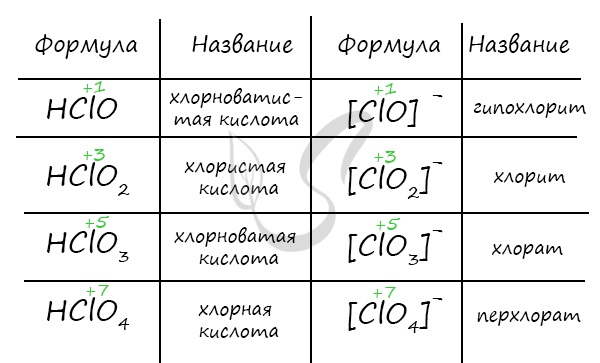
HIO3 - иодноватая кислота (соли иодаты), HBrO3 - бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
- Хлорноватистая кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.

В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.

Хлористая кислота может быть получена из собственных солей - хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе - хлорная кислота - может быть получение реакцией перхлората калия или натрия с концентрированной серной кислотой.

- Кислотные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная - к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.

KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
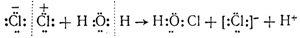
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
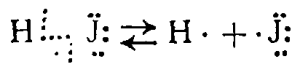
и электролитическая диссоциация иодистого водорода при растворении в воде:
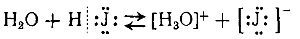
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
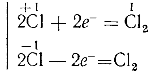
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
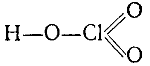
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
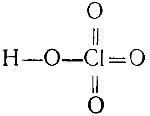
Строение хлорной кислоты выражается формулой
Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
Хлор
Фтор
Главная подгруппа VII группы
У элементов главной подгруппы, которые называются "галогены", на внешнем электронном уровне, имеющем общее строение . ns 2 p 5 , не достает одного электрона до устойчивого восьмиэлектронного уровня. Энергия сродства к электрону достаточно велика и галогены очень активны по отношению к металлам и неметаллам. Бурно идут реакции с водородом, образующиеся галогеноводороды растворяясь в воде дают кислоты сила которых растет сверху вниз по группе. Фтор, не имеющий d-подуровня, проявляет в своих соединениях только степень окисления -1, остальные галогены могут проявлять степени окисления -1, +1, +3, +5, +7.
В природе встречается в виде CaF2 – флюорит, KHF2 – бифторид. Простое вещество F2 в промышленности получают электролизом расплава бифторида. F2 - газ желтоватого цвета с удушающим запахом, крайне ядовит, химически чрезвычайно активен.
Химические свойства
1. Фтор взаимодействует со всеми простыми веществами, кроме гелия, неона и аргона :
2. При взаимодействии F2 со щелочами образуется фторид кислорода (OF2):
OF2 - бесцветный газ, по запаху напоминает озон, сильно ядовит. Это единственное соединение, где кислород имеет степень окисления +2.
3. Так как взаимодействие F2 + H2 = 2HF происходит со взрывом, фтористый водород получают не прямым синтезом, а по реакции:
HF - легко кипящая жидкость (Ткип.= +20 о С), с водой смешивается в любых соотношениях. 40%-ный раствор HF в воде называется плавиковой кислотой. Плавиковая кислота – кислота средней силы. Это вещество одно из самых опасных по физиологическому воздействию: ядовита, при попадании на кожу вызывает долго не заживающие язвы, разрушает зубы. Органику обугливает эффективней серной кислоты.
В растворе молекулы плавиковой кислоты сильно ассоциированы за счет водородных связей. Наиболее прочны димеры, поэтому правильнее записывать формулу плавиковой кислоты следует в виде H2F2. Известны многочисленные соли этого димера (KHF2 и др).
4. Практическое значение имеет реакция взаимодействия плавиковой кислоты с оксидом кремния (он входит в состав стекла):
Эта реакция лежит в основе нанесения узоров и рисунков на стекло.
Применение. F2 используется при производстве фторорганических соединений, например фторопласта (тефлона). Тефлон - белый плотный полимер, устойчивый во всех агрессивных средах вплоть до +350 o С. Фтор придает высокую эластичность резине в интервале температур от -80 о С до +200 о С.
В природе встречается в виде различных соединений, основным из которых является NaCl – поваренная соль, электролизом водного раствора которой на аноде получают хлор. Простое вещество Cl2 - газ желто-зеленого цвета. При -34 о С легко сжижается. Ядовит. Плохо растворим в воде.
Химические свойства
1. Хлор обладает несколько меньшим сродством к электрону, чем фтор, однако остается очень активным неметаллом. Многие реакции с участием Cl2 идут со взрывом. Cl2 является сильным окислителем. Не реагирует с кислородом, углеродом, азотом. Вступает в реакции со сложными молекулами:
2NO + Cl2 = 2NOCl – хлористый нитрозил;
Хлорированием метана в промышленности получают следующие соединения:
CHCl3 + Cl2 = CCl4 – четыреххлористый углерод
2. Хлористый водород можно получить прямым синтезом из простых веществ:
эта реакция относится к фотохимическим, т. е. идущая под действием света.
В лабораторных условиях хлористый водород обычно получают из NaCl при нагревании с концентрированной серной кислотой:
Хлористый водород – газ с резким запахом, хорошо растворимый в воде с образованием соляной кислоты (предел растворимости 38%). Соляная кислота сильнее, чем плавиковая, не ядовита. В концентрированном состоянии является восстановителем:
HClO – хлорноватистая кислота. Ей соответствует кислотный оксид Cl2O. Соли называются гипохлоритами.
HClO2 – хлористая кислота. Кислотный оксид Cl2O3 не получен. Соли – хлориты.
HClO3 – хлорноватая кислота. Кислотный оксид Cl2O5 не получен. Соли – хлораты.
HClO4– хлорная кислота. Кислотный оксид - Cl2O7. Соли – перхлораты.
1) HClO – желтоватая жидкость. Существует только в растворах. Получается при взаимодействии хлора с водой (без нагревания):
Соли этой кислоты получаются при действии на щелочь хлора:
2KOH + Cl2 = KClO + KCl + H2O
используется как отбеливатель в текстильной промышленности.
2) HClO2, HClO3 – не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в пиротехнике и взрывных работах. Наибольшее значение имеет KClO3 – хлорат калия (бертолетовая соль), получаемая насыщением горячей щелочи хлором:
Хлораты - сильнейшие окислители. При ударе или нагревании взрываются.
3) Известен оксид ClO2, который можно получить по реакции:
ClO2 – зелено-желтый газ, при растворении в воде дает смесь кислот:
4) Осторожным нагреванием хлораты можно перевести в перхлораты, из которых можно получить хлорную кислоту:
Хлорная кислота HClO4 – подвижная жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти все ее соли хорошо растворимы в воде.
5) В ряду HClO - HClO2 - HClO3 - HClO4 сила кислот растет, а окислительная способность падает.
Хлор находит широкое применение в химической промышленности для получения хлористого водорода и соляной кислоты, синтеза хлорорганических веществ, обеззараживания питьевой воды, в текстильной промышленности для отбеливания тканей, в производстве ядохимикатов.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:

