Иммунотерапия при раке поджелудочной железы препараты
Клетки рака поджелудочной железы переваривают собственные белки, которые могут выдать их иммунной системе.
Иммунитет должен уничтожать не только вирусы с бактериями, но и злокачественные клетки. Но у злокачественных клеток есть разные уловки, которые позволяют им оставаться незаметными для иммунитета. Однако если иммунной системе, так сказать, открыть глаза, то она увидит опухоль и начнёт её истреблять. Суть иммунотерапии в том и заключается, чтобы активировать противораковые свойства иммунитета. Здесь используют разные подходы, и два иммунотерапевтических открытия даже удостоились недавно Нобелевской премии.
Но разные виды рака по-разному реагируют на иммунотерапию, и рак поджелудочной железы в этом смысле один из самых стойких. Он не реагирует как раз на «нобелевские « методы терапии, основанные на том, что у иммунитета в прямом смысле отключают тормоза.
У иммунной системы есть предохранители, клетки и молекулы, которые следят, чтобы защитная реакция была по делу и адекватна угрозе – чтобы иммунитет не впадал в агрессию без повода и чтобы иммунная активность утихала по мере исчезновения опасности. В число таких предохранителей входят белки PD-1 и CTLA-4, сидящие на поверхности Т-лимфоцитов, которые обычно уничтожают больные клетки, в том числе и раковые.
PD-1 и CTLA-4 успокаивают Т-лимфоциты, то есть если PD-1 и CTLA-4 активны, Т-лимфоциты никого не убивают. Раковые клетки как раз поддерживают PD-1 и CTLA-4 во включённом состоянии, так что иммунитет опухоль игнорирует. Но если отключить PD-1 и CTLA-4 – иными словами, сорвать лимфоцитам тормоза – то иммунная система начнёт охотиться на раковые клетки.
Но и Т-лимфоциты с сорванными тормозами всё равно почему-то не трогают клетки рака поджелудочной железы. Тут может быть несколько причин. Во-первых, активность иммунных клеток зависит не только от этих двух белков. И в самой раковой опухоли могут быть какие-то другие клетки, которые усыпляют бдительность Т-лимфоцитов, используя какие-то другие клеточно-молекулярные механизмы. Во-вторых, собственно у раковых клеток могут быть особенности, из-за которых лимфоциты просто не могут их обнаружить.
Почему иммунные клетки начинают атаковать раковые? Потому что иммунные клетки чувствуют на поверхности раковых клеток особые молекулы, которые выдают раковые клетки с головой. Но особые раковые молекулы не появляются на поверхности клеток просто так. На днях мы писали о белках главного комплекса гистосовместимости (MHC), или человеческих лейкоцитарных антигенах (HLA), которые служат чем-то вроде клеточного паспорта: они сидят на клеточной мембране и держат на себе обломки разных клеточных белков.
Иммунные клетки проверяют, что держат на себе белки MHC: если они держат обломки обычных клеточных белков, то клетка здорова и трогать её не надо; если же они держат обломки вирусных или бактериальных молекул, то клетка инфицирована и её нужно уничтожить. И если белки MHC держат обломки других белков, которые присущи раковым клеткам, то такую клетку тоже нужно уничтожить.
Говорят, что белки MHC занимаются презентацией антигенов – молекул, на которые иммунная система может отреагировать. И если в генах MHC случается мутация, то они уже не могут показывать иммунным клеткам разные антигены, или показывают их плохо. Некоторые раковые клетки спасаются от иммунитета как раз благодаря тому, что в генах MHC у них мутированы.
Но рак поджелудочной железы в этом смысле особенный: мутации в генах MHC у него встречаются не более чем в 1% случаев, и одновременно в клетках рака поджелудочной в более чем 60% случаев уровень MHC ниже должного, или же MHC вовсе отсутствуют (что особенно заметно у метастазных клеток).
Исследователи из Нью-Йоркского университета пишут в Nature, что клетки рака поджелудочной избавляются от белков MHC с помощью важного клеточного процесса под названием аутофагия. С помощью аутофагии клетка переваривает ставшие ненужными белки и целые органеллы, чтобы из их запчастей снова сделать что-нибудь полезное (кстати, за расшифровку механизма аутофагии тоже дали Нобелевскую премию несколько лет назад). То, что нужно переварить, расщепить, разобрать на части, метится специальной меткой, после чего помеченный мусор упаковывается в мембранный пузырёк – аутофагосому; потом аутофагосома сливается с другим мембранным пузырьком – лизосомой, которой содержатся расщепляющие ферменты.
Если у подопытных мышей с раком поджелудочной аутофагию каким-то образом подавляли, то у мышей активировались Т-лимфоциты, задача которых была в истреблении раковых клеток – эти Т-лимфоциты массово приходили в опухоль, а если мышам ещё и давали иммунотерапевтические препараты, то болезнь у животных заметно отступала.
На самом деле, как пишет портал Nature, специалисты давно знали о том, что для рака поджелудочной железы аутофагия очень и очень важна; неясно было только, чем именно аутофагия так полезна именно раковым клеткам. Также сравнительно давно блокируют одну из стадий аутофагии; оба вещества, которые уже не одно десятилетие используют как средство от малярии, испытывали против злокачественных опухолей, но результаты тогда получались не слишком выдающиеся.
Возможно, что после новых данных интерес к противораковым свойствам хлорохина снова воскреснет, и рак поджелудочной железы можно будет успешно лечить иммунотерапевтическими методами, усиленными этим противомалярийным средством или же его аналогом.
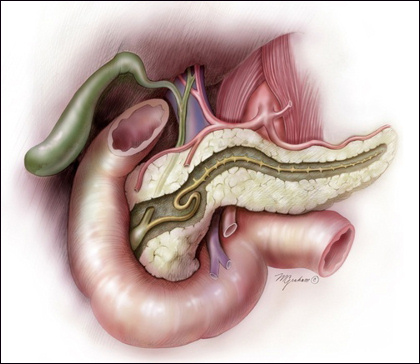
Рак поджелудочной железы (РПЖЖ) — это одно из самых смертельных заболеваний среди солидных опухолей. Ежегодно регистрируется более 250000 смертей от рака поджелудочной железы. Он является восьмой по частоте причиной смерти от злокачественных новообразований у мужчин и женщин во всем мире, а заболеваемость РПЖЖ варьируется от 1 до 10 случаев на 100000 человек. Проблема рака поджелудочной железы актуальна в современной медицине, так как большинство пациентов с локальным или метастатическим РПЖЖ не являются кандидатами на лечебную резекцию из-за чрезвычайно неблагоприятного прогноза.
Несмотря на огромный прогресс в лечении других злокачественных опухолей благодаря прорыву в иммунотерапии рака, лечение рака поджелудочной железы развивалось медленно в течение последних двух десятилетий. Неэффективность иммунотерапии РПЖЖ объясняется несколькими факторами, в том числе слабой иммуногенностью опухоли (мутантные белки, экспрессируемые на поверхности опухолевых клеток РПЖЖ, обладают слабыми антигенными свойствами, по сравнению, к примеру, с антигенами меланомы или рака легкого), а также наличием иммуносупрессивных свойств как у самой опухоли, так и у ее микроокружения. Не последнюю роль в резистентности к терапии играет десмопластическая строма опухоли, состоящая из фибробластов, клеток поджелудочной железы, иммунных клеток, кровеносных сосудов и белков внеклеточного матрикса. Помимо уже упомянутых иммуносупрессивных свойств, она играет роль физического барьера, препятствующего доставке терапевтических агентов к опухолевым клеткам. Взаимодействие опухолевых клеток с микроокружением может приводить как к усилению роста опухоли и подавлению иммунного ответа на нее, так и к нарушению ее развития, что делает опухолевое микроокружение хорошей целью для терапевтического воздействия. Совокупностью этих факторов обосновывается неэффективность традиционной иммунотерапии. Это поднимает необходимость разработки и внедрения новых, улучшенных способов лечения РПЖЖ с помощью различных иммунологических методик, а также подготовки комбинированных схем терапии с применением различных препаратов или иных методов (например, лучевая терапия).
Устранение иммуносупрессивных свойств опухолей — это один из зарекомендовавших себя подходов в иммунотерапии рака. Ингибирование иммуносупрессивных молекул CTLA-4 и PD-1 — неплохой метод, который проявил себя в лечении таких видов рака как меланома, уротелиальная карцинома, рак почки, гепатоцеллюлярный рак и др. CTLA-4 (цитотоксический лимфоцитарный антиген 4) представляет собой ингибирующий рецептор, локализующийся на CD4+ и CD8+ лимфоцитах. Его экспрессия повышена в опухолях, и было показано, что блокада CTLA-4 вызывает противоопухолевый иммунный ответ. Препарат ипилимумаб — это человеческое моноклональное антитело, нацеленное на CTLA-4. Однако несмотря на его эффективность в терапии других опухолей, клинические испытания ипилимумаба в терапии РПЖЖ не показали эффективных результатов. Другой супрессивной молекулой является programming death 1 (PD-1, рецептор запрограммированной смерти 1). Он экспрессируется на эффекторных Т-лимфоцитах, B-лимфоцитах, NK-клетках и Treg. При связывании со своим лигандом PD-1L этот рецептор активирует ингибирование активации и пролиферации лимфоцитов. Терапия моноклональными антителами против PD-1 (препараты пембролизумаб и ниволумаб) также была эффективна при лечении солидных опухолей, таких как меланома, рак почки и урогенитальная карцинома. Также применяются моноклональные антитела против PD-1L (атезолизумаб). Однако клинические испытания на РПЖЖ не показали эффективности данных методов.
Другим подходом к лечению злокачественных новообразований является стимуляция собственного иммунитета организма пациента с помощью противоопухолевых вакцин. Такие вакцины предназначены для увеличения представления опухолевых антигенов и активации антигенспецифичных эффекторных Т-лимфоцитов и Т-клеток памяти. Выявлено несколько антигенов, которые экспрессируются в большинстве опухолей поджелудочной железы, как например карциноэмбриональный антиген (СЕА), муцин-1 (MUC-1) и белок, кодируемый мутированным геном KRAS. В настоящее время несколько вакцин были испытаны для терапии РПЖЖ. GVAX — это клеточная вакцина, в которой модифицированные клетки рака поджелудочной железы экспрессируют гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Фаза I клинических испытаний показала безопасность данной вакцины, однако эффект от терапии был неоднозначный. Несмотря на то, что не было выявлено улучшения однолетней и общей выживаемости в группах пациентов, получавших данную вакцину в сочетании с химиолучевой терапией, и пациентов, получавших только адъювантную лучевую терапию, подгруппа пациентов с длительной безрецидивной выживаемостью показала увеличение опухолеспецифичных CD8+ Т-лимфоцитов после вакцинации. Это демонстрирует, что данная методика может использоваться в отношении некоторой группы пациентов. Другой тип вакцин, на основе опухолевых пептидов, также был исследован. Вакцина на основе мутантного белка KRAS, который мутирует больше чем в 90 % случаев РПЖЖ, давала появление иммунного ответа у 58 % пациентов, причем медиана выживаемости среди таких пациентов была в два раза выше, чем у группы, не развивших иммунный ответ. Другая мультипептидная вакцина OCV-C01, содержащая фрагменты рецептора фактора роста эндотелия сосудов 1 и 2 (VEGFR1 и VEGFR2 соответственно), а также белка семейства кинезина (KIF20A), была исследована на пациентах с РПЖЖ. 58,6 % испытуемых показали развитие иммунного ответа на KIF20A, что сопровождалось значительным улучшением безрецидивной выживаемости. Данные результаты свидетельствуют о перспективности использования противоопухолевых вакцин и необходимости установления новых антигенных детерминант, более специфичных для РПЖЖ.
Хорошие результаты вакцин и важность иммуносупрессивных свойств микроокружения опухоли для успешной терапии дают обоснования для комбинирования данных методик в терапии РПЖЖ. Клиническое исследование комбинированной терапии ипилимумабом и вакциной GVAX показало эффективность данного подхода, по сравнению с монотерапией ипилимумабом, а также безопасность данного сочетания препаратов. Эффективной оказалась и комбинация GVAX с ингибиторами PD-1, которая демонстрировала значительное увеличение средней общей выживаемости по сравнению с монотерапией. В группе пациентов, получавших оба препарата, обнаруживалось увеличение CD8+ T-лимфоцитов, продуцирующих IFN-gamma. Было показано, что пациенты, получавшие GVAX за 2 недели до резекции опухоли, демонстрировали увеличение уровня PD-L1, что указывает на один из механизмов иммунорезистентности. Таким образом, комбинация вакцин и ингибиторов иммуносупрессивных молекул является обоснованной и перспективной схемой терапии, требующей дальнейших исследований.
Новым подходом к лечению РПЖЖ являются методики, воздействующие на определенный компоненты стромы рака поджелудочной железы, о роли которой в резистентности к терапии было упомянуто ранее. Мезенхимальная строма РПЖЖ содержит большое количество фибробластов, продуцирующих белок-α активирующий фибробласты (FAP-α). Высокая экспрессия этого белка коррелирует с худшим прогнозом заболевания. В эксперименте на мышах ликвидация клеток, экспрессирующих FAP-α, повышала эффективность противоопухолевых вакцин. Эффективными оказались и комбинации данной методики с анти-CTLA-4 и анти-PD-L1 препаратами. Другое исследование было направлено на блокаду рецептора колониестимулирующего фактора 1 (CSF1R), который экспрессируется на ассоциированных с опухолью М2-макрофагах и супрессорных миелоидных клетках (MDSC). Данные клетки обладают способностью блокировать цитотоксический иммунный ответ. Ингибирование CSF1R в сочетании с химиотерапией улучшает противоопухолевый иммунитет. В мышиной модели трансплантации РПЖЖ лечение ингибиторами CSF1R приводило к усилению инфильтрации опухоли Т-клетками, однако эти клетки демонстрировали повышенные уровни CTLA-4, а также наблюдалось усиление экспрессии PD-L1 в опухоле. Этот факт делает обоснованным сочетание ингибиторов CSF1R и анти-CTLA-4, анти-PD-L1 препаратов. IMC-CS4 является CSF1R-антителом, которое в настоящее время проходит клинические испытания в сочетании с GVAX и анти-PD1 терапией. Еще одна важная молекула, а точнее пара молекул, была исследована в качестве мишени для терапии РПЖЖ. Хемокин CXCL12 широко представлен в микроокружении опухоли, а его рецептор CXCR4 экспрессирован на опухолевых клетках. Показано, что CXCL12 способствует хемотаксису опухолевых клеток, что указывает на перекрестное клеточное взаимодействие между опухолевыми клетками и стромой. Это взаимодействие оказалось значимым для иммунорезистентности РПЖЖ, так как при обработке опухоли AMD3100 моноклональным антителом к CXCR4, регистрировалось снижение роста опухоли, зависимое от Т-лимфоцитов. Комбинация AMD3100 с анти-PD-L1 препаратом также оказалась эффективной. На данный момент AMD3100 находится в I фазе клинических испытаний в качестве терапии РПЖЖ под торговым названием Мозобил (Mozobil). Помимо ингибирующих агентов моноклональные антитела могут использоваться и как агонисты различных рецепторов. CD40 является молекулой, располагающейся на поверхности иммунных клеток. При связывании со своим лигандом CD40L (который экспрессирован на CD4+ Т-хелперных клетках) активирует антигенпредставляющие клетки. Было продемонстрировано, что усиление действия CD40 повышает эффективность противоопухолевых вакцин. Моноклональные антитела, активирующие CD40, приводили к регрессии опухоли в сочетании с химиотерапией в доклинических исследованиях. В клинических испытаниях I фазы терапия агонистом CD40 в сочетании с химиотерапией привела к иммунному противоопухолевому ответу в 19 % случаев у пациентов с неоперабельной формой РПЖЖ. В мышиных моделях, сочетание анти-PD-1 или анти-CTLA-4 препаратов с агонистами CD40 усиливало противоопухолевый иммунитет. 39 % мышей, получавших подобную схему терапии, демонстрировали длительную полную ремиссию и продолжительную выживаемость. Также терапия привела к уменьшению Treg и увеличению CD8+ Т-лимфоцитов в микроокружении опухоли. Важно, что в экспериментах на мышах сочетание CD40 агонистов с анти-PD-1 или анти-CTLA-4 препаратами показало улучшенную среднюю выживаемость по сравнению с комбинацией химиотерапии и CD40 агониста. На данный момент моноклональное антитело-агонист CD40 R07009789 проходит клинические испытания в комбинации с химиотерапией и ингибиторами супрессорных молекул.
Таким образом, рак поджелудочной железы является важной проблемой в современной медицине. Традиционные подходы иммунотерапии, такие как ингибиторы иммуносупрессивных молекул и противоопухолевые вакцины, малоэффективны в качестве монотерапии при РПЖЖ. В то же время, комбинации специальных препаратов, воздействующих на компоненты микроокружения опухоли с традиционной иммунотерапией и химиотерапией показали многообещающие результаты. Требуется дальнейшее всестороннее изучение данного злокачественного новообразования для разработки эффективных методов лечения, в том числе и иммунотерапии.
Источники:
- Torphy R. J., Zhu Y., Schulick R. D. Immunotherapy for pancreatic cancer: Barriers and breakthroughs //Annals of Gastroenterological Surgery. — 2018.
- Bhosale R. R. et al. Current Perspectives on Novel Drug Carrier Systems and Therapies for Management of Pancreatic Cancer: An Updated Inclusive Review // Critical Reviews™ in Therapeutic Drug Carrier Systems. — 2018. — Т. 35. — №. 3.
64-хлетний мужчина, страдающий сахарным диабетом II типа, жаловался на боли в верхней половине живота и выраженное снижение аппетита, когда обратился в клинику 4 ноября 1999 года. Эндоскопия выявила нечеткое образование в слизистой стенке желудка. После проведения биопсии был поставлен диагноз: рак желудка первой стадии. На передней стенке желудка было также выявлено еще одно поражение. КТ исследование показало, что это поражение – рак поджелудочной железы. Опухоль проникла в стенку желудка и достигла большого распространения. Были также выявлены множественные метастазы в печень со скоплением асцитической жидкости в животе. Опухолевые маркеры: РЭА и СА были повышены (258.0нг\мл и19-9 – 28600 ед\мл соответственно), таковы результаты на 5 ноября 1999. Проведение хирургического лечения в таком случае невозможно, поэтому была проведена химиотерапия. Так как пациент пожелал проведение лечения амбулаторно, то ему были выписаны противораковые препараты, которые вызывают наименьшие побочные эффекты (Фуртулон, 1 200 мг за 1 раз и Эндоксан, 200 мг за 1 раз).
Продолжалась консервативная терапия и наблюдение за пациентом в течение некоторого времени, но опухолевые маркеры быстро росли (РЭА: 460.0 нг\мл, СА19-9: 54 000 ед\мл), потеря аппетита и боль усиливались. Примерно 2 месяца спустя, по просьбе пациента начата альтернативная терапия производной арабиноксиланаиз экстракта рисовых отрубей (BioBran, производитель компания DaiwaPharmaceuticals, Co., Ltd) и ACM π-водой (торговое название MRN-100A, производитель компания ACMCo., Ltd) с 7 января 2000 года π-вода усиливает циркуляцию крови, перенос питательных веществ и медицинских препаратов.
Примерно через месяц после начала лечения, рост опухолевых маркеров был остановлен (РЭА 441 нг\мл; СА19-9 61,000 ед\мл), улучшился аппетит и уменьшилось количество асцитической жидкости. Одновременно было отмечено повышение веса тела. Однако, по показаниям снимков КТ, диаметр опухоли поджелудочной железы составил 5 см и метастазы в печени остались без изменений. 31 марта 2000 года (3 месяца после лечения) показания опухолевых маркеров резко пошли на спад (РЭА 93.6 нг\мл, СА19-9 – 6,300 ед\мл). КТ снимки показали явное уменьшение рака поджелудочной железы и метастазов в печени. Диаметр рака поджелудочной железы практически не поддавался измерению, также сократились и метастазы в печени. Эндоскопическое исследование показалоявное уменьшение опухоли в слизистой. 20 декабря 2000 года практически не выявлялось патологий, кроме язвы в виде шрама. Образование на передней стенке желудка полностью исчезло. Биопсия не обнаружила никаких опухолевых клеток.
Пациенту с прогрессирующим раком последней стадии прогнозировали только 3 месяца жизни при первом посещении. Однако прием производной арабиноксилана из экстракта рисовых отрубей и π-воды, в дополнение к Фуртулону произвел значительный терапевтический эффект. Пациент скончался от кровотечения в другой больнице 13 апреля 2001 года. Смерть не была связана с раком, так как не было выявлено повышения в показаниях опухолевых маркеров. Что касается качества жизни, то пациент смог прожить нормальной жизнью примерно 17 месяцев.
Следует отметить, что у пациента был нарушен обмен сахара из-за рака поджелудочной железы, но терапия альтернативными средствами позволила легко контролировать уровень сахара в крови, поддерживать аппетит и хорошее самочувствие. Данная терапия – это возможность продления жизнибольных раком на последних стадиях, сохраняя при этом физическую силу пациента и поддерживая их качество жизни.
*Подготовлено по материалам статьи, опубликованной в мае 2004: Clinical Pharmacology and Therapy, Vol. 14 №3.

Исследования, проведенные в Лондонском Университете Королевы Марии в Лондоне, показали эффективность перспективного подхода к проведению иммунотерапии рака поджелудочной железы. Результаты этих исследований очень обнадеживают, поскольку новый метод обеспечил уничтожение не только атипичных клеток в самой поджелудочной железе, но также и метастатических очагов в печени и легких.
Как проводилось исследование
В исследовании, опубликованном в журнале Gut, участвовала команда из Университета Королевы Марии, использующая раковые клетки поджелудочной железы у пациентов с поздней стадией заболевания. Эти клетки были пересажены лабораторным мышам с целью исследования влияния на их рост иммунологического препарата из крови пациента.
Из крови больных раком были выделены так называемые CAR-T клетки, призванные обеспечивать идентификацию и уничтожение клеток злокачественного новообразования. Эти клетки были подвергнуты специфической генной модификации с целью реактивации их способности определять и поглощать клетки рака поджелудочной железы.
Помимо этого исследователи впервые применили новую технологию, которая дала возможность полностью контролировать активность CAR-T клеток. Это обеспечило не только большую эффективность в уничтожении злокачественных клеток, но и потенциально большую безопасность в отношении здоровых клеток.

Каких результатов удалось добиться исследователям
Значимость исследования
В Великобритании ежегодно выявляется около 9 800 человек с раком поджелудочной железы.
Эта форма рака очень агрессивна и чрезвычайно плохо поддается лечению. В результате чего рак поджелудочной железы имеет один из самых низких показателей пятилетней выживаемости среди всех форм рака.
Ситуация осложняется тем, что отсутствие специфических симптомов осложняет раннюю диагностику этого заболевания. Как итог — рак поджелудочной железы диагностируется у пациентов чаще всего уже на поздних стадиях. В этих случаях опухоль уже распространилась на соседние ткани и органы и — очень вероятно — дала отдаленные метастазы.
При лечении онкологических заболеваний крови иммунотерапия с использованием CAR-T-клеток показала очень высокий уровень эффективности. Однако при попытках применить эту методику для борьбы с солидными тканевыми опухолями, такими как рак поджелудочной железы, врачи столкнулись со сложностями. Основной проблемой стали выраженные побочные токсические эффекты.

Перспективы использования нового метода
К сожалению, за более чем 40 лет прогресс в разработке эффективного метода борьбы с раком поджелудочной железы был слишком незначительным и уровень выживаемости при этой форме рака оставался неприемлемо низким.
Однако новое исследование открывает многообещающие перспективы для внедрения в клиническую практику действенного и безопасного метода лечения этой формы рака. И, возможно, уже в ближайшие годы европейская онкология сможет спасать сотни жизней с новой иммунотерапевтической методикой.

Потенциал виротерапии, то есть использования онколитических вирусов для лечения рака, достаточно трудно реализовать.
Хотя результаты лабораторных исследований показывают, что онколитические вирусы убивают раковые клетки и оставляют здоровые клетки интактными, результаты клинических испытаний на людях пока разочаровывали ученых – иммунная система больных обычно подавляла вирус еще до того как он подействует.
Новое исследование продемонстрировало, что комбинирование виротерапии и иммунотерапии может сделать лечение рака гораздо более эффективным.
Группа ученых из Лондонского университета королевы Марии (QMUL), возглавляемая доктором Yaohe Wang, сообщила о своих результатах в журнале Clinical Cancer Research. Доктор Wang является сотрудником Центра молекулярной онкологии при Институте рака Бартса QMUL.
Вирус с IL-10 уменьшает опухоль и продлевает жизнь в 2 раза
Для своего исследования доктор Wang и его коллеги работали над несколькими линиями раковых клеток. Они убедились, что добавление в геном Vaccinia гена IL-10 не уменьшает противораковые свойства онколитического вируса.
Затем ученые перешли непосредственно к опытам на мышах. Они сравнивали эффективность вируса Vaccinia с новым геном и без него. Мыши были разбиты на две группы, у которых вызывали рак поджелудочной железы, причем во второй группе клетки рака у мышей были очень похожими на клетки человеческого рака (трансгенная группа).
Результаты показали, что через 6 недель терапии у 87,5% мышей, которые получали модифицированный вирус Vaccinia с геном IL-10, опухоли исчезли полностью. В группе контроля, которые лечили обычным вирусом, таких животных было только 42,8%.
В группе трансгенных мышей продолжительность жизни при лечении модифицированным вирусом Vaccinia с IL-10 была почти в 2 раза выше, чем при лечении обычным вирусом (138,5 дня против 69,7 дня).
Исследователи также проверили, что происходит через 4 недели после полного исчезновения первичной опухоли поджелудочной железы. Они повторно ввели в организм клетки рака и не давали мышам никакого лечения.
Оказалось, что, несмотря на рост клеток рака сразу после их введения, в обеих группах животных рак был полностью побежден максимум через 32 дня. За исключением одного грызуна. Но в группе, которая в первом эксперименте получала вирус Vaccinia с IL-10, рак исчезал уже через 18 дней. Иными словами, даже через месяц вирус продолжал защищать хозяина от раковых клеток.
Почему IL-10 подавляет ответ на вирус, но усиливает ответ на рак?
Доктор Wang говорит, что результаты его исследования совпадают с результатами других авторов, опубликованными ранее. Ученые уже выдвигали идею использования IL-10 из-за его собственного противоракового эффекта.
Исследователь поясняет, что он пока не может быть полностью удовлетворен результатами, так как остается несколько нерешенных загадок. К примеру, результаты показывают, что интерлейкин-10 нарушает ответ иммунной системы на вирус, но в то же время он усиливает реакцию иммунной системы на опухоль. Нужно понять, почему так происходит.
Исследование, которое организовал доктор Wang, было профинансировано благотворительным фондом Pancreatic Cancer Research Fund. СЕО фонда Мэгги Блэнкс (Maggie Blanks) говорит, что для внедрения этого открытия в клиническую практику нужно провести еще не одно исследование, но результаты выглядят вдохновляюще.
Для рака поджелудочной железы определенно нужен новый подход, потому что нынешние методы лечения не дают приемлемых результатов. Рак поджелудочной железы сегодня трудно лечить на любой стадии, а обнаруживают его, как правило, очень поздно.
Американская онкология (кстати, далеко не худшая в мире!) на данный момент дает возможность прожить более 5 лет с таким диагнозом только 6% больных. Основная проблема в том, что подавляющее большинство случаев рака поджелудочной железы выявляют тогда, когда рак начал распространяться за пределы железы.
Национальный институт рака США заявляет, что в 2014 году в Америке диагностировано более 46 тысяч случаев рака поджелудочной железы, а более 39 тысяч человек умерло от этого заболевания.
В ноябре 2014 года издание Cancer Discovery сообщало о том, что ученые идентифицировали первые молекулярные шаги, приводящие к раку поджелудочной железы. В журнале ученые рассказали, что эти реакции приводят к превращению нормальных клеток железы в раковые клетки. Их открытие может привести к созданию новых способов профилактики заболевания.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Рак поджелудочной железы относится к онкологическим заболеваниям, с которыми сложно бороться, и которые характеризуются относительно низкой выживаемостью. В течение 5 лет с момента установления диагноза в живых остаются лишь 9% больных. Рак поджелудочной железы нередко диагностируют в запущенной стадии, потому что не существует эффективного рекомендованного скрининга, злокачественная опухоль может долго не вызывать симптомов.
Тем не менее, пациенту можно помочь, даже если заболевание диагностировано на поздней стадии. В случаях, когда невозможно добиться ремиссии, врачи могут продлить жизнь пациента и избавить его от мучительных симптомов. Эффективное лечение можно получить в клинике Медицина 24/7.
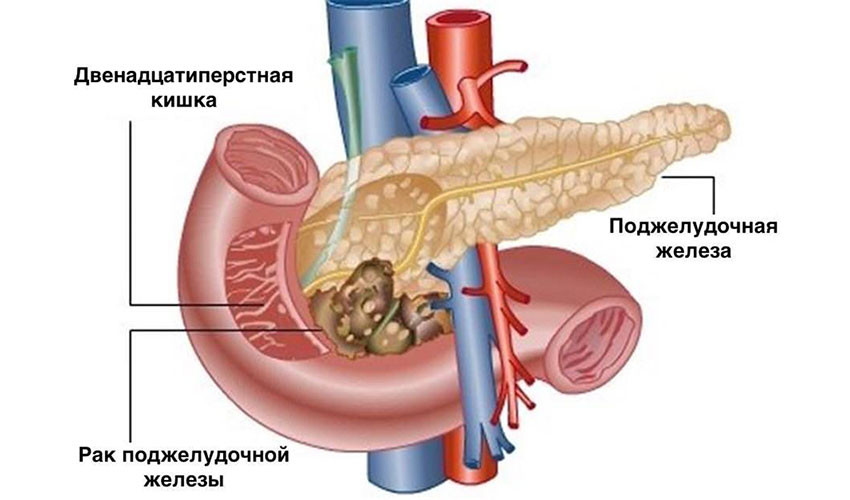
Хирургическое лечение
Хирургическое удаление опухоли — самый эффективный метод лечения рака поджелудочной железы. Это единственная реальная возможность достичь ремиссии. К сожалению, на момент постановки диагноза только у одного из пяти пациентов опухоль не успела распространиться за пределы поджелудочной железы, и лишь у некоторых из них рак можно полностью удалить. Обычно это узлы в головке органа: через неё проходит желчный проток, при его сдавлении развивается механическая желтуха, и эта симптоматика помогает рано диагностировать опухоль.
Операцию проводят, если хирург уверен, что он сможет удалить рак полностью. Циторедуктивные вмешательства, направленные на частичное удаление как можно большего количества опухолевой ткани, не проводятся, так как нет доказательств того, что они помогают продлевать жизнь пациентов.
При раке головки поджелудочной железы чаще всего выполняют операцию Уиппла. Во время нее удаляют головку органа, иногда вместе с телом, и часть окружающих органов: тонкой кишки, желчного протока, ближайшие лимфатические узлы, желчный пузырь, иногда часть желудка.
При резектабельном раке хвоста поджелудочной железы проводят дистальную панкреатэктомию: удаляют хвост поджелудочной железы, иногда вместе с телом, и селезенку.
В редких случаях встречаются ситуации, когда злокачественная опухоль распространилась по всей поджелудочной железе, но все еще является операбельной. При этом может быть выполнена тотальная панкреатэктомия: поджелудочную железу удаляют полностью, вместе с ней — желчный пузырь, часть желудка и тонкой кишки.

Паллиативные операции
Во время паллиативных операций не удаляют рак, их цель — избавить больного от симптомов, вызванных злокачественной опухолью. При раке головки поджелудочной железы нередко развивается механическая желтуха — состояние, вызванное сдавлением желчного протока и нарушением оттока желчи. У больного окрашиваются в желтый цвет кожа, слизистые оболочки и белки глаз, беспокоит кожный зуд, ухудшается общее состояние, прогноз.
С этим осложнением можно справиться тремя способами:
- Дренирование. Во время эндоскопической ретроградной холангиопанкреатографии (РХПГ) или чрескожной чреспеченочной холангиографии в желчные протоки устанавливают дренажную трубку. По ней желчь может оттекать наружу, в просвет двенадцатиперстной кишки или сразу в обоих направлениях. Это достаточно эффективно, но не очень удобно: дренажная трубка постоянно мешается, может случайно сместиться, выпасть.
- Стентирование — более современное решение. Эндоскопически, с помощью катетера, заведенного в желчные протоки из двенадцатиперстной кишки, в заблокированном участке устанавливают стент — трубку с сетчатой стенкой из полимера или металла. Он расширяет просвет протока и обеспечивает свободный отток желчи. Стентирование — быстрая и относительно безопасная процедура, ее выполняют без разрезов.
- Шунтирование — операция, во время которой хирург создает обходной путь для оттока желчи. По сравнению со стентированием, хирургическое вмешательство несет более высокий риск осложнений, его могут перенести не все больные. Но иногда оно позволяет более эффективно, надолго восстановить отток желчи. Во время операции можно перерезать нервы, которых беспокоят мучительные боли.
Насколько эффективна химиотерапия при раке поджелудочной железы?
Химиопрепараты довольно часто применяют при злокачественных опухолях поджелудочной железы. Они могут быть назначены с разными целями:
- Адъювантная химиотерапия проводится до операции, чтобы уменьшить объем опухоли.
- Неоадъювантная химиотерапия проводится после операции, чтобы снизить риск рецидива.
- Химиотерапия как основной метод лечения применяется при неоперабельных опухолях. Цель лечения в таком случае — не достичь ремиссии, а как можно дольше держать болезнь под контролем.
Чаще всего применяют такие химиопрепараты, как гемцитабин (Гемзар), оксалиплатин (Элоксатин), иринотекан (Камптозар), , цисплатин, капецитабин (Кселода). Обычно назначают комбинации из двух препаратов с разными механизмами действия, это помогает повысить эффективность лечения. Ослабленным пациентам назначают только один препарат риска серьезных побочных эффектов.
Эффективность лучевой терапии
Лучевую терапию при раке поджелудочной железы зачастую применяют вместе с химиопрепаратами. Такое лечение называется химиолучевой терапией. Ее назначают после операции, при неоперабельном раке.
Если опухоль находится в пограничном состоянии между резектабельной и нерезектабельной, после курса неоадъювантной лучевой терапии ее размеры могут уменьшиться так, что ее получится удалить хирургическим путем.
Также лучевую терапию при раке поджелудочной железы применяют в качестве симптоматического лечения, например, если беспокоят мучительные боли, и пациенту противопоказано хирургическое вмешательство.
Таргетная терапия
На поверхности раковых клеток в поджелудочной железе нередко увеличено количество молекул EGFR. Активируясь, он заставляет клетки быстро размножаться. Его можно заблокировать с помощью таргетного препарата эрлотиниб (Тарцева). Его часто назначают в сочетании с химиопрепаратом гемцитабином. Эффективность этой комбинации различается у разных онкологических больных.
Помогает ли иммунотерапия при раке поджелудочной железы?
Иммунная система человека должна не только атаковать чужеродные агенты, но и знать, когда пора остановиться, чтобы не навредить собственным тканям организма. Для этого в ней есть специальные сигнальные молекулы, подавляющие активность иммунных клеток. При раке эти молекулы начинают мешать. Они не дают иммунитету эффективно распознавать и уничтожать опухолевые клетки. Существуют препараты, которые могут заблокировать эти молекулы, они называются ингибиторами контрольных точек.
При раке поджелудочной железы ингибиторы контрольных точек могут быть полезны для пациентов, у которых выявлены определенные генетические отклонения: высокий уровень микросателлитной нестабильности, мутации в генах восстановления несоответствия (MMR).
В клинике Медицина 24/7 при многих типах рака можно пройти исследование, которое помогает выявить мишени для лекарственных препаратов, имеющиеся в раковых клетках пациента, и назначить оптимальную, персонализированную терапию.
Читайте также:





