Им ki-67 при опухоли головного мозга
Для лечения и прогнозирования. Индекс Ki-67 – это условный показатель, с помощью которого можно оценить степень агрессивности рака: при высокой пролиферативной активности надо опасаться быстрого роста опухоли и раннего метастазирования.
Пролиферативная активность раковых клеток
Индекс Ki-67: что это
Пролиферация – это активное разрастание клеток, это четкий и однозначный показатель агрессивности злокачественного новообразования. Индекс Ki-67 – это показатель пролиферативной активности раковых клеток. Проводя при иммуногистохимии этот тест, можно спрогнозировать:
- Поведение Карциномы в ближайшем и отдаленном периоде;
- Возможную скорость роста опухоли;
- Вероятность метастазирования;
- Ответ Карциномы на курсовое лечение;
- Исход болезни.
Значение Ki-67 определяется при проведении иммуногистохимического исследования опухолевых тканей, взятых при биопсии новообразования или после хирургического удаления первичных и/или вторичных раковых очагов.
Опухолевые клетки с высокой пролиферативной активностью и способностью к постоянному делению – это основной фактор прогрессирования и увеличения размера карциномы: именно благодаря этой агрессивной способности рака происходит быстрый рост, рано возникающее метастатическое распространение и неблагоприятный исход болезни.
Какие могут быть варианты
Один из показателей в иммуногистохимическом заключении, измеряемый в процентах (соотношение активно делящихся к неактивным раковым клеткам). Индекс Ki-67 отличается при разных видах рака. Опухолевая ткань иммуногистохимически оценивается в следующих случаях:
- На этапе первичной диагностики при взятии любого вида биопсии;
- После хирургического удаления новообразования;
- Во время радикальной операции после курса неоадъювантной терапии;
- При биопсии или удалении рецидивной опухоли;
- При резекции отдаленного метастаза.
Чем меньше цифра индекса, тем лучше. В частности, при люминальном типе рака молочной железы в зависимости от значения Ki-67 выделяют 2 подтипа: A – менее 14%, B – более 14%. Соответственно, люминальный РМЖ тип B прогностически хуже из-за высокой пролиферативной активности раковых клеток.
Важно понимать: для каждой разновидности рака цифры индекса пролиферации индивидуальны. Оптимально оценивать этот показатель в динамике: во всех случаях, когда проводится взятие биопсийного или операционного материала.
Значимость для лечения
Показатель Ki-67 может служить маркером эффективности лечения. При биопсии выявлен рак молочной железы с высоким индексом пролиферации, проведены курсы неоадъювантного лечения и гормонотерапии, а после операции при иммуногистохимии врач-гистолог в заключении указал низкое значение индекса. Это очень хорошо: учитывая наличие чувствительности опухоли к лекарственным препаратам, можно надеяться на положительный исход терапии (длительная гормонотерапия после операции станет основой стойкой ремиссии).
Помимо рака молочной железы, индекс Ki-67 используется в диагностике множества злокачественных опухолей (рак шейки матки, злокачественные новообразования почек и мочевого пузыря, желудка и поджелудочной железы, лимфомы и гормонозависимые опухоли и т.д.). По сути, это универсальный прогностический признак, указывающий на степень агрессивности Карциномы.
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами - антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
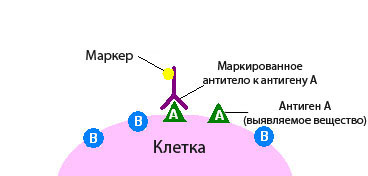
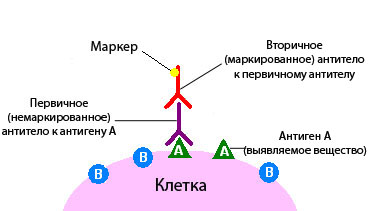
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR - протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны - эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от 0 до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu - это рецептор эпидермального фактора роста раковой клетки. Это - ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.

Ki-67 - это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот - чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 - это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке - активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется - индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.

VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF - для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
В настоящее время известны некоторые гистологические маркеры глиальных опухолей, определяющие прогноз лечения и химиочувствительность [5]. Несмотря на имеющиеся достижения, эффективность методов лечения глиальных опухолей недостаточна, что является причиной продолжения изучения морфологических и иммуногистохимических характеристик данных новообразований.
Целью нашего исследования явилось изучение сравнительных морфоиммуногистохимических показателей и коннексинов в астроцитомах головного мозга различной степени злокачественности с целью обосновать их комплексное лечение и улучшение его результатов.
Материалы и методы. Под наблюдением с 2013 по 2015 г.г. находились 95 больных. Из них – 19 больных, оперированы по поводу GrI астроцитомы (11 женщин, 8 мужчин), 21 человек — по поводу – астроцитомы GrII (12 женщин и 9 мужчин), 28 человек – астроцитомы GrIII (16 женщин и 12 мужчин), 27 чел. – GrIV-глиобластомы (14 женщин и 13 мужчин). Возраст больных был от 32 до 74 лет (средний возраст 53±14 лет). Для всех больных комплексное лечение заключалось в оперативном вмешательстве с микрохирургическим удалением опухоли в пределах здоровых тканей, адъювантной дистанционной гамма-терапей (ДГТ) и последующими курсами химиотерапии. Во время удаления опухоли с разрешения этического комитета института и согласия больных для гистологического и иммуногистохимического исследования забирался фрагмент опухоли объемом 1 см 3 .
Больные с астроцитомами GrI и GrII получили курс адъювантной дистанционной гамматерапии (ДГТ) до СОД 60 Гр и последующие курсы химиотерапии ломустином в дозе 100 мг/м 2 . Больные с астроцитомой GrIII и астроцитомой GrIV (глиобластомой) получали курс адъювантной дистанционной гамматерапии до СОД 60 Гр на фоне курса монохимиотерапии карбоплатином в дозе 50 мг в 1-й и 8-й дни ДГТ для усиления радиочувствительности опухоли, а впоследствии – курсы полихимиотерапии: карбоплатин, винкристин и перорально – ломустин в общепринятых дозировках. С помощью магнитно-резонансной томографии (МРТ) с контрастированием, которую проводили каждые 6 недель, выявляли отсутствие или наличие продолженного роста опухоли.
Нами использовался ступенчатый подход к химиотерапии, то есть, пациентам проводилась высокодозная многокурсовая внутриартериальная химиотерапия препаратами платины или полихимиотерапия по схеме: Карбоплатин+ Винкристин+ перорально Ломустин. Если пациент соглашался на имплантацию артериальной тромборезистентной порт-системы перед операцией по удалению опухоли, то в случае интраоперационного срочного гистологического подтверждения астроцитомы GrIII или GrIV ему имплантировали данную порт-систему. Она позволяет проводить многокурсовую внутриартериальную химиотерапию. В случае отказа на предлагаемую имплантацию данной порт-системы пациент получал системную полихимиотерапию.
В 1-й подгруппе (1п/г GrIII) в течение 18 месяцев с момента операции и начала комплексного лечения у 5 больных астроцитомой GrIII вследствие продолженного роста опухоли выполнена рекраниотомия с удалением продолженного роста опухоли. Учитывая продолженный рост было решено перейти ко второй ступени химиотерапии, усилить ее назначением Темодала по 250 мг/м 2 с 1 по 5 дни, а Карбоплатин 300 мг вводился внутриартериально в 1 день курса.
Во 2-й подгруппе у 4 больных в течение 15 месяцев обнаружен продолженный рост опухоли, вследствие чего выполнена рекраниотомия с удалением опухолевого узла, а в плане химиотерапии было также решено перейти на следующую ступень – алкилирующий препарат второго поколения – Темодал из расчета 200 мг/м 2 . Курс был стандартный – с 1-го по 5 дни, с интервалом в 28 дней.
Во 2-й подгруппе больных GrIV астроцитомой полихимиотерапия также начиналась со схемы Карбоплатин-150 мг, Винкристин-2 мг, peros Ломустин-200 мг.
При появлении на МРТ с контрастированием признаков отека вокруг ложа удаленной опухоли во всех подгруппах GrIII GrIV астроцитом осуществлялся переход на третью ступень химиотерапии — Иринотекан 200 мг/м 2 в 1-й и 15-й дни курса плюс ондастерон 8 мг перед введением Иринотекана, Авастин 400 мг в/в капельно в 1-й и 15-й дни курса, повтор каждые 28 дней.
Сравниваемые группы были сопоставимы по возрасту, полу, гистотипу, стадии опухолевого процесса.
Результаты. За 28-месячный период наблюдения в 1-й подгруппе больных с астроцитомой GrIII живы 6 человек (из 15), во 2-й подгруппе — 5 человек. Из 1-й подгруппы больных астроцитомой GrIV 18 месяцев наблюдения не пережил никто. Во второй подгруппе больных астроцитомой GrIV 16 месяцев не пережил никто. В группах больных с астроцитомами GrI и GrII все больные живы -100% общая выживаемость. Однако, в группе GrI два человека были оперированы повторно по поводу продолженного роста, а в группе GrII — 5 человек.
На рис.1. представлены показатели бессобытийной выживаемости (оценка по Каплану-Майеру) для групп GrI и GrII. Под событием понимаем продолженный рост или смерть, которой в этих группах не было.
На рис.2. представлены показатели общей выживаемости (Каплан-Майер), а на рис.3 –бессобытийной, для групп GrIII и GrIV.
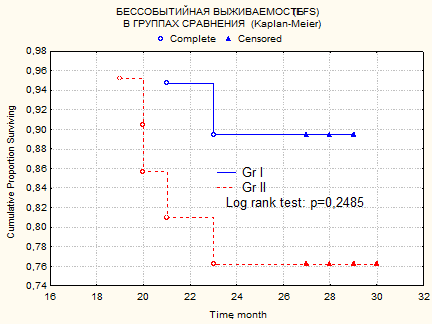
Рис.1. Показатели бессобытийной выживаемости для групп больных с астроцитомами GrI и GrII. Под событием понимаем продолженный рост опухоли. Различия статистически незначимы, р=0,2485. Медиана выживаемости в группах не достигнута. Двухлетняя бессобытийная выживаемость в группе с астроцитомой GrI – составляет 89%, в группе GrII – 76%. По оси абсцисс – время от начала лечения, месяцы.
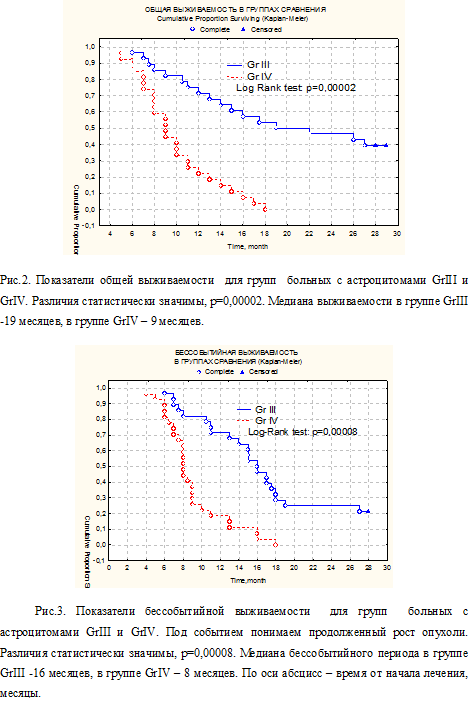

Статистический анализ выживаемости в группах и подгруппах сравнения показал достоверные различия в общей и бессобытийной выживаемости больных астроцитомой GrIII и GrIV. В подгруппе 1 больных как астроцитомой GrIII, так и GrIV, бессобытийный период достоверно больше, что свидетельствует об эффективности внутриартериальной химиотерапии.
Для выполнения гистологического исследования использовалась рутинная окраска гематоксилином-эозином. Иммуногистохимическое (ИГХ) исследование опухолей головного мозга было выполнено с использованием следующих моно- и поликлональных антител: bcl-6,p53, Ki-67, CD31, CD34, EGFR. Данная панель реактивов была подобрана для определения биологических свойств разных вариантов глиом.
Полученные результаты показателей иммуногистохимического профиля отражены в таблице 1.
Таблица 1. Иммуногистохимические показатели глиальных опухолей.
Иммуногистохимический профиль у больных астроцитомой GrI показал очень низкий уровень пролиферации Ki-67 и отрицательную реакцию на белок р53. CD31 и CD34 были единичными (1-3%). В ядрах отдельных клеток имелась очаговая экспрессия белка bcl-6, что свидетельствует о низкой транскрипционной активности опухолевых клеток (Рис. 6 а,б,в,г,д,е,ж,з).


На основании этих результатов было решено провести курс адъювантной дистанционной гамма-терапей (ДГТ) с последующими курсами монохимиотерапии ломустином.
Исследование иммуногистохимического профиля у больных астроцитомой GrIII показало повышение экспрессии белка Ki-67 (более 5-7%), увеличение до 20% bcl-6, что указывает на высокую транскрипционную активность клеток, свидетельствуя о её высоком ростовом потенциале. Показатель апоптоза — экспрессия белка p53 достигает 25-30%, увеличение плотности и экспрессии белков CD31, CD34, при отсутствии реакции с EGFR (рис. 8 а,б,в,г,д,е,ж,з).

У больных GrIV астроцитомой (глиобластомой) обнаружена высокая экспрессия белка Ki-67 (более 15-20%), отсутствие признаков апоптоза (экспрессии белка p53), единичная ядерная активность bcl-6, негативная реакция с EGFR, повышенная экспрессия в опухоли белков CD31, CD34 (усиленный неоангиогенез, неоэндотелиогенез) до 10-15% (рис. 9 а,б,в,г,д,е,ж,з). Поэтому было решено больным глиобластомой проводить ДГТ на фоне монохимиотерапии карбоплатином с целью повышения радиочувствительности опухоли к проводимому лучевому лечению.

Наблюдения в течение шестимесячного периода показали отсутствие продолженного роста опухоли, а также участков глиоза и отека в ложе удаленной опухоли.
Известно , что in vitro снижение способности сообщаться между собой через щелевые каналы у опухолевых клеток еще не определяет появление опухолевого роста. Восстановление межклеточной сообщаемости у коммуникационно дефектных линий опухолевых клеток путём устойчивой трансфекции в них генов щелевых контактов коннексинов в экспериментах показали, что межклеточная сообщаемость является сильным опухолеподавляющим фактором (Rose В. с соавт., 1991; Eghbali В, с соавт., 1991; ChenSh-Ch. с соавт., 1995).
Однако, при изучении глиом головного мозга в литературе отсутствуют сведения о роли различных типов коннексинов в динамике прогрессирования, рецидивирования, не установлены биологические потенции клеточного роста данных опухолей.
Среди семейства коннексинов, обнаруженных в ткани головного мозга следует отдельно выделить коннексин-43 (Cx43, CXA1_RAT), коннексин-36 — интегральные мембранные белки, образующие щелевые межклеточные контакты (gap-junction) между астроцитами, нейронами, участвующие в передаче межнейрональных импульсов и играющие важную роль в инвазии опухолевых клеток в паренхиму нормальной ткани мозга (Юсубалиева, Г.М., Зоркина Я.Л., Баклаушев В.П., Гурина О.И., Горяйнов С.А., Александрова Е.В., Жуков В.Ю., Савельева Т.А., Потапов А.А., Чехонин В.П., 2014 г.). Щелевые контакты играют Существуют экспериментальные данные, показывающие активирующее влияние Сх43 на процессы инвазии мультиформной глиобластомы человека и ее аналога у крыс — экспериментальной глиомы С6 (FuСТ, etal., 2004).
В этой связи целью нашего исследования явилось проведение сравнительного морфоиммуногистохимического исследования астроцитом 1-3 степени злокачественности, глиобластом с определением в опухолях головного мозга коннексинов-36, 43, GFAP, Ki67, CD34.
Гистологическое исследование выполнялось по обычной методике с окраской гематоксилином-эозином, для иммуногистохимического исследования использовались антитела к коннексинам-36, 43, GFAP, Ki67, CD34. Астроцитомы 1-2 степени злокачественности характеризовались наличием фибриллярных астроцитов, строящих компактные пучки клеток вытянутой формы, имеющих клеточные структуры с крупными гиперхромными ядрами. Коннексины-36, 43 в данных астроцитомах были умеренно выражены, имели мембранную, очаговую цитоплазматическую экспрессию. Экспрессия белка GFAP в клетках и волокнистых структурах астроцитом данной категории была резко выраженной, в виде четко очерченных пучковых структур. Индекс пролиферативной активности (Ki67) в глиомах был невысокий и составлял не более 3-5%, отмечались единичные тонкостенные новообразованные сосуды (CD34).
В астроцитомах 3 степени злокачественности количество атипичных астроцитов резко возрастало, отмечались поля новообразованных тонкостенных сосудов, расположенные вокруг опухолевых солидных участков. Иммуногистохимическое исследование данной категории опухолей головного мозга выявило умеренно выраженную цитоплазматическую, мембранную реакцию клеток опухоли со стороны коннексина-36, в то же время негативную реакцию коннексина-43 в этих же участках. По сравнению с астроцитомами 1-2 степени злокачественности наблюдалось увеличение индекса пролиферативной активности клеток опухоли до 10-15% (Ki67), количество новообразованных сосудов в опухолевых участках возрастало (CD34). Экспрессия белка GFAP была неравномерно выраженной с преимущественной локализацией в цитоплазме, мембранах клеток глии.
В глиобластомах 4 степени злокачественности имелось компактное солидное скопление атипичных клеток глии, расположенные вокруг сосудов, с ландкартообразнымикоагуляционными некрозами ткани. Весьма характерным для данной группы опухолей был высокий митотический индекс Ki-67 (более 35-40% клеток), слабо выраженная экспрессия GFAP, полное отсутствие цитоплазматической, мембранной экспрессии коннексинов-36, 43. Отличительными признаками было большое количество новообразованных сосудов в ткани опухоли (CD34), что свидетельствовало о высоком неоангиогенезе в опухоли.
Таким образом, данные нашего сравнительного морфо-иммуногистохимического исследования позволяют сделать вывод о том, что по мере нарастания степени злокачественности в глиомах нарушаются взаимоотношения коннексинов-36, 43, вплоть до полного их отсутствия в глиобластомах. Мы считаем, что такая дезинтеграция коннексинов с преобладанием коннексина-36 в астроцитомах разной степени злокачественности может указывать на нарушение синхронизации передачи нервных импульсов в клетках опухоли. В то же время негативная реакция коннексинов в глиобластомах обоих типов может свидетельствовать о полном закрытии или повреждении щелевых контактов, что, несомненно, ведет к нарушению передачи нервных импульсов. При этом митотическая активность клеток опухоли и процессы неоангиогенеза в глиобластомах значительно превышают таковые показатели по сравнению с астроцитомами 3 степени злокачественности, а все вышеизложенное может объяснять различную чувствительность астроцитом к комплексному лечению, в частности — к химиотерапии.
Белок Ki-67 — самый широко используемый маркер пролиферации как в нормальных, так и в опухолевых клетках. Впервые описан в 1983 году в Институте патологии в немецком городе Киль, где и были синтезированы первые антитела к нему в 67 лунке планшета [1].
Негистоновый белок Ki-67 кодируется геном MKI67. Он участвует в клеточном цикле, вовлекаясь в биогенез рибосом, организацию гетерохроматина и разделение митотических хромосом. Полный спектр его функций все еще неясен. Трудности исследования Ki-67 связаны с отсутствием гомологичных белков с уже известной функцией, а также с его большой молекулярной массой и высокой чувствительностью к разрушению протеазами [2].
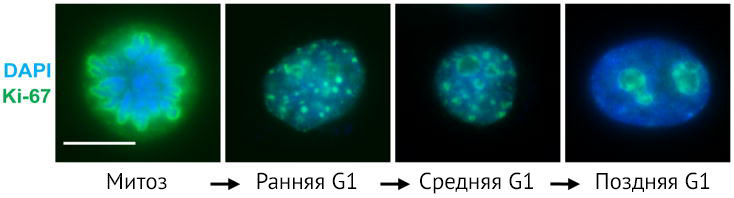
Но все меняется, когда происходит митоз. В профазу Ki-67 в виде тонкой сети связан с конденсированным хроматином. В метафазу эта сетчатая структура окружает уже отдельные хромосомы. После разрушения ядерной мембраны часть Ki-67 распределяется диффузно в цитоплазме. В анафазу и телофазу митоза количество Ki-67 в клетках начинает быстро снижаться.
При переходе клетки после митоза в фазу G0 Ki-67 быстро подвергается катаболизму (путем опосредованной протеасомами деградации) и перестает выявляться в ядрах интерфазных клеток [4].
Индекс пролиферации — это процент клеток с ядерным окрашиванием от общего числа опухолевых клеток. Интенсивность и тип экспрессии маркера не учитывается (перинуклеолярный, нуклеоплазменный, перихромосомный). Подсчет включает в себя не менее 500 опухолевых клеток (в идеале не менее 1000) не менее чем в 3 полях зрения при увеличении ×400. В случае гетерогенности опухоли выбирают участки с наибольшей митотической активностью [6].
Общие характеристики уровня пролиферации для опухолевой ткани различных локализаций:
В лабораториях используют антитела к Ki-67 клонов MIB-1 (для работы с материалом, полученным от человека, крупного рогатого скота, собак, овец и лошадей) и MIB-5 (для работы с материалом, полученным от крыс и других грызунов). Эти структуры показали более высокое сродство к эпитопу антигена Ki-67 в условиях формалиновой фиксации доставляемого материала [2].
Особую значимость этот маркер приобрел при патоморфологическом исследовании опухолей молочной железы. Гистологический подтип гормон-позитивных люминальных опухолей определяется на основании индекса Ki-67: подтип А (Ki-67
.
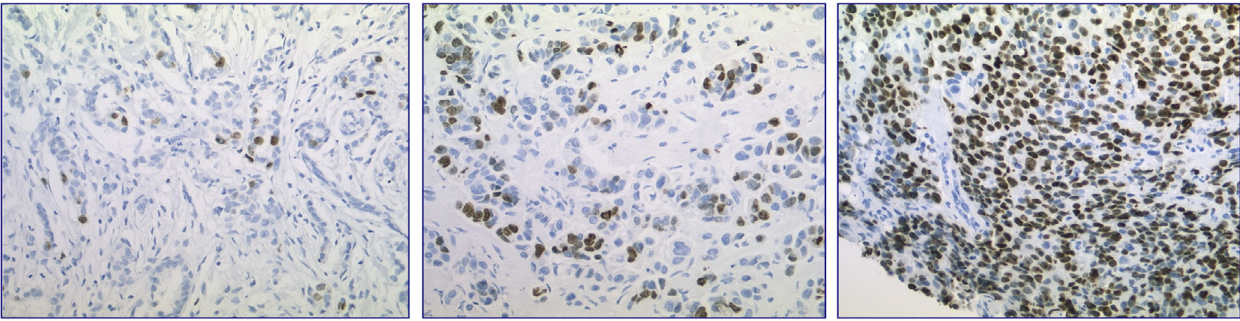
Прогностические горизонты применения маркера Ki-67 постоянно расширяются. Уточняется и дополняется его значение в предикции результатов лекарственной терапии опухолей. Например, для рака молочной железы, который не отвечает на химиотерапию, повышение Ki-67 является плохим прогностическим маркером. Напротив, в опухолях, реагирующих на химиотерапию, этот эффект не наблюдается, и даже присутствует корреляция увеличения Ki-67 с улучшением прогноза.
Объяснение этому феномену можно логически вывести из понимания биологии каждого подтипа опухоли:
- Низко пролиферирующие опухоли хуже реагируют на химиотерапию, но в любом случае имеют хороший прогноз ввиду меньшей агрессивности (низкий Ki-67 — хороший результат).
- В тех высокопролиферирующих опухолях, которые чувствительны к терапии, высокий Ki-67 связан с большей частотой достижения полного патоморфологического ответа (pCR) и улучшением выживаемости (высокий Ki-67 — хороший результат).
- Но в высокопролиферирующих опухолях, которые при этом также являются резистентными к химиотерапии, увеличение индекса Ki-67 связано с уменьшением выживаемости: активно пролиферирующие клетки обусловливают агрессивное поведение опухоли, не контролируемое химиопрепаратами (высокий Ki-67 — плохой результат) [6].
Читайте также:

