Хронические миелопролиферативные заболевания jak-2 617 что значит
— фермент, который синтезируется в печени. Играет важную роль в регуляции нормальной выработки гемопоэтических клеток. Изменение активности киназы обуславливает склонность к увеличению числа клеток одного или нескольких ростков кроветворения.
Выявление JAK2 V617F мутации в гене — генетический анализ, который позволяет определить риск развития миелопролиферативных заболеваний, полицитемии, риск прерывания беременности, образования тромбозов.
Синонимы
Определение JAK2 V617F мутации в гене; JAK2 полиморфизм, мутации гена JAK2 V617.
Метод исследования
Полимеразная цепная реакция в режиме реального времени ( ПЦР).
Биоматериал для анализа
Подготовка
Кровь желательно сдавать натощак.
Описание
Название гена: JAK2.
Мутации гена JAK2:
- мутация гена JAK2 V617F,
- определение наличия делеций в 12 экзоне гена JAK2 киназы,
- мутации в гене , приводящие к заменам в 515 положении белка MPL.
Функция гена JAK2: кодирует регуляторные белки, обладающие тирозинкиназной активностью.
— это тирозинкиназа, фермент подкласса протеинкиназ, группы киназ. Синтезируется в печени. Тирозинкиназы ускоряют перенос фосфатного остатка от АТФ на тирозиновый остаток специфических клеточных . Регулируют клеточный рост и дифференцировку, апоптоз. Эти тирозинкиназы получили название наличия двух активных участков (доменов), сходных по строению, но противоположных по функциям.
Фермент служит промежуточным звеном между рецепторами на мембране клетки и сигнальными молекулами (например, факторы роста, пролактин, интерферон, интерлейкины). Когда определенные цитокины или факторы роста (эритропоэтин, тромбопоэтин, гранулоцитарный колониестимулирующий фактор и др.) связываются с рецепторами на поверхности клетки, активируются (фосфорилируются). Далее происходит последовательное активирование белков семейства STAT (Signal Transducers and Activators of Transcription). Белки STAT соединяются и проникают в ядро. Там они сами или с участием других белковых факторов передают сигналы о размножении, дифференцировки клеток гемопоэтического ряда (), тем самым влияя на кроветворную систему человека.
При появлении мутации JAK2 V617F происходит усиление сигнала от JAK2, что приводит к избыточному образованию клеток. При соматической мутации JAK2 V617F в позиции 617 валин заменен на фенилаланин. Появляется эта мутация в гемопоэтических . Фермент JAK2 всё время активирует белки сигнальных путей, которые воздействуют на образование и дифференцировку , что ведет к увеличению числа клеток одного или нескольких ростков кроветворения. Морфологически это проявляется в виде увеличения числа клеток костного мозга.
Для чего используется анализ
Анализ позволяет достоверно определить мутацию в гене JAK2.
Когда назначается
Установка или подтверждение диагноза истинной полицитемии, эссенциальной тромбоцитемии или идиопатического миелофиброза.
Определение риска развития тромбозов.
Определение риска прерывания беременности.
Исследование рекомендуется проводить в комплексе: цитогенетическое и гистологическое исследование костного мозга.
Референсные значения (норма)

В норме в губчатом веществе костного мозга, находящегося в полостях крупных костей скелета, продуцируются незрелые стволовые клетки. Постепенно они созревают и преобразуются в полноценные форменные элементы:
- эритроциты, доставляющие кислород к органам и тканям,
- лейкоциты, защищающие организм от инфекционных агентов и прочих чужеродных веществ,
- тромбоциты, формирующие кровяной сгусток и останавливающие кровотечение.

созревание форменных элементов крови в норме
При наличии у человека миелопролиферативного заболевания в кровь поступают клетки, неспособные выполнять свои функции. Стволовые клетки при патологии часто преобразуются только в один тип форменных элементов. Патологический процесс отличается медленным прогрессированием.
Миелопролиферативное заболевание — это собирательное понятие, включающее группу гемобластозов, которые характеризуются аномальным разрастание костномозговых структур, отвечающих за образование кровяных телец. Выделяют несколько основных форм МПЗ, при которых поражаются разные клеточные элементы крови:
- Истинная полицитемия,
- Эссенциальная тромбоцитемия,
- Хронический миелолейкоз.
Причины

пример jak2 мутации при истинной полицитемии (избытке эритроцитов)
В основе МПЗ лежит приобретенная генная мутация, обусловленная влиянием негативных внешних или внутренних факторов. Мутация генов MPL и jak 2 приводит к повреждению ДНК одной гемопоэтической клетки, которая дает начало всем типам клеточных элементов. Аномально изменившаяся бластная форма приобретает отрицательные черты — перестает развиваться, не созревает полностью, не самоуничтожается, а непрерывно делится и порождает многочисленные клоны. Именно поэтому МПЗ называют клональным. Клоны также остаются на начальном уровне развития и имеют полностью недифференцированную структуру. Повреждаться может как один, так сразу несколько ростков кроветворения.
В результате в костном мозге увеличивается количество клеток-предшественниц эритроцитарного, тромбоцитарного и лейкоцитарного типов. По мере их накопления в кровяном русле ухудшается самочувствие больных. От того, какой росток переродился, зависит характер патологии, ее симптоматика и прогноз. Формы МПЗ отличаются медленным развитием. Если заболевание было выявлено на ранней стадии, у больного есть все шансы добиться стойкой ремиссии.
Причины, вызвавшие мутационные процессы, остаются до конца неизученными. Одни ученые относят к ним негативные факторы окружающей среды, другие — ошибки при делении клеток. МПЗ не является наследственным. Мутации генов могут возникать на протяжении всей жизни человека. Они называются приобретенными. Риск развития патологии увеличивается с возрастом. Лицам старше 50 лет необходимо внимательно относиться к здоровью и при появлении подозрительной симптоматики обращаться к гематологу. Вероятность развития недуга повышается под воздействием факторов риска — облучения и химикатов, оказывающих токсическое влияние на организм.
Классификация
Миелопролиферативные заболевания имеют код по МКБ 10 — D47.1. По типу течения их подразделяют на острые и хронические. В первую группу входят максимально агрессивные и быстро прогрессирующие недуги, поражающие в основном молодых людей. К группе хронических миелопролиферативных заболеваний относятся медленно развивающиеся патологии, имеющие относительно благоприятный прогноз и возникающие у пожилых лиц.
В зависимости от пораженного ростка кроветворения выделяют следующие формы процесса:
- Истинная полицитемия — гиперпродукция красных кровяных телец и сгущение крови. Эритроциты задерживаются в селезенке, развивается спленомегалия. У больных возникают признаки тромбогеморрагического синдрома, повышается риск инсультов и инфарктов. В целом данная форма отличается доброкачественным течением. По сравнению с другими видами МПЗ она характеризуется высокой выживаемостью.
- Эссенциальный тромбоцитоз — опасное для жизни состояние, при котором происходит усиленное образование тромбоцитарных клеток.
- Хронический миелолейкоз — злокачественное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка и появлением в крови недифференцированных лейкоцитов.
- Эозинофильная лейкемия — усиленное разрастание и повреждение эозинофилов, которые относятся к лейкоцитарным клеткам. При этом нарушаются их главные функции — борьба с инфекцией и иммунный ответ на потенциальные аллергены.
- Миелофиброз — образование в косном мозге патологически измененных клеток с заменой функциональной ткани соединительнотканными волокнами.
- Хронический нейтрофильный лейкоз — формирование незрелых нейтрофилов, которые перестают защищать организм от патогенов.

Классификация МПЗ имеет важное значение для диагностики онкологических заболеваний органов кроветворения. С ее помощью гематологи-онкологи могут легко определить тип сформировавшейся патологии и подобрать больному адекватную терапию, которая может спасти жизнь.
Видео: лекция по классификации и патогенезу ХМПЗ
Развитие и симптомы
Существует три пути распространения заболевания по организму:
- Лимфогенный — аномальные структуры проникают во внутренние органы по лимфатическим сосудам.
- Гематогенный — проникновение видоизмененных клеток в здоровые ткани по кровеносному руслу.
- Имплантационный — прорастание пораженных бластных форм в соседние органы и близлежащие ткани.
Гематогенное распространение злокачественных клеток считается самым опасным. Таким пациентам вместе с лечебными мероприятиями проводят динамическое наблюдение за функционированием внутренних органов. Данный тип патологии дает метастазы в самые отдаленные участки организма человека, что приводит к формированию вторичных онкологических очагов.
Клиническая картина МПЗ зависит от конкретной формы процесса, сопровождающегося разрастание кроветворных тканей костного мозга и чрезмерным поступлением в кровоток остановившихся в своем развитии атипичных кровяных телец. Каждый вид заболевания отличается характерной симптоматикой. Но существуют общие распространенные симптомы. Это признаки анемии или тромбоза:
- не проходящая слабость, быстрая утомляемость, упадок сил,
- отсутствие аппетита и похудание,
- шум в ушах и головокружение,
- помрачение сознания,
- дезориентация во времени и пространстве,
- гематомы на теле,
- частые кровотечения и кровоизлияния,
- отечность тканей и артралгия,
- абдоминальная боль,
- бледность кожи,
- гепатоспленомегалия,
- плетора (“полнокровие”),
- лихорадка.
Это общая симптоматика, возникающая при любой форме МПЗ. Существуют также специфические проявления, характерные для каждой из них.
-
Признаки, типичные для полицитемии: гепатомегалия и спленомегалия, гиперемия кожи, гипертензия, ночная потливость, головная боль, кожный зуд, диплопия, нечеткость зрения, онемение и жжение в ступнях, распирание и тяжесть в левом подреберье.


картина крови при тромбоцитемии

общая клиника лейкозов
Диагностика
Симптоматика МПЗ — основание для назначения пациенту диагностических процедур, позволяющих подтвердить или опровергнуть наличие процесса, а также выяснить, в какой именно форме протекает патология органов кроветворения.
Обследование начинают с опроса и сбора анамнеза. Врачи уточняют, какой образ жизни ведет больной, имеет ли пагубные пристрастия, какие заболевания перенес и чем лечился. Осмотр пациента – определение общего состояния и выявление признаков, которые обычно отсутствуют у здоровых людей.

Лабораторная диагностика МПЗ заключается в проведении целого ряда исследований и испытаний:
- Гемограмма — подсчет лейкоцитарной формулы, определение количества эритроцитов, тромбоцитов, уровня гемоглобина, гематокрит.
- Микроскопия мазка периферической крови — обнаружение бластных форм.
- БАК — определение функционального состояния печени и других внутренних органов.
- Миелограмма – результат микроскопии мазка пунктата костного мозга, отражающий качественный и количественный состав ядросодержащих клеток миелоидной ткани.

пункция КМ для миелограммы
Помимо лабораторной диагностики для постановки диагноза необходимы результаты инструментальных исследований. Больным проводят УЗИ брюшной полости для определения степени гепатоспленомегалии. В диагностически сложных случаях их направляют на томографическое исследование.
Лечение
Онкогематологи назначают лечение своим больным по результатам диагностических исследований. Существуют стандартные терапевтические методики, которые применяют при различных видах МПЗ. Если у пациента обнаружена начальная стадия процесса, когда еще отсутствуют клинические признаки, за ним устанавливают динамическое наблюдение. При появлении первых признаков патологии переходят непосредственно к лечению.

Каждому больному подбирается индивидуальная лечебная методика в соответствии с его состоянием и степенью выраженности имеющихся нарушений.

трасплантация КМ – наиболее радикальная, но и потенциально действенная методика при удачном исходе
После проведения полного лечебного курса наступает период реабилитации. Больной должен находится под постоянным наблюдением доктора и строго выполнять все его предписания, позволяющие организму быстрее восстановиться.
- правильное, сбалансированное питание с ограничением жирных, соленых, острых блюд и полным исключением алкоголя, курения;
- долгие пешие прогулки на свежем воздухе, желательно около водоема;
- исключение чрезмерного физического перенапряжения;
- соблюдение режима дня – полноценный сон, чередование труда и отдыха.
Миелопролиферативное заболевание — рецидивирующий процесс, способный обостриться в любое время. Именно поэтому всем пациентам необходимо регулярно посещать лечащего врача и проходить диагностические исследования с профилактической целью.
Прогноз МПЗ считается благоприятным только в случае успешной трансплантации костного мозга, которая разрешена не всем больным. Хронические формы переносятся легче острых. Продолжительность жизни пациентов в этом случае составляет 5–7 лет при условии получения комплексной терапии. Если у больных обнаружены метастазы, прогноз становится неутешительным — они погибают в течение 6 месяцев.
Видео: лекция об опыте лечения ХМПЗ
Далеко не каждый человек имеет представление о том, что такое миелопролиферативное заболевание. Однако те, кто столкнулся с данной патологией, знают о ней абсолютно все.
Это объясняется тем, что такие люди вынуждены на протяжении всей жизни наблюдаться у специалиста и поддерживать свое здоровье медикаментозными препаратами. Ведь не так просто самостоятельно вести борьбу с нарушениями в костном мозге, который производит стволовых кровяных клеток больше, чем это необходимо.
Описание патологии
Хроническое миелопролиферативное заболевание крови относится к группе патологий, характеризующихся чрезмерной выработкой тромбоцитов, эритроцитов, лейкоцитов.
В нормальном состоянии вырабатываются стволовые незрелые клетки. С течением времени происходит их созревание, они преобразуются в полноценные. Несформированные, в свою очередь, образуют три типа:
- тромбоциты, которые способствуют предотвращению кровотечений посредством формирования кровяных сгустков;
- эритроциты, которые участвуют в транспортировке кислорода и питательных веществ ко всем жизненно важным органам и тканям человеческого организма;
- лейкоциты, которые отвечают за обеспечение защитной реакции в борьбе с болезнями инфекционного характера или иными патологиями.
Прежде чем происходит их трансформация, стволовые клетки развиваются в несколько этапов. В случае проявления миелопролиферативного заболевания их большое количество преобразуется в один тип форменного кровяного элемента. Как правило, прогрессирование патологии происходит медленными темпами.
У пациентов, имеющих такой недуг, значительно возрастает риск образования тромбов и геморрагических осложнений.
Миелопролиферативные заболевания в большинстве случаев наблюдаются у мужчин в возрасте старше 40 лет. Женщины такому состоянию подвергаются значительно реже. Данные формы болезней нехарактерны для лиц младше двадцатилетнего возраста, у детей отмечаются лишь единичные случаи.
Виды патологий
По типу недуга выделяют следующую классификацию миелопролиферативных заболеваний:
- Истинная полицитемия. Характеризуется избытком эритроцитов, в результате чего наблюдается загустение крови. Находясь в большом количестве, данные клетки начинают скапливаться в селезенке, на фоне чего она увеличивается в размерах. Кроме этого, возможны кровотечения и формирование тромбов в сосудах. Такие нарушения способствуют инсульту или инфаркту. Но несмотря даже на такой возможный исход, протекает в доброкачественной форме и отличается большей выживаемостью по сравнению с остальными патологиями.
- Эссенциальный тромбоцитоз — большое количество тромбоцитов.
- Хроническая форма миелолейкоза. При данной патологии в костном мозге происходит избыточное скопление лейкоцитов.
- Эозинофильная лейкемия характеризуется чрезмерным содержанием эозинофилов, которые являются одним из видов лейкоцитов. Борются с инфекционными болезнями, спровоцированными определенными типами паразитов и отвечают за аллергические реакции организма на раздражители.
- Идиопатический миелофиброз. Наблюдается выработка патологических форменных элементов, постепенное замещение костного мозга фиброзной тканью.
- Хронический нейтрофильный лейкоз. Стволовые клетки формируют нейтрофилы, отвечающие за борьбу с патологиями инфекционного характера. Развивается медленно.
Все патологии могут переходить в лейкемию острой формы.
Стадии развития
Миелопролиферативный синдром не имеет стандартной системы стадирования, которую используют при выявлении степени развития опухолевых образований. Выбор метода лечения осуществляется в зависимости от типа патологии у больного.
Выделяют 3 основных пути, по которым опухолевый процесс распространяется по человеческому организму:
.jpg)
- Проникновение в клетки здоровой ткани.
- Лимфогенный путь. Попадание патогенных клеток в другие системы и органы происходит посредством лимфатических сосудов.
- Гематогенный. При проникновении в кровеносную систему злокачественные элементы с кровотоком попадают в здоровые ткани.
Характерные признаки
Клиническая картина каждого из заболеваний будет проявляться по-разному. Однако выделяют общие распространенные симптомы, характерные для всех миелопролиферативных патологий. К ним относят:

- утомляемость;
- стремительную потерю в весе, вплоть до анорексии;
- звон в ушах;
- нарушенное сознание;
- предрасположенность к синякам;
- возможные кровотечения;
- симптомы тромбоза;
- отеки;
- боли в суставах;
- болезненные ощущения в животе и левом предплечье.
У пациента могут наблюдаться такие признаки, как:
- кровоизлияние;
- бледность кожных покровов;
- увеличение печени или селезенки;
- плетора;
- лихорадка, сопровождающаяся проявлением пятен лилового окраса на конечностях и лице.
Только осмотр позволит дать оценку общему состоянию, а также выявить любые патологические отклонения, не соответствующие норме здорового организма.
Диагностические мероприятия
Лабораторная диагностика включает:
- проведение микроскопии мазка;
- сдачу общего анализа крови;
- цитогенетический анализ, определяющий уровень изменений в рh-хромосомах;
- полимеразную цепную реакцию.
Биопсия и аспирация возможны не во всех случаях. Проведение процедуры заключается во введении иглы в область грудины для взятия образца крови и костной ткани. Изучение полученных материалов позволяет определить наличие патологических элементов.
.jpg)
При подтвержденном диагнозе больные в течение всей жизни должны наблюдаться у гематолога.
Как лечатся миелопролиферативные болезни
В настоящее время применяют несколько терапевтических методов для лечения таких заболеваний. Выбор того или иного варианта зависит от общего состояния больного и выраженности клинических проявлений. Лечение возможно стандартным способом, неоднократно проверенным на практике, или экспериментальным, когда применяется новое средство.
Среди наиболее часто используемых методов выделяют следующие:
- Флеботомия. При данном методе берут забор крови из вены. После этого материал отправляется на биохимию или общий анализ. При лечении миелопролиферативного заболевания основная задача будет заключаться в понижении уровня эритроцитов.
- Аферез тромбоцитов. Этот способ похож на предыдущий, разница лишь в том, что действия направляются на уменьшение количества тромбоцитов с помощью предназначенного для этого оборудования. Суть метода заключается в следующем: кровь больного пропускается через так называемый сепаратор. В очищенном виде ее заново вливают пациенту.
- Химиотерапия. Подразумевает использование препаратов цитостатической группы. Они эффективно воздействуют на опухолевые клетки, в результат чего устраняют их и препятствуют развитию новообразований. Применение их возможно перорально, внутримышечно или внутривенно. В любом случае происходит проникновение активных компонентов лекарства в кровоток, что способствует подавлению патологических клеток. Такой метод называют системным. При региональном лекарственный препарат вводится в канал спинномозговой области или же непосредственно в орган, где происходят опухолевые изменения.
- Лучевая терапия. Основана на применении рентгеновского или иного излучения, имеющего высокие частоты. Данный метод способствует полному удалению опухолей и замедляет развитие новых образований. В медицинской практике используется два типа такого лечения:
- внешнее, при этом излучение идет от препарата, который располагают непосредственно около больного;
- внутреннее, когда трубки, иголки и катетеры наполняют средством, содержащим радиоактивные вещества; после этого их вставляют в саму опухоль или в ткань, находящуюся вблизи нее.
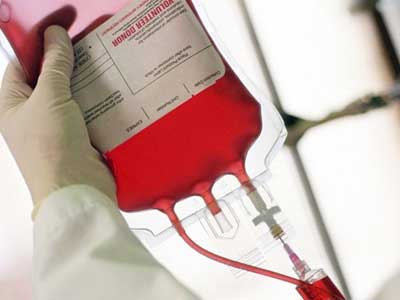
- Трансфузия — переливание крови, характеризуется замещением одних элементов на другие. В результате вместо клеток, подвергшихся разрушению, человек получает трансфузию, состоящую из тромбоцитов, эритроцитов и лейкоцитов.
- Химиотерапия с клеточной трансплантацией. Медикаментозные средства назначают в высоких дозах, а пораженные клетки замещают здоровыми, которые получают у самого больного или у донора. Такие элементы подвергаются заморозке. По завершении курса химиотерапии данный материал помещают в организм. Там они уже созревают и формируют новые клетки.
В каждом конкретном случае специальная диета для пациента разрабатывается индивидуально. Необходимо в как можно меньших количествах употреблять жирную, соленую и острую пищу. Питание обязательно должно быть сбалансированным.
Период восстановления
После того как все терапевтические мероприятия будут проведены, больной в обязательном порядке должен находиться постоянно под присмотром специалиста, то есть регулярно приходить на прием.
Чтобы оценить, насколько эффективным оказалось лечение, могут быть назначены те процедуры, которые применялись при диагностировании заболевания. Только после получения повторных результатов врач может прекратить, продолжить или сменить применяемую до этого схему терапии.
Ряд обследований должен проводиться постоянно, даже после окончания всего курса лечебного процесса. Это позволит прослеживать изменения в организме и не допустить или вовремя обнаружить рецидив.
Прогнозирование
При хронической форме течения заболевания с применением стандартных терапевтических методов в среднем продолжительность жизни примерно 5–7 лет.
В случае проведения трансплантации прогноз наиболее благоприятный. Излечение составляет около 60%. Эффективность данного метода будет зависеть от фазы патологии.
Аннотация научной статьи по клинической медицине, автор научной работы — Сабурова И.Ю., Оникичук Я.С., Зотова И.И., Салогуб Г.Н., Зарайский М.И.
Похожие темы научных работ по клинической медицине , автор научной работы — Сабурова И.Ю., Оникичук Я.С., Зотова И.И., Салогуб Г.Н., Зарайский М.И.
Detection of JAK2V617F mutation in Patients with Myeloproliferative Disorders
Myeloproliferative disorders (MPD) represent a heterogeneous group of hematopoietic disturbances accompanied by multiple hyperplasia of bone marrow cells. They are rather difficult to be diagnosed and are often revealed by excluding other conditions. One of the most valuable diagnostic criteria for MPD is JAK2V617F mutation . The main object of the study was to develop a routine technique for detection of JAK2V617F mutations to be of help in primary diagnosis. The genomic DNA was substracted from 58 patients by standard technique. The V617F mutation of Jak2 gene was detected with 2 pairs of primers specific to mutated and wild-type Jak2. The JAK2V617F mutation was detected with two pairs of primers specific to mutated and wild types of JAK2 gene on the UKE1 cell line (donated by Professor Boris Fehse, Germany). The suggested method proved to be rather sensitive in JAK2V617F mutation detection. The mutation rate in the combined group was 29.3 %. The frequency of JAK2V617F mutations in newly diagnosed patients with non-verified MPD was 25.7 %. Consequently the newly developed method for detection of JAK2V617F mutations can be used as a screening diagnostic method in patents with myeloproliferative disorders .
УЧЕНЫЕ ЗАПИСКИ СПбГМУ ИМ. АКАД. И. П. ПАВЛОВА • ТОМ XV • №4 • 2008
И. Ю. Сабурова, Я. С. Оникичук, И. И. Зотова, Г. Н. Салотуб, М. И. Зарайский
В ГЕНЕ Jak2 У ПАЦИЕНТОВ С ХРОНИЧЕСКИМИ МИЕЛОПРОЛИФЕРАТИВНЫМИ ЗАБОЛЕВАНИЯМИ
Кафедра клинической лабораторной диагностики с курсом молекулярной медицины, кафедра факультетской терапии, 31 поликлиника Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова
Хронические миелопролиферативные заболевания (МПЗ) представляют собой группу клональных нарушений гемопоэтической стволовой клетки, характеризующихся пролиферацией одной или более миелоидных линий в косном мозге и повышенным количеством зрелых и незрелых клеточных форм в крови [1]. Согласно классификации ВОЗ, МПЗ включают в себя истинную полицитэмию, эссенциальную тромбоцитэмию, идеопатический миело-фиброз и хронический миелолейкоз, плюс редкие типы патологии, такие как нейтрофильная лейкемия, гиперэози-нофильный синдром и хроническая эозинофильная лейкемия [4]. Данные патологии имеют ряд схожих клинических признаков: гиперклеточность костного мозга, увеличение количества зрелых клеток одной или нескольких линий в крови, тромбозы, кровотечения, трансформация в острый миелоидный лейкоз или миелофиброз. Диагностика этих патологий сложна и часто основывается на критериях исключения [2]. Поэтому поиск специфических признаков, позволяющих провести дифференциальную диагностику, является чрезвычайно актуальным.
В 1960 г. был открыт первый молекулярный маркер хронического миелолейкоза - Всг/АЫ, транслокация ^9;22). Это позволило не только разработать высокоспецифичный метод диагностики, но и развить таргетную терапию и разработать методики мониторинга минимальной остаточной болезни. С тех пор перечень молекулярных маркеров, ассоциированных с гематологической патологией, постоянно расширяется.
Одним из наиболее диагностически значимых критериев для МПЗ является наличие мутации V617F в гене Jak2 [6]. Мутация V617F в гене Jak2 определяется в 9095 % случаев истинной полицитэмии, 50-70 % случаев эссенциальной тромбоцитэмии и 40-50 % случаев мие-лофиброза [3]. Ген Jak2 экспрессирован в ранних предшественниках гемопоэза и кодирует нерецепторную ти-розинкиназу, участвующую в передаче сигнала от рецепторов цитокинов и факторов роста к ядру клетки. Мутация
V617F вызывает конститутивную активацию рецептора без участия лиганда, что приводит к активации пролиферации клетки и блокаде процессов апоптоза.
Таким образом, основной целью данного исследования явилась разработка простого метода детекции мутации V617F в гене Jak2, пригодной как для первичной диагностики данных патологий, так и для полуколичественной оценки минимальной остаточной болезни на фоне терапии.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика групп пациентов
В качестве положительного контроля использовалась клеточная линия ЦКЕ1, любезно предоставленная профессором Борисом Фезе (Германия). Данная клеточная линия несет гомозиготный генотип мутированного гена Jak2 в позиции G1849T экзон 14 (мутация V617F).
Кровь: забор образцов производился в стерильных условиях из периферической вены или центрального катетера в вакуумный контейнер, содержащий в качестве антикоагулянта раствор ЭДТА. Объем крови составлял 10 мл.
Костный мозг: забор аспирата костного мозга производился в стерильных условиях путем пункции грудины или крыла подвздошной кости. Образец переносился в вакуумный контейнер, содержащий в качестве антикоагулянта раствор ЭДТА. Объем пробы составлял 1 мл.
Полученные образцы доставлялись в лабораторию не позже 1 ч после их получения.
ности используемых праймеров: прямой (общий для дикого и мутантного аллелей) праймер Jak2-F: 5'-GGGTTTCCTCAGAACGTTGA-3' и 2 обратных праймера: Jak2-RW: 5'-TTTACTTACTCTCGTCTCCACArAC-3' на дикий тип и Jak2-RM: 5'-TTTACTTACTCTCGTCTCCACATAA-3' на мутантный тип.
Амплификация проводилась по стандартной двухпрай-мерной схеме в конечном объеме 10 мкл. Реакционная смесь содержала 2 мкл ДНК, 14 рМол каждого праймера, смесь дНТФ в конечной концентрации 240 мкМол и 2,5 единицы термостабильной Taq ДНК-полимеразы (Helicon, Россия) в стандартном ПЦР буфере с содержанием Mg2+15 мМол. Типовая программа амплификации состояла из начальной денатурации (96 оС, 3 мин), 40 циклов, включавших денатурацию (94 оС, 20 с), отжиг праймеров (61 оС, 30 с), элонгацию (72 оС , 40 с) и заключительной элонгации (72 оС, 1 мин).
Оценка результатов исследования
Для проверки специфичности методики была использована клеточная линия UKE1. В качестве отрицательного контроля было использовано 10 образцов ДНК, выделенных из периферической крови стандартных доноров.
Образцы: 1 - донор, 2 и 3 - пациенты, 4 - клеточная линия (UKE1). Проба 1 и 2 - гомозиготы по дикому типу гена Jak2, проба 3 - гетерозигота, проба 4 - гомозигота по мутантному типу гена Jak2
це. Положительным контролем служила клеточная линия UKE1; отрицательным контролем служили образцы доноров (рисунок).
Полуколичественная оценка результатов исследования проводилась с помощью компьютерной программы GelPro Analyzer 3.1.
В процессе работы программа выдает количественную оценку уровней свечения сигнала в пробах в относительных единицах интенсивности (ОЕ). Суммарный сигнал с обеих дорожек (для мутированного и дикого типа гена Jak2) для каждой пробы приравнивался к 100 %. Относительная интенсивность сигнала мутированного варианта гена указывала на процентное содержание клеток опухолевого клона в пробе.
И ИХ ОБСУЖДЕНИЕ
Выявление у пациентов мутации V617F гена Jak2 является достоверным диагностическим маркером наличия хронического миелопролиферативного заболевания [6]. Общепризнанной является методика раздельной амплификации ДНК пациента с праймерами, специфичными для мутированного и дикого типа гена Jak2. В настоящей статье мы предлагаем один из адаптированных вариантов данной методики.
УЧЕНЫЕ ЗАПИСКИ СПбГМУ ИМ. АКАД. И. П. ПАВЛОВА • ТОМ XV • N04 • 2008
Полученные результаты частично совпали с литературными данными [2]. Расхождения могут быть связаны с малой выборкой. Причиной расхождения с литературными данными может также являться то, что данное обследование являлось проспективным, а диагноз пациентов предварительным.
Jak2 является нерецепторной тирозинкиназой, расположенной на цитоплазматическом домене многих рецепторов цитокинов, гормонов и факторов роста. Jak2 представляет собой сложную белковую структуру, в которой наибольший интерес, с точки зрения клиники, представляют киназный и псевдокиназный домены [7]. В норме псевдокиназный домен предотвращает сближение и спонтанную самоактивацию двух киназных доменов. После связывания лиганда с рецептором в псевдокиназном домене происходят конформационные изменения, приводящие к сближению киназных доменов и их активации за счет перекрестного фосфорилирования тирозиновых оснований. Следствием этого является запуск каскада биохимических процессов, передающих сигнал от рецептора к ядру и модулирующих транскрипцию специфических генов. Таким образом, осуществляется регуляция пролиферации, созревания и выживания клетки.
Мутация G1849T в 14 экзоне гена Jak2 приводит к замене валина на фенилаланин в позиции 617 псевдокиназ-ного домена. Это вызывает нарушение пространствен-
Встречаемость мутации V617F гена Jak2 у пациентов в зависимости от нозологии
Нозология ^личество пациентов Положите льная Отрицательная %
Гиперэозино-фильный синдром 2 0 2 0
Идеопатический миелофиброз 6 3 3 50
Истинная 8 3 5 37,5
Эссенциальная тромбоцитэимя 7 2 5 28,6
Хроническое миелопролифератив-ное заболевание 35 9 26 25,7
ной структуры тирозинкиназы, сближение киназных доменов, их спонтанную самоактивацию и появление конститутивной активности тирозинкиназы Jak2. Фенотипи-чески это проявляется активацией пролиферации и блокированием процессов апаптоза. Все эти механизмы лежат в основе патогенеза ХМПЗ, и даже гетерозиготная мутация может привести к запуску миелопролиферации. Таким образом, выявление мутации у первичных больных может служить надежным диагностическим критерием.
Представленная методика в основном ориентирована на скрининг первичных пациентов с подозрением на ХМПЗ. Дальнейшее совершенствование данной методики с введением количественной оценки опухолевого клона может быть использовано для мониторинга МОБ при проведении стандартной химиотерапии и трансплантации гемопоэтических стволовых клеток.
1. Dameshek, W. Some speculations on the myeloproliferative syndromes / W. Dameshek // Blood. - 1951. - № 6. - Р. 372-375.
2. McLornan, D. Melanie Percy, Mary Frances McMullin JAK2 V617F : A Single Mutation in the Myeloproliferative Group of Disorders / D. McLorman [et al] // Ulster. Med. J. - 2006. - № 75 (2). -Р. 112-119.
3. Ross, L. Role of JAK-STAT Signaling in the Pathogenesis of Myeloproliferative Disorders / L. Ross // Hematology. - 2006. - P. 233-239.
4. Tefferi, А. Classification and diagnosis of myeloproliferative neoplasms : the 2008 World Health Organization criteria and point-of-care diagnostic algorithms / A. Tefferi, J. W. Vardiman // Leukemia. -2008. - № 22. - Р. 14-22.
5. Tefferi, А. Classification, Diagnosis and Management of Myeloproliferative Disorders in the JAK2V617F Era / A. Tefferi // Hema-tology. - 2006. - P. 240-245.
6. Wolanskyj, A. P. JAK2V617F mutation in essential thrombocy-thaemia : clinical associations and long-term prognostic relevance / A. P. Wolanskyj [et al] // Br. J. Haematol. - 2005. - № 131 (2). -Р. 208-213.
7. Yamaoka, K. The Janus kinases (Jaks) / K. Yamaoka [et al] // Genome Biology. - 2004. - № 5. - Р. 253.
И. Ю. Сабурова, Я. С. Оникичук, И. И. Зотова,
Г. Н. Салотуб, М. И. Зарайский
Определение мутации V617F в гене Jak2 у пациентов с хроническими миелопролиферативными заболеваниями
группе составила 29,3 %. Процент встречаемости мутации V617F в гене Jak2 в группе первичных пациентов с невирифицирован-ным диагнозом МПЗ составил 25,7 %. Таким образом, разработанный нами метод определения мутации V617F в гене Jak2 может быть использован в качестве скрининговой диагностики у пациентов с невирифицированными хроническими миелопролифератив-ными заболеваниями.
Ключевые слова: миелопролиферативные заболевания, мутация V617F в гене Jak2, ПЦР.
I. Y. Saburova, Y. S. Onikichuk, I. I. Zotova,
G. N. Salogub, MI. I. Zarayskiy
Detection of JAK2V617F mutation in Patients with Myeloproliferative Disorders
Myeloproliferative disorders (MPD) represent a heterogeneous group of hematopoietic disturbances accompanied by multiple
hyperplasia of bone marrow cells. They are rather difficult to be diagnosed and are often revealed by excluding other conditions. One of the most valuable diagnostic criteria for MPD is JAK2V617F mutation. The main object of the study was to develop a routine technique for detection of JAK2V617F mutations to be of help in primary diagnosis. The genomic DNA was substracted from 58 patients by standard technique. The V617F mutation of Jak2 gene was detected with 2 pairs of primers specific to mutated and wild-type Jak2. The JAK2V617F mutation was detected with two pairs of primers specific to mutated and wild types of JAK2 gene on the UKE1 cell line (donated by Professor Boris Fehse, Germany). The suggested method proved to be rather sensitive in JAK2V617F mutation detection. The mutation rate in the combined group was 29.3 %. The frequency of JAK2V617F mutations in newly diagnosed patients with non-verified MPD was 25.7 %. Consequently the newly developed method for detection of JAK2V617F mutations can be used as a screening diagnostic method in patents with myeloproliferative disorders.
Key words: myeloproliferative disorders, JAK2V617F mutation, PCR.
Д. В. Дзадзуа, А. С. Захарова, Л. Н. Новикова, В. А. Воинов, К. С. Карчевский, Р. В. Чеминава, О. Э. Бакланова
ОЦЕНКА ЭФФЕКТИВНОСТИ ПЛАЗМАФЕРЕЗА У БОЛЬНЫХ ИДИОПАТИЧЕСКИМ ФИБРО-ЗИРУЮЩИМ АЛЬВЕОЛИТОМ
НИИ пульмонологии Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова
Интерстициальные заболевания легких (ИЗЛ) составляют 10-15 % в структуре всех болезней легких. К ним относятся более 200 нозологий известной и неизвестной этиологии [7]. Одним из наиболее распространенных и прогностически неблагоприятных заболеваний является идиопатический фиброзирующий альвеолит. Идиопа-тический фиброзирующий альвеолит (ИФА) (синонимы: криптогенный фиброзирующий альвеолит, идиопатический фиброз легких, болезнь Хаммена-Рича и др.) представляет собой своеобразный патологический процесс в легких неясной природы, характеризующийся нарастающей дыхательной недостаточностью вследствие развития преимущественно в интерстициальной ткани легких небактериального воспаления, ведущего к прогрессирующему интерстициальному фиброзу [3].
ИФА - заболевание, в развитии которого определенную роль играют иммунные механизмы, о чем свидетельствует присутствие активированных лимфоцитов, макрофагов, нейтрофилов и эозинофилов в легких.
Существенные отклонения от нормы определяются и в системе Т-клеточного иммунитета.
В связи с тем, что степень отклонения иммунологических показателей от нормы зависит от особенностей течения болезни, в литературе описаны существенные различия в оценке иммунологической реактивности больных ИФА. Исследования, проведенные Т. П. Сесь и соавт. (2000), свидетельствуют о том, что при ИФА наиболее информативными являются изменения следующих показателей: повышение общего числа эффекторных клеток в жидкости бронхоальвеолярного лаважа (ЖБАЛ) - альвеолярных макрофагов, нейтрофилов, лимфоцитов, увеличение числа Т-лимфоцитов (Т-хелперов), повышение активности интер-лейкинов (ИЛ-1Р, ИЛ-2), пролиферативной активности Т-лимфоцитов, активности протеолитических ферментов -эластазы и коллагеназы. Отклонение показателей гуморального иммунитета - иммуноглобулины трех основных классов (А, G и М) и циркулирующие иммунные комплексы (ЦИК) - служит критерием интенсивности аутоиммунных процессов в организме [3]. Поэтому оценка иммунологического статуса при ИФА имеет важное значение в решении вопросов лечебной тактики.
Для лечения больных ИФА используются кортикосте-роиды, иногда в сочетании с иммунносупрессантами и антифибротическими препаратами ф-пеницилламин и др.). Наряду с медикаментами, применяются и эфферентные методы лечения, главным образом плазмаферез (ПФ). Положительный эффект ПФ заключается в элиминации аутоантител и циркулирующих в крови иммунных комплексов, которые играют важную роль в развитии ИФА. ПФ повышает чувствительность к кортикостерои-дам [4], удаляя аутоантитела и ЦИК, улучшает микроциркуляцию, способствует нормализации основных метаболических процессов [1].
Однако до настоящего времени эффективность эфферентных методов при ИФА вызывает сомнения, не дока-
Читайте также:

