Химиоперфузия в онкологии давыдов м и
Эффективных методов лечения большинства метастатических опухолей не существует. Однако разработка и внедрение в клиническую практику комплексных подходов к лечению онкологических больных с использованием перфузионных технологий значительно изменили ситуацию с оказанием помощи таким больным.
Химиоперфузия – что это за метод лечения?
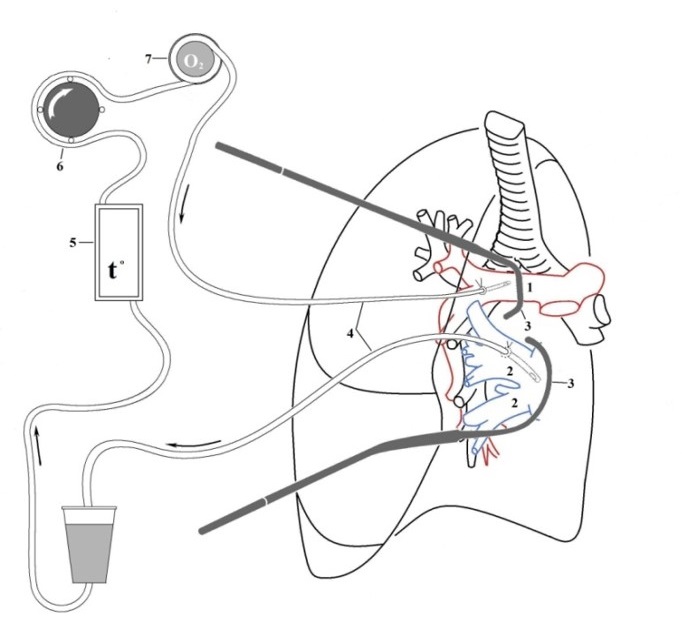
В результате этого создается высокая концентрация препаратов в месте локализации опухоли, при минимальном всасывании в системный кровоток. Таким образом, появляется возможность для максимально агрессивного воздействия на опухоль при незначительной системной токсичности, которая часто заставляет пациентов прерывать или прекращать курсы внутривенной химиотерапии.
В этом и состоит основное преимущество химиоперфузии — с ее помощью создается максимальная концентрация химиопрепаратов, действующих локально на опухоль. При обычной системной химиотерапии такие дозы невозможны, организм больного просто не смог бы выдержать воздействие такого количества токсичных препаратов.
При химиоперфузии уменьшается риск побочных эффектов и значительно снижается общая токсичность лечения.
В сочетании с химиоперфузией часто применяется тепловая обработка клеток опухоли (гипертермия), которая оказывает самостоятельное противоопухолевое действие и усиливает действие химиопрепаратов.
Виды химиоперфузии
Существует несколько видов химиоперфузии, в зависимости от того, через какую часть организма или органа осуществляется циркуляция раствора химиопрепарата:
- Внутрибрюшинная химиоперфузия – для пациентов с опухолевым поражением брюшной полости (перитонеальный канцероматоз);
- Химиоперфузия плевральной полости – для пациентов с опухолевым поражением плевры;
- Изолированная химиоперфузия легкого – для пациентов с метастатическим поражением легких;
- Изолированная химиоперфузия конечности – для пациентов с местно-распространенными формами меланомы кожи и саркомы мягких тканей конечности.
По температурному режиму:
- Гипертермическая
- Нормотермическая
По цели процедуры:
- Лечебная
- Паллиативная
Как проходит химиоперфузия
Во время операции нужный орган изолируется при помощи систем катетеров и на него направляется противоопухолевый препарат с помощью внешнего насоса аппарата искусственного кровообращения.
Аппаратно-техническое обеспечение химиоперфузии имеет следующую принципиальную схему (рис. 1):
- Специальный резервуар содержит перфузат (смесь физраствора и цитостатика)
- Перфузионный насос обеспечивает циркуляцию перфузата по замкнутому контуру.
- Термостатирующее устройство поддерживает температуру перфузата на заданном уровне.
- Система управления и контроля
К основным факторам, определяющим эффективность химиоперфузии, относятся:
- Температура перфузата;
- Вид и объем перфузата;
- Длительность перфузии;
- Техника выполнения перфузии;
- Противоопухолевый препарат и его доза.
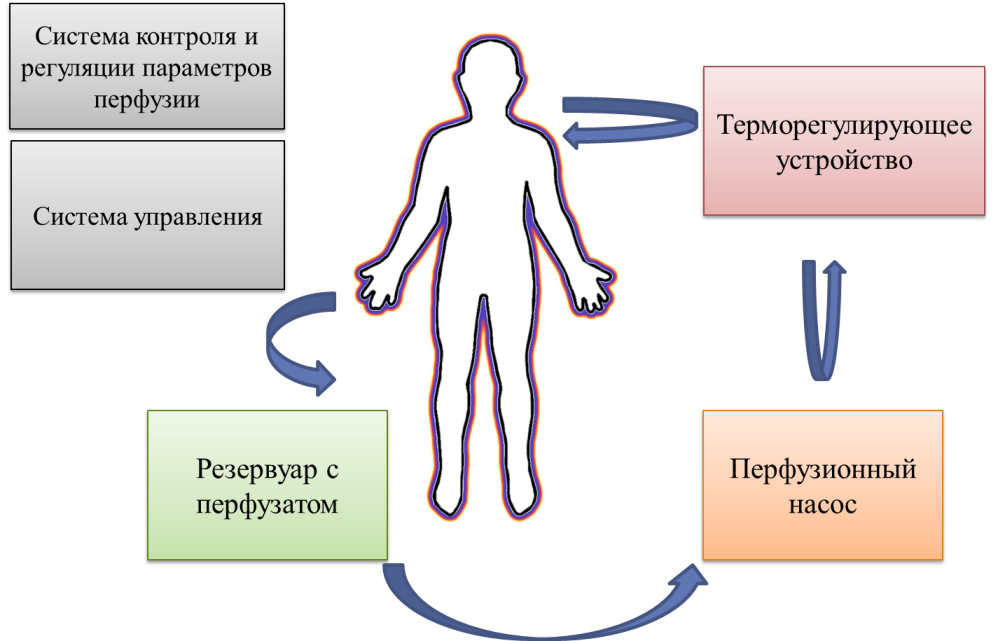
Рис. 1. Схема аппаратно-технического обеспечения химиоперфузии
Аппараты для проведения химиоперфузии начали разрабатываться и использоваться в клинической практике с 1990-х годов.
Изолированная химиоперфузия легкого
Метод изолированной химиоперфузии легкого с использованием одного аппарата искусственного кровообращения, подключаемого через полости сердца, был предложен в начале 70-х годов прошлого столетия. Но даже сегодня на тему проведения изолированной химиоперфузии легкого опубликовано, пожалуй, наименьшее количество работ и доступно наименьшее количество информации в сравнении с другими видами химиоперфузии. Это во многом обусловлено сложностью выполнения процедуры – немногие врачи владеют техникой ИХПЛ – а также особенностями послеоперационного ведения таких пациентов, куда входит комплекс мер по профилактике и лечению осложнений.
Каким пациентам необходима изолированная химиоперфузия легкого (ИХПЛ)?
Основным методом оказания помощи больным раком легких является хирургический. Для пациентов с 3-4 стадией, с метастатическими изменениями в лёгких, результаты лечения не всегда являются удовлетворительными. В зависимости от локализации первичной опухоли пятилетняя выживаемость таких больных составляет не более 40 %.
Важным недостатком хирургического лечения является невозможность удаления микрометастазов легочной ткани, высокая вероятность того, что при множественном метастатическом поражении не все метастазы будут обнаружены и удалены во время хирургического вмешательства. Это впоследствии приводит к появлению новых метастазов в легких более чем у трети оперированных пациентов. В таких случаях приходится выполнять повторные операционные вмешательства, отличающиеся повышенным травматизмом и осложненным послеоперационным течением.
Одним из перспективных путей улучшения результатов лечения пациентов с метастатическим поражением лёгких считается комбинированное лечение. Во время хирургического вмешательства, после хирургического удаления легочных метастазов, проводится изолированная перфузия органа противоопухолевым препаратом в высокой дозе.
Противопоказания к ИХПЛ
Абсолютные противопоказания к ИХПЛ:
- Острая сердечно-сосудистая недостаточность
- Острое нарушение мозгового кровообращения
- Декомпенсированная и терминальная полиорганная недостаточность
- Наличие метастазов в других органах
- Невозможность выполнения полной метастазэктомии
Аппарат для ИХПЛ представлен на рисунке 2 и состоит из следующих элементов:
- центробежный перфузионный насос,
- блок управления насосом,
- мембранный оксигенатор, выполняющий также роль резервуара,
- фильтр.
Кроме этого, в состав перфузионного контура входит термостатирующее устройство, поддерживающее температуру перфузата на требуемом уровне.

Рис. 2. Аппарат для изолированной химиоперфузии легкого
На таком аппарате в НМИЦ онкологии им. Н.Н. Петрова ИХПЛ производится в течение 30 мин при температуре перфузата 37ºС. В качестве перфузата используется стерильный физиологический раствор объемом 1000-1500 мл. В качестве противоопухолевого препарата для ИХПЛ, как правило используется мелфалан (30-50 мг) или цисплатин (110-135 мг/м 2 ).
Послеоперационный период у пациентов после изолированной химиоперфузии легкого
В послеоперационном периоде все пациенты проходят:
- контрольное рентгенологическое обследование органов грудной клетки;
- лабораторные исследования:
- клинический анализ крови;
- биохимический анализ крови;
- коагулограмма;
- определение газового состава крови;
- общий анализ мочи.
- Электрокардиография.
Кроме того, в послеоперационном периоде проводится лечение, включающее кратковременную профилактическую антибактериальную терапию, терапию антикоагулянтами, коррекцию водноэлектролитных нарушений, терапию, направленную на предотвращение развития отека легкого, а также симптоматическая терапия.
Проведение ИХПЛ в процессе хирургического вмешательства по поводу внутрилегочных метастазов позволяет достоверно увеличить показатели общей и безрецидивной выживаемости больных с метастатическим поражением легких.
В НМИЦ онкологии им. Н.Н. Петрова накоплен наибольший в России опыт выполнения как полостных, так и изолированных регионарных химиоперфузий у онкологических больных.
Мировой лидер по выполнению изолированной химиоперфузии легкого — заведующий хирургическим торакальным отделением НМИЦ онкологии им. Н.Н. Петрова, д.м.н., профессор, Евгений Владимирович Левченко. Эффективность процедуры составляет 50% (то есть стойкая ремиссия наступила у каждого второго пациента). За 10 лет, с 2010 по 2017 год им выполнено 168 перфузий.
В 2017 г. за одну из таких операций Е.В. Левченко удостоен премии фонда им. академика В.Н. Перельмана – в 2009 г. хирург провел ИХПЛ 17-летней пациентке с многочисленными метастазами в легких. Во время вмешательства он удалил в общей сложности 70 метастазов и добился стойкой ремиссии несмотря на агрессивность первичной опухоли – остеогенной саркомы. На момент вручения награды прошло почти 9 лет после операции, пациентка благополучно живет без признаков прогрессирования.

Кроме ИХПЛ в Центре занимаются химиоперфузиями конечностей и брюшной полости. С 2004 по 2017 г. сделано более 150 регионарных химиоперфузий конечностей – этой темой занимается заведующий научным отделением онкоурологии и общей онкологии, д.м.н. Георгий Иванович Гафтон.
Перфузия брюшной полости выполняется в НМИЦ онкологии им. Н.Н. Петрова с 2008 года на отделениях общей онкологии и урологии (д.м.н. Георгий Иванович Гафтон), онкогинекологии (к.м.н. Константин Джамильевич Гусейнов), абдоминальной онкологии (д.м.н. Алексей Михайлович Карачун). Использование внутрибрюшинной химиоперфузии специалистами разных отделений объясняется тем, что метод применяется у пациентов с перитонеальным канцероматозом (опухолевое поражение брюшной полости), который развивается у пациентов с колоректальным раком, раком яичников, желудка, опухолями аппендикса. Почти за 10 лет было выполнено около 100 перфузий.


Авторская публикация:
КИРЕЕВА ГАЛИНА СЕРГЕЕВНА
старший научный сотрудник научной лаборатории канцерогенеза и старения, кандидат биологических наук,
Председатель Совета молодых ученых НМИЦ онкологии им. Н.Н. Петрова
- Клиническая медицина
Аннотация научной статьи по клинической медицине, автор научной работы — Е. В. Левченко, Э. Д. Гумбатова, С. А. Кулева, К. Ю. Сенчик, О. Ю. Мамонтов
Введение. Терапия метастатического поражения злокачественных опухолей является одной из важнейших проблем современной детской онкологии. Наличие отдаленных метастазов рассматривается как основной признак генерализации опухолевого процесса. В целях улучшения результатов лечения таких пациентов нами было предложено дополнить циторедуктивную операцию интраоперационной изолированной химиоперфузией легкого и/или плевры цитостатиком. Цель исследования – определение эффективности метастазэктомии, комбинированной с изолированной химиоперфузией легкого/плевры (ИХПЛ/ИХПП) в условиях гипероксии у детей. Материалы и методы. За 10 лет исследования (2008–2018 гг.) на базе НМИЦ онкологии им. Н.Н. Петрова было произведено 45 ИХПЛ и ИХПП у 30 больных с внутрилегочными и внутриплевральными метастазами различных злокачественных опухолей костей. Метод ИХПЛ представляет собой хирургическую процедуру, в процессе которой происходит временное выключение легкого из кровообращения и его перфузия модифицированным физиологическим раствором, содержащим высокие концентрации противоопухолевого препарата ( мелфалан или цисплатин ), что позволяет осуществить доставку высоких доз цитостатика, избегая при этом системного воздействия препарата. В случаях выявления метастатического поражения париетальной плевры после метастазэктомии выполняли ИХПП, заключающуюся в дренировании плевральной полости и интраоперационном проведении после ушивания операционной раны гипертермической (42 oС) химиоперфузии плевральной полости раствором цисплатина в течение 2 ч. Результаты. У детей со злокачественными опухолями костей было выполнено 37 изолированных химиоперфузий с цисплатином и 8 – с мелфаланом. У 27 пациентов проведено 36 ИХПЛ, у 7 больных – 9 ИХПП. Девяти (20 %) пациентам выполнена билатеральная перфузия с интервалом от 1,5 до 31 мес. Летальных исходов во время операций и в послеоперационном периоде не было. Средняя длительность хирургических вмешательств составила 270 ± 90 (120–520) мин. Количество удаленных очагов – от 1 до 56 (среднее значение – 9). Средняя кровопотеря составила 300 ± 200 (150–1000) мл. Средний период наблюдения составил 45 мес; медиана общей выживаемости – 38 мес; 3-летняя общая выживаемость – 65,5 ± 9,4 %. Выживаемость без прогрессирования – 40,5 ± 10,5 % (n = 30). Выводы. ИХПЛ/ИХПП с цитостатиками – это метод комплексной терапии , способный улучшить качество и увеличить продолжительность жизни больных, особенно при исчерпанной возможности других вариантов лечения.
Похожие темы научных работ по клинической медицине , автор научной работы — Е. В. Левченко, Э. Д. Гумбатова, С. А. Кулева, К. Ю. Сенчик, О. Ю. Мамонтов
Isolated chemoperfusion of the lung and pleura as a method of treatment in children with common forms of solid bone tumors
Introduction. Therapy of malignant tumors is one of the most important problems of modern pediatric oncology. The presence of distant metastases is considered as the main sign of generalization of the tumor process. In order to improve the results of treatment of these patients, we proposed to supplement cytoreductive surgery with intraoperative isolated chemoperfusion of the lung and/or pleura with cytostatic. The purpose of the study is to determine the effectiveness of metastasectomy combined with isolated lung/pleura chemoperfusion (ILCP/PCP) under conditions of hyperoxia in children. Materials and methods. For 10 years of research (2008–2018) on the basis of the N.N. Petrov National Medical Research Center of Oncology produced 45 ILCP and PCP in 30 patients with intrapulmonary and intrapleural metastases of various malignant bone tumors. The ILCP method is a surgical procedure, during which the lung is temporarily switched off from the circulation and perfused with modified saline containing high concentrations of an antitumor drug ( melphalan or cisplatin ), which allows delivery of high doses of cytostatics while avoiding systemic exposure to the drug. In cases of detection of metastatic lesions of the parietal pleura after metastasectomy, PCP was performed, consisting in drainage of the pleural cavity and intraoperatively conducting, after suturing the surgical wound, hyperthermic (42 oС) chemoperfusion of the pleural cavity with a cisplatin solution for 2 hours. Results. In children with malignant bone tumors, 37 isolated chemoperfusions with cisplatin and 8 with melphalan were performed. In 27 patients, 36 ILCP were performed, in 7 patients – 9 PCP. Nine (20 %) patients underwent bilateral perfusion with an interval from 1.5 to 31 months. There were no lethal outcomes during operations and in the postoperative period. The average duration of surgical interventions was 270 ± 90 (120–520) minutes. The number of remote foci – from 1 to 56 (average value – 9). The average blood loss was 300 ± 200 (150–1000) ml. The mean follow-up was 45 months; median overall survival – 38 months; 3-year overall survival – 65.5 ± 9.4 %. Survival without progression – 40.5±10.5%(n=30). Conclusions. ILCP/PCP with cytostatics is a method of complex therapy that can improve the quality and increase the life expectancy of patients, especially with the exhausted possibility of other treatment options.
Российский журнал ДЕТСКОЙ ГЕМАТОЛОГИИ и ОНКОЛОГИИ Лгио The Russian Journal of Pediatric Hematology аnd Oncology
Изолированная химиоперфузия легкого и плевры как метод лечения у детей с распространенными формами
солидных опухолей костей
Е.В. Левченко1, Э.Д. Гумбатова1, С.А. Кулева1, К.Ю. Сенчик1, О.Ю. Мамонтов1, П.С. Калинин1, Е.М. Сенчуров1, Ю.А. Пунанов2
Контактные данные: Эльвира Джангировна Гумбатова gumbatovaelvira@gmail.com
Введение. Терапия метастатического поражения злокачественных опухолей является одной из важнейших проблем современной детской онкологии. Наличие отдаленных метастазов рассматривается как основной признак генерализации опухолевого процесса. В целях улучшения результатов лечения таких пациентов нами было предложено дополнить циторедуктивную операцию интраоперационной изолированной химиоперфузией легкого и/или плевры цитостатиком.
Цель исследования — определение эффективности метастазэктомии, комбинированной с изолированной химиоперфузией легкого/плевры (ИХПЛ/ИХПП) в условиях гипероксии у детей.
Материалы и методы. За 10 лет исследования (2008—2018 гг.) на базе НМИЦ онкологии им. Н.Н. Петрова было произведено 45 ИХПЛ и ИХППу 30 больных с внутрилегочными и внутриплевральными метастазами различных злокачественных опухолей костей. Метод ИХПЛ представляет собой хирургическую процедуру, в процессе которой происходит временное выключение легкого из кровообращения и его перфузия модифицированным физиологическим раствором, содержащим высокие концентрации противоопухолевого препарата (мелфалан или цисплатин), что позволяет осуществить доставку высоких доз цитостатика, избегая при этом системного воздействия препарата. В случаях выявления метастатического поражения париетальной плевры после метастазэк-томии выполняли ИХПП, заключающуюся в дренировании плевральной полости и интраоперационном проведении после ушивания операционной раны гипертермической (42 0С) химиоперфузии плевральной полости раствором цисплатина в течение 2 ч. Результаты. У детей со злокачественными опухолями костей было выполнено 37 изолированных химиоперфузий с цисплатином и 8 — с мелфаланом. У 27пациентов проведено 36 ИХПЛ, у 7 больных — 9 ИХПП. Девяти (20 %) пациентам выполнена билатеральная перфузия с интервалом от 1,5 до 31 мес. Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Information about the authors
K.Yu. Senchik: Dr. of Sci. (Med.) Leading Researcher of Anesthesiology and Intensive Care Department N.N. Petrov National Medical Research Center of Oncology, Ministry of Health of Russia, e-mail: k-yurivich@bk.ru
Е.В. Левченко: внедрение метода, проведение оперативного этапа лечения, разработка дизайна исследования, ведение больных, написание текста статьи, научная редакция статьи
Э.Д. Гумбатова: ведение больных, анализ научного материала, анализ полученных данных, обзор литературных публикаций, написание текста статьи
СА. Кулева: разработка дизайна исследования, ведение больных, анализ полученных данных, написание текста статьи, научная редакция статьи К.Ю. Сенчик: выполнение процедуры изолированной химиоперфузии О.Ю. Мамонтов: написание текста статьи
П.С. Калинин: координация радиологического обследования пациентов, проведение лучевой диагностики Е.М. Сенчуров: ведение больных, участие в оперативном этапе лечения Ю.А. Пунанов: ведение больных
Российский журнал ДЕТСКОЙ ГЕМАТОЛОГИИ и ОНКОЛОГИИ "í TÜMIVj^:.^—
E.V. Levchenko: implementation of the method, carrying out the operational stage of treatment, research design development, patients' management, writing the text of the article, scientific edition of the article
E.D. Gumbatova: patients' management, analysis of scientific material, analysis of the data, a review of literary publications, writing the text of the article S.A. Kuleva: research design development, patients' management, analysis of the data, writing the text of the article, scientific edition of the article K.Yu. Senchik: performing an isolated chemoperfusion procedure O. Yu. Mamontov: writing the text of the article
P.S. Kalinin: coordination of radiological examination ofpatients, use of radiologic procedures in diagnosis E.M. Senchurov:patients' management, participation in the operational stage of treatment Yu.A. Punanov:patients' management
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. / Conflict of interest. The authors declare no conflict of interest. Финансирование. Исследование проведено без спонсорской поддержки. / Funding. The study was performed without external funding.
Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Метастатическое поражение легких встречается при большинстве злокачественных опухолей костей. Злокачественные новообразования (ЗНО) костей представляют собой достаточно разнородную группу нозологических форм, отличающихся клиническими проявлениями, способностями к метастазированию, рецидивированию, чувствительностью к химиотерапии и лучевым методам воздействия. В России ежегодно регистрируется около 10 000 новых случаев злокачественных опухолей костей, что составляет 1 % всех малигнизированных новообразований. В 50 % наблюдений первичные злокачественные опухоли костей представлены остеогенными саркомами [1], на 2-м месте саркомы Юинга. Остальные гистологические формы встречаются реже. Гораздо чаще костные саркомы выявляются у детей и подростков во втором десятилетии жизни, когда их частота составляет 3 на 100 000 населения [1]. Остеогенная саркома представлена в 35—50 % случаев всех злокачественных опухолей костей у детей и подростков [2]. Частота встречаемости — 4 случая на 1 000 000 за год. При первичном обследовании у 20 % пациентов диагностируется распространенная форма заболевания, а еще у 22 % происходит прогрессирование на разных этапах лечения [3]. Появление метастазов в легких является результатом генерализации опухолевого процесса [3, 4]. За последние 30 лет достигнут значительный прогресс в терапии ЗНО костей у детей. Однако большая часть наблюдений касается пациентов с локализованными формами заболеваний. Общая выживаемость (ОВ) в этих случаях достигает 75—90 % [5]. К сожалению, около 10—40 % детей со злокачественными опухолями имеют метастазы уже при первичной диагностике. ОВ при IV стадии варьирует от 17 до 70 % в зависимости от гистологической верификации первичной опухоли [6—9]. Результаты многочисленных проведенных исследований показали, что наиболее благоприятными прогностическими факторами для распространенной формы остеогенной саркомы являются появление метастатических образований не во время неоадъювантной и адъювантной полихимиотерапии, а после завершения лечения; более длительный безрецидивный интервал между лечением и прогресси-рованием; отсутствие экстраторакальных метастазов;
выраженный патоморфоз опухоли по операционному материалу и возможность удаления всех метастатических образований хирургическим путем [10]. Внелегочные метастазы и местный рецидив рассматриваются многими авторами как неблагоприятные прогностические факторы [3, 11—14].
Отличительной особенностью саркомы Юинга, которая составляет 10—15 % наблюдений, является ее химио- и радиочувствительность. Имеющиеся публикации содержат противоречивые мнения о применении хирургического лечения метастатических образований в легких у детей [3, 15, 16]. Однако в 2011 г. P.A. Letourneau et al. доказали, что у детей с саркомой Юинга и метастатическими образованиями в легких хирургический подход лечения увеличивает 5-летнюю выживаемость до 80 % [17]. Отсутствие единого мнения и убедительные данные эффективности мета-стазэктомии обусловливают поиск и разработку новых альтернативных, в том числе комбинированных, подходов к терапии данной категории больных. Перспективным у этих детей в дополнение к циторедуктивной операции может стать проведение интраоперацион-ной изолированной химиоперфузии легкого и/или плевры (ИХПЛ/ИХПП) цитостатиком. Смысл ИХПЛ заключается во временном выключении легкого из кровообращения и перфузии его модифицированным физиологическим раствором, содержащим высокие концентрации противоопухолевого препарата, что позволяет осуществить доставку высоких доз химио-препарата в легкое, избегая при этом системного воздействия на организм [18—25]. В случаях же выявления метастатического поражения париетальной плевры после метастазэктомии проводили гипертермическую ИХПП в целях антибластики.
Целью настоящего исследования стало определение эффективности метастазэктомии, комбинированной с ИХПЛ/ИХПП, у детей.
Материалы и методы
В период с марта 2008 г. по январь 2018 г. на базе Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова было выполнено 45 ИХПЛ и ИХПП у 30 больных с внутрилегочны-ми и внутриплевральными метастазами различных ЗНО костей. Большую часть группы составили дети
Российский журнал ДЕТСКОЙ ГЕМАТОЛОГИИ и ОНКОЛОГИИ The Russian Journal of Pediatric Hematology аnd Oncology
Остеогенная саркома (n = 20) Osteogenic sarcoma Саркома Юинга (n = 8) Ewing's sarcoma ПНЭО (n = 1)
Primitive neuroectodermal tumor Недифференцированная опухоль (n = 1) Undifferentiated tumor
Рис. 1. Патогистологические варианты исследуемой группы больных Fig. 1. Histopathological variants of the studied group ofpatients
Таблица 1. Общая характеристика пациентов исследуемой группы (n = 30) Table 1. General characteristics ofpatients of the studied group (n = 30)

- Почему возникает канцероматоз брюшины?
- В чем преимущества гипертермической интраперитонеальной химиотерапии?
- Как проводят процедуру?
- Ревизия
- Циторедуктивная операция
- Гипертермическая интраперитонеальная перфузия
- Какие химиопрепараты применяют для HIPEC?
- Реконструкция
- Риски и возможные осложнения
- При каких других типах рака применяют методику?
- Насколько хорошо изучена HIPEC? Доказана ли эффективность?
- Каков прогноз?
Гипертермическая интраперитонеальная химиотерапия (HIPEC — от англ. Hyperthermic IntraPeritoneal Chemotherapy) — инновационный метод лечения в онкологии, который предполагает введение в брюшную полость химиопрепарата, нагретого до 42–43 °C. Ее применяют при канцероматозе (поражении раковыми клетками) брюшины.
Благодаря появлению HIPEC, стало возможным лечение злокачественных опухолей, которые ранее считались неоперабельными.
Почему возникает канцероматоз брюшины?
Брюшина представляет собой тонкую пленку из соединительной ткани. Она выстилает изнутри брюшную полость, покрывает внутренние органы. Некоторые органы покрыты брюшиной со всех сторон (расположены интраперитонеально), другие — частично (мезоперитонеально) или только с одной стороны (экстраперитонеально).
На поздних стадиях некоторых онкологических заболеваний раковые клетки могут распространяться в брюшину и проникать в брюшную полость, давать начало вторичным очагам. При этом резко ухудшается прогноз, снижается эффективность противоопухолевого лечения, так как многие препараты при внутривенном введении плохо проникают через брюшину.
Наиболее распространенные причины поражения брюшины раковыми клетками:
- Колоректальный рак (аденокарцинома толстой и прямой кишки) приводит к канцероматозу брюшины в 15% случаев.
- Рак желудка — в 50% случаев.
- Рак яичника — в 60% случаев.
- Рак аппендикса (аппендикулярная карцинома).
- Рак молочной железы.
- Рак поджелудочной железы.
- Псевдомиксома брюшины — редкая злокачественная опухоль, которая, как правило, начинается в аппендиксе. Реже первичный очаг может находиться в кишечнике, яичнике, мочевом пузыре. Опухолевые клетки производят желеобразную жидкость — муцин — которая со временем накапливается в брюшной полости. При отсутствии лечения больной погибает от кишечной непроходимости, истощения.
- Перитонеальная мезотелиома — редкая злокачественная опухоль, которая изначально развивается в брюшине.
Асцит брюшины, который часто сопровождает канцероматоз, проявляется увеличением объёма и болями в животе, потерей аппетита, тошнотой и рвотой. Из-за нарастания асцита (скопления жидкости в брюшной полости) нарушается работа кишечника и других органов, возникает одышка. Зачастую поражение брюшины не вызывает каких-либо симптомов и обнаруживается только во время хирургического вмешательства.
В диагностике канцероматоза брюшины помогают такие исследования, как компьютерная томография, ПЭТ-КТ, биопсия, диагностическая лапароскопия, анализ крови на онкомаркеры.
В чем преимущества гипертермической интраперитонеальной химиотерапии?
Ранее пациентов, у которых был диагностирован канцероматоз брюшины, часто признавали безнадежными. Классические методы лечения рака (хирургия, системная химиотерапия, лучевая терапия) не могли продлить жизнь таких больных. Выживаемость измерялась неделями и месяцами. За последние два десятилетия ситуация изменилась.
HIPEC обладает преимуществами, которые помогли существенно повысить эффективность борьбы с поражением брюшины раковыми клетками:
Как проводят процедуру?
Лечение состоит из четырех этапов:
- Ревизия (осмотр) брюшной полости.
- Циторедуктивная операция.
- Собственно HIPEC.
- Реконструкция.
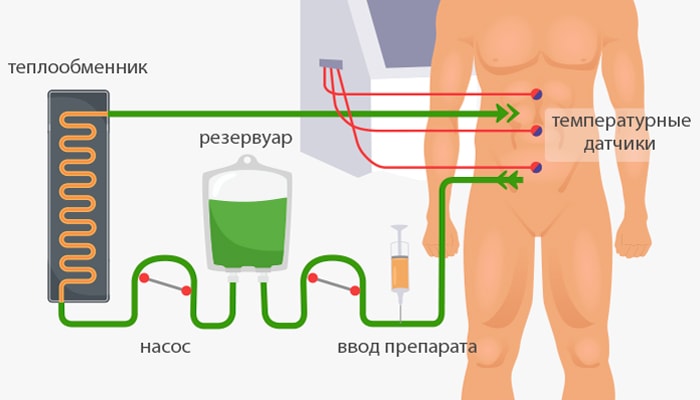
Вмешательство сложное и длительное, оно может продолжаться до 16 часов (в среднем — 3–9 часов).
Ревизия
Во время ревизии хирурги тщательно осматривают брюшную полость. Оценивают перитонеальный индекс рака (peritoneal cancer index, сокращенно — PCI). Брюшную полость условно делят на 13 областей. В каждой из них оценивают размеры самого большого узла. В зависимости от этого каждая область получает определенное количество баллов:
- узел не визуализируется — 0 баллов;
- менее 0,5 см — 1 балл;
- 0,5–5 см — 2 балла;
- узел более 5 см или несколько сливающихся более мелких узлов — 3 балла.
Врачи должны убедиться, что смогут удалить все видимые узлы. Прогноз оценивают в зависимости от общей суммы баллов и типа опухоли. Если сумма превышает критическое значение, лечение признают нецелесообразным. Операцию завершают, HIPEC отменяют. Перитонеальный индекс рака можно также оценить в ходе диагностической лапароскопии на этапе обследования.
Циторедуктивная операция
Во время циторедуктивной операции нужно удалить все видимые очаги размерами более 1–2 мм. От того, насколько качественно это сделано, зависит эффективность всего лечения и прогноз для пациента. Удаляют орган, в котором находится опухоль, или его пораженную часть, париетальную (выстилающую стенки брюшной полости) и часть висцеральной (покрывающей внутренние органы) брюшины, соседние пораженные органы.
Гипертермическая интраперитонеальная перфузия
После операции все видимые опухоли удалены, но в брюшной полости все еще остались раковые клетки. Если эти клетки не будут уничтожены, они дадут начало новым очагам, произойдет рецидив, и весь эффект от лечения будет сведен на нет. Эту задачу и помогает решить HIPEC.
Через катетеры, подсоединенные к специальному аппарату, брюшную полость пациента промывают раствором химиопрепарата, подогретым до 42–43 °C. Процедура продолжается 30–90 минут, после чего раствор полностью удаляют из брюшной полости. Постоянно контролируют скорость потока, давление, объем раствора. В теле пациента во время процедуры установлены температурные датчики.
Какие химиопрепараты применяют для HIPEC?
Чаще всего в брюшную полость вводят митомицин C, оксалиплатин и цисплатин. Нагревание повышает эффективность таких химиопрепаратов, как карбоплатин, митоксантрон, доксорубицин, эпирубицин, ифосфамид.
Реконструкция
После того как все очаги удалены, хирург восстанавливает целостность кишечника, если это невозможно — накладывает еюно-, цеко- или колостому: подшивает к коже подвздошную, слепую или ободочную кишку и формирует отверстие для отхождения стула.
Пациент перенес серьезное хирургическое вмешательство, поэтому на некоторое время его помещают в палату интенсивной терапии.

Риски и возможные осложнения
Циторедуктивная операция в сочетании с HIPEC — сложное вмешательство. Оно несет определенные риски. Смертность от осложнений после лечения составляет 3%. Это ниже, чем при многих других сложных операциях.
После хирургического вмешательства возможны некоторые осложнения:
- Инфекции легких и мочевого пузыря.
- Осложнения в месте операционной раны.
- Сложности с приемом пищи и жидкости в течение нескольких дней.
- Редко встречаются инфекции брюшной полости и выпадение волос.
Срок госпитализации в среднем составляет 2–4 недели. Спустя несколько недель проводится контрольное обследование. Затем его повторяют через каждые 3 месяца, постепенно частоту уменьшают до 1 раза в год.
При каких других типах рака применяют методику?
Подогретые растворы химиопрепаратов можно вводить не только в брюшную полость. Существует такая процедура, как изолированная гипертермическая перфузия (LIMB). Химиопрепарат вводят в артерию ноги или руки. LIMB помогает спасти конечность от ампутации при меланомах, саркомах мягких тканей.
Насколько хорошо изучена HIPEC? Доказана ли эффективность?
HIPEC помогает существенно увеличить продолжительность жизни и улучшить состояние пациентов — это доказано в ходе научных исследований.
Семьдесят два ведущих хирурга-онколога из 55 онкологических центров в 14 странах мира, включая США, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих раком толстой и прямой кишки.

Каков прогноз?
Если лечение при канцероматозе брюшины не проводится, средняя выживаемость пациентов составляет всего 2–6 месяцев. HIPEC в сочетании с циторедуктивной операцией помогает существенно улучшить прогноз. Средняя выживаемость после лечения измеряется годами. Фактически HIPEC способна полностью уничтожить опухоль, но впоследствии может возникнуть рецидив.
С целью предотвращения рецидива и метастазирования через 4–6 недель после хирургического лечения и HIPEC может быть назначен курс адъювантной химиотерапии.
Читайте также:

