Химический канцерогенез является основной причиной раковых заболеваний
Перед тем как развиться в инвазивную метастатическую форму злокачественного новообразования, опухоль проходит множество стадий. Схематично процесс преобразования нормальной здоровой клетки в опухолевую показан на рисунке. Специфические биологические характеристики раковой ткани описаны ниже.
Биологические признаки рака:
- Самодостаточная пролиферация и рост
- Невосприимчивость к ингибиторам роста
- Жизнеспособность в отсутствие поддерживающих стимулов Неограниченный репликативный потенциал
- Прорастание кровеносными сосудами Инвазивность и метастазирование
- Потеря генетической стабильности
Некоторые из этих биологических характеристик являются общими для всех типов опухолей. С точки зрения клинической практики, пожалуй, самую большую проблему представляет генетическая нестабильность. В этом случае даже после проведенного лечения генетически измененные клетки будут продолжать постоянно продуцировать факторы роста опухоли, что может сводить на нет всю эффективность лечения.
Подозрения о том, что рак может вызываться различными химическими соединениями, существует уже довольно давно. Еще в 1775 г. сэр Персиваль Потт отмечал необычайно высокий уровень заболеваемости опухолями мошонки у трубочистов.
В 1895 г. Рен описал повышенную заболеваемость раком мочевого пузыря у рабочих анилинового красочного производства. К настоящему времени известен уже целый список веществ, как присутствующих в окружающей среде, так и потребляемых с пищей, которые считаются потенциальными канцерогенами. Одним из наиболее известных и распространенных канцерогенов является табачный дым.
Механизмы химического канцерогенеза в настоящее время интенсивно исследуются.
Этот класс химических соединений широко представлен в продуктах горения углеродсодержащего топлива. Такие соединения присутствуют в табачном дыме, продуктах обработки коксующихся углей, выхлопных газах и в чаде при приготовлении некоторых видов пищи. Когда была продемонстрирована канцерогенность бензантрацена в коксующихся углях, из них был выделен 3,4-бензапирен, который обнаружил явно выраженный канцерогенный эффект в развитии рака кожи у лабораторных животных.
В то же время не все полициклические углеводороды являются канцерогенами. По-видимому, канцерогенное действие оказывает только одна часть молекул веществ этого класса, так называемый К-сайт. Он связывает молекулы кислорода в реакциях, где катализаторами выступают клеточные ферменты. Эта часть молекулы реагирует с клеточной ДНК, особенно с гуанидиновыми основаниями, что, по-видимому, и обусловливает ее канцерогенное действие.
Добавление в пищу лабораторных животных диметилнитрозоамина вызывает у них рак печени. Присутствующие во многих пищевых продуктах нитриты в желудке преобразуются в нитритную кислоту.
Последняя может реагировать с пищевыми аминами, превращая их в нитрозоамины. Так формально описывается механизм образования потенциальных канцерогенов из обычной еды. Тем не менее в настоящее время не существует убедительных доказательств того, что нитрозоамины играют существенную роль в человеческом канцерогенезе.

В исследованиях, проведенных вслед за оригинальными работами Рена, показавшего рост заболеваемости раком мочевого пузыря у работников анилиновой промышленности, было доказано, что производные анилина, такие как а-нафтиламин и бензидин, являются канцерогенами. Позднее обнаружилось, что и производные азокрасителей также могут быть канцерогенными. Так канцерогенные свойства обнаружились у диметиламино-азобензена, пищевого красителя, который ранее использовался для подкрашивания маргарина. Попав в организм вместе с пищей, такие вещества вызывают индукцию первичных опухолей отнюдь не в пищеварительном тракте.
Дело в том, что этот класс веществ должен сначала метаболизироваться в организме, а вот продукты метаболизма уже и являются канцерогенами. Например, а-нафтиламин гидроксилируется в желудке в активную канцерогенную форму, которая затем в печени гликозилируется в неактивные водорастворимые молекулы и выводится с мочой. В то же время присутствующий в слизистой оболочке мочевого пузыря фермент глюкоронидаза освобождает активный канцероген.
Рак развивается только у тех организмов, у которых есть данный фермент в мочевом пузыре. Механизм индукции опухолей у освобожденного аминофенола, как и в случае с полициклическими углеводородами, состоит в том, что он реагирует непосредственно с гуаниновыми основаниями ДНК. Латентный период между попаданием этих веществ в организм человека и развитием опухоли мочевого пузыря может составлять до 20 лет. Табачный дым также содержит 3-нафтиламин, с чем связывается развитие рака мочевого пузыря у курильщиков.
Этот токсин вырабатывается микроскопическим грибом Aspergillus flavus, которым могут быть заражены пищевые продукты. Существуют подозрения, что этот токсин может являться канцерогеном при раке печени, так как получены данные о повышенной заболеваемости раком печени у людей, в пище которых он присутствует. Однако прямых доказательств канцерогенного действия указанного токсина не обнаружено. Скорее афлатоксин может выступать промотором размножения вируса гепатита В, который поражает ткани печени, с их возможным последующим перерождением.
Химически токсин представляет собой сложную молекулу, которая метаболизируется по пути, сходному с метаболизмом полицикличеких углеводородов, а значит, продукты его метаболизма могут вступать в реакцию с ДНК клеток.
Терапевтические медикаментозные средства, используемые в онкологии, сами в свою очередь являются канцерогенами. Применяемые в онкологии алкилирующие агенты напрямую связываются с ДНК, и их использование всегда связано с риском возникновения вторичных опухолей. Так успешное лечение болезни Ходжкина и рака яичников очень часто сопровождается развитием острой лейкемии. Применение эпиподофилотоксинов также чревато высоким риском развития вторичных лейкемий.

В лабораторных условиях канцерогенные свойства обнаружены более, чем у 2000 химических продуктов. Считается, что для человека безусловно канцерогенными является несколько десятков агентов.
- Полициклические ароматические углеводороды (3,4-бензпирен, 9,10-диметилбензантрацен, метилхолантрен и др.) обладают главным образом местным действием, но могут вызывать опухоли и в отдалении от места попадания в организм. Встречаются везде, их источниками является промышленность, отопительные системы, транспорт. Природные источники химических канцерогенов - горючие ископаемые, вулканы. Однако, по сути дела, это проканцерогены (т. е. предшественники), а канцерогенами являются продукты их обмена (для бензпирена - это дигидродиолэноксиды, для других веществ - фенолы, хиноны и т. д.
- Ароматические амины - b -нафтиламин (вызывает опухоли мочевого пузыря).
- Нитрозосоединения (нитрозамины), такие как диметилнитрозамин, нитрозомочевина, нортитрозоникотин и нитрозоанабазин (содержащиеся в табаке) и др., оказывают системное политропное действие на организм. Наиболее важный источник этих веществ - эндогенный синтез из пищевых аминов и нитратов, а также - курение, некоторые сорта пива, амидопирин.
- Производные гидразина, источниками которых являются некоторые лекарственные вещества (гидразид изоникотиновой кислоты, фенилэтилгидразин и др.), гербициды, некоторые грибы.
- Природные канцерогены (микробные, грибковые, растительные) - микотоксины (афлатоксин), пирролизидоновые алкалоиды, гризеофульвин, азасерин. Асбест и другие минеральные волокна - вызывают мезотелиому, рак легкого, может быть, опухоли органов желудочно-кишечного тракта. Неясно, правда, физико-химический, химический это канцерогенез или канцерогенез инородных тел. Источниками канцерогенов этой группы являются промышленность, транспорт, воздух, иногда питьевая вода.
- Соединения металлов - As (легкие), Cr (легкие), Ni (полость рта, легкие, гортань? ), Be (легкие), Pb, Ka (дыхательные пути, предстательная железа).
- Эндогенные канцерогены - продукты обмена тирозина и триптофана (рак мочевого пузыря, лейкозы, лимфомы, рак яичников, печени), серотонина, стероидные гормоны. Считается, что эндогенные канцерогены (например, тирозин) могут оказывать трансплацентарное действие и вызывать, в частности, гемобластозы.
Известно, что некоторые канцерогены, эффективные в экспериментальных условиях, действуют на организм человека. При этом одни из них обладают довольно четкой органотропностью (асбест у животных и человека - мезотелиома плевры, винилхлориды - ангиосаркома печени), другие могут вызывать опухоли различных органов. Очень большое значение для чувствительности к канцерогенам имеет пролиферативная активность тканей.
Несмотря на огромное количество химических канцерогенов (проканцерогенов) их конечным продуктам присущи одинаковые свойства:
- электрофильность (способность взаимодействовать с нуклеофильными центрами макромолекул (в частности с ДНК);
- мутагенность;
- короткий период полураспада (десятки минут - часы).
Первым и наиболее сильным канцерогеном является солнечное излучение, с которым коррелирует возникновение рака кожи. Он возникает в основном на открытых частях тела у лиц, проводящих значительную часть времени на открытом воздухе. Не зря его давно называют "болезнью фермеров” и "болезнью моряков”. Частота рака кожи больше у блондинов, чем у брюнетов; у белых, чем у людей с темным цветом кожи. Также коррелирует с интенсивностью воздействия на кожу солнечного излучения и развитие меланомы.
Ионизирующая радиация влияет на частоту развития лейкозов (преимущественно миелоидных). Накопление в организме радиоактивного йода и цезия вызывает рак щитовидной железы, радиоактивного стронция - опухоли костей.
Сведения о канцерогенном влиянии других видов излучения противоречивы.
В настоящее время считается доказанной роль ряда вирусов в развитии опухолей.
- Вирус ATLV (adult T-cеll leukemia virus), эндемичный для района Японского моря и у негров стран Карибского моря, вызывает у лиц старше 50 лет последовательное развитие гепатоспленомегалии, лимфаденопатии, а затем и лейкоза. Передается он Т-лимфоцитами от матери к ребенку, от мужа к жене, а также при переливании крови.
- Высоко вероятна роль вируса Эпстайна - Барра в этиологии лимфомы Беркитта, а также опухолей носоглотки.
- Вирус герпеса II типа, а также вирус папилломы человека (передаваемые половым путем) являются, вероятно, индукторами в развитии рака шейки матки. Активаторами процесса могут явиться, например, раннее начало половой жизни с частой сменой партнеров.
- Инфицирование вирусом гепатита В и С - один из основных факторов риска развития гепатоцеллюлярного рака печени.
- Давно известна роль шистосомы в развитии рака мочевого пузыря в Египте, Ирак и странах Юго-Восточной Азии, а печеночной двуустки - в развитии рака желчных путей в Японии, Корее, странах Юго-Восточной Азии, на Дальнем Востоке.
- Не вызывает сомнения роль гормонов (как экзогенных, так и эндогенных). Можно привести две опухоли, развитие которых связано с действием гормонов:
- светлоклеточный рак влагалища у молодых женщин под действием диэтилстильбестрола;
- аденома печени у женщин, принимавших гормоны.
При этом гормоны принимают различное участие в канцерогенезе:
- оказывают прямое канцерогенное действие;
- оказывают активирующее действие путем стимуляции пролиферации;
- влияют на метаболизм химических канцерогенов;
- влияют на иммунитет.
Следует, однако, отметить, что в развитии гормонально-зависимых опухолей имеет значение не избыток или недостаток того или иного гормона, а нарушение всего гормонального баланса. Различный гормональный статус может предрасполагать к развитию различных (определенных) опухолей. Например, рак эндометрия часто сочетается с ожирением, гипертонической болезнью, сахарным диабетом. В развитии рака молочной железы определенно имеет значение наличие или отсутствие у женщины беременностей, а также кормила она ребенка грудью или нет. В отношении беременности, однако, данные противоречивы. Профилактическое значение имеет лишь 1-я беременность, если она завершилась нормальными родами до 30 лет.
Роль организма в возникновения и развития рака
Не вызывает сомнений, что большая роль в развитии опухолей принадлежит наследственности. При некоторых опухолях (например, таких, как ретинобластома,) отмечается отчетливая семейная предрасположенность. Существуют также семьи, у которых из поколения в поколение отмечается множественный полипоз желудка и кишечника, являющийся облигатным предраком.
В настоящее время описано много наследственных синдромов и болезней, при которых опухоли являются одним из частых или основных проявлений или при которых вероятность развития опухолей становится очень высокой (болезнь Дауна, при которой лейкоз встречается в 11 раз чаще, синдром Клайнфелтера и рак молочной железы). Отчетливо обнаруживается корреляция между пороками развития и возникновением опухолей, например, нефробластома и пороки мочеполовой системы, гемигипертрофия, аниридия.
Отмечаются половые особенности частоты различных опухолей. Многие опухоли в Европе чаще у мужчин, чем у женщин (кстати, у них отмечается более высокий метаболизм канцерогенов): опухоли носоглотки - в 2 раза чаще; глаз - в 2,4 раза; желудка - в 2,1 раза; гемобластозы - в 1,8- 1,3 раза; костей - в 1,7 раза, нервной системы и соединительной ткани - в 1,4 раза. Первое место по частоте у мужчин занимают опухоли дыхательных путей.
У женщин в 2 раза чаще, чем у мужчин встречаются опухоли щитовидной железы; несколько чаще - опухоли желчного пузыря и меланомы. Первое место по частоте у женщин занимают опухоли молочной железы и половых органов.
После 60 лет риск рака в 50-100 раз выше, чем в возрасте 25 лет.
- с возрастом увеличивается суммарная доза канцерогена или латентный период ("доза - время - эффект);
- одновременно с возрастом снижается активность клеточного иммунитета, имеющая первостепенное значение в противоопухолевом резистентности.
Для разных опухолей характерны разные возрастные кривые. Например, ретинобластома, рак кишечника при наследственном полипозе, остеогенная саркома длинных костей встречаются преимущественно в первые годы жизни. В последующие 10- 15 лет частота их снижается почти до 0.
Для большинства опухолей (желудок, легкие и др.) характерно прогрессивное увеличение частоты, начиная с 30 до 80, после чего темп несколько замедляется. Рак шейки матки встречается тем чаще, чем раньше начинается половая жизнь, чем больше женщина имеет половых партнеров и чаще рожает. Правда, в отношении влияния родов существует обоснованное мнение, что основное значение при этом имеют возникающие при родах, плохо зашитые разрывы шейки матки.
Рак молочной железы, напротив, чаще встречается у не беременевших и не рожавших женщин (у монахинь, незамужних женщин), что связывается с большой ролью в развитии этих опухолей стероидных гормонов. Считается, что до 2/3 опухолей у женщин являются гормонально зависимыми.
Канцерогены могут проникать и через плаценту. Введение канцерогенов в 1-й трети беременности оказывает эмбриотоксический эффект; во 2-й - тератогенный; в 3-й - преимущественно канцерогенный. Одним из проявлений наследственной предрасположенности, возможно, является очень высокая чувствительность тканей плода к действию минимальных доз эндогенных и экзогенных канцерогенов.
Канцерогены и статистика рака
В развитии опухолей человека безусловно играют роль различные факторы, относительная роль которых оценивается следующим образом:
- табак - 25-40%
- пища - 10-70%
- сексуальная активность и репродуктивная деятельность - 1- 13%
- производственные факторы - 2 - 8%
- загрязнение среды обитания (в том числе промышленными отходами) - 2- 7%
- алкоголь - 2 - 4%
- геофизические факторы - 2 - 4%
- лекарственные препараты и медицинские процедуры - 0,5 - 3%
Курение - главная причина увеличения частоты рака легкого (у курящих рак легкого в 11,3 раза чаще, чем у некурящих), при этом в так называемых развитых странах на долю рака легкого в настоящее время приходится более 6% от общего количества смертей. Квартирующее в Лионе Международное агентство по исследованию рака в своем обзоре, посвященном проблеме курения, приводит сведения, что увеличение частоты рака легких у женщин отмечается с начала в 60-х годов текущего столетия, то есть через 15-20 лет после того, как женщины приобрели привычку к курению во время второй мировой войны.
Табак влияет также и на развитие опухолей других локализаций: у курящих рак полости рта, глотки, гортани, пищевода встречается в 7 раз, рак мочевого пузыря - в 2,2 раза, поджелудочной железы - в 1,7 раз, почек - в 1,4 раза чаще, чем у некурящих. Считается, что в США с курением связано 43% злокачественных опухолей у мужчин и 15% у женщин.
В табаке содержится более 3000 химических веществ, в том числе 10 безусловно канцерогенных полициклических углеводородов, а также нитрозамины, мышьяк, никель, кадмий, свинец и другие канцерогенные продукты.
Курение в любом виде и в любых количествах опасно для жизни и представляет собой форму медленного самоубийства.
Питание. Здесь имеет значение комплекс факторов, но в первую очередь отмечается высокая корреляция между поступлением в организм жира и распространенностью опухолей молочной железы, предстательной железы, тела матки, яичников, толстой кишки. Кстати, экспериментальные исследования показывают, что многие канцерогены накапливаются именно в жировой ткани.
- К развитию рака желудка предрасполагает недостаток белка и большое количество углеводов в пище, копчености, вяленая рыба, соленая рыба, соленые и маринованные овощи, недостаток свежих овощей и фруктов, много соли (атрофический и анацидный гастрит), хранение пищи при комнатной температуре (образование нитратов, предшественников нитрозаминов).
- Для учащения развития рака толстой кишки продуктами риска в отношении развития опухолей является жир (жирные кислоты являются активатором канцерогенеза), животные белки, мало волокон, пиво.
- Фактором риска для развития рака желчного пузыря и эндометрия является ожирение (эстрогены).
Кроме того в пище может содержаться примесь явных химических канцерогенов. Канцерогенными являются некоторые пищевые добавки.
Веществами, тормозящими рост опухолей, являются витамин А, С, каротин. Из пищевых продуктов больше всего антиканцерогенных свойств приписывают капусте.
Роды и риски развития женских опухолей
Риск развития рака молочной железы гораздо выше у не рожавших, мало рожавших, не кормивших грудью, а также у женщин, родивших первого ребенка в сравнительно зрелом возрасте.
Рак шейки матки развивается тем чаще, чем раньше начинается половая жизнь и больше женщина имеет половых партнеров.
Риск развития рака молочной железы и яичников увеличивается при применении эстрогенных гормонов в период менопаузы и постклимактерическом периоде. Роль пероральных противозачаточных средств, вероятно, двояка: с одной стороны (во всяком случае у молодых женщин при длительном применении) они увеличивают риск развития рака молочной железы, но с другой - уменьшают риск развития рака матки и яичников.
На сегодняшний день известно более 30 канцерогенов, с которыми человек сталкивается в процессе производственной деятельности.
- Сельское хозяйство - мышьяковые инсектициды (опухоли кожи и легких).
- Горнодобывающая промышленность - продукты радона (опухоли легких).
- Асбестовая промышленность, судостроение и моторостроение - асбест (мезотелиома и рак легкого).
- Нефтяная промышленность - полициклические углеводороды (опухоли кожи).
- Металлургическая промышленность - хром (опухоли легких).
- Химическая промышленность - поливинилхлорид (ангиосаркома печени), анилиновые красители (рак мочевого пузыря)
- Газовая промышленность - продукты карбонизации газа, b -нафтиламин (опухоли легкого, мочевого пузыря).
- Производство резины - бензол (лейкозы).
- Производство кожи и ремонт обуви - кожаная пыль, бензол (опухоли носоглотки, лейкозы).
- Производство мебели - древесная пыль (опухоли носоглотки).
- Текстильная промышленность - минеральные масла с загрязняющими добавками (опухоли кожи).
При лечении лейкозов цитостатиками часто возникают вторые опухоли. Доказана канцерогенное влияние анальгетика с фенацетином (рак почечной лоханки), диэтилстильбестрола, конъюгированного эстрогена (рак эндометрия), винкрестина (острый лейкоз) и др.
Алкоголь, вероятно, является не канцерогеном, а активатором, повышая частоту опухолей, в частности, вызываемых курением. Отмечается связь тяжелого пьянства и рака полости рта, глотки, гортани и пищевода. Накапливаются свидетельства, что употребление пива повышает риск рака прямой кишки и молочной железы. Алкогольный цирроз печени (как и постнекротический цирроз другой этиологии) является предраковым состоянием.
Ультрафиолетовое излучение повышает риск развития опухолей кожи (базальноклеточный рак, плоскоклеточный рак, меланома).
Ионизирующее излучение у человека может вызывать любые опухоли, кроме хронического лимфолейкоза. Имеют значение доза (особенно ее мощность), вид излучения, возраст в момент облучения. При пренатальном облучении максимум развития опухолей отмечается в возрасте 4- 5 лет.
При постнатальном облучении латентный период при развитии лейкозов составляет 2 года и больше, при развитии других опухолей - до 20 лет и более (максимум опухолей возникает через 5- 10 лет после облучения).
Считается, что ионизирующие излучения вызывают около 2% всех смертей от злокачественных опухолей (75% - естественный фон облучения, 25% - лечебно-диагностические процедуры и 0,01% - профессиональное облучение).
Помните: только вы и ваше внимательное отношение к своему здоровью позволит вам прожить долгую жизнь без болезней.
Химическими канцерогенами являются соединения, которые после проникновения в организм прямо (без предварительных изменений своей молекулы), или косвенно, то есть после того, когда их исходные молекулы, именуемые проканцерогенами, в организме превращаются в активные соединения, вызывают злокачественный рост клеток.
Химические канцерогены могут быть разделены на антропогенные, появление которых в окружающей среде связано с деятельностью человека, и природные, не связанные с производственной или иной деятельностью.
Химический канцерогенез начал развиваться с 1775 года, когда английский врач P. Pott описал рак кожи мошонки у трубочистов.
Именно сэр Персиваль Потт может считаться его номинальным основателем, поскольку статистико-эпидемиологическое исследование, выполненное этим хирургом больницы святого Варфоломея по заданию палаты лордов британского парламента, позволило доказать связь между компонентами сажи и раком кожи мошонки у помощников лондонских трубочистов.
От рака мошонки умирал почти каждый пятый лондонский трубочист! Очень важной стороной этих исследований было открытие наличия патентного периода между началом действия канцерогена и появлением неоплазмы.
Когда помощниками трубочистов были маленькие дети 5-8 лет, а прочистка трубы происходила непосредственно каудальным концом тела такого помощника — рак мошонки возникал у трубочистов в возрасте 20-25 лет. После законодательного запрещения использовать в данной профессии труд лиц моложе 16 лет, которое последовало на основе данных Потта, рак мошонки у трубочистов не исчез, однако, возраст его проявления отодвинулся к 40-45 годам.
Интересно, что руководствуясь исследованиями Потта, Датская гильдия трубочистов в начале XIX века обязала этих специалистов ежедневно принимать ванну, что имело радикальный профилактический эффект, устранив риск рака мошонки у трубочистов Копенгагена.
Но решающую роль в признании химического канцерогенеза имело создание химической экспериментальной модели рака японскими патофизиологами Ямагивой и Ишикавой (1918). Повторные многократные аппликации каменноугольной смолы на кожу уха кролика вызывали сначала воспаление и гиперплазию в виде гиперкератоза, затем формировалась папиллома, а при продолжении аппликаций — и плоскоклеточная карцинома, вначале неинвазивная, а затем инвазивно-метастазирующая. Весь процесс занимал от 1 до 6 месяцев.
Принципиальным достижением стало установление того факта, что самые разные новообразования могут развиться при различных способах экспериментального контакта с одним и тем же химическим канцерогеном: при кожной аппликации возникает рак кожи, при ингаляции — рак легких, при субкутанных инъекциях — саркомы, при внутрикостномозговом и внутривенном введении — лейкоз. Это свидетельствовало о монопатогенетическом характере полиэтиологического процесса химического канцерогенеза.
С этого момента начались систематические исследования в области химического канцерогенеза. Первыми подверглись идентификации природные канцерогены каменного угля и другого промышленного сырья (метилхолантрен, дибенз(а)пирен, бензантрацен). Затем оказалось, что искусственные производные природных соединений (бензидин, нафтиламин, ортоаминоазотолуол и др.) также канцерогенны.
Наконец, в век пластмасс Оппенгеймер (1948) показал, что синтетические вещества (полистирол, дакрон) также вызывают неоплазию при имплантации животным сделанных из них пленок и сеток.
К настоящему времени в природе существует около 6 млн естественных и созданных искусственно химических соединений, ежегодно появляется около 5-6 тысяч новых.
Человек активно контактирует с 50 тыс. из них. Около 7 тыс. веществ испытано на канцерогенную активность. Канцерогенными для животных оказались 800-900 соединений.
Механизм действия и классификация химических канцерогенов
Изучение химических канцерогенов впервые выявило закономерности, послужившие основой для создания современной концепции многоступенчатого (многошагового или поэтапного) канцерогенеза. В частности, были обозначены первые ступени этого процесса — инициация и промоция.
Химические канцерогены, включая гормоны, ответственны за возникновение до 80-90% всех злокачественных опухолей человека, вызывая изменения в клеточном геноме в виде специфических мутаций. В зависимости от механизма реализации своего канцерогенного действия химические канцерогены подразделяются на генотоксические и негенотоксические (эпигенетические).
Генотоксические канцерогены вызывают мутации при прямом взаимодействии канцерогена или его метаболита с ДНК негенотоксические — в результате спонтанных мутаций или вторичных влияний на ДНК (оксидативный стресс, торможение апоптоза, стимуляция пролиферации и др.), т.е. негеномных (эпигенетических) воздействий. Имеются и другие различия.
Если генотоксический механизм канцерогенеза является практически универсальным для всех видов, включая человека, то важной особенностью эпигенетических канцерогенов является видовая, линейная, половая специфичность механизмов их канцерогенного действия.
Принципиальным различием между генотоксическими и негенотоксическими канцерогенами является и то, что первые оставляют след в геноме клетки в виде активации того или иного специфического для этого канцерогена онкогена или инактивации антионкогена, а при действии вторых — в геноме будут обнаружены различные изменения, соответствующие примененным негенотоксикантам.
Деление канцерогенов на генотоксические и негенотоксические в определенной степени соответствует делению на инициаторы и промоторы канцерогенеза.
Генотоксические канцерогены
Генотоксические агенты делят на канцерогены прямого действия и непрямые канцерогены или проканцерогены — вещества, не канцерогенные в исходной форме, но активирующиеся в клетке под действием соответствующих ферментов, соединения прямого действия не требуют химического преобразования для обретения канцерогенных свойств.
К агентам такого рода относятся производные N-нитрозоалкилмочевины, азотистый иприт, этиленамин и др. Некоторые из них являются доказанными канцерогенами человека. Для каждого класса прямых канцерогенов существуют свои пути метаболизма, конечные активные метаболиты и образуемые ими аддукты. Последние нередко используются как маркеры воздействия канцерогенов (в молекулярной эпидемиологии).
Большинство же химических канцерогенов непрямые, т.е. сами по себе они неактивны и для них не характерно прямое канцерогенное действие. Непрямые канцерогены вначале подвергаются в организме метаболизму (распаду), а некоторые их продукты — ферментативной (метаболической) активации с последующим образованием конечных канцерогенных веществ, повреждающими ДНК вторично и вызывающих трансформацию клетки.
К непрямым генотоксическим канцерогенам относятся полициклические ароматические углеводороды (ПАУ), нитрозосоединения, ароматические амино- и азосоединения, афлатоксины, стероиды и т.д.
Длительное время изучению свойств и действия химических канцерогенов мешала их необычная химическая пестрота, и только в последние годы удалось сформулировать гипотезу об общем механизме действия всех этих соединений.
Судьба химических канцерогенов в организме может быть различной: они превращаются либо в токсические, либо в биологически инертные, либо в канцерогенные метаболиты.
Очевидно, на риск возникновения злокачественных опухолей будет влиять индивидуальная способность организма метаболизировать, т.е. детоксицировать или активировать попадающие в организм канцерогенные вещества.
Как правило, попавшие в организм любые химические канцерогены, как чужеродные вещества, разрушаются в метаболических реакциях специальными ферментными системами.
Эти системы эволюционировали в ходе исторического развития в направлении не только метаболизма эндогенных субстратов, но и нейтрализации чужеродных соединений (ксенобиотиков). Наиболее изученными, влияющими на метаболизм канцерогенных веществ, являются изоферменты семейства цитохрома Р450 (в настоящее время их известно более 400).
Большинство канцерогенов гидрофобны, поэтому способ их выведения из организма сводится в основном к повышению водорастворимости. При этом первым событием в цепи метаболических превращений является окисление исходной молекулы изоформами цитохрома Р450. Затем продукты окисления образуют парные соединения (с лутатионом, серной кислотой и др.).
В результате они становятся гидрофильными и легко выводятся из клетки и организма. Вместе с тем, наряду с процессом детоксикации, ряд соединений, в частности непрямые канцерогены, в ходе этих реакций могут превращаться в канцерогенные вещества. Этот процесс носит название метаболической активации канцерогенов.
В результате метаболических превращений в организме все генотоксические канцерогены (и прямого, и конечные продукты непрямого действия) приобретают одно общее свойство — высокореактивную электрофильность за счет наличия в своей структуре избыточного положительного заряда — электрофильной группы. Последняя взаимодействует в клетке с отрицательно заряженными (нуклеофильными). т.е. богатыми электронами зонами, включая молекулы ДНК, РНК и белков.
Следовательно, критическим событием в химическом канцерогенезе является электрофипьная неферментная реакция в виде ковалентного связывания метаболитов химических соединений с отрицательно заряженными группами молекул ДНК и белков (в основном содержащими атомы N, S, О) и образования стабильных продуктов (добавочных продуктов) — канцероген-ДНК и канцероген-белок.
При репликации нуклеотид-аддукт может быть неправильно считан ДНК-полимеразой, что приводит к повреждению (мутации) ДНК. При этом клетка может погибнуть, или выправить образовавшийся дефект или сохранить нелегальную мутацию, инициирующую опухоль.
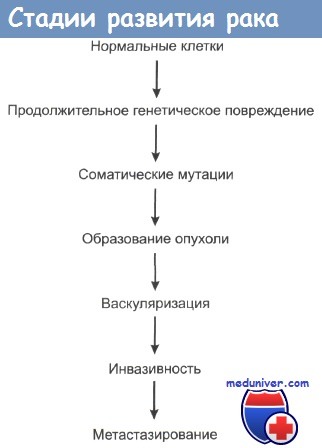
Таким образом, канцерогенный эффект генотоксических канцерогенов является результатом взаимодействия между продуктами их метаболизма и ДНК, ведущим к мутациям последней. Последовательность стадий химического канцерогенеза приведена на рисунке 4 2.

Рис. 4.2. Последовательность действия химических канцерогенов [Заридзе Д.Г., 2004].
Негенотоксические канцерогены (промоторы)
Под негенотоксическими или эпигенетическими канцерогенами понимают большую группу химических соединений, способных вызывать злокачественные опухоли другими механизмами, но не путем ковалентной связи с ДНК и образованием аддуктов.
Сейчас общепризнано, что негенотоксические канцерогены, обладая промоторным действием, также способны самостоятельно, без предварительного действия инициатора, индуцировать развитие новообразований.
Однако, при этом негенотоксические канцерогены, в отличие от генотоксических, для достижения канцерогенного эффекта требуют определенных условий. К ним относятся многократное или длительное беспрерывное воздействие, необходимость больших доз.
При прекращении воздействия негенотоксических канцерогенов происходит остановка канцерогенеза. А в случае генотоксических канцерогенов прекращение их воздействия ведет к замедлению образования опухолей, но они появляются, хотя и после длительного латентного периода. Пример — развитие профессионального рака через десятилетия после прекращения контакта с производственным канцерогеном.
К негенотоксическим канцерогенам относятся соединения различной химической структуры и различного механизма действия. В отличие от генотоксикантов, имеющих единый конечный механизм, негенотоксические канцерогены обладают специфическими способами реализации канцерогенного воздействия.
К ним относятся:
1. Промоция спонтанной инициации. Это, по-видимому, наиболее распространенный механизм канцерогенеза среди негенотоксических канцерогенов.
2. Торможение апоптоза также относится к частым механизмам индукции рака;
3. Индукция длительной клеточной пролиферации (митогенный аффект).
Общеизвестно, что стойкая прилиферация — характерный признак действия промоторов.
При этом активное деление клеток сопровождается многократно возрастающей возможностью возникновения мутаций и развитием опухоли. Многие негенотоксические канцерогены обладают цитотоксическим действием и могут вызывать некрозы с массовой гибелью клеток и активной пролиферацией выживших, в том числе мутировавших.
Некоторые канцерогены данной группы могут выступать в качестве ингибиторов или стимуляторов систем, участвующих в регуляции пролиферации, что также заставляет клетки постоянно делиться.
4. Стимуляция образования молекул активного кислорода и перекиси водорода. Многие негенотоксические канцерогены стимулируют образование в клетке активных форм кислорода, которые вызывают изменения ДНК, ведущие к развитию опухоли.
При этом уровень активного кислорода и перекиси может повышаться вследствие:
В группу стимуляторов пероксисом (их более 71) входят пластификаторы, некоторые пестициды, растворители (трихлорэтилен), гиполипидемические средства (клофибрат, гемифиброзил и др.), применяемые в ряде стран для похудения, однако опухоли, печени или других органов у таких пациентов не описаны.
Следует заметить, что в канцерогенном действии одного и того же негенотоксического вещества могут участвовать несколько вышеприведенных механизмов. Поэтому все промоторы, проявившие канцерогенную активность, относятся к эпигенетическим канцерогенам. Кроме того, генотоксический и негенотоксический механизмы постоянно взаимодействуют в процессе канцерогенеза.
В группу негенотоксических канцерогенов включены и некоторые гормоны — эстрогены и соединения с эстрогеноподобным действием, тиреотропные гормоны, а также вызывающие опухоли у животных сахарин и лимонен, которые используют огромные контингенты людей. Тем не менее, они не представляют канцерогенной опасности для человека.
Считается, что человек потребляет сахарина не более 5 мг/кг в сутки, т.е. при регулярном потреблении такой ничтожно малой дозы нет оснований ожидать повышения риска развития рака мочевого пузыря. Лимонен содержится в цитрусовых маслах и фруктовых соках, его потребление в США составляет до 2 мг/кг в сутки.
Однако риск развития рака почки у человека отсутствует вследствие видовой и половой специфичности канцерогенного действия лимонена (рак индуцируется только у крыс-самцов).
Закономерности действия химических канцерогенов
Малигнизация клетки не начинается с момента контакта их с канцерогеном. Вначале, согласно мутационной концепции рака, образуются метаболиты, они внедряются в клетку, воздействуют на ее генетический аппарат, вызывают мутации, которые и приводят к малигнизации клетки.
В онкологии обычно пользуются понятием клинического латентного периода — время от начала контакта с канцерогеном до клинического обнаружения опухоли. Он может составлять 1/10-1/2 жизни.
Необходимость латентного периода при злокачественной опухоли — фундаментальное свойство, отличающее опухолевый рост от других гипербиотических явлений. Это распространяется на действие любых, а не только химических канцерогенов. Данная закономерность показывают, что опухолевую трансформацию нельзя понимать, как разовое событие, вне связи с жизненным циклом и обновлением клеточных клонов и популяций.
В общей форме это может быть сформулировано следующим образом. Чем выше разовая доза канцерогенного вещества, тем короче латентный период и тем выше частота возникновения опухолей. Частота возникновения опухоли зависит не только от дозы вещества, но также от его канцерогенной активности.
Чем она выше, тем короче латентный период развития опухолей. Однако, на самом деле, не все так просто. Для характеристики процесса химического канцерогенеза был предложен показатель — коэффициент Друкрея (1960). Он представляет собой произведение концентрации канцерогена на время его воздействия.
Действительно процент воспроизведения опухолей возростает пропорционально увеличению коэффициента, но при сверхвысоких значениях коэффициента доминируют летальные токсические эффекты и летальные мутации, поэтому процент воспроизведения опухолей падает.
Принято считать, что канцерогенное действие генотоксикантов является беспороговым т.е. теоретически достаточно одной молекуле метаболита связаться ковалентно с ДНК, чтобы возникла опухоль. В противоположность этому перечисленные выше механизмы действия негенотоксичных веществ имеют пороговую величину.
Поэтому подход к оценке риска злокачественных опухолей от действия генотоксичмых и негенотоксичных канцерогенов принципиально различен. Определение предельно допустимой дозы (ПДК) генотоксичных канцерогенов производится на основе линейной (беспороговой) концепции методом математической экстраполяции из области высоких доз, использованных в эксперименте, в область очень малых реальных доз.
ПДК негенотокейчных канцерогенов рассчитывают на основе экспериментально найденной максимальной недействующей дозы с использованием коэффициента запаса.
В тоже время, так как инициирующая мутация должна возникнуть не в любом участке ДНК, а только в том, повреждение которого обеспечит экспрессию протоонкогенов или инактивацию супрессорных генов, то действует принцип мишени.
Классификация химических канцерогенов
Помимо деления химических канцерогенов на группы в зависимости от механизма действия, широко распространена их классификация по степени канцерогенной опасности для человека.
Суммарная оценка канцерогенной опасности (реальной или потенциальной) химических соединений производится на основе комплексного анализа эпидемиологических данных, результатов экспериментов на животных и краткосрочных тестов.
Из гигиенических классификаций наиболее известна классификация международного агентства по изучению рака (МАИР), в которой выделены 4 группы. Гигиеническая значимость классификации состоит в том, что она дает основания для установления определенной приоритетности в проведении профилактических мероприятий.
Агент, вероятно, не канцерогенен для человека. Имеются доказательства отсутствия канцерогенности для человека и животных.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Читайте также:

