Формула уксусной кислоты с хлором
Хлоруксусная кислота представляет собой уксусную кислоту, в которой один из атомов водорода, находящийся в метильной группе, замещен на свободный атом хлора. Ее получают в результате взаимодействия уксусной кислоты с хлором.
Основным сырьем для получения является уксусная кислота. Хлоруксусная кислота также может быть получена при гидролизе трихлорэтилена.
В результате гидролиза получают химически чистый продукт. Однако данный метод подразумевает использование чистой дистиллированной воды без каких-либо примесей.
Хлоруксусная кислота применяется для получения различного рода красителей, лекарственных препаратов, витаминов и всевозможных пестицидов. Ее также используют в качестве поверхностно-активного вещества (ПАВ).
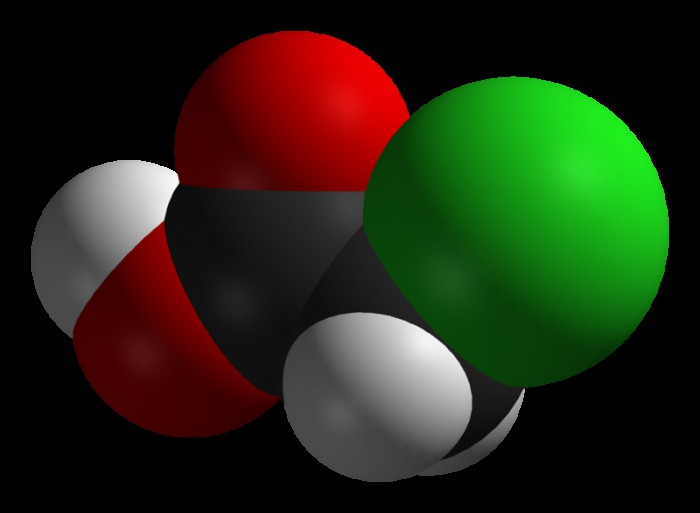
При хлорировании уксусной кислоты в среде неорганических катализаторов (а именно уксусного ангидрида, серы и фосфора) получается хлоруксусная кислота, формула которой CH2Cl-COOH:
Хлоруксусная кислота представляет собой гигроскопические, прозрачные кристаллы с температурой плавления 61,2°С и температурой кипения 189,5°С. Вещество легкорастворимое (как в спирту, так и в водной среде, а также в ацетоне, бензоле и четыреххлористом углероде).
Монохлоруксусная кислота – ядовитое и чрезвычайно опасное вещество, при проглатывании которого довольно часто наблюдается летальный исход. При попадании на кожные покровы хлоруксусная кислота вызывает сильнейшие ожоги, которые длительное время не заживают.
При вдыхании паров кислоты могут наблюдаться воспалительные изменения в легких, а также в верхних и нижних дыхательных путях.
Рабочие производственных цехов по производству монохлоруксусной кислоты страдают нарушением обоняния, хроническими ринофарингитами, шелушением и сухостью кожи.
Также при длительном взаимодействии с агрессивным веществом наблюдаются поражения эпидермиса кожи, выраженные дерматитами в области лица, шеи, верхних и нижних конечностей, в редких случаях - туловища.
Хлоруксусная кислота в человеческом организме превращается в тиодиуксусную кислоту, которая выводиться из организма с калом и мочой.
Основные методы предосторожности при эксплуатации:
- категорически запрещается вдыхать пары, газ, дым и пыль;
- обязательно использовать средства индивидуальной защиты при выполнении работ, связанных с любым контактом с кислотой (непроницаемый комбинезон, защитные очки, резиновые сапоги и перчатки);
- в случае вдыхании паров или попадании кислоты на кожу следует незамедлительно обратиться за квалифицированной помощью в ближайшее медицинское учреждение.

Предельно допустимая и теоретически безопасная концентрация хлоруксусной кислоты в воздухе производственного помещения составляет около одного мг/м 3 .
При транспортировке кислоты ее упаковывают в полимерную тару (контейнера или бочки), картонные барабаны, а также стальные емкости. Допускается транспортировка любым видом крытого транспорта.
Следует помнить, что монохлоруксусная кислота пожаро- и взрывоопасна. Это вещество легко воспламеняется.
Этановая кислота больше известна как уксусная. Она представляет собой органическое соединение с формулой CH3COOH. Относится к классу карбоновых кислот, молекулы которых содержат функциональные одновалентные карбоксильные группы COOH (либо одну, либо несколько). О ней можно представить много информации, но сейчас вниманием стоит отметить лишь самые интересные факты.
Формула
Как она выглядит, можно понять по приложенному ниже изображению. Химическая формула уксусной кислоты несложная. Это обуславливается многим: само соединение является одноосновным, да и относится оно к карбоксильной группе, для которой характерно легкое отщепление протонов (стабильная элементарная частица). Данное соединение – типичный представитель карбоновых кислот, поскольку оно обладает всеми их свойствами.
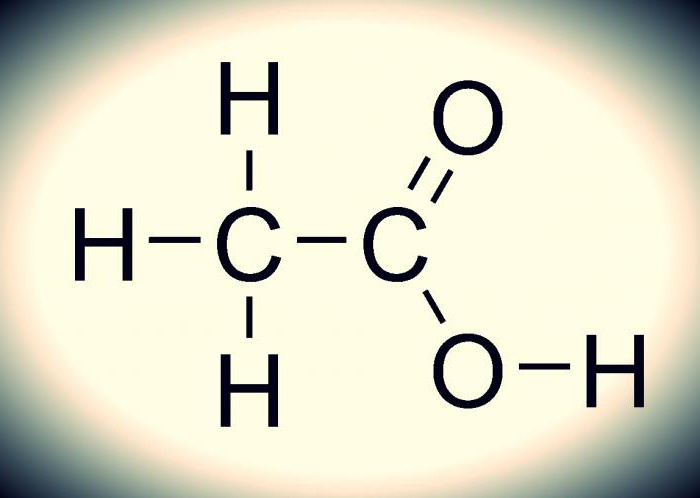
Связь между кислородом и водородом (−COOH) - сильнополярная. Это обуславливает легкий процесс диссоциации (растворения, распада) данных соединений и проявление их кислотных свойств.
В итоге образуется протон H + и ацетат-ион CH3COO − . Что представляют собой эти вещества? Ацетат-ион – это лиганд, связанный с определенным акцептором (объектом, получающим что-то от донорского соединения), образующий устойчивые ацетатные комплексы с катионами многих металлов. А протон – это, как уже говорилось выше, частица, способная захватывать электрон с электронной М-, К- или L- оболочками атома.
Качественный анализ
Он основан именно на диссоциации уксусной кислоты. Качественный анализ, также называемый реакцией, представляет собой совокупность физических и химических методов, которые применяются для обнаружения соединений, радикалов (независимые молекулы и атомы) и элементов (совокупности частиц), которые входят в состав анализируемого вещества.
С помощью данного способа удается обнаружить соли уксусной кислоты. Выглядит все не так сложно, как может казаться. В раствор добавляют сильную кислоту. серную, например. И если появляется запах уксусной кислоты, то ее соль в растворе присутствует. Как это работает? Остатки уксусной кислоты, которые образуются из соли, связываются в тот момент с катионами водорода от серной. Каков результат? Появление большего количества молекул уксусной кислоты. Диссоциация так и происходит.
Реакции
Следует отметить, что обсуждаемое соединение способно взаимодействовать с активными металлами. К таковым относится литий, натрий, калий, рубидий, франций, магний, цезий. Последний, кстати, является наиболее активным. Что происходит в момент таких реакций? Выделяется водород, и происходит образование пресловутых ацетатов. Вот как выглядит химическая формула уксусной кислоты, вступившей в реакцию с магнием: Mg + 2СН3СООН → (СН3СОО)2Mg + Н2↑.

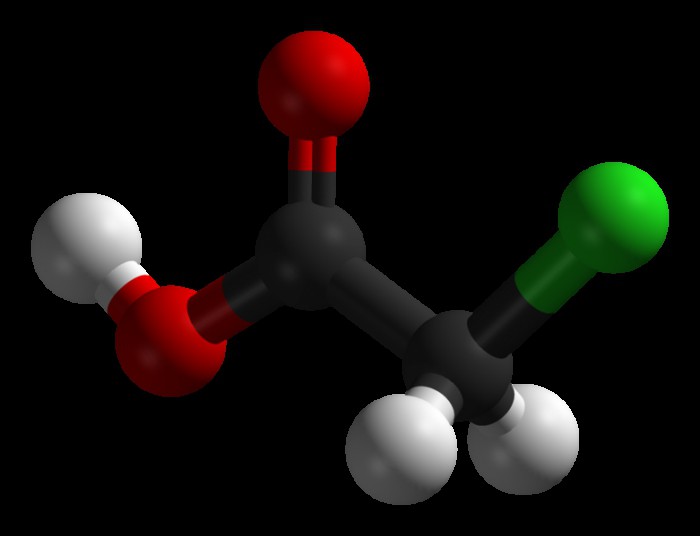
Есть способы получения дихлоруксусной (CHCl2COOH) и трихлоруксусной (CCl3COOH) кислот. В них атомы водорода метильной группы замещены хлорными. Способа их получения всего два. Один заключается в гидролизе трихлорэтилена. И он менее распространен, чем другой, основанный на способности уксусной кислоты хлорироваться действием газообразного хлора. Данный метод проще и эффективней.
Вот как этот процесс выглядит в виде химической формулы уксусной кислоты, взаимодействующей с хлором: СН3СООН + Cl2 → СН2CLCOOH + HCL. Только стоит уточнить один момент: так получается просто хлоруксусная кислота, две вышеупомянутые образуются с участием красного фосфора в небольших количествах.
Другие превращения
Стоит отметить, что уксусная кислота (CH3COOH) способна вступать во все реакции, которые являются характерными для пресловутой карбоновой группы. Ее можно восстановить до этанола, одноатомного спирта. Для этого необходимо воздействовать на нее алюмогидридом лития – неорганическим соединением, которое является мощным восстановителем, часто применяемым в органическом синтезе. Его формула – Li(AlH4).

Также уксусную кислоту можно превратить в хлорангидрид – активный ацилирующий агент. Происходит это под воздействием тионилхлорида. Он, кстати, является хлорангидридом сернистой кислоты. Ее формула – H2SO3. Стоит еще отметить, что натриевая соль уксусной кислоты при нагревании со щелочью декарбоксилируется (молекула диоксида углерода исключается), в результате чего образуется метан (CH₄). А он, как известно, представляет собой простейший углеводород, являющийся легче воздуха.
Кристаллизация
Ледяная уксусная кислота – нередко рассматриваемое соединение называют именно так. Дело в том, что она при охлаждении всего до 15-16 °C переходит в кристаллическое состояние, как будто бы замерзает. Визуально это действительно очень похоже на лед. При наличии нескольких ингредиентов можно провести эксперимент, результатом которого станет превращение уксусной кислоты в ледяную. Все просто. Из воды и льда нужно приготовить охлаждающую смесь, а потом опустить в нее подготовленную заранее пробирку с уксусной кислотой. Через несколько минут она кристаллизуется. Кроме соединения, для этого нужен химический стакан, штатив, термометр и пробирка.
Вред вещества
Уксусная кислота, химическая формула и свойства которой были перечислены выше, является небезопасной. Ее пары оказывают раздражающее действие на слизистые оболочки верхних дыхательных путей. Порог для восприятия запаха этого соединения, находящегося в воздухе, находится в районе 0,4 мг/л. Но есть еще понятие предельно допустимой концентрации – санитарно-гигиенический норматив, утвержденный в законодательном порядке. Согласно ему, в воздухе может находиться до 0,06 мг/м³ этого вещества. А если речь идет о рабочих помещениях, то предел возрастает до 5 мг/м 3 .

Губительность действия кислоты на биологические ткани напрямую зависит от того, как сильно она разбавлена водой. Наиболее опасны растворы с содержанием этого вещества более 30 %. А если человек случайно вступит в контакт с концентрированным соединением, то ему не удастся избежать химических ожогов. Этого категорически нельзя допустить, поскольку после этого начинают развиваться коагуляционные некрозы – отмирание биологических тканей. Смертельная доза составляет всего 20 мл.
Последствия
Логично, что чем выше концентрация уксусной кислоты, тем больший вред она окажет в случае попадания ее на кожу или внутрь организма. К общим симптомам отравления относят:
- Ацидоз. Кислотно-щелочной баланс смещается в сторону увеличения кислотности.
- Сгущение крови и нарушение ее свертываемости.
- Гемолиз эритроцитов, их разрушение.
- Поражение печени.
- Гемоглобинурия. В моче появляется гемоглобин.
- Острая почечная недостаточность.
- Токсический ожоговый шок.
Степени тяжести
Принято выделять три:
- Легкая. Характеризуется небольшими ожогами пищевода и ротовой полости. Но сгущение крови отсутствует, а внутренние органы продолжают функционировать нормально.
- Средняя. Наблюдается интоксикация, шок и сгущение крови. Желудок поражен.
- Тяжелая. Сильно страдают верхние дыхательные пути, стенки пищеварительного тракта, развивается почечная недостаточность. Болевой шок максимальный. Возможно развитие ожоговой болезни.

Отравление парами уксусной кислоты тоже возможно. Оно сопровождается сильным насморком, кашлем и слезотечением.
Оказание помощи
Если человек отравился уксусной кислотой, то очень важно быстро действовать для минимизирования последствий от случившегося. Рассмотрим, что надо делать:
Важно оказать первую помощь в течение двух часов после случившегося. По истечении данного срока слизистые оболочки сильно отекают, и уже уменьшить боль человека будет сложно. И да, ни в коем случае нельзя использовать соду. Сочетание кислоты и щелочи даст реакцию, в ходе которой выработается углекислый газ и вода. А такое образование внутри желудка может привести к летальному исходу.
Применение
Водные растворы этановой кислоты широко используются в пищевой промышленности. Это уксусы. Для их получения кислоту разводят водой, чтобы получился 3-15-процентный раствор. Как добавка они обозначаются маркировкой Е260. Уксусы входят в состав различных соусов, а еще их используют для консервирования продуктов, маринования мяса и рыбы. В быту они широко применимы для удаления накипи, пятен с одежды и посуды. Уксус – прекрасный дезинфектор. Им можно обработать любую поверхность. Иногда его добавляют при стирке, чтобы смягчить одежду.

Также уксус применим в получении душистых веществ, лекарственных средств, растворителей, в производстве ацетона и ацетилцеллюлозы, например. Да, и в крашении и книгопечатании уксусная кислота принимает непосредственное участие.
Кроме всего, ее используют как реакционную среду для проведения окисления самых разных органических веществ. Примером из промышленности можно считать окисление параксилола (углеводород ароматического ряда) кислородом воздуха в терефталевую ароматическую кислоту. Кстати, так как пары этого вещества имеют резкий раздражающий запах, его можно использовать как замену нашатырного спирта для выведения человека из обморочного состояния.
Синтетическая уксусная кислота
Это легковоспламеняющаяся жидкость, которая относится к веществам третьего класса опасности. Она используется в промышленности. При работе с ней применяются индивидуальные средства защиты. Хранят это вещество в особых условиях и только в определенной таре. Как правило, это:
- чистые железнодорожные цистерны;
- контейнеры;
- автоцистерны, бочки, емкости из нержавеющей стали (вместимость до 275 дм 3 );
- стеклянные бутыли;
- полиэтиленовые бочки вместимостью до 50 дм 3 ;
- герметичные резервуары из нержавеющей стали.

Если жидкость хранят в полимерной таре, то это как максимум месяц. Также категорически не допускается совместное хранение данного вещества с такими сильными окислителями, как перманганат калия, серная и азотная кислоты.
Состав уксуса
О нем тоже стоит сказать пару слов. В состав традиционного, всем привычного уксуса входят следующие кислоты:
- Яблочная. Формула: НООССН₂СН(ОН)СООН. Является распространенной пищевой добавкой (Е296) природного происхождения. Содержится в незрелых яблоках, малине, рябине, барбарисе и винограде. В табаке и махорке представлена в виде солей никотина.
- Молочная. Формула: CH₃CH(OH)COOH. Формируется при распаде глюкозы. Пищевая добавка (Е270), которую получают молочнокислым брожением.
- Аскорбиновая. Формула: C₆H₈O₆. Пищевая добавка (Е300), применяемая как антиоксидант, предотвращающий окисление продукта.
И конечно же, этановое соединение в состав уксуса тоже входит – это основа данного продукта.
Как разбавить?
Это часто задаваемый вопрос. Все видели в продаже уксусную кислоту 70 %. Ее покупают, чтобы готовить смеси для народного лечения, или для использования в качестве приправы, маринада, добавки в соус или закатку. Но нельзя применять такой мощный концентрат. Поэтому появляется вопрос о том, как развести до уксуса уксусную кислоту. Для начала нужно себя обезопасить – надеть перчатки. Затем следует подготовить чистую воду. Для растворов различных концентраций понадобится определенное количество жидкости. Какое? Что ж, смотрим на приведенную ниже таблицу и разводим уксусную кислоту с учетом данных.
Начальная концентрация уксуса 70 %
1:1,5 (соотношение – одна часть уксуса на энную часть воды)
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg + | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | Р | Н | ? | Н | Н | ? | Р | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | ? | ? | ? | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (  Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса " " содержит ошибку, нажмите на кнопку "Отправить". Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений.
Здесь, возможно, указаны не все изомеры данного вещества. Более полный поиск изомеров следует проводить по формуле. Например, чтобы получить изомеры вещества с формулой С6H10O6 , следует сделать запрос так: Изомеры - это соединения с одинаковым количественным составом (то есть одинаковым числом атомов каждого элемента), но разным строением. Читайте также:
|

