Формула соединения серы с кислородом и хлором
Свойства соединений серы(IV).
Оксид серы(IV) SO2(сернистый газ) – это бесцветный газ, с резким запахом, тяжелее воздуха. при температуре -10оС сгущается в бесцветную жидкость. Диоксид серы менее токсичен, чем сероводород, хорошо растворим в воде (40 объемов в 1 объеме воды). Молекула SO2 имеет угловое строение, связи в молекуле располагаются под углом 120о друг к другу. Связь сера –кислород – полярная связь, молекула SO2 тоже полярна. Длина связи S – О равна 0,143 нм. В промышленности SO2 получают:
а) сжиганием серы в специальных печах:
б) при обжиге сернистых металлов:
4 FeS2 + 11 О2 = 8 SO2 + 2 Fe2О3
Сера входит в состав многих твердых горючих ископаемых и при их сжигании выделяется большое количество сернистого газа, загрязняющего атмосферу.
В лаборатории диоксид серы получают действием разбавленной серной кислоты на сульфиты:
Na2SО3 + Н2 SО4 (разб.) = Na2SО4 + Н2SО3 ;
или действием концентрированной серной кислоты на медь:
Cu + 2 Н2 SО4 (конц.) = CuSО4 + SO2↑+ Н2О
Оксид серы(IV) химически активное вещество, в окислительновосстановительных реакциях может проявлять двойственные свойства. При пропускании SO2 через сероводородную воду выделяется сера:
SO2 + 2 H2S = 3 S + 2 H2O
Однако для оксида серы(IV) более характерны восстановительные свойства:
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
SO2 + Br2 + 2H2O = H2SO4 + 2 НВr
В пищевой промышленности SO2 используют для продувки через сок сахарной свеклы (сульфитизация) для его обесцвечивания, обеззараживания и снижения щелочности. В процессах консервирования пюре, соков, плодов он играет роль антисептика, консерванта и антиокислителя. После удаления SO2 (десульфитизация) остаточное содержание диоксида серы в продуктах не должно превышать 0,01 %. Наличие неподеленной электронной пары у атома серы придает молекуле SO2 способность к реакциям присоединения. На прямом солнечном свету SO2 соединяется с хлором, образуя хлористый сульфурил:
SO2 + С12 = SO2С12
SO2С12 – бесцветная жидкость с резким запахом, является хлорангидридом серной кислоты, легко гидролизуется:
SO2С12 + 2H2O = H2SO4 + 2 НС1
Способность SO2 к реакциям присоединения и его окислительные свойства позволяет использовать диоксид серы для отбелки шерсти, шелка, соломы, для осветления дубильных экстрактов. Однако со временем бесцветные соединения SO2 с окрашивающими материал примесями разрушаются, и материал приобретает свой прежний цвет.
С кислородом диоксид серы взаимодействует с заметной скоростью только в присутствии катализатора (Pt, V2О5 и другие):
2 SO2 + О2 = 2 SO3
Оксид серы(IV) проявляет свойства кислотного оксида, при растворении в воде, взаимодействует с ней, образуя, сернистую кислоту:
SO2 + Н2О = Н2SО3.
При сжигании угля, содержащего небольшие количества соединений серы, в атмосферу выбрасывается диоксид серы. Растворяясь во влаге, находящейся на листьях или в воздухе, SO2 образует раствор сернистой кислоты, который затем окисляется до серной кислоты. Атмосферная влага с растворенными SO2 и H2SO4 выпадает в виде кислотных дождей, приводящих к гибели растительности.
Свойства сернистой кислоты. Раствор SO2 в воде называется сернистой кислотой. Н2SО3 неустойчивая кислота, существует только в растворах:
При нагревании равновесие смещается в сторону прямой реакции и можно полностью удалить диоксид серы из раствора. Сернистая кислота является кислотой средней силы. Она двухосновна:
Н2SО3 ↔ Н+ + НSО3 - (Кд = 2.10-2)
НSО3 - ↔ Н+ + SО3 2- (Кд = 6.10-8)
Н2SО3 – образует средние соли Na2SО3 (сульфиты) и кислые соли NaНSО3 (гидросульфиты). Сульфиты большинства металлов нерастворимы в воде (кроме щелочных металлов и аммония). Соли подвергаются гидролизу:
Na2SО3 + H2O ↔ NaHSО3 + NaOH
Все сульфиты и гидросульфиты разлагаются кислотами:
Na2SО3 + 2 НС1 = 2 NaС1 + Н2SО3
При нагревании сульфиты диспропорционируют:
4 Na2SО3 = 3 Na2SО4 + Na2S
Сернистая кислота и ее соли обладают окислительно-восстановительной
So ← S+4O2 → S+6O4 2-
5Na2SО3 + 2КМnО4 + 8Н2SО4 = 5Na2SО4 + 2МnSО4 + К2SО4 + 8H2O
Na2SО3 + С12 + H2O = Na2SО4 + 2 НС1
SО3 2- + 4Н+ + 4 ē = S + 2 H2O, Е° = 0,45
SО3 2- + 2 ОН- - 2 ē = SО4 2- + H2O, Е° = -0,93 В
Восстановительные свойства для производных серы со степенью окисления +4 (диоксид, сернистая кислота и ее соли) более характерны, чем окислительные свойства. Практически мгновенно протекает окисление сульфитов и гидросульфитов многими окислителями (КМnО4, С12, Вr2 и т.д.) На этом основано использование NaНSО3 в качестве антихлора. Сульфит-ион открывают с помощью раствора йода, при этом раствор йода обесцвечивается.
I2 + Na 2SО3 + Н2О = 2 НI + Na2SO4
Сульфиты настолько сильные восстановители, что даже в твердом виде они постепенно окисляются кислородом воздуха:
2 Na2SО3 + О2 = 2 Na2SО4
Сульфиты легко присоединяют не только кислород, но и серу:
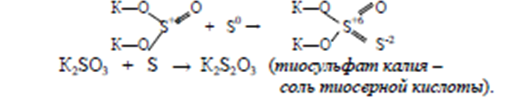
Н2S2О3– тиосерная кислота. По силе эта кислота близка к серной кислоте, но в свободном состоянии неустойчива и разлагается:
К2S2О3 + Н2SО4 = К2SО4 + Н2S2О3
Н2S2О3 = SО2↑ + S↓ + Н2О
Соли тиосерной кислоты (известны только средние соли) довольно устойчивы, бесцветны и хорошо растворимы в воде. Свойства этих солей обуславливаются присутствием атомов серы в различных степенях окисления. Наличие S-2 придает им восстановительные свойства. Тиосульфат натрия (гипосульфит) имеет наибольшее практическое значение. Na2S2О3 используется для связывания хлора:
Na 2S2О3 + С12 (недостаток) + Н2О = Na2SО4 + S + 2 НС1
Na 2S2О3 + 4 С12 (избыток) + 5 Н2О = Na2SО4 + Н2SО4 + 8 НС1
Na 2S2О3 используется в медицине как противотоксичекое средство при отравлениях соединениями ртути, свинца, синильной кислотой и ее солями, при этом образуются плохо растворимые нетоксичные сульфиты или менее ядовитые тиоцианаты:
S2О3 2- = SО3 2- + S;
Pb2+ + SО3 2- = PbSО3↓
В фотографии Na 2S2О3 (фиксанажная соль) используется для удаления
неразложившегося бромида серебра.
2 Na 2S2О3 + AgBr = NaBr + Na3[Ag(S2О3)2]
Важным свойством тиосульфата натрия является его способность образовывать с иодом бесцветный тетратионат нария:
I2 + 2Na 2S2О3 = 2NaI + Na2S4O6 (Соль тетратионовой кислоты)
Эта реакция широко используется в аналитической химии (в объемном анализе).
Политионовые кислоты – это кислоты состава: Н2SхО6или Н2(О3S–Sх–SО3), где х = 0-16, В состав политионовых кислот входят зигзагообразные цепи атомов серы. Название кислоты и ее солей определяется числом атомов серы, входящих в состав кислоты или соли:
Na2S6O6 - гексатионат; Na2S5O6 - пентатионат; Na2S4O6 – тетратионат; Na2S2O6 - дитионат. Политионовые кислоты существуют только в водных растворах и медленно разлагаются при хранении:
Н2SхО6 = Н2SО4 + SО2 + (х-2)S
Соли политионовых кислот щелочных металлов хорошо растворимы в воде. В сухом состоянии довольно устойчивы, при нагревании они разлагаются: Na2S6O6 = Na2SО4 + SО2 + 4 S↓
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
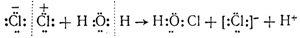
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
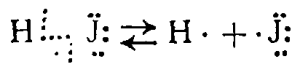
и электролитическая диссоциация иодистого водорода при растворении в воде:
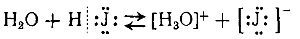
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
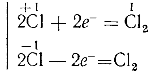
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
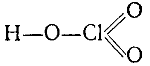
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
Строение хлорной кислоты выражается формулой
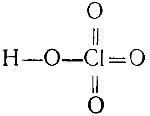
Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
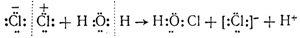
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
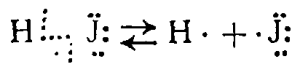
и электролитическая диссоциация иодистого водорода при растворении в воде:
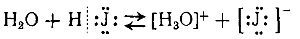
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
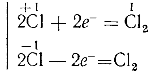
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
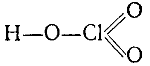
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
Строение хлорной кислоты выражается формулой

Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
Читайте также:

