Колядина и в рак молочной железы
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
профессор, д. м.н., зав.кафедрой патологической анатомии,
4. O’Neill F1, Madden SF, Clynes M et all. A gene expression profile indicative of early stage HER2 targeted therapy response. Mol Cancer. 2013 Jul 1;12:69.
5. Abramovitz M, Barwick BG, Willis S et all. Molecular characterisation of formalin-fixed paraffin-embedded (FFPE) breast tumour specimens using a custom 512-gene breast cancer bead array-based platform. Br J Cancer. 2011 Nov 8;105 (10):1574–81.
6. Strehl JD, Wachter DL, Fasching PA et all. Invasive Breast Cancer: Recognition of Molecular Subtypes. Breast Care (Basel). 2011;6 (4):258–264.
7. E. Senkus, S. Kyriakides, F. Penault-Llorca et all., on behalf of the ESMO Guidelines Working Group* Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†Annals of Oncology 0: 1–17, 2013.
10. Pracella D, Bonin S, Barbazza R et all. Are breast cancer molecular classes predictive of survival in patients with long follow-up? Dis Markers. 2013;35 (6):595–605.
11. Prat A, Cheang MC, Mart n M et all. Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically definedluminal A breast cancer. J Clin Oncol. 2013 Jan 10;31 (2):203–9.
12. Kim HS, Park I, Cho HJ and all. Analysis of the potent prognostic factors in luminal-type breast cancer. J Breast Cancer. 2012 Dec;15 (4): 401–6.
13. Parise CA, Bauer KR, Brown MM et all. Breast cancer subtypes as defined by the estrogen receptor (ER), progesterone receptor (PR), and the human epidermal growth factor receptor 2 (HER2) among women with invasive breast cancer in California, 1999–2004. Breast J. 2009 Nov-Dec;15 (6):593–602.
14. Cheang MC, Chia SK, Voduc D et all. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst. 2009 May 20;101 (10):736–50.
15. Wang Y, Yin Q, Yu Q et all.. A retrospective study of breast cancer subtypes: the risk of relapse and the relations with treatments. Breast Cancer Res Treat. 2011 Nov;130 (2):489–98.
16. Zhang HM, Zhang BN, Xuan LX, Zhao P. Clinical characteristics and survival in the operable breast cancer patients with different molecular subtypes. Zhonghua Zhong Liu Za Zhi. 2009 Jun; 31 (6):447–51.
17. Najafi B, Anvari S, Roshan ZA. Disease free survival among molecular subtypes of early stage breast cancer between 2001 and 2010 in Iran. Asian Pac J Cancer Prev. 2013;14 (10):5811–6.
18. Nofech-Mozes S, Trudeau M, Kahn HK et all. Patterns of recurrence in the basal and non-basal subtypes of triple-negative breast cancers. Breast Cancer Res Treat. 2009;118:131–137.
19. Elsamany S, Abdullah S. Triple-negative breast cancer: future prospects in diagnosis and management. Med Oncol. 2014 Feb;31 (2):834.
20. Bauer KR, Brown M, Cress RD et all. Descriptive analysis of estrogen receptor (ER) -negative, progesterone receptor (PR) -negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California Cancer Registry. Cancer. 2007;109:1721–1728.
21. Lips EH, Mulder L, Oonk et all.Triple-negative breast cancer: BRCAness and concordance of clinical features with BRCA1-mutation carriers. Br J Cancer. 2013 May 28;108 (10):2172–7.
22. Dent R, Trudeau M, Pritchard KI et all. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res. 2007;13:4429–4434
23. Foulkes WD, Brunet J-B, Stefansson IM et all. The prognostic implication of the basal-like (cyclin E high/ p27low/p53+/glomeruloid-microvascular-proliferation+) phenotype of BRCA1-related breast cancer. Cancer Res. 2004;64:830–835.
24. Slamon DJ, Clark GM, Wong SG et all. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987 Jan 9;235 (4785):177–82.
25. Zurawska U, Baribeau DA, Giilck S et all. Outcomes of HER2-positive early-stage breast cancer in the trastuzumab era: a population-based study of Canadian patients. Curr Oncol. 2013 Dec;20 (6): e539–45.
26. Slamon D, Eiermann W, Robert N, et all. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 2011; 365:12731283.
27. Perez EA, Romond EH, Suman VJ and all. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: joint analysis of data from NCCTG N9831 and NSABP B-31. J Clin Oncol. 2011 Sep 1;29 (25):3366–73.
28. Piccart-Gebhart MJ, Procter M, Leyland- Jones B, et all. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353:1659–72.
29. Romond EH, Perez EA, Bryant J, et all. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005;353:1673–84.
30. Nagtegaal ID, Allgood PC., Duffy SW et all. Prognosis and Pathology of Screen-Detected Carcinomas How Different Are They? J Cancer. 2011 Apr; 1360–8.
31. Coldman A, Phillips N, Wilson C et all. Pan-canadian study of mammography screening and mortality from breast cancer. J Natl Cancer Inst. 2014 Oct 1;106 (11).
33. Domingo L, Salas D, Zubizarreta R et all. on behalf of the INCA Study Group. Tumor phenotype and breast density in distinct categories of interval cancer: results of population-based mammography screening in Spain. Breast Cancer Res. 2014 Jan 10;16 (1): R3.
34. Bucchi L, Puliti D, Ravaioli A et all. Breast screening: axillary lymph node status of interval cancers by interval year. Breast. 2008 Oct;17 (5):477–83.
35. Theriault RL, Litton JK, Mittendorf EA et all. Age and survival estimates in patients who have node-negative T1ab breast cancer by breast cancer subtype. Clin Breast Cancer. 2011 Oct;11 (5):325–40.
36. Curigliano G, Viale G, Bagnardi V et all. Сlinical relevance of HER2 overexpression/amplification in patients with small tumor size and node-negativebreast cancer. J Clin Oncol. 2009 Dec 1;27 (34):5693–9.
37. Livi L, Meattini I, Saieva C et all. Prognostic value of positive human epidermal growth factor receptor 2 status and negative hormone status in patients with T1a/T1b, lymph node-negative breast cancer.Cancer. 2012 Jul 1;118 (13):3236–43.
38. Gonzalez-Angulo AM, Litton JK, Broglio KR et all. High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller. J Clin Oncol. 2009 Dec 1;27 (34):5700–6.
39. Schroeder MC, Lynch CF, Abu-Hejleh T et all. Chemotherapy Use and Surgical Treatment by Receptor Subtype in Node-Negative T1a and T1b Female BreastCancers, Iowa SEER Registry, 2010- to 2012. Clin Breast Cancer. 2014 Aug 18. pii: S1526–8209 (14) 00164–5.
40. С. Garbino. St.Gallen international breast cancer conference 2013. Panel voting results, p.1–30.
42. O'Sullivan CC, Bradbury I, de Azambuja E et all. Efficacy of adjuvant Trastuzumab compared with no Trastuzumab for patients with HER2-positive breast cancer and tumors ≤2cm: a meta-analysis of the randomized Trastuzumab trials, ASCO meeting presentation, Chicago 2014.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Анастасии 28 лет. Год назад она закончила лечение от рака груди и согласилась рассказать Onliner свою историю, чтобы показать: жизнь после рака существует. Более того — счастливая жизнь.
— До 27 лет я, конечно, знала, что онкология существует. Но искренне думала, что меня это никогда не коснется.

Когда в поликлинике мне делали биопсию (берут большой шприц, вставляют иголку — и прямо в грудь, без анестезии), я потеряла сознание. Пришлось онкологу нашатырь мне нести. А потом сказали ждать 10 дней — и будет готов результат.

Онколог сказал, что мне придется удалять грудь полностью. Тяжело было это принять. Я каждый день плакала. Долго думала, советовалась с мамой, с женихом, но в итоге согласилась. Меня оперировал Ростислав Киселев — спасибо ему большое, он человечный доктор. Успокаивал меня, объяснял нюансы. В итоге мне вырезали не только грудь, но и лимфоузлы. Операция прошла хорошо.

На химию я ездила на метро, боялась садиться за руль из-за слабости. Представьте: лето, я сижу в парике, мне жарко, ресниц уже нет, на руках синяки от капельниц… И мне кажется, что все, абсолютно все в вагоне смотрят на меня и понимают, что я онкобольная. Такое неприятное чувство.

Честно, я не ожидала такого поступка от мужа. Я ведь специально рассказала ему все в максимально страшных подробностях. А он все равно от меня не отказался.

Пока что я стесняюсь своего тела — такого, каким оно стало после операции. Пробовала ходить в бассейн, но там раздевалки общие. Я прямо в шкафчик этот залажу, только бы никто не увидел меня без купальника. На очередном осмотре онколог посоветовал удалить и вторую, здоровую грудь, чтобы обезопасить себя. А потом сделать операцию по восстановлению груди, вставить импланты. Сама операция бесплатная, но один имплант в среднем стоит около $1500 по курсу. То есть нужно $3000. Это очень большие деньги для нашей семьи. Как собрать такую сумму.
Мне хотелось бы сказать всем женщинам: пожалуйста, не забывайте, не откладывайте, регулярно делайте УЗИ и маммографию! При малейших подозрениях сразу же идите к врачу. Об этом нужно говорить в СМИ постоянно.

— Маммография — наследница рентгена?
— Это самый первый метод лучевой диагностики, который подарил нам Вильгельм Рентген, когда в 1895 году открыл икс-лучи. Изначально о маммографах речь не шла, возможность рентгеновской визуализации молочной железы появилась после изучения удаленного постоперационного материала на обычном рентген-аппарате. Технический прогресс с 1900 года и до наших дней занимался тем, чтобы улучшить качество изображения, а еще — снизить лучевую нагрузку, ведь ткань молочной железы очень чувствительна к излучению. Сначала появились аналоговые маммографы, а начиная с 2000-х годов — цифровые. Сегодня и в Центральной Европе, и в Минске практически все исследования молочной железы проводятся с помощью цифровой аппаратуры.

— Что изменила цифровая эпоха?
Но, несмотря на высокое качество оборудования, опыт и квалификация врача имеют решающее значение. Важно иметь возможность эту квалификацию поддерживать на высоком уровне. Например, в Великобритании, в Лондоне, где я была на стажировке, есть программа по обучению и аттестации врачей-рентгенологов. Есть пакет изображений, врач должен их оценить, а система начислит определенное количество баллов за правильно поставленный диагноз. И доктор тут же увидит, какое место он занимает среди коллег своего района, области, Лондона, всей Великобритании. Это не карательная мера. Смысл в том, чтобы врачи более тщательно подходили к обучению и стандартам. Важный момент — эта программа с помощью видеозаписи может фиксировать, как именно доктор читает снимки: на всех ли изображениях он начинает с соска и ареолы, потом идет по часовой стрелке, рассматривая всю молочную железу, и заканчивает аксиллярным отростком? Если у доктора есть стандарт чтения снимка, вряд ли он что-либо пропустит.
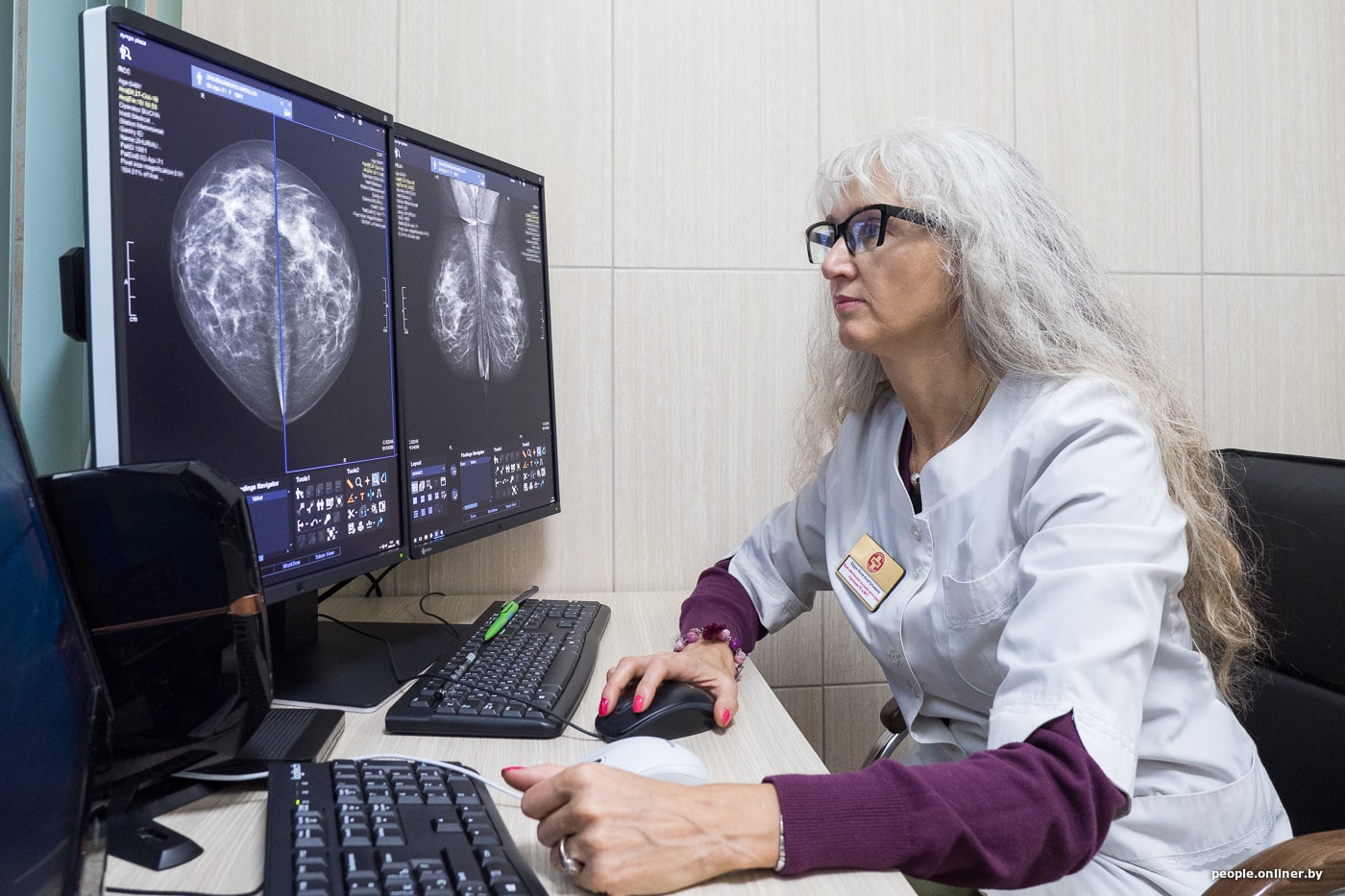
— Многие женщины опасаются, что маммография вредна. Почему-то этот миф очень устойчив. А что на самом деле?
— Это миф, конечно. Любое направление на лучевое исследование (и маммографию в том числе) обосновывается врачом. Цифровые маммографы последнего поколения обладают малой лучевой нагрузкой, которая сопоставима с рентген-исследованием органов грудной клетки.
Наблюдать за состоянием молочных желез нужно начинать с 20 лет. В первую очередь, необходимо раз в год проводить УЗИ молочных желез, а также раз в год посещать маммолога. Это касается тех женщин, которых ничего не беспокоит. Если же что-то беспокоит, то начать нужно с посещения врача-маммолога, который, учитывая возраст пациентки, направит изначально либо на УЗИ, либо на маммографию.
Начиная с 45—50 лет женщина в первую очередь выполняет маммографию с последующей консультацией маммолога, который при необходимости может добавить УЗИ молочной железы. Такая комбинация методов в разном возрастном периоде у женщин обусловлена разным структурным состоянием молочных желез.
— МРТ молочных желез подходит молодым женщинам?
— МРТ — это не метод массового обследования. МРТ молочных желез применяется в трудных диагностических случаях, когда результаты УЗИ и маммографии не совпадают; когда у женщины известен генетический статус: она является носителем BRCA1 и BRCA2; когда в семье было заболевание молочной железы у близких родственников: мамы, родной сестры, тети и так далее.

Тройной негативный подтип рака молочной железы (ТНРМЖ) диагностируется в 15% случаев заболевания 1 , однако на него приходится около 40% летальных исходов от этого новообразования 1-4 . Клетки ТНРМЖ не содержат рецепторов эстрогенов и прогестерона, а также амплифицированного гена HER2, что делает заболевание малочувствительным к проведению гормональной и таргетной терапии 5 . ТНРМЖ характеризуется агрессивным течением и частыми рецидивами. 6-8
Помимо этого, специалисты выделяют PD-L1-положительный подтип заболевания, течение которого сопряжено с наиболее неблагоприятным исходом. 9
В отличие от других подтипов рака молочной железы, для ТНРМЖ характерно мультиорганное метастазирование (легкие — 32%, головной мозг — 9%, кости — 36%, печень — 22%). 10 Кроме того, ТНРМЖ чаще диагностируется в более молодом возрасте (средний возраст постановки диагноза 53 года). 11
До недавнего времени для пациенток с ТНРМЖ была показана только химиотерапия. 12 Однако наука не стоит на месте, ученые продолжают поиски уязвимых точек коварного заболевания, в результате в арсенале онкологов появилась комбинация атезолизумаба с наб-паклитакселом. Ее эффективность и безопасность для терапии ТНРМЖ оцениваются в продолжающемся клиническом исследовании III фазы IMpassion130, результаты которого и стали предметом обсуждения на симпозиуме.
С его данными участников мероприятия ознакомила научный сотрудник отделения клинической фармакологии и химиотерапии НИИ клинической онкологии НМИЦ онкологии им. Н.Н. Блохина Мона Фролова. По ее словам, в исследование были включены 902 пациентки с местнораспространенным или метастатическим ТНРМЖ, не получавшие предшествующего системного лечения. Участниц разделили на две группы, в первой назначили атезолизумаб в комбинации с наб-паклитакселом, во второй — плацебо и наб-паклитаксел.
Рациональность иммунотерапии у больных ТНРМЖ определяют три фактора: мутационная нагрузка, инфильтрация опухоли Т-лимфоцитами и экспрессия PD-L1. Так, у 41% участников исследования экспрессия PD-L1 оказалась положительной.
В ходе исследования в группе применения атезолизумаба в комбинации с наб-паклитакселом было показано достоверное снижение риска прогрессирования или смерти на 38%, а также клинически значимое увеличение общей выживаемости на 7 месяцев (25 мес. против 18 мес.) по сравнению с монотерапией наб-паклитакселом у пациенток с экспрессией PD-L1 более 1%. 15-16
Что касается безопасности комбинации, включавшей атезолизумаб и наб-паклитаксел, то она соответствовала известному профилю безопасности препаратов в отдельности; новые сигналы безопасности при применении комбинации не выявлены [16].
Атезолизумаб (Тецентрик®) стал первым зарегистрированным в России иммуноонкологическим препаратом, одобренным для применения в комбинации с наб-паклитакселом для первой линии терапии PD-L1-положительного неоперабельного распространенного ТНРМЖ. 13 По данному показанию препарат включен в клинические рекомендации, разработанные Ассоциацией онкологов России (АОР), Российским обществом клинической онкологии (RUSSCO), Российским обществом онкомаммологов (РООМ). 14
Профессор кафедры онкологии и паллиативной медицины Российской медицинской академии последипломного образования Ирина Колядина сосредоточилась в своем выступлении на особенностях выявления биомаркера PD-L1 в терапии ТНРМЖ.
Нюанс первый: где определять PD-L1 экспрессию? Так, если при немелкоклеточном раке легкого ее можно выделять как в опухолевых клетках, так и в лимфоцитах, инфильтрирующих опухоль, то в случае с ТНРМЖ PD-L1 статус определяется на иммунокомпетентных клетках и только в 2% — на опухолевых (в 9% случаев наблюдается сочетанная экспрессия).
Нюанс второй: важен ли уровень PD-L1 экспрессии? В рамках исследования IMpassion130 PD-L1 экспрессия выявилась у 41% пациентов, при этом у 27% из них она составляла 1-5 %, у 14% — более 5%. Но, как показывает анализ, выигрыш от комбинации атезолизумаба с наб-паклитакселом имели все пациенты независимо от уровня PD-L1 экспрессии. А это обстоятельство свидетельствует, что уже сам факт наличия экспрессии позволяет назначать эффективную терапию и существенно снижает риск рецидива и смерти.
Нюанс третий: какой материал выбрать для определения PD-L1 экспрессии — первичный или метастатический? Согласно исследованию IMpassion130, клиническая активность наблюдалась у пациентов с выявленной экспрессией PD-L1 вне зависимости от того, был ли образец первичным или метастатическим.
Нюанс четвертый: нужно ли выбирать конкретный диагностический тест для определения PD-L1 статуса? Как известно, сегодня достаточно соответствующих тестов, главное различие которых состоит в выборе мишеней для определения PD-L1 экспрессии. Большая их часть предназначена для проведения тестирования и на опухолевых, и на иммунокомпетентных клетках. Притом, что в случае ТНРМЖ принципиально важно определять PD-L1 экспрессию именно на иммунокомпетентных клетках. Как показало исследование IMpassion130, тест SP142 обладает наибольшей чувствительностью и специфичностью к иммунокомпетентным клеткам. 16,19 Этому условию отвечает единственный тест SP142 VENTANA, доступный для российских специалистов в рамках проведения научного исследования RUSSCO.
Ряд клинических случаев ТНРМЖ у пациенток 42—58 лет представила на суд участников симпозиума заместитель директора Московского клинического научного центра им. А.С. Логинова Людмила Жукова. При этом практикующие онкологи имели возможность с помощью интерактивных пультов выбирать наиболее эффективный вариант терапии для каждого профиля пациенток. В частности, учитывая данные исследования IMpassion130, принимать решение, какой диагностический тест необходимо провести на конкретном этапе заболевания, на каких клетках определять PD-L1 экспрессию, какие препараты назначать для лечения.
Разбирая клинические случаи, профессор Жукова обратила внимание на упущенные возможности, когда PD-L1-положительным пациенткам с диагнозом тройной негативный рак молочной железы, не выясняя их статус, проводили хирургические операции, адъювантное лечение и лучевую терапию. Отметив, что в этих случаях все заканчивалось рецидивом болезни, специалист подчеркнула, что чем раньше начинается иммунная терапия, тем больше выживаемость.
Атезолизумаб представляет собой моноклональное антитело, направленное на взаимодействие с белком под названием PD-L1. Связываясь с PD-L1, экспрессируемым на опухолевых и инфильтрирующих опухоль иммунных клетках, атезолизумаб предотвращает взаимодействие PD-L1 с PD-1 и B7.1. Блокируя PD-L1, атезолизумаб нормализует активацию Т-клеток.
Кроме того, атезолизумаб не нарушает механизм защиты нормальных тканей от аутоиммунных реакций за счет сохранения взаимодействия PD-1 и PD-L2. Большая безопасность ингибиторов PD-L1 (в т.ч. атезолизумаба) была подтверждена в мета-анализе 125 клинических исследований иммунотерапии, включающем более 20 000 пациентов. 17 Препарат одобрен в России к применению как в виде монотерапии, так и в комбинации с таргетной терапией и/или химиотерапией при различных формах немелкоклеточного и мелкоклеточного рака легкого, некоторых типах метастатического уротелиального рака и при PD-L1-положительном метастатическом трижды негативном раке молочной железы. 18
Ирина Колядина, профессор кафедры онкологии и паллиативной медицины Российской медицинской академии последипломного образования:
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Lavelle F., Gueritte-Voegelein F., Guenard D. Taxotere: from yew's needles to clinical practice. Bull Cancer 1993;80(4):326–38.
2. Hanauske A.R., Degen D., Hilsenbeck S.G. et al. Effects of Taxotere and taxol on in vitro colony formation of freshly explanted human tumor cells. Anticancer Drugs 1992;3(2):121–4.
3. Rowinsky E.K., Onetto N., Canetta R.M., Arbuck S.G. Taxol: the first of the taxanes, an important new class of antitumor agents. Semin Oncol 1992;19(6):646–62.
4. Arioka H., Saijo N. Microtubules and anti- neoplastic drugs. Gan To Kagaku Ryoho 1994;21(5):583–90.
5. Gelmon K. The taxoids: paclitaxel and docetaxel. Lancet 1994;344(8932):1267–72.
6. Hanauske A.R., Depenbrock H., Shirvani D., Rastetter J. Effects of the microtubule-disturb- ing agents docetaxel (Taxotere), vinblastine and vincristine on epidermal growth factor-re- ceptor binding of human breast cancer cell lines in vitro. Eur J Cancer 1994;30A(11):1688–94.
7. Hill B.T., Whelan R.D., Shellard S.A. et. al. Differential cytotoxic effects of docetaxel in a range of mammalian tumor cell lines and cer- tain drug resistant sublines in vitro. Invest New Drugs 1994;12(3):169–82.
8. Bissery M.C., Guenard D., Gueritte- Volgelein F., Lavelle F. Experimental antitumor activity of Taxotere (RP 56976, NSC 628503), a taxol anologue. Canc Res 1991;51(18):4845– 52.
9. Harrison S.D., Dykes D.J., Shepherd R.V., Bissery M.C. Response of human xenografts to taxotere. Proc AACR 1992;33:526.
10. Bissery M.C., Nohynec G., Sanderink G.J., Lavelle F. Docetaxel (Taxotere): a review of preclinical and clinical experience. Part 1: pre- clinical experience. Anticancer Drugs 1995;6(3):339–68.
11. Hortobagyi G.N. Recent progress in the clinical development of docetaxel. Semin Oncol 1999;26(3 Suppl 9):32–6.
12. Mamounas E.P. NSABP Protocol B-27. Preoperative doxorubicin plus cyclophospha- mide followed by preoperative or postopera- tive docetaxel. Oncology (Williston Park) 1997;11(6 Suppl 6):37–40.
13. Nabholtz J.M., Mackey J., Smylie M., Tonkin K. Taxane-based three-drug combina- tion in metastatic and adjuvant treatment of breast cancer. Semin Oncol 1998;25(5 Suppl 12):27–31.
14. Costa S.D., von Minckwitz G., Raab G. et al. The role of docetaxel (Taxotere) in neoadjuvant
15. chemotherapy of breast cancer. Semin Oncol 1999;26(3 Suppl 9):24–31.
16. Figgitt D.P., Wiseman L.R. Docetaxel: an update of its use in advanced breast cancer. Drugs 2000;59(3):621–51.
17. Колядина И.В., Макаренко Н.П., Поддубная И.В. Роль таксотера в лечении метастатического рака молочной железы. Совр онкол 2009;2(11):10–2.
18. Mackey J.R., Martin M., Pienkowski T. et al. Adjuvant docetaxel, doxorubicin, and cy- clophosphamide in node-positive breast can- cer: 10-year follow-up of the phase 3 ran- domised BCIRG 001 trial. Lancet Oncol 2013;14(1):72–80.
19. Ozdemir N., Aksoy S., Zengin N., Altundag K. Taxanes in the adjuvant treatment of node-negative breast cancer patients. J BUON 2012;17(1):27–32.
20. Jones S.E., Collea R., Paul D. et al. Adju- vant docetaxel and cyclophosphamide plus trastuzumab in patients with HER-2-amplified early stage breast cancer: a single-group, open- label, phase 2 study. Lancet
21. Oncol 2013;14(11):1121–28.
22. Bulent Akinci M., Algin E., Inal A. et al. Sequential adjuvant docetaxel and anthracy- cline chemotherapy for node positive breast cancers: a retrospective study. J BUON 2013;18(2):314–20.
23. Yuan P., Xu B.H., Wang J.Y. et al. Docetax- el plus carboplatin versus EC-T as adju-
24. vant chemotherapy for triple-negative breast cancer: safety data from a phase III random- ized open-label trial. Zhonghua Zhong Liu Za Zhi 2012;34(6):465–8.
25. Coudert B., Asselain B., Campone M. et al. Extended benefit from sequential administra- tion of docetaxel after standard fluorouracil, epirubicin, and cyclophosphamide regimen for node-positive breast cancer: the 8-year follow- up results of the UNICANCER-PACS01 trial. Oncologist 2012;17(7):900–9.
26. Eiermann W., Pienkowski T., Crown J. et al. Phase III study of doxorubicin/cyclophospha- mide with concomitant versus sequential docetaxel as adjuvant treatment in patients with human epidermal growth factor receptor 2-normal, node-positive breast cancer: BCIRG-005 trial. J Clin Oncol 2011;29(29):3877–84.
27. Jones S., Holmes F.A., O'Shaughnessy J. et al. Docetaxel With Cyclophosphamide Is As- sociated With an Overall Survival Benefit Com- pared With Doxorubicinand Cyclophospha- mide: 7-Year Follow-Up of US
28. Oncology Research Trial 9735. J Clin Oncol 2009;27(8):1177–83.
29. De Laurentiis M., Cancello G., D’Agostino D. et al. Taxane-based combinations as adjuvant chemotherapy of early breast cancer: A meta- analysis of randomized trials. J Clin Oncol 2008;26(1):44–53.
30. Martín M., Seguí M.A., Antón A. et al. Ad- juvant docetaxel for high-risk, node-nega-
31. tive breast cancer. N Engl J Med 2010;363(23):2200–10.
32. Slamon D.J., Clark G.M., Wong S.G. et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987;235(4785):177–82.
33. Slamon D.J., Godolphin W., Jones L.A. et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science 1989;244(4905):707–12.
34. De Luca A., Carotenuto A., Rachiglio A. et al. The role of the EGFR signaling in tumor mi- croenvironment. J Cell Physiol 2008;214(3):559–67.
35. Piccart-Gebhart M.J., Procter M., Leyland-Jones B. et al. Trastuzumab after adju- vant chemotherapy in HER-2-positive breast cancer. N Engl J Med 2005;353(16):1659–72.
36. Romond E.H., Perez E.A., Bryant J. et al. Trastuzumab plus adjuvant chemotherapy for operable HER-2-positive breast cancer. N Engl J Med 2005;353(16):1673–84.
37. Joensuu H., Kellokumpu-Lehtinen P.-L., Bono P. et al. Adjuvant docetaxel or vinorel- bine with or without trastuzumab for breast cancer. N Engl J Med 2006;354:809–20.
38. Gennari A., Sormani M.P., Pronzato P. et al. HER-2 status and efficacy of adjuvant anthra- cyclines in early breast cancer: A pooled analy- sis of randomized trials. J Natl Cancer Inst 2008;100(1):14–20.
39. Pritchard K.I., Messersmith H., Elavathil L. et al. HER-2 and topoisomerase II as predic- tors of response to chemotherapy. J Clin Oncol 2008;26(5):736–744.
40. Slamon D., Eiermann W., Robert N. et al. Adjuvant trastuzumab in HER-2-positive breast cancer. N Engl J
41. Med 2011;365(14):1273–83.
42. Au H.J., Eiermann W., Robert N.J., Pienkowski T. et al. Health-related quality of life with adjuvant docetaxel- and trastuzumab- based regimens in patients with node-positive and high-risk node-negative, HER-2-positive early breast cancer: results from the BCIRG 006 Study. Oncologist 2013;18(7):812–8.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Рак молочной железы: выход есть!
Статистика заболеваемости раком молочной железы в нашей стране тревожная — маммологи выявляют около 50 000 новых случаев ежегодно. Средний возраст пациенток — 59 лет, но это не означает, что более молодые женщины не рискуют. Наоборот, как уже было сказано, эта болезнь все чаще поражает женщин в самом расцвете сил.
Причины развития рака молочной железы врачам пока точно неизвестны, однако очевидно, что ключевую роль здесь играют генетика и экология. Жительницы сельской местности болеют раком груди на 30% реже, чем горожанки.
Однако при диагностике рака груди на ранних стадиях прогноз благоприятный — если рак был обнаружен на первой стадии, выживаемость в течение 5 лет составляет 94%, на второй стадии — 79%.
Онкологи выделяют 4 стадии рака молочной железы:
- На первой — опухоль невелика, не превышает 2 см в диаметре, метастазы отсутствуют.
- На второй стадии рака молочной железы размеры опухоли — от 2 до 5 см в диаметре. На этой стадии раковые клетки присутствуют в 4-5 лимфатических узлах.
- Третья стадия рака характеризуется большими размерами опухоли, от 5 см, при этом рак распространяется к основанию органа.
- Четвертая — опасна тем, что опухоль дает метастазы в разные органы, чаще всего — в печень, легкие, кости и головной мозг.
Рак молочной железы составляет 20-25% всех случаев онкологических заболеваний у женщин.
На сегодняшний день существует несколько методов лечения рака груди. Выбор подходящего зависит от многих факторов: размера первичной опухоли, состояния регионарных лимфатических узлов, наличия отдаленных метастазов и рецепторного статуса, то есть чувствительности к гормонам.
При хирургическом вмешательстве главная задача врача — сохранение жизни и здоровья пациентки, даже если это означает утрату молочной железы. Однако сейчас доктора стараются не только удалить опухоль, но и сохранить железу. В тех случаях, когда это невозможно, проводится протезирование груди — обычно пластику проводят через полгода после мастэктомии. Хотя, например, в Израиле реконструкцию молочной железы осуществляют в рамках одной операции: сразу после удаления.
Если размеры опухоли не превышают 25 мм, прибегают к органосохраняющей операции. Нередко удаляют несколько ближайших лимфоузлов, даже если метастазов не найдено — это позволяет предупредить рецидив болезни.
Отметим, что на вооружении у хирургов передовых в лечении онкологии стран уникальные хирургические инструменты. Например, в израильских клиниках с успехом применяется прибор Margin Probe, который, по утверждениям медиков, дает возможность удалить абсолютно все раковые клетки.
Радиотерапия, или лучевая терапия, является частью поддерживающего лечения рака молочной железы, ее назначают женщинам до или после удаления опухоли. Радиотерапия снижает вероятность рецидива рака, убивая клетки опухоли. При лучевой терапии опухоль облучается при помощи мощного рентгеновского или гамма-излучения.
Инновационная методика внутриоперационного облучения. Позволяет избежать послеоперационной радиотерапии и снизить риск рецидивов. Данная процедура проводится во время операции и избавляет женщину от послеоперационного лечения. В отличие от традиционной лучевой терапии, излучение направлено лишь на те области, в которых предположительно находятся раковые клетки. Применение метода позволяет сократить продолжительности лечения на 6 недель, уменьшив при этом риск рецидивов и нанося минимальный вред здоровым тканям.
Химиотерапия, или медикаментозное лечение рака молочной железы, применяется до, после и даже вместо хирургического лечения в тех случаях, когда оно невозможно. Химиотерапия — это введение особых токсинов, воздействующих на клетки опухоли. Курс химиотерапии может продолжаться от 3 до 6 месяцев и обычно начинается сразу же после хирургического вмешательства. Для химиотерапии применяются различные препараты — одни разрушают белки, которые контролируют развитие опухолевых клеток, другие встраиваются в генетический аппарат раковой клетки и вызывают ее гибель, третьи замедляют деление пораженных клеток.
Гормонотерапия бывает эффективна, но лишь в половине случаев, поскольку не все виды рака молочной железы чувствительны к данному лечению.
Или целевая терапия — наиболее щадящий вид лечения рака молочной железы. Препараты для таргетной терапии воздействуют только на пораженные клетки, не затрагивая здоровые, поэтому такая терапия переносится намного лучше.
- Нулевая стадия
Если диагностировать болезнь именно на этом этапе, то шансы выздороветь стремятся к 100%. Для излечения проводят лампэктомию — щадящую операцию, при которой удаляется только само новообразование и небольшая часть прилегающих тканей, хотя в некоторых случаях показано удаление всей железы с последующей пластикой. Однако такой способ лечения применяется реже. После операции показан курс химио-, таргетинговой и гормональной терапии. - Первая стадия
Прогноз также благоприятен: примерно 94–98% пациенток полностью выздоравливают после лампэктомии с последующей химио-, таргетинговой и гормональной терапией. Иногда показан курс радиотерапии. - Вторая стадия
На этой стадии опухоль уже слишком велика, и обойтись лампэктомией, скорее всего, не получится — показано полное удаление молочной железы — мастэктомия с удалением подмышечных лимфоузлов и обязательной последующей лучевой терапией. Стоит сказать, что в зарубежных клиниках, например израильских, к данному методу прибегают лишь в крайних случаях, прилагая все усилия для сохранения груди. - Третья стадия
На этой стадии образуются многочисленные метастазы. Для выздоровления необходимо удалить не только саму опухоль, но и метастазы. Обязательно проводится мастэктомия с удалением лимфоузлов и радиотерапией, а также гормонотерапия, химио- и таргетинговая терапия для уничтожения всех раковых клеток. - Четвертая стадия
Это запущенный рак груди с большим количеством метастазов. Показаны лучевая и химиотерапия, а также оперативное вмешательство, целью которого является не удаление опухоли, а ликвидация опасных для жизни осложнений, а также — в некоторых случаях — гормональная терапия. Вылечить рак полностью на этой стадии практически невозможно, но можно продлить жизнь и улучшить ее качество.
Ранняя диагностика рака груди — залог результативного лечения. В последнее время эта тема часто поднимается в СМИ, что заставляет многих женщин чаще задумываться о своем здоровье и регулярно посещать маммолога.
Читайте также:

