Fish исследование при лейкозах
Современный метод цитогенетического анализа, позволяющий определять качественные и количественные изменения хромосом (в том числе транслокации и микроделеции) и используемый для дифференциальной диагностики злокачественных заболеваний крови и солидных опухолей.
Флуоресцентная гибридизация in situ
Fluorescence in-situ hybridization
Флуоресцентная гибридизация in situ.
Какой биоматериал можно использовать для исследования?
Образец ткани, образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
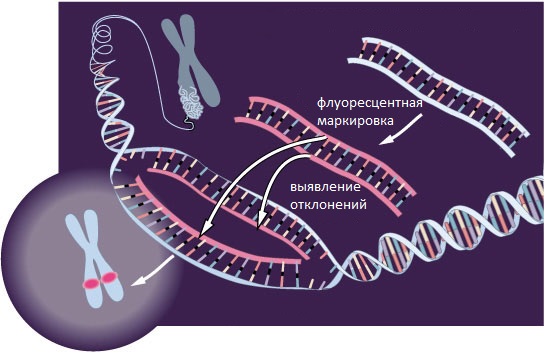
Флуоресцентная гибридизация in situ (FISH, от англ. fluorescence in-situ hybridization) – это один из самых современных методов диагностики хромосомных аномалий. Он основан на использовании ДНК-проб, меченных флуоресцентной меткой. ДНК-пробы представляют собой специально синтезированные фрагменты ДНК, последовательность которых комплементарна последовательности ДНК исследуемых аберрантных хромосом. Таким образом, ДНК-пробы различаются по составу: для определения разных хромосомных аномалий используются разные, специфические ДНК-пробы. ДНК-пробы также различаются по размеру: одни могут быть направлены к целой хромосоме, другие – к конкретному локусу.
В ходе процесса гибридизации при наличии в исследуемом образце аберрантных хромосом происходит их связывание с ДНК-пробой, которое при исследовании с помощью флуоресцентного микроскопа определяется как флуоресцентный сигнал (положительный результат FISH-теста). При отсутствии аберрантных хромосом несвязанные ДНК-пробы в ходе реакции "отмываются", что при исследовании с помощью флуоресцентного микроскопа определяется как отсутствие флуоресцентного сигнала (отрицательный результат FISH-теста). Метод позволяет оценить не только наличие флуоресцентного сигнала, но и его интенсивность и локализацию. Таким образом, FISH-тест – это не только качественный, но и количественный метод.
FISH-тест обладает рядом преимуществ по сравнению с другими методами цитогенетики. В первую очередь, исследование FISH может быть применено как к метафазным, так и к интерфазным ядрам, то есть к неделящимся клеткам. Это основное преимущество FISH по сравнению с классическими способами кариотипирования (например, окрашиванием хромосом по Романовскому-Гимзе), которые применяются только к метафазным ядрам. Благодаря этому исследование FISH является более точным методом для определения хромосомных аномалий в тканях с низкой пролиферативной активностью, в том числе в солидных опухолях.
Так как в FISH-тесте используется стабильная ДНК интерфазных ядер, для исследования могут быть использованы самые различные биоматериалы – аспираты тонкоугольной аспирационной биопсии, мазки, аспираты костного мозга, биоптаты и, что немаловажно, сохраненные фрагменты ткани, например гистологические блоки. Так, например, FISH-тест может быть с успехом выполнен на повторных препаратах, полученных из гистологического блока биоптата молочной железы при подтверждении диагноза "аденокарцинома молочной железы" и необходимости определения HER2/neu-статуса опухоли. Следует особо подчеркнуть, что в данный момент исследование FISH рекомендовано в качестве подтверждающего теста при получении неопределенного результата иммуногистохимического исследования опухоли на онкомаркер HER2/neu(ИГХ 2+).
Другим преимуществом FISH является его способность определять микроделеции, которые не выявляются с помощью классического кариотипирования или ПЦР. Это имеет особое значение при подозрении на синдром Ди Джорджи и велокардиофациальный синдром.
FISH-тест широко используется в дифференциальной диагностике злокачественных заболеваний, в первую очередь в онкогематологии. Хромосомные аномалии в сочетании с клинической картиной и данными иммуногистохимического исследования являются основой классификации, определения тактики лечения и прогноза лимфо- и миелопролиферативнх заболеваний. Классическими примерами являются хронический миелолейкоз – t (9;22), острый промиелоцитарный лейкоз – t (15;17), хронический лимфолейкоз – трисомия 12 и другие. Что касается солидных опухолей, наиболее часто FISH-исследование применяется при диагностике рака молочной железы, мочевого пузыря, толстой кишки, нейробластомы, ретинобластомы и других.
Исследование FISH также может быть использовано в пренатальной и преимплантационной диагностике.
FISH-тест часто проводят в сочетании с другими методами молекулярной и цитогенетической диагностики. Результат этого исследования оценивают в комплексе с результатами дополнительных лабораторных и инструментальных данных.
Для чего используется исследование?
- Для дифференциальной диагностики злокачественных заболеваний (крови и солидных органов).
Когда назначается исследование?
- При подозрении на наличие злокачественного заболевания крови или солидных опухолей, тактика лечения и прогноз которых зависит от хромосомного состава опухолевого клона.
Что означают результаты?
- Наличие в исследуемом образце аберрантных хромосом.
- Отсутствие в исследуемом образце аберрантных хромосом.
Что может влиять на результат?
- Количество аберрантных хромосом.
- 18 Иммуногистохимическое исследование клинического материала (с использованием 1 антитела)
- 19 Иммуногистохимическое исследование клинического материала (с использованием 4 и более антител)
- 19 Определение HER2 статуса опухоли методом FISH
- 28 Определение HER2 статуса опухоли методом СISH
Кто назначает исследование?
Онколог, педиатр, акушер-гинеколог, врач-генетик.
Литература
- Wan TS, Ma ES. Molecular cytogenetics: an indispensable tool for cancer diagnosis. Anticancer Res. 2005 Jul-Aug;25(4):2979-83.
- Kolialexi A, Tsangaris GT, Kitsiou S, Kanavakis E, Mavrou A. Impact of cytogenetic and molecular cytogenetic studies on hematologic malignancies. Chang Gung Med J. 2012 Mar-Apr;35(2):96-110.
- Mühlmann M. Molecular cytogenetics in metaphase and interphase cells for cancer and genetic research, diagnosis and prognosis. Application in tissue sections and cell suspensions. Genet Mol Res. 2002 Jun 30;1(2):117-27.
Флуоресцентная гибридизация (FISH) - это высокотехнологичное тестирование, которое "отображает" генетический материал в клетках человека. Этот тест может быть использован для визуализации специфических генов или частей генов и даешь широкие возможности для диагностической генетической онкологии.
Тестирование FISH проводится на ткани молочной железы во время биопсии, чтобы увидеть, имеют ли клетки дополнительные копии гена HER2. Чем больше в образце копий гена HER2, тем больше HER2 рецепторов имеют клетки. Эти HER2 рецепторы получают сигналы, которые стимулируют рост клеток рака молочной железы.
FISH-диагностика основана на принципе флуоресцентных отметок, которые связаны с выбранными частями хромосом. Специальное оборудование находит участки хормосом, с которыми вошли в контакт флуоресцентные зонды. Теоретически, это может говорить о патологиях, приводящих к раку. К таким отклонениям относят делецию или дупликацию части хромосомы, неправильно локализированные части хромосом или инверсию (мутационная перестройка). Преимущества этого вида диагностики в том, что врач может уловить даже малейшие изменения в генетике, обычно не определяемые при помощи стандартного оборудования.
Результаты испытаний FISH покажут, является ли результат HER2 положительным или отрицательным (результат иногда может расшифровываться как "ноль"). Как правило, тестирование FISH не так широко доступно в клиниках. Во-первых, это связано с более высокой стоимостью анализа, во-вторых - со сложностью процедуры. Как аналог, может быть проведен другой метод тестирования гена HER2, который имеет название иммуногистохимия, или ИГХ. Тем не менее, результаты FISH считаются более точными. Во многих случаях врачи сперва проводят иммуногистохимию. И если получен неясный результат, получают дополнительную информацию по средствам FISH-тестирования. FISH точно показывает, являются ли клетки HER2-положительными или отрицательными.
Исследования показали, что некоторые результаты испытаний HER2 могут быть неточными. Это происходит из-за того, что лаборатории следуют разным протоколам для классификации положительного и отрицательного статуса HER2. Каждый врач может также использовать несколько различных критериев, чтобы решить, являются ли результаты положительными или отрицательными. В большинстве случаев это происходит, когда результаты диагностики не имеют сильно выраженного "+" или "-" гена (так называемое пограничное состояние).
Также в медицине известны случаи, когда из разных участков опухоли проявляются разные результаты. Например, один фрагмент ткани с раком молочной железы показывает положительный результат, тогда как в другой области биопсия говорит об отсутствии гена HER2.
Неверные результаты испытаний HER2 во время стандартной иммуногистохимии могут привести к неправильной постановке диагноза и - как следствие - некорректному назначению лечения. Специалисты в Израиле исследуют опухоль и в случае, если рак молочной железы является HER2-положительным, но результаты испытаний классифицируют его как HER2-отрицательным, врачи не будут рекомендовать обычные лекарства. Лечение рака в Израиле проходит по индивидуальному протоколу для каждого конкретного пациента.
Врачи выделяют три основных лекарства, которые успешно работают против HER2-положительного рака молочной железы:
- - Herceptin (химическое название: трастузумаб)
- - Tykerb (химическое название: лапатиниб)
- - Perjeta (химическое название: пертузумаб)
Если результаты испытаний HER2 являются HER2-отрицательными, пациент в праве узнать, уверен ли лечащий врач в точности анализов и оснащенности лаборатории, и при желании запросить еще одну диагностику. Если результаты признаны пограничными, в Израиле обычно собирается консилиум, где обсуждают этот случай несколько специалистов-онкологов, генетики и специалисты из смежных областей медицины.
Кроме применения в маммологии, данные исследования FISH сообщают о других типах онкологических заболеваний. Пациенты с раком мочевого пузыря могут определить возможность рецидива, а транслокация хромосом обычно говорит о присутствии лейкозов, сарком или лимфом.
FISH тест был разработан несколько лет назад, но регулярно улучшают его характеристики и разрабатывают это направление, поскольку ученые по всему миру считают его перспективным и наиболее точным в определении онкологических заболеваний, восприимчивых к герцептину.

Рак молочной железы является самым частым онкологическим заболеванием у женщин. Поэтому данной проблеме уделяется очень много внимания со стороны врачей и ученых. На сегодняшний день методы диагностики рака молочной железы существенно изменились и усовершенствовались. Одним из таких методов является флуоресцентная гибридизация in situ или FISH (фиш).
Зачем нужен FISH-анализ?
Рак молочной железы может иметь различный гормональный статус, который очень важно определить для подбора дальнейшего лечения. Выделяют несколько биологических маркеров опухоли, одним из которых является рецептор HER2-neu. Он отвечает за рост и деление клеток.
Когда назначается FISH тест
Определить статус HER2-neu в клетках рака молочной железы можно разными способами. Наиболее простым и дешевым является иммуногистохимическое исследование. Однако в части случаев оно не дает точного ответа. При анализе результатов, врач определяет статус HER2-neu в баллах или плюсах (+).
- 0-1+ — результат негативный.
- 2+ — статус не определен.
- 3+ — статус позитивный.
FISH тест назначается при неопределенном результате иммуногистохимического исследования (2+). В этом случае нельзя достоверно оценить экспрессию гена, следовательно, нельзя быть уверенным, что пациенту поможет соответствующее лечение.
На сегодняшний день не существует FISH-тестов, позволяющих проводить раннюю диагностику рака молочной железы. Это исследование показано тем женщинам, у которых уже опухоль выявлена, удалена и которым требуется подобрать лечение.

Подготовка к тесту и алгоритм его проведения
Для того чтобы провести FISH исследование, необходимо получить образец опухолевых клеток. Как правило, к тому моменту, когда женщине назначается данный анализ, она уже прошла все необходимые диагностические процедуры, в том числе биопсию. Однако в некоторых случаях требуется повторное проведение биопсии молочной железы, о чем врач предупредит заранее.
На следующем этапе обязательно проводится иммуногистохимическое исследование. Во-первых, оно более дешевое и простое, во-вторых, оно тоже с большой точностью может помочь определить статус HER2-neu в молочной железе. Если результат иммуногистохимии оценивается в 2+, то материал отправляется на FISH исследование.
Тест проводится на таком же материале молочной железы, который использовался при проведении иммуногистохимии. Метод FISH подразумевает использование ДНК-зондов, которые связываются с определенными мишенями в клетке. Для того чтобы зонд можно было визуализировать, его помечают специальными флуоресцентными красителями.
При оценке статуса HER2-neu интерес представляет 17 хромосома, на которой расположен ген, который кодирует данный белок. В процессе проведения FISH теста можно оценивать как количество хромосом, так и количество копий гена в клетках рака молочной железы. Для этого ткань проходит пробоподготовку и помечается ДНК-зондом, после чего врач оценивает срез под флуоресцентным микроскопом и дает свое заключение.
Достоинства и недостатки FISH теста
В настоящее время метод FISH позволяет с высокой точностью определить HER2-статус опухоли молочной железы и подобрать необходимое лечение. Такая необходимость возникла с разработкой лекарственного препарата Трастузумаб (Герцептин). Согласно исследованиям, при назначении его на ранних стадиях рака молочной железы удается снизить вероятность рецидива заболевания на 50%, а показатели смертности — на 30%, что является очень хорошим результатом.
Препарат оказывает действие только на те клетки рака молочной железы, которые отличаются высокой гиперэкспрессией HER2-neu. В остальных случаях Герцептин будет неэффективен. Среди других достоинств, которыми обладает тест FISH, можно отметить относительно быстрые сроки выполнения анализа (около 2-3 дней), высокую чувствительность и специфичность.
Для проведения FISH теста требуется дорогостоящее оборудование (флуоресцентный микроскоп) и расходные материалы, поэтому его пока предлагают лишь крупные клиники и диагностические центры. Кроме того, стоимость самого исследования также является высокой, но при этом полностью оправдывает себя.
Тест FISH — это один из методов современной диагностики рака молочной железы, который применяется только в специфических ситуациях. Несмотря на высокую точность, его не требуется назначать всем пациентам подряд, но при наличии показаний, этот метод может существенно помочь в выборе метода лечения и улучшить прогноз при раке молочной железы.
Хронический лимфоцитарный лейкоз (ХЛЛ) является одной из разновидностей рака крови. Его также называют хронической лимфоидной лейкемией или лимфомой малых лимфоцитов.
Что такое хронический лимфоцитарный лейкоз?
ХЛЛ развивается из-за аномалий в образовании и развитии одной из разновидностей кровяных телец – лимфоцитов.
Большинство случаев ХЛЛ (около 95%) начинается с повреждения B-лимфоцитов (B-клеток). Основные признаки:
Из-за этого лейкоциты не могут нормально выполнять некоторые свои функции по борьбе с инфекциями;
Постепенно они накапливаются в костном мозге и крови, вытесняя из кровотока здоровые лимфоциты;
Низкий уровень здоровых лимфоцитов может привести к заражению вторичными инфекциями, анемии и кровотечениям;
Поврежденные клетки разносятся кровотоком по всему телу и мешают нормальному функционированию органов;
В редких случаях хроническая форма лейкоза переходит в агрессивную.
Другие разновидности хронических лимфом
Помимо ХЛЛ существуют и другие разновидности лейкозов.
Пролимфоцитарная лейкома (ПЛЛ). Она более агрессивна, чем большинство типов ХЛЛ. Поражает как B-лимфоциты, так и T-лимфоциты. Обычно развивается стремительнее ХЛЛ, но все-таки не так быстро, как острый лимфобластный лейкоз.
Крупнозернистая лимфоцитарная лейкемия (КЛЛ). Имеет тенденцию к медленному росту, однако, в некоторых случаях быстро переходит в агрессивную стадию. Характеризуется увеличенными лимфоцитами с видимыми гранулами, поражает T-лимфоциты или естественные киллеры (NK-клетки).
Волосатоклеточный лейкоз (ВКЛ). Медленно растущая разновидность рака B-клеток, при этом довольно редкая. Название происходит от внешнего вида лимфоцитов – точечных проекций на поверхности клеток, которые делают их волосатыми на вид.
Малая лимфоцитарная лимфома (МЛЛ). Это заболевание тесно связано с хронической формой лимфомы, однако, при МЛЛ раковые клетки обнаруживаются в лимфоузлах и селезенке, а не в костном мозге и крови.
Органы кроветворения и ХЛЛ
Для начала полезно разобраться, как вообще устроено кроветворение в организме и какую роль в этом играет костный мозг.
Стволовыми клетками называют особый тип клеток в организме, которые могут трансформироваться практически в любую иную форму: клетки печени, кожи, мозга или крови. Они формируются в костном мозге. Те стволовые клетки, которые участвуют в кроветворении, называются гемопоэтическими (стволовыми клетками крови).
Кровяные тельца непрерывно стареют, повреждаются и погибают. На них место должны непрерывно поступать новые, причем в достаточном количестве. Так, например, в норме у здорового взрослого человека должно содержаться от 500 до 1500 лимфоцитов на 1 мкл (примерно 25-40% от общего объема крови).
Стволовые клетки продуцируются в основном в мягкой губчатой ткани костей, но некоторое их число также можно встретить в циркулирующей крови.
Гемопоэтические клетки активно трансформируются в лимфоидные и миелоидные стволовые клетки:
-
Лимфоидные вырабатывают лимфобласты, которые в свою очередь преобразуются в несколько типов лейкоцитов, включая лимфоциты и NK-клетки;
Миелоидные, соответственно, продуцируют миелобласты. А те превращаются в другие типы лейкоцитов: гранулоциты, эритроциты и тромбоциты.
У каждого типа клеток крови своя специализация и предназначение.
Лейкоциты активно противостоят инфекциям и внешним раздражителям.
Красные кровяные тельца (эритроциты) отвечают за перенос кислорода из легких к тканям и доставку углекислого газа обратно в легкие для удаления.
Тромбоциты образуют сгустки, чтобы замедлить или прекратить кровотечение.
На ранних стадиях ХЛЛ обычно не беспокоит пациента. Для развития выраженных симптомов могут уйти годы, но как только они появляются – это уже повод говорить о хронической стадии заболевания.
Симптомы ХЛЛ часто путают с гриппом и прочими распространенными заболеваниями. При этом падает уровень содержания всех типов клеток крови. Симптомы низких лейкоцитов в крови:
жар, потливость, боли в различных частях тела;
Также может наблюдаться снижение уровня эритроцитов:
усталость, слабость, недостаток энергии и сонливость.
Симптомы низких тромбоцитов:
красные пятна нёбе или лодыжках;
частое или сильное носовое кровотечение;
синяки по всему телу и плохая свертываемость крови при порезах.
Общие симптомы хронического лимфоцитарного лейкоза:
необъяснимая потеря веса;
боли в костях или суставах;
опухание лимфатических узлов в шее, подмышках, желудке или паху.
Диагностика хронического лимфоцитарного лейкоза
Вышеперечисленные симптомы уже могут навести вашего врача на подозрения, однако, чтобы поставить окончательный диагноз, ему потребуется изучить историю болезни и провести полное медицинское обследование.
Для точной диагностики ХЛЛ потребуется несколько тестов. Некоторые из них могут не понадобиться, но будут нужны, чтобы уточнить диагноз и разработать более эффективную стратегию лечения.
Тест на типы и количество клеток крови, наличие аномальных лимфоцитов или уже сформировавшихся раковых клеток. Врачу здесь необходимо определить тип дефектных клеток, признаки замедления или наоборот прогрессирования рака. Применяется два вида специальных анализов крови: имунофенотипирование и проточная цитометрия. Иногда ХЛЛ можно заподозрить и при помощи общего анализа.
Отбор тканей из костей таза при помощи иглы (аспирация и биопсия костного мозга) и их проверка на наличие раковых клеток.
Клетки крови или костного мозга проверяют на наличие хромосомных аномалий: недостающих частей, дополнительных копий, дублировании хромосом. Также могут быть проверены изменения в белках иммунной системы, которые могут предсказать степень агрессивности ХЛЛ. В целом, выделяют три вида генетических тестов: цитогенетический анализ, флуоресцентную гибридизацию in situ (FISH)и полимеразную цепную реакцию (ПЦР-тест).
Сюда входят рентген грудной клетки, компьютерная и магнитно-резонансная томографии, а также ультразвуковое исследование лимфоузлов.
Стадии хронического лимфоцитарного лейкоза по Rai
Чтобы определить, как далеко зашла болезнь, и спланировать лечение, врачи пользуются системой Rai. Она была специально разработана для ХЛЛ:
Стадии заболевания зависят от количества лимфоцитов, эритроцитов и тромбоцитов в костном мозге и кровотоке, а также от того, были ли поражены селезенка, печень и лимфоузлы;
Стадии варьируются от 0 до IV, где 0 – наименее, а IV – наиболее тяжелая.
Ваш этап Rai даст онкологу информацию о вероятности прогрессирования болезни и необходимости лечения. Этап 0 характеризуется низким уровнем риска, этапы I–II – умеренным, этапы III–IV – высоким.
Ваш врач должен тщательно изучить и другие факторы, чтобы спрогнозировать перспективы и подобрать наиболее оптимальную стратегию лечения. В их числе:
Генетические отклонения и мутации в лейкоцитах (к примеру, отсутствие части хромосомы или наличие дополнительной хромосомы);
Наличие мутационного статуса IGHV-гена (наличие тяжелых цепей иммуноглобулина с переменной областью);
Проявляются ли симптомы ХЛЛ;
Возраст, наличие сопутствующих заболеваний, образ жизни;
Количество онкогенных (прелейкемических) клеток;
Скорость деления лейкемических клеток;
Как болезнь реагирует на первичное лечение и как долго длится ответная реакция.
Онкологу потребуется провести дополнительные тесты, анализы крови и костного мозга после анализа лечения.
Ремиссия будет означать, что болезнь реагирует на терапию. Полная ремиссия означает отсутствие каких-либо симптомов и клинических признаков рака. Частичная ремиссия означает уменьшение всех симптомов на 50%;
Рецидив означает, что ХЛЛ возвращается после пребывания в ремиссии более шести месяцев;
Резистентность – заболевание прогрессирует в течение шести месяцев после лечения.
Насколько распространен хронический лимфоцитарный лейкоз?
В США ежегодно диагностируется порядка 20 тысяч случаев ХЛЛ. По статистике это наиболее распространенная разновидность лейкемии среди взрослых – на нее приходится почти 40% случаев.
Причины хронического лейкоза
Медицине не известно, что является причиной ХЛЛ. Известно, что болезни подвержены люди среднего и старшего возраста. Средний возраст пациентов на момент постановки диагноза составляет 72 года. ХЛЛ чаще встречается среди мужчин, чем среди женщин.
В целом, это заболевание более распространено в Северной Америке и Европе, чем в Азии. Однако это зависит не от места проживания, а скорее от генетической предрасположенности отдельных рас. Азиаты, живущие в США, Канаде или европейских странах, подвергаются примерно одинаковому риску ХЛЛ со своими соплеменниками из азиатских стран.
В настоящий момент выявлено всего два фактора риска по ХЛЛ:
случаи ХЛЛ или иных типов лейкозов среди близких родственников.
Нужно иметь в виду, что у многих людей с ХЛЛ вообще не было факторов риска в анамнезе.
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

