Фенол реагирует с хлором азотной кислотой
Фенолы - кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название "фенол".
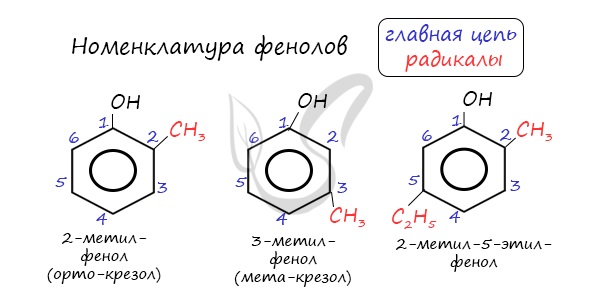
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
- Гидролиз галогенбензолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.

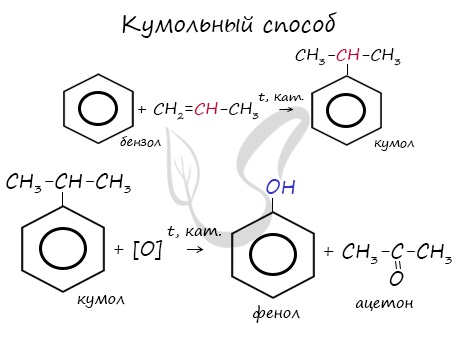
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
- Кислотные свойства
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей - фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)

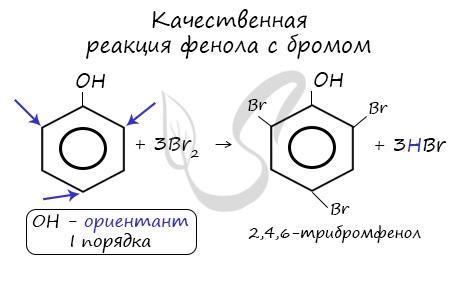
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь - осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал - нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.

При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.

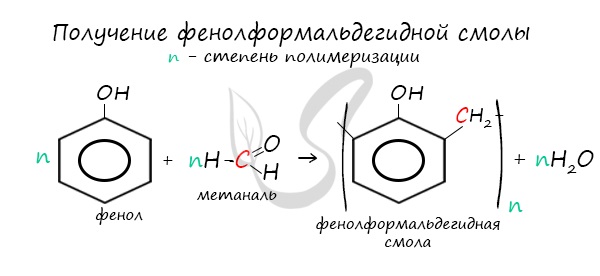
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
В отличие от предельных одноатомных спиртов, фенолы реагируют с щелочами, например NaOH.
Качественной реакцией на фенол является реакция c бромной водой.
В результате кумольного синтеза фенола, помимо фенола, получают ацетон (пропанон-2)
Гидроксогруппа в молекуле фенола вступает как ориентант I порядка.
Фенол с метаналем вступает в реакцию поликонденсации, в результате которой получают фенолформальдегидную смолу.
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.

Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |

Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |

Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.

При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:

Получается фенолят натрия, из которого затем выделяют фенол:
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: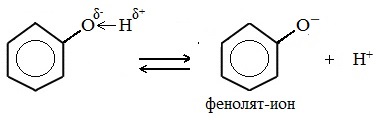
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.

1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
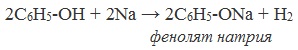
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
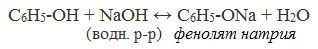
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой: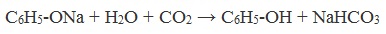
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 - , Br - )
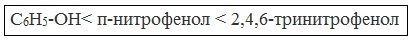
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: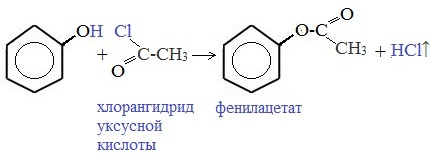
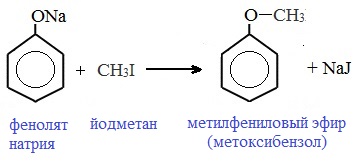
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
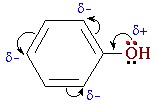
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
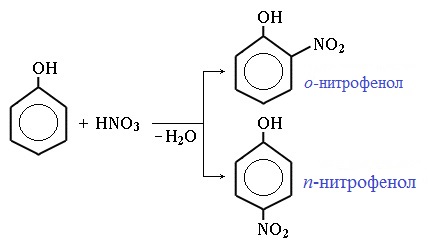
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):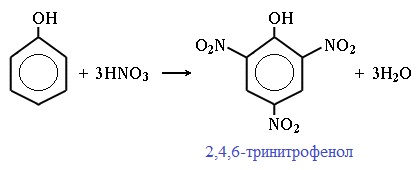
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):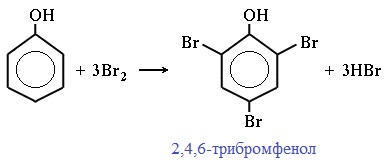
Образуется белый осадок трибромфенола.
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: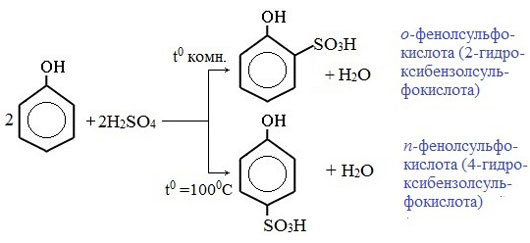
Реакции присоединения
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
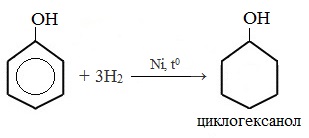
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
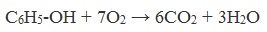
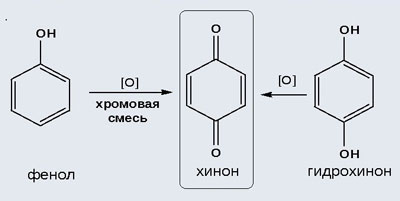
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
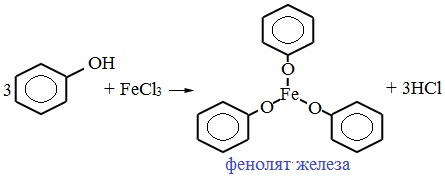
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Электрофильное замещение в ароматическом кольце фенолов
Реакции ароматического кольца фенолов протекают по механизму электрофильного ароматического замещения. Гидроксильная группа ориентирует вступление электрофильного реагента в орто- и пара-положения бензольного кольца. Из-за донорного влияния гидроксигруппы (+М эффект) реакции электрофильного замещения в фенолах протекают значительно легче, чем в бензоле и его гомологах. Фенолы и фенолят-анионы вступают во взаимодействие даже с очень слабыми электрофилами, с которыми большинство других ароматических соединений не реагирует – катионами арендиазония ArN 2+ , нитрозония NO + , иминия R2C=N + H2 и диоксидом углерода (одним из самых слабых электрофилов).
Галогенирование
В отличие от бензола галогенирование фенола не требует катализа и протекает при действии молекулярного галогена. При бромировании фенола в водном растворе остановить реакцию на стадии образования монобромпроизводного невозможно, образуется сразу 2,4,6-трибромофенол, который при избытке брома превращается в 2,4,4,6-тетрабромоциклогексадиен-2,5-он. Это происходит из-за того, что в воде фенол частично диссоциирован и галогенированию подвергается фенолят-анион, значительно легче вступающий в реакции электрофильного замещения. Получающийся вначале монобромфенол является более сильной кислотой (-I эффект атома брома) по сравнению с фенолом и, следовательно бромируется быстрее, чем фенол. 2,4-Дибромфенол, в свою очередь, реагирует с бромом легче, чем бромфенол. Как следствие – образование в этой реакции исключительно трибромпроизводного даже при недостатке брома.
Для того чтобы осуществить моногалогенирование фенола, необходимо проводить реакцию в условиях, где диссоциация фенола полностью подавлена. Например, п-бромфенол синтезируют при действии на фенол бромом в среде бромоводородной кислоты, сероугрерода или реакцией фенола с диоксандибромидом в хлороформе.
Нитрование фенола протекает при действии разбавленной азотной кислоты и приводит к двум изомерам – орто- и пара-нитрофенолам. Дальнейшее взаимодействие с концентрированной азотной кислотой дает сначала динитрофенолы и затем 2,4,6-тринитрофенол (пикриновую кислоту). Этот процесс сопровождается значительным смолообразованием из-за окислительного действия азотной кислоты.
Поэтому для синтеза пикриновой кислоты преимущественно применяют нитрование 4-гидроксибензол-1,3-дисульфокислоты, основанное на ипсо-замещении сульфогрупп на нитрогруппы.
Сульфирование
Сульфирование фенола осуществляют путем нагревания с концентрированной серной кислотой. Температура проведения реакции решающим образом определяет строение образующихся оксибензолсульфокислот. орто-Изомер, скорость образования которого выше, чем пара-изомера, является доминирующим продуктом, если температура проведения реакции не превышает 100 °С. Его называют кинетическим продуктом. Напротив, при более высоких температурах основным продуктом является пара-изомер, скорость образования которого ниже, но он обладает высокой термодинамической устойчивостью Реакция электрофильного ароматического сульфирования обратима и при нагревании орто-оксибензолсульфокислоты, с серной кислотой выше 100 °С получают пара-изомер – продукт термодинамического контроля реакции.
Алкилирование
В отличие от алкилирования фенола по гидроксигруппе, которое идет в щелочной среде, введение алкильных заместителей в ароматическое кольцо фенола протекает при действии галогеналканов, спиртов или алкенов в присутствии катализаторов – минеральных кислот или кислот Льюиса (реакция Фриделя-Крафтса).
орто-Аллилфенолы образуются при нагревании до 200-220 °С аллилфениловых эфиров. Это превращение называют перегруппировкой Кляйзена. Реакция протекает внутримолекулярно и аллильная группа присоединяется к бензольному кольцу γ -углеродным атомом.
Если орто-положения в аллилфениловом эфире заняты, по перегруппировка Кляйзена осуществляется в пара-положение. Так, аллил-2,6-диметилфениловый эфир перегруппировывается при нагревании в 4-аллил-2,6-диметилфенол.
Ацилирование
Ацилирование фенола по Фриделю-Крафтсу можно осуществить только в присутствии кислот Льюиса. Фенол взаимодействует с ацетилхлоридом в присутствии хлорида алюминия, давая смесь о- и п-ацетилфенолов (о- и п-гидроксиацетофенонов).
Другой способ получения С-ацилпроизводных фенолов основан на упомянутой выше перегруппировке Фриса. Ариловые эфиры карбоновых кислот при нагревании в присутствии AlCl3 или AlBr3 превращаются в орто- и пара-ацилфенолы. При этом, варьируя температуру и растворитель, можно изменить соотношение изомеров в пользу одного из них. Механизм реакции включает две стадии: 1) межмолекулярное ацилирование бензольного кольца одной молекулы сложного эфира комплексом второй молекулы с кислотой Льюиса; 2) межмолекулярный перенос О-ацильной группы к молекуле фенола.
Ацилирование многоатомных фенолов нитрилами в присутствии газообразного хлороводорода носит название реакции Геша. Например, резорцин при действии ацетонитрила в условиях реакции Геша дает 2,6-дигидроксиацетофенон.
Ацилирование фенолов фталевым ангидридом в присутствии серной кислоты или хлорида цинка приводит к образованию фталеинов, многие из которых являются индикаторами (фенолфталеин, тимолфталеин) или красителями (флуоресцеин).
Формилирование
Введение формильной группы в ароматическое кольцо фенолов осуществляется различными методами – для этого применимы реакции Реймера-Тимана, Вильсмайера-Хаака, Гаттермана.
Взаимодействие фенола с хлороформом в щелочной среде (реакция Реймера-Тимана) дает орто-гидроксибензальдегид (салициловый альдегид).
Электрофильной частицей в реакции выступает дихлоркарбен, который генерируется из хлороформа под действием щелочи. Промежуточно образующийся орто-(дихлорметил)фенол гидролизуется в ходе реакции до альдегида. По Реймеру-Тиману формилируется большинство С-замещенных фенолов, нафтолы и многоатомные фенолы, при этом формильная группа вступает всегда в орто-положение относительно гидроксила.
Для формилирования фенолов по Вильсмайеру-Хааку используют замещенные амиды муравьиной кислоты – N,N-диметилформамид и N-метилформанилид, которые в ходе реакции превращают в электрофильные иминиевые соли взаимодействием с хлорокисью фосфора, тионилхлоридом или фосгеном. Последние, хотя и являются слабыми электрофилами, атакуют ароматическое ядро, что приводит к соответствующим иммониевым солям, которые далее гидролизуются до альдегидов. Формильная группа вводится исключительно в пара-положение относительно гидроксильной группы.
Классическое формилирование по Гаттерману-Коху (СО и HCl), протекающее для бензола, нафталина и их гомологов, для фенолов неосуществимо. Однако сам Л. Гаттерман предложил модификацию метода, приемлемую для фенолов, в том числе и многоатомных, и нафтолов. При действии на фенол б/в HCN и газообразного хлороводорода (реакция Гаттермана) образуется пара-гидроксибензальдегид. В некоторых случаях вместо токсичного цианистого водорода используют цианид цинка. Природа электрофильной реагирующей частицы в этой реакции точно не определена.
Карбоксилирование (реакция Кольбе)
Нагревание фенолята натрия с диоксидом углерода при давлении в 5 атм приводит к образованию салицилата натрия. Интересно, что при использовании в качестве исходного соединения фенолята калия карбоксильная группа вступает в пара-положение бензольного кольца и образуется пара-гидроксибензоат калия. Электрофилом в реакции Кольбе выступает диоксид углерода, который атакует электроноизбыточные орто- или пара-положения фенолят-аниона. Предполагают, что если в реакционной смеси присутствуют ионы натрия, то за счет комплексообразования происходит стабилизация переходного состояния, ведущего к образованию салициловой кислоты.
Многоатомные фенолы реагируют с диоксидом углерода в более мягких условиях. Например, резорцин карбоксилируется уже при кипячении с раствором карбоната натрия.
Азосочетание
Фенолят-ионы взаимодействуют с солями арендиазония в слабощелочной среде с образованием производных азобензола. При этом азосочетание протекает преимущественно по пара-положению фенола, и только если пара-положение занято – диазосотавляющая атакует свободное орто-положение. Фенолы, содержащие сильные электроноакцепторы (например, нитрофенолы) не вступают в эту реакцию. (См. главу Диазосоединения)
Нитрозирование
Катион нитрозония, генерируемый из нитрита натрия и соляной или уксусной кислот селективно атакует пара-положение фенола. Получающийся пара-нитрозофенол существует виде таутомерной смеси с монооксимом п-бензохинона, причем содержание последнего превалирует.
Конденсация с формальдегидом
Большое промышленное значение имеет конденсация фенола с формальдегидом, в результате которой получают фенолоформальдегидные смолы (бакелит), которое было разработано Бакелундом. Реакция катализируется кислотами или основаниями и по механизму напоминает одновременно альдольно-кротоновую конденсацию альдегидов и электрофильное замещение в аренах. Так, образующийся из формальдегида при действии кислоты карбокатион атакует орто- или пара-положения молекулы фенола. Получающийся гидроксиметилфенол дегидратируется, давая гидроксифенилметильный карбокатион, который далее реагирует с молекулой фенола или гидроксиметилфенола. Дальнейшая поликонденсация приводит к образованию разветвленного полимера бакелита.
Читайте также:

