Фактор некроза опухоли альфа при ревматоидном артрите
Воспаление суставов: причины артрита
Наиболее часто встречаемым хроническим воспалительным заболеванием является ревматоидный артрит, которым страдают около 70 млн. человек.
Ревматоидный артрит (РА) характеризуется болями в пораженных суставах и постепенным нарушением двигательной функции, что приводит к ухудшению качества жизни пациентов, наступлению стойкой утраты трудоспособности.
Как показывают статистические данные, почти половина заболевших ревматоидным артритом в течение 5 лет становятся инвалидами, а каждый десятый пациент получает инвалидность спустя 1,5 – 2 года от начала заболевания.
Протекание в организме хронического воспалительного процесса повышает вероятность возникновения и других патологий, которые называют сопутствующими (снижение иммунитета, остеопороз, атеросклероз и др.).
Помимо этого лечение РА нередко приводит к различным осложнениям со стороны желудочно-кишечного тракта, почек, свертывающей системы крови.

У 65% пациентов с РА болезнь медленно прогрессирует, течение заболевания характеризуется неполными ремиссиями и частыми обострениями.
У 25% больных РА имеет место злокачественное течение, при котором возникают множественные поражения суставного аппарата, нарушаются функции внутренних органов.
РА имеет сходный прогноз с лимфогранулематозом, инсулинозависимым сахарным диабетом. У пациентов с РА продолжительность жизни сокращается на 7 – 10 лет. Все это позволяет причислять РА к тяжелым хроническим заболеваниям.
В развитии РА играют роль множество факторов, что дает полное основание относить данную патологию к группе мультифакторальных болезней. В основе патологического механизма возникновения РА лежит обусловленное действием иммунной системы генерализированное воспаление (аутоиммунное воспаление).
Это воспаление затрагивает многие внутренние органы, но в большей степени синовиальные оболочки суставов . Воспалительный процесс приводит к разрастанию (гиперплазии) синовиальной ткани, разрушению гиалинового хряща и лежащего под ним субхондрального слоя кости.
Сегодня в патогенезе РА ученые отводят значительную роль действию фактора некроза опухоли - альфа (ФНО-α). Данный фактор представляет собой особый белок, название которого произошло от способности данного вещества вызывать геморрагический некроз (омертвение) опухолей.
Ранее считалось, что ФНО-α выполняет в организме человека только одну функции – защищает от возникновения опухолей . По мере изучения белка было обнаружено, что ФНО способен не только вызывать некроз клеток опухолей, но и выполнять другие биологические функции.
Однократное инъекционное введение препарата ФНО вызывало у подопытных животных повышение температуры тела, которое проходило с выраженным ознобом, диареей, снижением аппетита.
Если же ФНО-α вводился курсом, то у подобных животных развивалась кахексия (крайнее истощение организма).
В настоящее время установлено, что ФНО-α играет важную роль во многих физиологических и патологических процессах, протекающих в организме, в том числе в патологическом механизме развития РА. ФНО-α задействован в развитии воспаления, а также обладает иммуномодулирующим действием.
Как показали результаты исследований, ФНО-α:
- участвует в проявлении признаков воспаления (лихорадка, боль, потеря костной и мышечной массы);
- определяет миграцию белых клеток крови (лейкоцитов) в полость пораженного сустава за счет индуцирования экспрессии молекул адгезии; оказывает стимулирующее воздействие на синтез медиаторов воспаления (фактор активации тромбоцитов, простагландинов, желатиназы, коллагеназы, стромелизина), которые вызывают повреждения гиалинового хряща и кости;
- оказывает стимулирующее действие на рост новых кровеносных сосудов в зоне воспаления (неоангиогенез), а также способствует пролиферации (размножению) фибробластов, что приводит к разрастанию синовиальной оболочки и образованию ревматоидного паннуса (выросты синовиальной оболочки в подлежащие ткани – костную, хрящевую).
Неоднократные клинические исследования позволили установить, что в сыворотке крови, синовиальной жидкости и синовиальных тканях пациентов с РА отмечается повышенное содержание ФНО-α.
При этом уровень ФНО-α в сыворотке крови коррелирует (взаимосвязан) с активностью воспалительного процесса , определяемой по клиническим признакам.
Учитывая все сказанное выше, можно предположить, что основным медиатором воспаления при РА является ФНО-α и ему же принадлежит ведущая роль в патогенезе заболевания.
За последние десятилетия в терапии РА были достигнуты хорошие результаты. Сегодня в широкую клиническую практику внедрены ингибиторы ФНО-α – препараты, которые подавляют активность ФНО.
Фактор некроза опухоли-альфа – определение концентрации в крови белка, продуцируемого иммунокомпетентными клетками и участвующего в комплексной регуляции воспалительных и иммунных процессов в организме человека.
Tumor necrosis factor-alpha, TNF-α, cachectin.
Пг/мл (пикограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Фактор некроза опухоли относится к классу цитокинов – белков, которые вырабатываются различными клетками иммунной системы для регуляции комплекса межклеточных взаимодействий при иммунном ответе. Название белка отражает лишь один из его биологических эффектов, обнаруженный в опытах на мышах, после которых и был открыт ФНО. Однако роль этого цитокина не ограничивается разрушением опухолевых клеток - помимо этого, ФНО принимает ключевое участие в регуляции иммунного ответа.
Основные клетки, продуцирующие фактор некроза опухоли, это активированные моноциты и макрофаги. Также ФНО может выделяться гранулоцитами периферической крови, естественными киллерами и Т-лимфоцитами. Главными стимуляторами секреции фактора некроза опухоли являются вирусы, микроорганизмы и продукты их метаболизма (например, липополисахариды грамотрицательных бактерий). Кроме того, роль стимуляторов могут выполнять и другие цитокины, вырабатываемые иммунными клетками: интерлейкины, колониестимулирующие факторы, интерфероны.
Основные биологические эффекты фактора некроза опухоли:
цитотоксическая активность – ФНО обуславливает геморрагический некроз опухолевых клеток, а также вызывает гибель клеток, пораженных вирусами;
оказывает иммуномодулирующее действие - активирует гранулоциты, макрофаги, гепатоциты (усиливается продукция белков острой фазы), стимулирует синтез других провоспалительных цитокинов;
стимулирует пролиферацию и дифференцировку нейтрофилов, Т- и В-лимфоцитов, усиливает поступление их из костного мозга в кровь и миграцию в очаг воспаления.
Выраженность биологических эффектов ФНО зависит от его концентрации. Так, в низких концентрациях он действует преимущественно в месте выработки, опосредуя локальные иммуновоспалительные процессы. Однако в высоких концентрациях он может приводить к гиперактивации цитокинов и потере контроля организмом за воспалением и иммунными реакциями.
Фактор некроза опухоли играет основную роль в развитии некоторых критических состояний. В начальных стадиях развития синдрома системной воспалительной реакции (SIRS) и сепсиса происходит увеличение концентрации ФНО в крови (под влиянием бактериальных эндотоксинов). В настоящее время считается, что высокие концентрации ФНО на фоне тяжелой инфекции и сепсиса приводят к развитию септического шока. ФНО способен вмешиваться в процессы обмена жиров и углеводов и вызывать у пациентов с опухолями и длительными инфекционными заболеваниями истощение и кахексию.
Помимо цитотоксической активности против опухолевых и инфицированных клеток, ФНО принимает участие и в реакциях отторжения трансплантированных органов и тканей. Повышение концентрации цитокина в крови в ранние сроки после трансплантации может косвенно говорить о начале реакции отторжения. ФНО участвует в патогенезе многих аутоиммунных заболеваний, в том числе ревматоидного артрита.
Это далеко не исчерпывающий список биологических эффектов ФНО. Однако перечисленные эффекты фактора некроза опухоли определяют основные диагностические потребности исследования его концентрации.
Для чего используется исследование?
- Для определения концентрации фактора некроза опухоли в крови.
Когда назначается исследование?
- Определение концентрации ФНО не является рутинным исследованием. Учитывая, что данный цитокин принимает участие в широком спектре иммунных процессов, необходимость его исследования определяется конкретной клинической ситуацией. Нередко уровень ФНО исследуется в комплексе с другими цитокинами для диагностики нарушений иммунного статуса. У пациентов с тяжелыми инфекциями и сепсисом уровень цитокина коррелирует с тяжестью и исходом заболевания. Иногда целесообразно определять уровень ФНО при терапии лекарственными препаратами класса ингибиторов фактора некроза опухоли.
Что означают результаты?
Кто назначает исследование?
Ревматолог, онколог, трансплантолог, терапевт, врач общей практики.
Литература
Henry's Clinical Diagnosis and Management by Laboratory Methods, 23e by Richard A. McPherson MD MSc (Author), Matthew R. Pincus MD PhD (Author). St. Louis, Missouri : Elsevier, 2016. Page 974.
A Manual of Laboratory and Diagnostic Tests, 9th Edition, by Frances Fischbach, Marshall B. Dunning III. Wolters Kluwer Health, 2015. Page 644.
Клиническая лабораторная диагностика: национальное руководство: в 2 т. – T. I / Под ред. В. В. Долгова, В. В. Меньшикова. – М.: ГЭОТАР-Медиа, 2012. С. 236-237.
Что такое фактор некроза опухоли (ФНО)?

Гликопротеин фактор некроза опухоли
ФНО (кахексин) — гликопротеин, регулирующий иммунные и воспалительные явления. Исследование на уровень ФНО позволяет выявить наличие заболеваний, осложнений, нарушений иммунного статуса, злокачественных образований. Концентрация гликопротеина является основополагающим фактором в определении тактики лечения при аутоиммунных заболеваниях, полиорганной недостаточности, онкологических патологиях.
ФНО впервые был обнаружен в качестве вещества, обладающего способностью вызывать некроз опухолевых клеток, откуда и произошло название. Кахексин активирует процесс уничтожения раковых клеток с помощью образования окиси азота и воздействия на мембранный кислород в клетке. Впоследствии было обнаружено, что ФНО имеет множество функций:
- является ключевым регулятором всех воспалительных процессов;
- при необходимости ускоряет либо приостанавливает процессы пролиферации В- и Т-лимфоцитов;
- способствует активации белков острой фазы, выработке факторов роста нервов;
- увеличивает экспрессию ряда антигенов, участвует в активации продукции антител;
- стимулирует биосинтез факторов свёртывания;
- разрушает вредоносные клетки: опухолевые, поражённые паразитами и вирусами;
- способствует расщеплению жировой ткани;
- провоцирует усиление синтеза некоторых интерлейкинов;
- участвует в процессе отторжения трансплантированных тканей.
Норма для ФНО

Референтные интервалы зависят от лаборатории
Нормативные значения составляют 0 — 50 пг/л, но многие лаборатории исчисляют уровень ФНО в миллилитрах, тогда референсные значения равны 0 — 8,2 пг/мл.
При показателях в пределах нормы или небольшом повышении ФНО способствует резистентности организма к различным заболеваниям, стимулирует иммунитет, защищает от ионизирующей радиации, препятствует развитию злокачественных опухолей.
Но в высоких дозах провоцирует обратный эффект, патологии приобретают более тяжёлые формы, наиболее опасная из них — шоковый синдром. Также способствует развитию иных критических состояний, вызывает при хронических заболеваниях кахексию, при рассеянном склерозе провоцирует апоптоз нейронов и клеточную деградацию. У пациентов с малярией кахексин в большой концентрации развивает неврологический синдром, при артритах вызывает деформацию суставов, при сахарном диабете стимулирует уничтожение клеток, продуцирующих инсулин.
Повышенный уровень ФНО (причины)

Уровень показателя может возрастать при псориазе
Факторами, вызывающими высокую концентрацию ФНО являются:
- тяжёлые инфекционные заболевания (сепсис, гепатит С);
- нарушения в системе свёртывания (синдром ДВС);
- менингит бактериального происхождения;
- гнойные процессы поджелудочной железы;
- сердечная недостаточность при ишемической болезни;
- хроническая патология лёгких;
- аутоиммунные патологии (СКВ, ревматоидный артрит);
- обширные ожоги;
- болезнь Крона;
- аллергические реакции;
- онкологические заболевания;
- шоковые состояния;
- псориаз, коллагенозы;
- коронарный атеросклероз;
- патология беременности;
- отторжение трансплантата.
Пониженный уровень ФНО (причины)

Снижение показателя может иметь место при новообразовании желудка
Низкая концентрация указывает на причины:
- положительная динамика заболевания, эффективная терапия;
- истощение иммунной системы на фоне затяжных инфекционных заболеваний;
- иммунодефицит, в том числе СПИД;
- новообразования в желудке;
- тяжёлый атопический синдром;
- мегалобластная анемия.
На понижение уровня ФНО влияет приём кортикостероидов, иммунодепрессантов, цитостатических средств.
Показания к анализу на ФНО

Уровень показателя необходим при определении лечебной тактики
Исследование на уровень кахексина назначается:
- В качестве показателя состояния иммунной системы при тяжёлом течении заболеваний.
- Для определения стадии и формы различных болезней.
- При онкологических заболеваниях.
- Для выявления скрытых патологических процессов.
- При выборе тактики лечения ряда заболеваний.
- При терапии ингибиторами ФНО, препаратами на основе ФНО.
Подготовка к исследованию

Подготовка к анализу обеспечивает истинные результаты
Перед сдачей анализа необходимо учесть следующие правила:
- За сутки до исследования следует исключить алкоголь, курение, чрезмерные физические и эмоциональные нагрузки.
- Последний приём пищи должен быть завершен за 12 часов до анализа.
- В день сдачи образца крови не употреблять чай, кофе либо иные напитки. Можно пить чистую воду.
- Приём лекарств рекомендуется отменить. Если это сделать невозможно, необходимо предоставить перечень медицинских препаратов лечащему врачу.
- Все иные исследования (УЗИ, рентген) должны проводиться после анализа.
- Сдавать кровь следует утром.
ФНО в диагностике и лечении онкологических заболеваний

Препараты ФНО заняли прочное место в лечении онкопатологии
Уровень ФНО значительно возрастает при злокачественных образованиях, так как кахексин активно принимает участие в иммунном противоопухолевом ответе, вызывает лизис онкологических клеток и геморрагический некроз опухолей. Примечательно, что действие ФНО направлено именно на злокачественные клетки, не затрагивая здоровые. Эти свойства подвигли учёных к созданию противоопухолевых препаратов на основе ФНО.
Первые опыты дали положительный результат в борьбе с онкологическими новообразованиями, но сопровождались множеством побочных эффектов, так как ФНО обладают высокой токсичностью. Тогда препараты начали вводить в зону опухоли, чтобы оказывать воздействие локально. Вместе с этим во всём мире продолжались разработки менее токсичного лекарственного средства.

Препарат на основе ФНО
В Европе был создан рекомбинантный препарат ФНО под названием Беромун, обладающий способностью повреждать сосуды злокачественных опухолей. В США исследуют различные комбинации ФНО с иными препаратами, а также применяют коллоидное золото, связанное с ФНО. В России в 1990 году был создан препарат на основе ФНО и Тимозина альфа 1, получивший название Рефнот.
Токсичность современных препаратов снижена в 100 раз, их можно применять внутримышечно и подкожно, вследствие чего достигается эффект воздействия, как на саму опухоль, так и на отдалённые метастазы. ФНО в новом виде применяют в качестве самостоятельного лечения и наряду с лучевой и химиотерапией. Преимуществом лекарств с ФНО является их избирательное воздействие на раковые клетки. Также препараты способствуют более лёгкой переносимости облучения и химиотерапии, помогают снизить интоксикацию, служат профилактическим средством против инфекционных осложнений при терапии. В целом положительный эффект достигнут примерно в 60% случаев.
- Программа обследования для офисных сотрудников
- Обследование домашнего персонала
- Оценка риска развития заболеваний сердечно-сосудистой системы
- Диагностика антифосфолипидного синдрома (АФС)
- Оценка функции печени
- Диагностика состояния почек и мочеполовой системы
- Диагностика состояния желудочно-кишечного тракта
- Диагностика заболеваний соединительной ткани
- Диагностика сахарного диабета
- Диагностика анемий
- Онкология
- Диагностика и контроль терапии остеопороза
- Биохимия крови
- Диагностика состояния щитовидной железы
- Госпитальные профили
- Здоров ты – здорова страна
- Гинекология, репродукция
- Здоровый ребёнок: для детей от 0 до 14 лет
- Инфекции, передаваемые половым путём (ИППП)
- Проблемы веса
- VIP-обследования
- Болезни органов дыхания
- Аллергия
- Определение запасов микроэлементов в организме
- Красота
- Витамины
- Диеты
- Лабораторные исследования перед диетой
- Спортивные профили
- Гематологические исследования
- Глюкоза и метаболиты углеводного обмена
- Белки и аминокислоты
- Желчные пигменты и кислоты
- Липиды
- Ферменты
- Маркеры функции почек
- Неорганические вещества/электролиты:
- Витамины
- Белки, участвующие в обмене железа
- Кардиоспецифичные белки
- Маркёры воспаления
- Маркёры метаболизма костной ткани и остеопороза
- Определение лекарственных препаратов и психоактивных веществ
- Биогенные амины
- Метаболический синдром
- Специфические белки
- Комплексные иммунологические исследования
- Лимфоциты, субпопуляции
- Оценка фагоцитоза
- Иммуноглобулины
- Компоненты комплемента
- Регуляторы и медиаторы иммунитета
- Интерфероновый статус, оценка чувствительности к иммунотерапевтическим препаратам:
- Системные заболевания соединительной ткани
- Ревматоидный артрит, поражения суставов
- Антифосфолипидный синдром
- Васкулиты и поражения почек
- Аутоиммунные поражения желудочно-кишечного тракта. Целиакия
- Аутоиммунные поражения печени
- Неврологические аутоиммунные заболевания
- Аутоиммунные эндокринопатии
- Аутоиммунные заболевания кожи
- Заболевания легких и сердца
- Иммунная тромбоцитопения
- Клинический анализ мочи
- Биохимический анализ мочи
- Светооптическое исследование сперматозоидов
- Электронно-микроскопическое исследование спермы
- Антиспермальные антитела
- Генетические VIP-профили
- Образ жизни и генетические факторы
- Репродуктивное здоровье
- Иммуногенетика
- Резус-фактор
- Система свертывания крови
- Болезни сердца и сосудов
- Болезни желудочно-кишечного тракта
- Болезни центральной нервной системы
- Онкологические заболевания
- Нарушения обмена веществ
- Описание результатов генетических исследований врачом-генетиком
- Фармакогенетика
- Система детоксикации ксенобиотиков и канцерогенов
- Определение пола плода
- Резус-фактор плода
- Обследование новорождённых для выявления наследственных болезней обмена веществ
- Дополнительные исследования (после проведения скрининга и консультации специалиста)
- Исследование качества воды
- Исследование качества почвы
- Общая оценка естественной микрофлоры организма
- Исследование микробиоценоза урогенитального тракта (ИНБИОФЛОР)
- Фемофлор: профили исследований дисбиотических состояний урогенитального тракта у женщин
- Специфическая оценка естественной микрофлоры организма
- Кровь
- Моча
- Кал
- Спермограмма
- Гастропанель
- УЗИ
- Полезно знать
Литература
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
- 5041
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




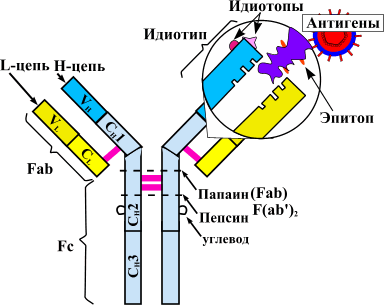
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
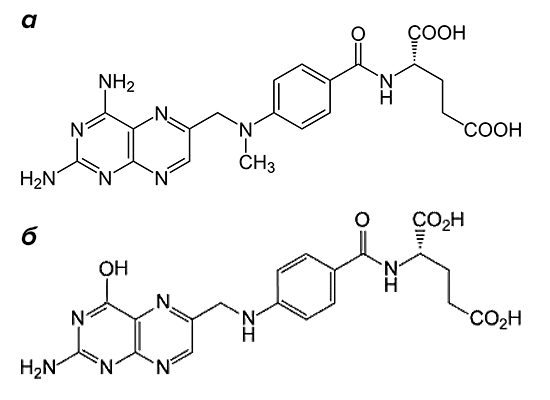
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
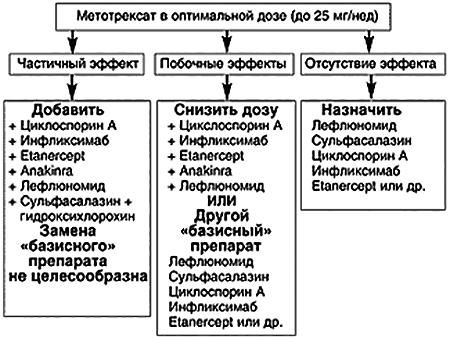
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
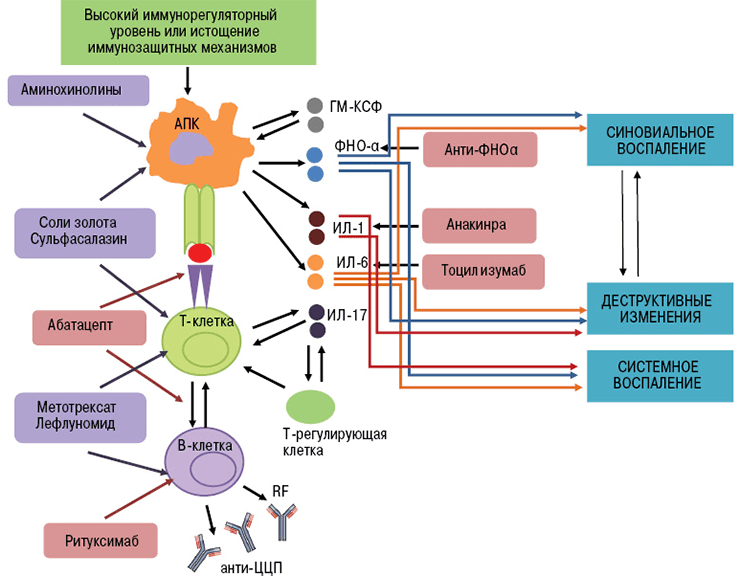
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
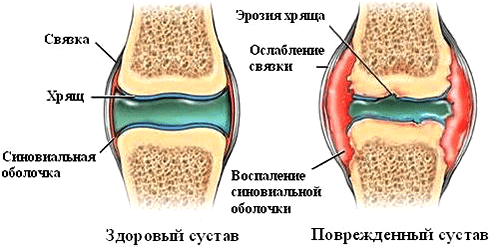
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
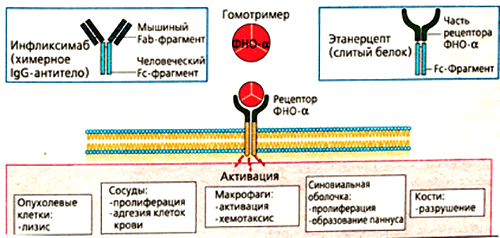
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
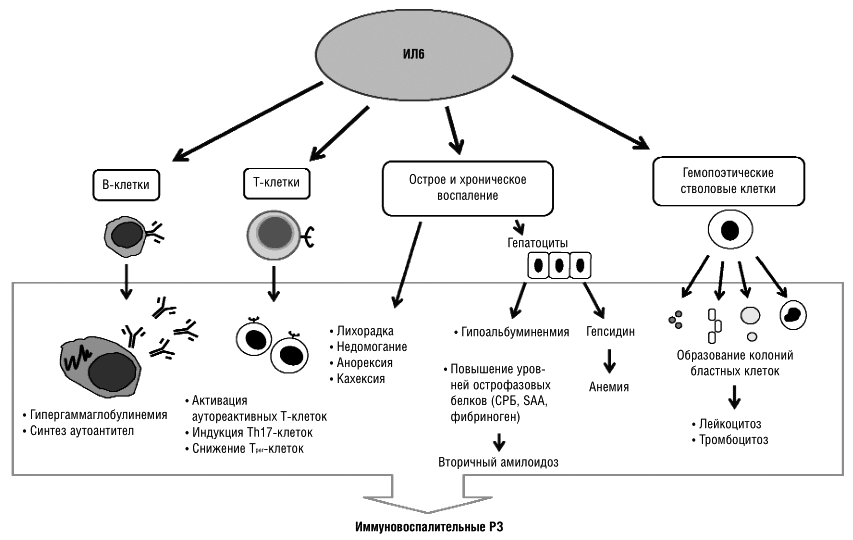
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
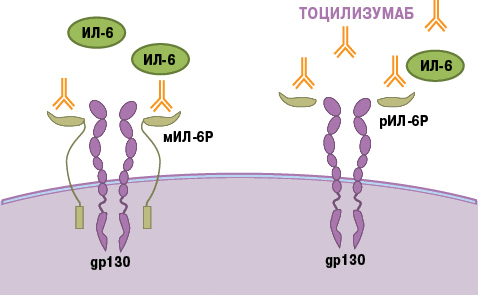
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
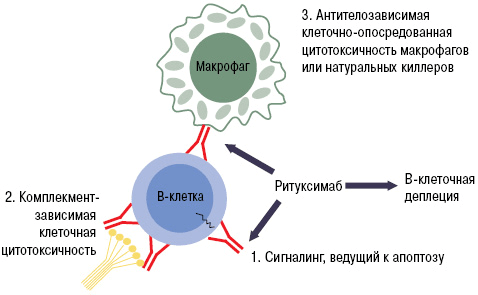
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
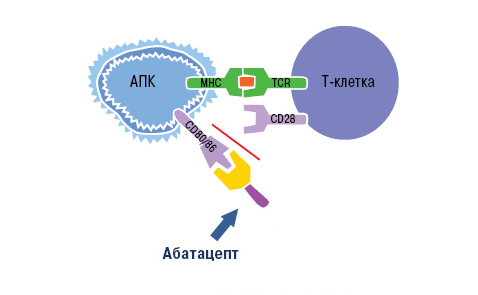
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:




