Эмболизация простатических артерий при доброкачественной гиперплазии предстательной железы
Аденома простаты – доброкачественная опухоль, которая развивается у мужчин после пятидесяти лет. К восьмидесяти годам заболевание встречается у 85% пациентов. Для лечения аденомы простаты все условия созданы в Юсуповской больнице:
- Комфортные палаты;
- Обеспечение пациентов диетическим качественным питанием и индивидуальными средствами личной гигиены;
- Современная аппаратура ведущих мировых производителей;
- Использование инновационных методов лечения, к которым относится эмболизация сосудов при аденоме простаты.
Эмболизация артерий простаты – современный способ хирургического лечения аденомы простаты с применением эндоваскулярной методики под постоянным рентгеноскопическим контролем. Вмешательство является альтернативной удалению аденомы простаты. Выполняется только в специализированных клиниках. Преимуществом операции является то, что эмболизация артерий простаты при аденоме производится амбулаторно и не требует госпитализации. Пациент может оставаться в клинике до утра следующего дня. Все сложные процедуры пациенты Юсуповской больницы могут получить в клиниках-партнёрах.

Показания и противопоказания к эмболизации сосудов простаты
Эмболизация аденомы простаты (отзывы об операции положительные) выполняется при наличии следующих показаний:
- Наличие новообразования объёмом больше 50 см 3 ;
- Отсутствие или недостаточная эффективность медикаментозной терапии;
- Обструктивный тип мочеиспускания по данным урофлоуметрии.
Вмешательство не выполняют пациентам с непереносимостью йодистых препаратов, коагулопатией, выраженным снижением азотовыделительной функции почек (если уровень креатинина выше 300 мкмоль/л), страдающим раком простаты.
Вмешательство не выполняют при аномалиях развития и окклюзионных поражениях подвздошных сосудов, наличии флотирующих тромбов в системе вен нижних конечностей. Врачи Юсуповской больницы проводят обследование пациентов с помощью новейших аппаратов США и европейских стран, определяют наличие противопоказаний, сопутствующей патологии, что позволяет свести риск развития осложнений к минимуму.
Преимущества и эффективность метода
Эмболизация аденомы простаты может проводиться даже пожилым людям с заболеваниями сердечно-сосудистой системы и сахарным диабетом. Метод является миниинвазивным. После него не развиваются такие тяжёлые осложнения, как открытое оперативное вмешательство. Во время реабилитации отсутствует воспаление и болевой синдром.
Процедура занимает минимум времени и не вызывает дискомфорта. После неё пациенты быстро возвращаются к привычному для них способу жизни. Отсутствует необходимость в применении в послеоперационном приёме антибиотиков, выполнении перевязок, получении физиотерапевтических процедур.
Положительная динамика наблюдается в течение семи дней после эмболизации артерий простаты. С помощью компьютерной томографии с контрастом рентгенологи выявляют значительное снижение размеров опухоли. Пациенты отмечают постепенное улучшение мочеиспускания и эрекции, что является отличным результатом.
На эффективность оперативного вмешательства могут повлиять следующие факторы:
- Возраст пациента;
- Длительность заболевания;
- Степень нарушения мочеиспускания;
- Наличие инфекции в мочевых путях, сопутствующих заболеваний.
По этой причине перед операцией необходимо получить консультацию уролога. Врач собирает подробную информацию о состоянии здоровья пациента, выбирает оптимальный метод лечения, оценивает показания и противопоказания и даёт ответы на любые вопросы касательно предстоящего оперативного вмешательства. Цены эмболизации аденомы простаты в Москве варьируют от 17000 до 150000 рублей.
Методика выполнения эмболизации аденомы простаты
Эмболизация артерий аденомы простаты выполняется эндоваскулярными хирургами, прошедшими специальную подготовку в ведущих европейских клиниках и имеющими большой опыт работы. Вмешательство проводится под местной анестезией. Пациент не чувствует боли, всё время операции находится в сознании.
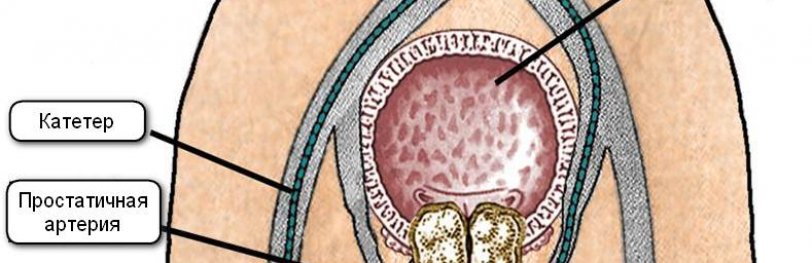
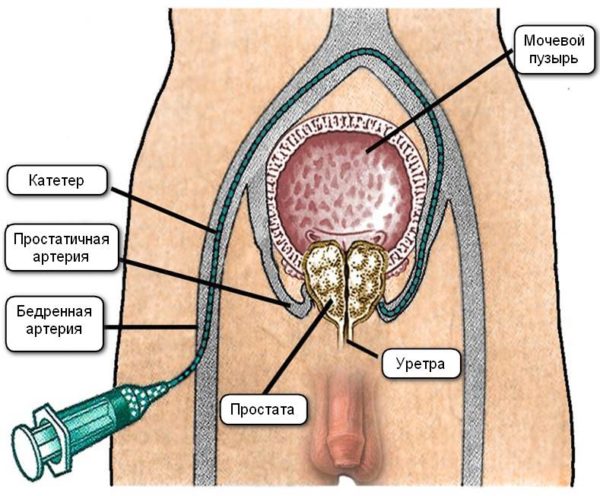
После пункции бедренной или лучевой артерии под рентгенологическим контролем по катетеру вводят специальное эмболизирующее вещество в артерию простаты. Его микрочастицы перекрывают просвет сосуда и останавливают приток крови к предстательной железе. Лишившись кислорода и питательных веществ, опухоль уменьшается в размере. Поскольку блокируется кровоток только по артериям, снабжающим кровью узлы аденомы, остальная часть предстательной железы функционирует нормально. Со временем у пациента восстанавливается функция мочеиспускания, потенция.
Операцию выполняют в рентгеноперационной, снабжённой полным комплексом современного оборудования. Пациент ложится на стерильный операционный стол. После этого область прокола артерии обрабатывают современным антисептическим средством. Далее устанавливают капельницу для того, чтобы избежать осложнений при оперативном вмешательстве. Пациенту вводят седативные препараты, которые снимают нервное напряжение. К указательному пальцу пациента подключают пульсоксиметр, благодаря которому хирург следит за объёмом кислорода в крови и частотой пульса.
Из-за поступления в кровь контрастирующего препарата пациент может испытывать дискомфорт, у него может повышаться температура тела. Для устранения боли хирург проводит анестезию места ввода катетера эффективным и совершенно безопасным анестетиком. После этого вводит в артерию иглу оптимальной длины и толщины. Это необходимо для введения проводника – металлической струны с тонким наконечником. После его введения иглу извлекают, в струну вставляют интродьюсер. Это позволяет сохранить целостность артерии и не допускать обширной кровопотери. В интродьюсер плавно вводится катетер. Процесс контролируют с помощью рентгенографии. Благодаря этому хирург имеет возможность видеть артерии, через которые поступает кровь в аденому простаты. Для усиления изображения используют контрастирующее вещество.
В артерии, питающие кровью узлы аденомы простаты, через шприц вводят эмболизирующие частицы, размер которых не превышает 0,5 мм. После этого врач в течение пятнадцати минут примерно надавливает на область выполнения операции, что позволяет не допускать скопления крови. Затем на область операции накладывают давящую повязку. Её снимают через 24 часа. В течение суток после хирургического вмешательства пациенту рекомендуют не вставать с постели и соблюдать покой.
Осложнения эмболизации аденомы простаты
Эмболизация сосудов при аденоме простаты является совершенно безопасным малоинвазивным вмешательством. У 5% пациентов в месте введения катетера может развиться гематома. Она не требует лечения и рассасывается самостоятельно.
Иногда после операции кратковременно возникают расстройства мочеиспускания. Симптомы дизурии врачи ликвидируют с помощью катетеризации мочевого пузыря. Моча начинает выделяться через 1-2 дня.
Чтобы пройти осмотр уролога, определить наличие показаний для лечения аденомы простаты с помощью хирургического вмешательства, звоните в контакт центр Юсуповской больницы. Специалисты запишут вас на приём в удобное вам время, расскажут, сколько стоит эмболизация аденомы простаты. Урологи Юсуповской больницы индивидуально подходят к выбору метода лечения аденомы предстательной железы.
Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) — одно из самых распространенных урологических заболеваний мужчин пожилого и старческого возраста. Более 50 % мужчин в возрасте 60 лет и старше страдают ДГПЖ. Выбор метода лечения ДГПЖ зависит от большого количества факторов, в том числе от размеров простаты и наличия сопутствующей соматической патологии. Противопоказаниями к традиционным хирургическим методам лечения ДГПЖ являются тяжелая сопутствующая патология, высокий анестезиологический риск, некорригируемые коагулопатии. Для лечения такой группы пациентов применяют различные малоинвазивные методики. Преимущества малоинвазивных методов заключаются в отсутствии необходимости общей анестезии, минимальном риске послеоперационных осложнений, снижении длительности пребывания в стационаре. К таким методам относится эмболизация простатических артерий (ЭПА). Принцип метода основан на снижении артериального притока к предстательной железе, что приводит к достаточно быстрому уменьшению ее объема и снижению выраженности симптомов нижних мочевых путей. В условиях рентгеноперационной выполняется пункция общей бедренной артерии, проведение специального микрокатетера до артерий предстательной железы и производится их селективная эмболизация микрочастицами диаметром 250–500 мкм.
Показаниями к ЭПА являются ДГПЖ больших (>80 см3 ) размеров, наличие тяжелой сопутствующей патологии, высокий анестезиологический риск, отсутствие эффекта консервативной терапии или отказ пациента от проведения традиционных хирургических вмешательств.
К противопоказаниям относятся непереносимость рентгеноконтрастных веществ, наличие острых инфекционно-воспалительных заболеваний любой локализации, состояние после перенесенного острого инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 месяцев, наличие флотирующих тромбов в бассейне вен нижних конечностей. Основное препятствие для выполнения ЭПА представляют окклюзионно-стенотические поражения и аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
Цель исследования — оценить эффективность и безопасность ЭПА при лечении ДГПЖ.
Материалы и методы. Проанализированы результаты лечения 13 пациентов, которым была выполнена ЭПА при ДГПЖ. Средний возраст пациентов составил 73 года (от 62 до 83 лет). Средний объем предстательной железы — 86 см3 (от 67 до 105 см3 ). Шести пациентам была ранее выполнена троакарная цистостомия по поводу острой задержки мочеиспускания. Эффективность лечения оценивали по динамике следующих показателей:
- восстановление самостоятельного мочеиспускания;
- IPSS (Международная шкала оценки простатических симптомов);
- Qmax (урофлоуметрия);
- объем простаты и остаточной мочи (УЗИ).
Безопасность оценивали по частоте развития и тяжести послеоперационных осложнений.
Результаты. Все пациенты отмечали положительную динамику при оценке качества мочеиспускания. Эпицистостомический дренаж был удален всем пациентам, ранее перенесшим троакарную цистостомию, в течение 3 суток после ЭПА. У 1 (8 %) пациента эффект ЭПА оказался недостаточным (самостоятельное мочеиспускание восстановилось, однако сохранялось большое количество остаточной мочи), в связи с чем потребовалась последующая ТУР предстательной железы. У 1 (8 %) пациента развилась ишемия головки полового члена с поверхностным некрозом тканей. На фоне консервативной терапии осложнение полностью разрешилось.
Простатические симптомы по Международной шкале снизились после ЭПА с 25,3 до 10. Значение Qmax повысилось с 8 до 15 мл/с. Среднее значение объема предстательной железы уменьшилось с 86 до 56 см3 . Наиболее выраженный эффект отмечен в отношении объема остаточной мочи.
В раннем послеоперационном периоде у 2 (15 %) пациентов отмечено обострение хронической инфекции мочевых путей. Трое (23 %) пациентов отмечали умеренно выраженный болевой синдром. У одного пациента развилась транзиторная макрогематурия. Все осложнения носили кратковременный характер и разрешились на фоне консервативного лечения.
Заключение. ЭПА является эффективным малоинвазивным методом лечения ДГПЖ и может рассматриваться как самостоятельная методика, а также применяться с целью уменьшения объема простаты в рамках подготовки к последующей ТУР или в качестве этапа лечения с последующей консервативной терапией. ЭПА расширяет арсенал врача при выборе способа терапии ДГПЖ и улучшает результаты лечения заболевания.
С возрастом у каждого представителя сильного пола сильно повышается риск аденомы (доброкачественной гиперплазии) простаты. На данный момент есть очень много методик и принципов терапии этой патологии.
Пока болезнь еще не сильно развилась, полезно медикаментозное лечение. Если же аденома достигла значительных размеров, требуется прибегнуть к хирургическому вмешательству.
Лекарственная терапия хоть и представляет собой наилучшую методику избавления от аденомы простаты, но примерно в каждом десятом случае она оказывается бессильна. Тогда делают операцию – проводят аденомэктомию, а также трансуретральную резекцию простаты. Эти способы дают прекрасные результаты, однако есть и противопоказания к ним в виде серьезных патологий некоторых органов. Например, сердца и щитовидной железы.
Благодаря разработке и началу использования ЭАП (эмболизации артерий простаты) данное обстоятельство оказалось исправлено. При ЭАП в сосуды органа внедряют вещества, чтобы те перекрывали там просветы.
При помощи ЭАП в простате перекрывают артерии, если та начинает разрастаться хотя бы до 60 кубических сантиметров. Еще методика применяется, если мочеиспускание сильно затруднено.
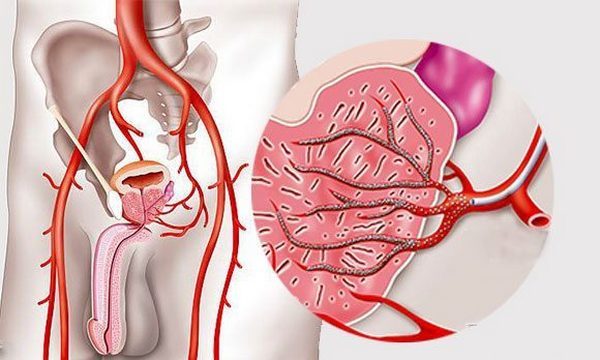
В самый первый раз ЭАП использовали в Бразилии в 2008 году. Тогда с его помощью успеха добивались в 91 случаях из 100. В 2009 году методику использовали и португальцы. На территории РФ она получила широкую популярность лишь совсем недавно благодаря Георгию Киму и других авторам, вместе опубликовавшим доклад об эффективности методики.
Ее используют для пациентов, для которых медикаментозная терапия не принесла положительных результатов, либо для тех людей, у которых простата достигла объема более 60 кубических сантиметров, а с мочеиспусканием появляются трудности.
Обычно это плановая процедура. Благодаря этому можно без излишней торопливости обговорить с врачами все, что необходимо, дополнительно обследуясь и готовясь к операции.
Интересно! Рентгенэндоваскулярная ЭАП представляет собой новейшую методику терапии ДГПЖ.
Традиционная терапия
В обычное хирургическое вмешательство входят эндоскопическая ТУР и открытая операция с разрезом в мочевом пузыре, которую делают, если простата сильно выросла. У подобных методик есть слабые стороны. Например:
- сильная травма, получаемая в процессе операции;
- большая вероятность опасностей из-за анестезии;
- возможные осложнения;
- падение либидо;
- множество противопоказаний.
Важно! Среди больных есть и те, при чьем лечении бесполезна медикаментозная методика, а хирургическое вмешательство навредит еще больше.
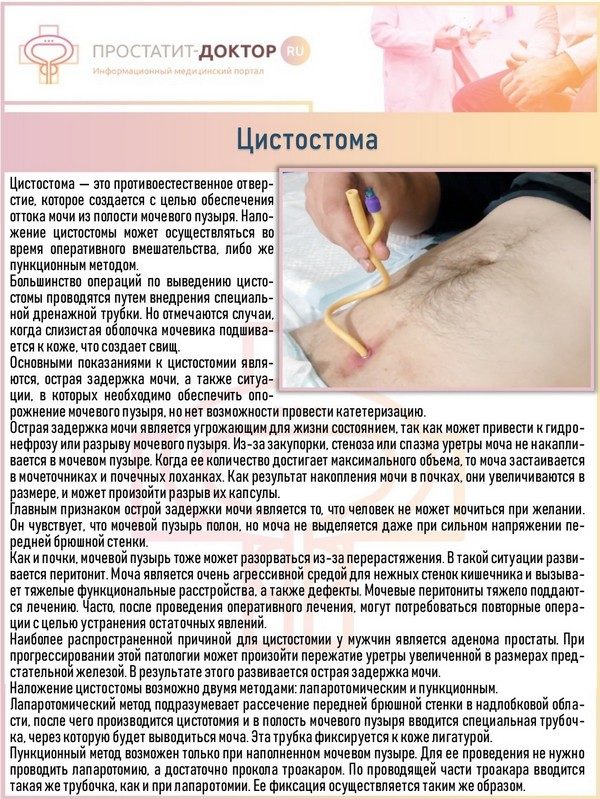
Последствия
В большей части случаев первым симптомом аденомы простаты является проблема с опорожнением мочевого пузыря. То есть струя становится слабее, из-за чего процесс становится дольше, порой достигая пяти минут, причем в день такое случается десяток-полтора раз. Также зараз из организма редко выходит более 50 мл мочи. Больной бывает вынужден ходить в туалет и ночью по 5-6 раз. Через некоторый срок аденома прогрессирует еще больше, позывы становятся еще чаще, и мужчина не может надолго выйти из помещения, где есть туалет, нормально посмотреть желаемый фильм, отправиться отдохнуть хотя бы день-другой.

На фоне обострения хронического простатита, весьма распространенного у активно живущих мужчин, аденома и вовсе становится кошмарной болезнью. В таком случае наблюдаются симптомы не только аденомы, но и обострения простатита.
Более того, аденома портит эректильную функцию. Подобное превращает жизнь любого представителя сильного пола в ад. Семейное счастье тоже может пострадать. Все это создает огромный дискомфорт, деморализуя и психологически угнетая больного.
Предназначение ЭАП
Этой методикой лечат только симптомную аденому простаты. Врачи перед использованием ЭАП обязаны убедиться, что симптомы возникли именно от нее, а не какого-либо другого заболевания простаты, не лечимого с помощью ЭАП.
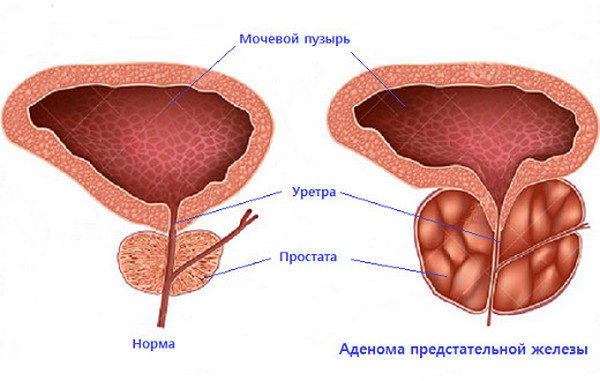
Показания
Вот случаи при аденоме простаты, когда ЭАП помогает больше всего:
- простата, достигшая в объеме больше 80 кубических сантиметров;
- серьезные патологии сердца и сосудов, к которым относятся, например, инфаркт миокарда, тяжелый сахарный диабет, проблемы со свертываемостью крови, а также почечные патологии;
- вены простаты варикозно расширены, из них течет кровь, и все это не лечится традиционной терапией;
- больной очень хочет избавиться от установленной цистостомы.

Противопоказания
У ЭАП существуют и противопоказания. Вот главные из них:
- неправильное развитие подвздошных сосудов;
- флотирующие тромбы в бассейне вен ног.
Кто именно решает, нужно ли сделать ЭАП?
Стоит ли прибегнуть к ЭАП, решает врачебный консилиум. Перед использованием данной методики без ее обсуждения двумя врачами никак не обойтись: в процессе терапии участвуют уролог и эндоваскулярный хирург, а это представители разных направлений медицины. Вместе с тем решающее слово остается за пациентом. Так что он должен выяснить у врачей всю интересующую его информацию, если хочет принять правильное решение.
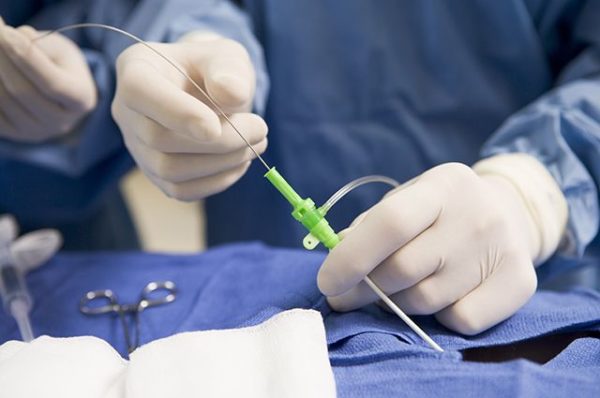
Для данной процедуры предназначены специальные рентгеноперационные, оборудованные аппаратом для ангиографии. Он нужен для того, чтобы контролировать ЭАП при помощи рентгенотелевидения. Именно в этих условиях выполняется каждая эндоваскулярная процедура.
Подготовка
ЭАП обычно делают в тот же день, когда госпитализировали пациента. За границей в порядке вещей выписать пациента спустя шесть часов после процедуры. Но правильнее для пациента будет задержаться в клинике на ночь.
Последний прием пищи перед ЭАП должен быть не ранее, чем за 4 часа до нее, и утром завтрак должен быть небольшим. Пить допускается так же, как обычно. А перед тем, как ложиться в больницу, требуется побрить пах и бедра по обе стороны от паховой складки.

Перед самой процедурой больному делают укол с успокоительными и анестезирующими средствами — премедикацию. Еще ему устанавливают катетер Фолея. Тот требуется как при процедуре, так и 4-6 часов после ее окончания. Лучше всего, когда используются современные катетеры, — они безопаснее и имеют очень малый диаметр.
Важно! В случае аллергий на препараты пациент должен сообщить о них врачам.
Каким образом проводят ЭАП?
Это малоинвазивная процедура. Ее сутью является закупоривание сосудов артерий в предстательной железе. Это заставляет ее уменьшиться в размерах.
ЭАП проводят эндоваскулярные хирурги. Здесь нужен достаточный опыт манипуляций на очень тонких, часто меньше миллиметра, сосудах, а также высокий навык в использовании рентгенангиографической установки для контроля собственных действий.
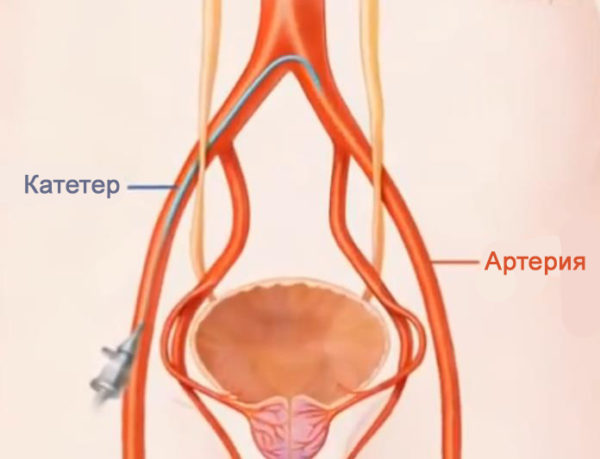
Стоит знать! ЭАП – малоинвазивная процедура, и для ее осуществления не нужно вводить пациента в общий наркоз. Достаточно использовать местную анестезию там, где будет проводиться пункция артерии.
Хирург делает прокол на правом бедре на сантиметр-другой ниже паховой складки. Все, что почувствует пациент при операции, это появляющееся иногда ощущение тепла в паху, ягодицах. Это чувство появляется из-за контрастного вещества, вводимого хирургом по катетеру.
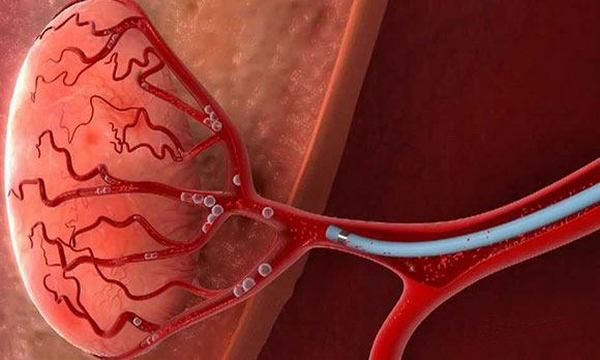
Эндоваскулярный хирург должен выявить источники кровоснабжения простаты, в которые после этого ввести микрокатетер диаметром 0,6-0,8 мм. Убедившись, что катетер стоит устойчиво и в нужном месте, врач через него вводит в артерию эмболизационный препарат — частицы медицинского пластика.
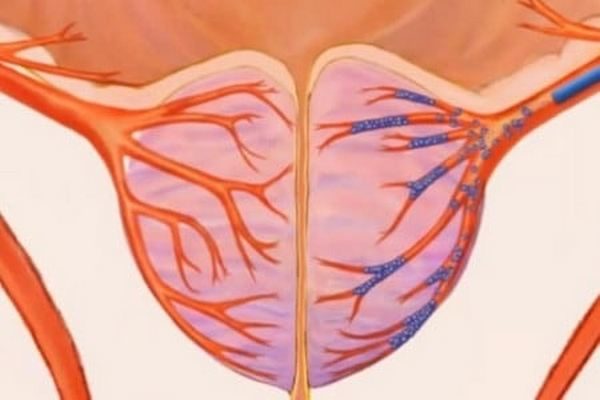
Потом результат проверяют контрастированием, позволяющим убедиться в надежности закупоривания всех простатических артерий.
Эмболизацию обязательно проводят справа и слева, однако прокалывать левую ногу обычно незачем: нынешние катетеры устроены так, что с их помощью можно катетеризовать обе стороны, используя общий для них доступ.
Результативность
Сейчас есть результаты двух серьезных исследований. Из них можно сделать вывод, что ЭАП представляет собой очень эффективную методику закупоривания простатических артерий для терапии аденомы простаты. Почти у всех пациентов за первый же месяц сильно уменьшается простата и улучшается мочеиспускание.

Почти у каждого третьего пациента, прошедшего ЭАП, улучшения заметны в первую же неделю после операции. Далее простата уменьшается, и состояние мочеполовой системы полностью восстанавливается не более, чем за год.
Для ЭАП требуются:
- высокие технологии;
- специальная операционная;
- очень точные приборы;
- высочайший профессионализм опытных врачей;
- новейшие эндоваскулярные методы.
Таблица. Результаты лечения 52 пациентов с аденомой простаты с помощью ЭАП.
| Показатели\сроки | Через 3 мес. | Через 6 мес. | Через 12 мес. | Через 24 мес. |
|---|---|---|---|---|
| Объем остаточной мочи(мл) | 158,2±0,028 | 143,0±0,0023 | 25,3±0,0020 | 26,3±0,0020 |
| Баллы по шкале IPSS | 6,2±0,051 | 4,0+0,014 | 3,6+0,011 | 3,9+0,011 |
| ПСА (общий/ свободный) (нг/мл) | 1,3±/0,03± 0,0036 | 1,08± /0,027 ± 0,0015 | 1,06± /0,022± 0,0015 | 1,09±/0,027 ± 0,0017 |
| Объем предстательной железы (см) | 83,4±8,3 | 54,29 ±5,37 | 52,07+5,37 | 53,07+5,38 |
| Объем узла (см 3 ) | 52,9±5,17 | 33,26±6,67 | 32,16±5,43 | 33,18±4,83 |

Данные показатели говорят о том, что у пациентов уже спустя 3-6 месяцев работа предстательной железы и мочеполовой системы в целом нормализуется, а спустя год-два и вовсе не остается следа от каких-либо патологий, связанных с этой областью.
Вызывает ли боль процесс ЭАП?
При данной процедуре не бывает боли. Из неприятных ощущений пациент может почувствовать лишь первый укол местного обезболивающего. А вот после ЭАП около 50% пациентов отмечают внизу живота и в области уретры тянущую боль либо резь. Этот дискомфорт обычно проходит за несколько часов, а быстро убрать его можно при помощи нестероидных противовоспалительных средств.
Вероятность рисков
Данная процедура — сравнительно новая методика. Но уже известно, что она очень безопасна. Из всех возможных осложнений при ЭАП чаще всего встречается гематома там, где была проведена артериальная пункция. И то этот риск, в принципе, можно и не считать. Мало того, что это осложнение развивается только у 5% пациентов, оно еще и проходит само дней за пятнадцать.
Поначалу, на заре разработки ЭАП, у пациентов изредка ненадолго нарушалось мочеиспускание, что выправлялось за день-другой при помощи катетеризации мочевого пузыря.
Благодаря нынешним технологиям данная методика сводит даже такие риски к минимуму. И потому пациенты обычно выписываются уже наутро.
Положительные стороны данной методики:
- почти полное отсутствие боли при реабилитации;
- быстрое восстановление способности к прежнему образу жизни;
- практически полное отсутствие риска каких-либо осложнений;
- госпитализация, равная всего суткам, причем в других странах процедура обычно и вовсе проходит на дому;
- отсутствие необходимости перевязок, обезболивания, интенсивного лечения, посторонней помощи.

Предварительные процедуры
Чтобы планово лечь в клинику на ЭАП, нужно сдать определенные анализы, а также пройти обследования. К ним относятся:
- общий анализ крови — не ранее, чем за две недели до ЭАП;
- биохимический анализ крови – при этом должны быть указаны уровни мочевины, АЛТ, АСТ, а также билирубина — не ранее, чем на две недели до операции;
- коагулограмма с указанием МНО, ПТИ, АПТВ – не ранее, чем за две недели до операции;
- анализы на RW, ВИЧ, пробы на гепатит В и С, не ранее, чем за 90 суток до операции;
- ЭКГ в 12 отведениях;
- флюорография — не ранее, чем за год до операции;
- анализ крови на ПСА. Если уровень повышен, то также консультация онкоуролога и данные биопсии;
- УЗИ простаты.

Отзывы
Ниже, для наглядности, приведены отзывы мужчин, переживших ЭАП.

Реабилитация
После ЭАП аденома уменьшается на 50-80%. Простата — на 40-50%. Данные показатели позволяют без больших затрат времени вернуть процесс опорожнения мочевого пузыря в норму.
Важно! Процедура приносит пользу спустя буквально считанные дни. Частота и длительность походов в туалет становятся намного меньше, уходят в прошлое боли в уретре, а также остальные признаки аденомы простаты.

Для предотвращения повторного возникновения заболевания пациент должен следовать определенным рекомендациям:
- слежение за уровнем ПСА, регулярные визиты к урологу для осмотров;
- правильное питание — избегание жирной и насыщенной углеводами пищи;
- избегание употребления спиртного, в особенности пива, в котором очень много фитоэстрогенов;
- отказ от табакокурения;
- по возможности избегание приема медикаментов, основанных на гормонах, поскольку изменения в гормональном фоне могут спровоцировать рецидив аденомы простаты;
- ведение активного образа жизни, что особо важно при сидячей работе. Следует регулярно прогуливаться на свежем воздухе, плавать, а также бегать трусцой.
Важно! Стоит также помнить, что ингибиторы 5-альфа-редуктазы, а также альфа-1-адреноблокаторы вредны для потенции. Также они понижают качество спермы.
Для профилактики рекомендуется применять биодобавки. Это безопасные средства, которые можно использовать и после операции. Наилучшая в данном случае из них — урологический пластырь ZB Prostatic Navel Plasters, производимый в Китае.
Чтобы не ошибиться, выбирая клинику, следует обращать внимание на многое:
- цена диагностики (сдача всех анализов, обследования, консультация);
- цена операции;
- отзывы пациентов о больнице и специалистах.
Стоимость такой операции в российских клиниках варьируется от 50 до 150 тысяч рублей. В нее включены расходы на лекарства, нахождение в больнице и непосредственно сама эмболизация.
Заключение
Итак, ЭАП представляет собой самую лучшую по всем показателям методику терапии доброкачественной гиперплазии простаты. А то, насколько она хороша, показывают результаты масштабных исследований, проведенных в различных странах.

В настоящее время все большее социальное значение отводится сердечно-сосудистой патологии, новообразованиям, эндокринным заболеваниям, которые являются частой причиной высокой смертности населения, случаев временной и длительной нетрудоспособности. В то же время уделяется меньше внимания хроническим заболеваниям мочеполовой системы, резко снижающим качество жизни больных. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из таких заболеваний [1; 2].
Несмотря на хорошую эффективность указанных вмешательств, не каждому больному возможно предложить такое лечение в силу различных обстоятельств. К ним можно отнести: возраст – что неразрывно связано с самим определением ДГПЖ, обусловленные указанным фактором сопутствующие заболевания, повышающие анестезиологический риск, нежелание самого больного ввиду риска характерных осложнений – таких как ретроградная эякуляция, недержание мочи, снижение эректильной функции.
Не так давно появились такие минимально инвазивные методы, как трансуретральная микроволновая терапия, интерстициальная лазерная термоабляция, трансуретральная игольчатая абляция, водо-индуцированная термотерапия и др. [5; 6]. Однако применение данных методов при большом объеме железы также ограниченно.
Одна из активно развивающихся высокотехнологических отраслей медицины – эндоваскулярная хирургия. Достоинствами эндоваскулярных вмешательств являются: минимальная инвазивность, низкий операционный риск, быстрое восстановление пациентов, отсутствие необходимости в проведении анестезиологического пособия, возможность проведения у пожилых людей и у пациентов с тяжелой соматической патологией.
Изначально эндоваскулярная эмболизация в урологии рассматривалась лишь как способ остановки жизнеугрожающих кровотечений из мочевого пузыря и предстательной железы [7].
У части пациентов после выполнения эмболизации в бассейне нижней мочепузырной артерии были отмечены редукция объема ПЖ и, как следствие, улучшение качества мочеиспускания, что натолкнуло исследователей на мысль о возможности применения данного метода в лечении больных ДГПЖ.
Уже в 2010 году португальские исследователи во главе с J.M. Pisco представили данные 4-летних наблюдений по результатам нового метода лечения доброкачественной гиперплазии простаты. Метод был технически успешным у 14 из 15 пациентов (93,3%) [8]. В этом же 2010 г. отечественные исследователи (Неймарк А.И., Карпенко А.А., Яковец Я.В.) представили данные по эмболизации артерий простаты у 40 больных с высоким риском оперативного вмешательства. Вмешательство позволило после операции на фоне снижения выраженности клинических проявлений уменьшить объем предстательной железы на 50%, объем аденоматозного узла — на 43%, исследования продолжаются и по сей день [9].
Другие независимые исследователи в 2012 году во главе с Carnevale F.C. опубликовали результаты лечения более 100 больных ДГПЖ с СНМП и объемом железы от 30 до 90 см3. Эффективность процедуры оценивалась как крайне высокая [10]. До настоящего момента ежегодно появляются новые результаты исследований со всего мира, свидетельствующие о высоком потенциале метода эмболизации простатических артерий (ЭПА).
Цель исследования
Оценить долгосрочные результаты лечения методом ЭПА больных ДГПЖ. Разработать алгоритм ведения различных групп пациентов после выполнения ЭПА.
Материал и методы
Начиная с 2004 по 2015 год на базе отделения рентгеноперационных методов диагностики и лечения Алтайской краевой клинической больницы у 70 пациентов проведена ЭПА. Возраст больных составил 69,7±7,3 года, объем предстательной железы 111,6±52,6 см3. Максимальный объем ПЖ - 296 см3. Индекс IPSS - 18,3±3,2, максимальная скорость мочеиспускания Qmax (maximum urinary flowrate) – 7,3±4,2 мл/с. Все пациенты были предупреждены о возможных осложнениях при проведении процедуры и о возможных альтернативных методах лечения. Подавляющее большинство пациентов имело различную сопутствующую патологию: сахарный диабет, патологию сердечно-сосудистой системы, избыточный вес, что в значительной степени увеличивало риск оперативного лечения общепринятыми методами. Перед процедурой проводилось анкетирование по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), оценке качества жизни QoL. Объем простаты и узла определялся по данным трансректального ультразвукового исследования (ТРУЗИ) ПЖ. Перед оперативным вмешательством всем больным было проведено исследование крови на определение уровня простатспецифического антигена (ПСА), в сомнительных случаях произведена пункционная биопсия предстательной железы.
Для анализа качества мочеиспускания проводилась урофлоуметрия (УФМ).
Эффективность лечения оценивалась на 6, 12 и 24-й месяцы после процедуры.
ЭПА проводилась под местной анестезией трансфеморальным либо чресплечевым доступом по методике Сельдингера. Под рентгеновским контролем выполнялась суперселективная катетеризация ветвей внутренней подвздошной артерии (ВПА). Затем выполнялась эмболизация сосудов, питающих ПЖ, путём применения микрокатетерной техники с введением микросфер EmboGold (BiosphereMedical, Франция), размером 100-300 или 300-500 мкм, до полной блокады кровотока (рис. 1).
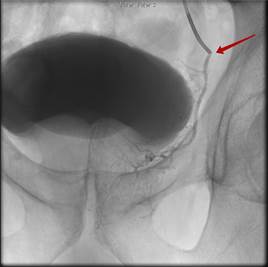
Рис. 1. Стрелкой указан дистальный конец катетера, контрастируется простатическая артерия слева
Диаметр микросфер выбирался в зависимости от диаметра артерий, питающих предстательную железу. Для катетеризации применялись катетеры конфигурации Roberts5F или Cobra5F, которые выполняли роль проводникового катетера. Через просвет проводникового катетера проводился микрокатетер на микропроводнике. После эмболизации артерий простаты с одной стороны, проводниковый катетер 5F устанавливался в контр- либо ипсилатеральную артерию, в зависимости от доступа, и процедура повторялась. В ряде случаев требовалась пункция обеих бедренных артерий с проведением проводникового катетера контрлатерально.
Для оценки типа распределения признаков использовали показатели эксцесса и асимметрии, характеризующие форму кривой распределения. Значения непрерывных величин представлены в виде M±m, где M – выборочное среднее арифметическое и m – стандартная ошибка среднего. В случаях нормального распределения, а также равенства выборочных дисперсий, для сравнения связанных выборок использовали парный t-критерий Стьюдента. В иных случаях использовали непараметрический T-критерий Вилкоксона. Равенство дисперсий оценивали по F-критерию Фишера. Уровень статистической значимости при проверке нулевой гипотезы принимали соответствующий Р
Читайте также:

