Эффективность скрининга рака шейки матки

В настоящее время рак шейки матки (РШМ) относят к одному из наиболее значимых аспектов онкогинекологии. По статистике он занимает третье место в мировой структуре раковых опухолей у женщин [1]. Согласно ВОЗ каждый год в мире обнаруживается 530 тыс. новых случаев РШМ, при этом более 270 тыс. женщин умирают от данной патологии. В Российской Федерации на основании данных смертность от РШМ женщин в возрасте 30–39 лет составляет около 24 %, а женщин 40–49 лет 13,7 % [2].
В последние годы отмечается рост заболеваемости РШМ среди женщин 20–40 лет почти вдвое (41,2 %). Увеличение количества заболевших женщин с тенденцией к омоложению данного заболевания обуславливает социально-экономическую значимость данной проблемы [3].
Скрининговые программы играют немаловажную роль в своевременной диагностике, профилактике, а также правильно подобранной терапии рака шейки матки [1].
Очень важно дифференцировать раннюю диагностику и скрининг. Так, при ранней диагностике патология обнаруживается при обращении лиц с уже имеющимися жалобами и появившимися симптомами заболевания. При этом скрининг преследует за собой цель – выявление признаков РШМ в доклинической стадии, то есть еще до появления первых симптомов заболевания для последующего его лечения более щадящими методами, что позволяет избежать травматичных радикальных операций, снижающих работоспособность и приводящих к инвалидизации больных [1].
История скрининговой диагностики начинается в 1928 г., когда французский эмигрант Георгиос Папаниколау впервые заявил о возможности определения злокачественных клеток с ШМ путем цитологического метода исследования. Методика, позже получившая название ПАП-теста, была признана во всем мире только в 1940 г. [3–5].
После внедрения цитоскрининга в мировой статистике наблюдалось снижение заболевших раком шейки матки женщин [2, 6]. Так, к примеру, в СССР после создания централизованных цитологических лабораторий (ЦЦЛ), произошло значительное уменьшение числа заболевших и умерших женщин от РШМ. Имеются статистические данные скрининг-диагностики лечебных организаций Октябрьской железной дороги (1965–1984 гг.), согласно которым отмечалась тенденция к значительному снижению числа заболевших женщин на 74,3 %. Однако после роспуска ЦЦЛ в 90-х годах в стране обращает на себя внимание возобновление роста заболеваемости и смертности от РШМ [2, 6].
Во многих работах выделяют факторы риска развития РШМ. Считается, что данные факторы не являются причиной патологии, а лишь повышают вероятность ее появления [1]. Согласно многочисленным эпидемиологическим и клиническим исследованиям было выделено множество факторов риска. К основным из которых относятся:
1) начало половой жизни в 14–18 лет;
2) ранняя первая менструация;
3) ранняя первая беременность;
4) два и более абортов;
5) множество половых партнеров и частая их смена;
6) длительные воспалительные процессы в женских половых органах;
7) вредные привычки: алкоголь и курение [2, 6–8].
Многие авторы отводят большое значение курению как фактору риска по развитию РШМ. Считается, что никотин и другие компоненты дыма, такие как оксид и диоксид углерода, антрацен, бензопирен и другие, оказывают канцерогенное влияние на организм целом, и в том числе на шейку матки, вызывая в ней злокачественную трансформацию эпителия. Имеются данные [9, 10], в которых отмечается, что в шеечной слизи активных и пассивных курильщиц, больных РШМ, были найдены составляющие сигаретного дыма.
Также к неблагоприятным факторам необходимо отнести избыток эстрогенов, так как считается, что последние в противовес прогестерону содействуют канцерогенезу [11, 12]. В ряде клинико-статистических данных приводится взаимосвязь между применением оральных контрацептивов и риском возникновения аденокарциномы, что, по мнению некоторых авторов, может быть обусловлено как гормональным влиянием препаратов, так и отсутствием барьерных методов защиты (ИППП, в том числе ВПЧ) [13]. Особый интерес вызывают исследования о выявляемости рака шейки матки у женщин с внутриматочными контрацептивами, нити которых выходят из цервикального канала и свисают на шейку матки, что может травмировать ее и приводить к раку [14]. Ю.А. Петров [15, 16] доказал безопасность внутриматочной контрацепции в плане возникновения РШМ.
В работах L.A. Brinton указано на то, что гены и наследственность в этиопатогенезе РШМ не имеют никакого существенного значения, однако могут определять тип течения заболевания [13].
Одну из самых высоких групп риска по заболеванию РШМ отводят иммунодефицитным состояниям, при которых происходит инфицирование и персистирование папилломовирусной инфекции (ПВИ) [17]. Со второй половины девятнадцатого года было выдвинуто предположение о роли ВПЧ в генезе раковой трансформации ШМ. Но лишь в конце двадцатого века с помощью современных технологий, таких как гибридизация, были получены подтверждения этиологической роли вируса в развитии РШМ [18]. Патогенез ПВИ заключается в том, что вирусы включают в свой генетический материал специфические участки, ответственные за синтез белков Е6 и Е7, последние в свою очередь, обуславливают злокачественные изменения эпителия ШМ [19–21].
По данным European Centre for Disease Prevention and Control считается, что у половины женщин после инфицирования вирусом папилломы человека вырабатываются антитела, которые справляются с инфекцией и ПВИ носит транзиторный характер. То есть в течение двух лет вирус полностью может элиминироваться из организма. Однако в некоторых случаях, вирус может приобрести латентное течение или быть реактивирован в форме персистирующей инфекции [22]. Существуют кофакторы, которые могут способствовать персистированию ПВИ. К ним относятся: тип и количество вируса (онкогенными являются 16 и 18 типы), сочетание с другими инфекциями, передающимися половым путем и др. [18, 22, 23]. Таким образом, для возникновения РШМ необходимо обязательное условие – персистирование ПВИ.
Общеизвестно, что скрининг РШМ включает в себя цитологический метод исследования. На сегодняшний день в силу доказанности ВПЧ в генезе РШМ в скрининг включены также ПЦР и digene HPV тест.
ПАП тест, разработанный Георгиосом Папаниколау – это традиционный мазок на стекло с влагалищной части ШМ и цервикального канала (ЦК) [8]. Преимущества данного метода заключаются в диагностике РШМ на ранней стадии и исследовании процесса в динамике, а также безопасности и отсутствии болезненности при взятии материала. Однако недостаток его заключается в том, что он не позволяет обнаружить инфильтративный раковый процесс в ШМ.
По данным литературы [12], чувствительность цитологических мазков по Папаниколау находится в пределах 30–80 %, при этом специфичность колеблется от 86 до 100 %. Достаточно часто в практике встречаются ложноотрицательные результаты [5]. Полагают, что только в трети всех случаев причиной полученных ложноотрицательных тестов при цитологических исследованиях является неправильная трактовка результатов, а в остальных случаях зачастую это обусловлено неполноценным взятием материала [11]. Именно поэтому правильное получение мазка для цитологического исследования является важнейшим этапом в скрининговой диагностике РШМ. При взятии мазка с ШМ и ЦК необходимо следовать следующим правилам: мазок берется с поверхности влагалищной части ШМ, переходной зоны и цервикального канала не ранее 48 часов после полового контакта, обязательно при отсутствии менструации [1]. При этом рекомендуется использовать специализированные цитощетки, а не инструменты (зонды, ложка Фолькмана, шпатели и др.), так как использование последних часто искажает полученные результаты [5].
Также известно, что на сегодняшний день большую популярность приобрела новая технология получения цитопрепаратов – так называемая жидкостная цитология [1]. Она базируется на помещении материала не на стекло, а в специальной жидкости, в которой транспортируется. Данная методика имеет более высокую чувствительность, чем обычный мазок на стекло [3].
Имеются свидетельства и о других преимуществах жидкостной цитологии: клетки не теряют генетических, иммунохимических и структурных признаков в транспортной жидкости; мазок имеет тонкий слой, то есть в нем отсутствует кровь и воспалительный экссудат; имеется возможность одновременного использования нескольких дополнительных методов исследования (ВПЧ-тест, обнаружение онкомаркеров) [1].
Для трактовки данных, полученных в результате цитологического исследования, применяют классификацию цитологических картин по Папаниколау и по Бетесда [2].
Установлено, что вирус папилломы играет основную роль в развитии РШМ в 99 % случаев. Доказана роль ВПЧ в генезе кондилом, диспластических изменений шейки матки, а также в пре- и инвазивном раке. Объектом поражения онкогенных типов вируса является переходная зона ШМ, где располагаются активно делящиеся клетки. Процесс развития РШМ от заражения до клинической симптоматики может занимать от года до десяти лет. Именно поэтому диагностика ПВИ наряду с цитологическим методом относится к важнейшим элементам скрининга и профилактики [9].
При соотнесении цитологического метода скрининга и теста на ВПЧ можно заметить, что чувствительность последнего значительно выше (88–98 %), однако специфичность немного уступает цитологическому методу, что объясняется транзиторным характером ПВИ у некоторых женщин [5, 9]. При этом важно, что цитоскрининг позволяет обнаружить РШМ только в субклинической и клинической стадиях, тогда как ВПЧ-тестирование дает возможность выделить группу риска женщин с ПВИ с целью дальнейшего наблюдения, однако не исключает гипердиагностику в связи с носительством ВПЧ. Имеются данные о том, что если результат на тест по Папаниколау и тест на ВПЧ были отрицательными, то риск развития РШМ будет минимальным по сравнению с тремя последовательно повторяющимися результатами традиционного мазка [17].
Таким образом, в каждом методе скрининга отмечаются свои преимущества и недостатки, поэтому только сочетание методов увеличивают точность скрининга и позволяет на ранних стадиях диагностировать интраэпителиальную неоплазию.
Так, например, в клинике Кливреда в США имеется четкий порядок скрининговой диагностики пациенток, в котором указано, что сам по себе тест на ВПЧ не гарантирует наличие у женщины злокачественного процесса в ШМ, а должен обязательно дополниться цитологическим методом [24].
Вместе с тем одним из существенных вопросов в скрининге РШМ является возраст начала и окончания диагностики, а также интервал между исследованиями.
По рекомендациям ВОЗ женщины от 25 до 65 лет должны обязательно проходить цервикальный скрининг первые два года ежегодно, далее – раз в три года при отрицательных результатах. Однако из-за участившихся случаев предраковых изменений ШМ у женщин до 25 лет некоторые страны привлекают к обследованию женщин и раньше. Так, например, в США согласно рекомендациям ACS (американской раковой ассоциации), ACOG (американского колледжа акушеров и гинекологов), USPSTF (целевой группы профилактического сервиса) женщины должны проходить скрининг в 21 год независимо от начала половой жизни или через 3 года после первого полового контакта [7].
В данный момент в нашей стране нет государственных программ по всеобщему скринингу РШМ у женщин. Однако в 2013 г. в программу диспансеризации были включены мероприятия по диагностике патологии ШМ, в которых рекомендуется обследовать женщин от 25 до 65 лет с периодичностью в три года моложе 50 лет и в пять лет – старше 50 лет. При этом обязательному цервикальному обследованию подлежат женщины после перенесенной тотальной и субтотальной гистерэктомии, а также имеющие неблагоприятный преморбидный фон в анамнезе [3].
Что касается возраста прекращения скрининга, то ВОЗ предлагает окончание обследования женщин старше 65 лет при двух последовательных отрицательных результатах и отсутствии изменений в мазках с ШМ и ЦК за последние 10 лет [1, 7].
Таким образом, подводя итог всему вышеизложенному, можно обозначить основные цели массового обследования женщин на РШМ:
1) уменьшение статистических показателей заболеваемости и смертности от данного заболевания;
2) обязательная периодическая диагностика женщин из групп риска;
3) организация своевременных и рациональных лечебных мероприятий [4].
Правильная организация скрининговой диагностики является первым этапом профилактики РШМ. Так как в основе РШМ лежит персистирование инфекции, то и профилактика, соответственно, как и при большинстве инфекционных заболеваний, состоит в вакцинировании [8].
Разработаны два основных типа вакцин при ПВИ: квадри- и бивалентная – Гердасил и Цервивакс соответственно. Однако существует еще множество дискуссионных вопросов по поводу возраста начала вакцинопрофилактики, контингента, дозы и т.п. [24, 25].
Качественный и эффективный скрининг должен преследовать за собой следующие цели: быть бюджетным, удобным, безвредным и быстрым, а также охватывать большие популяции женщин. Помимо организационных моментов, важно стандартизировать техсредства и трактовку полученных при скрининге результатов.
Для решения поставленных задач необходимо распространение в практике сочетания метода жидкостной цитологии и теста на ВПЧ, а при возможности с дополнением иммуноцитологическими методами; обучение работников, повышение их квалификации, формирование единого банка интерпретации данных, а также внедрение дистанционного консультирования через специальное телеоборудование [8].

Основная цель, с которой врачами-гинекологами проводится скрининг рака шейки матки (РШМ) , раннее выявление этой опасной патологии. Почти половина случаев первичного его выявления заканчивается летальным исходом потому, что диагноз ставится на поздних стадиях. При своевременном выявлении он излечивается щадящими методами.
Скрининг шейки матки: что это такое и какую пользу он приносит?
Скринингом называются профилактические мероприятия, направленные на выявление заболевания у пациентов, входящих в группу риска, но не имеющих клинических симптомов. В данном случае в группу риска входят все женщины репродуктивного возраста. Для них и разработаны программы скрининга рака.
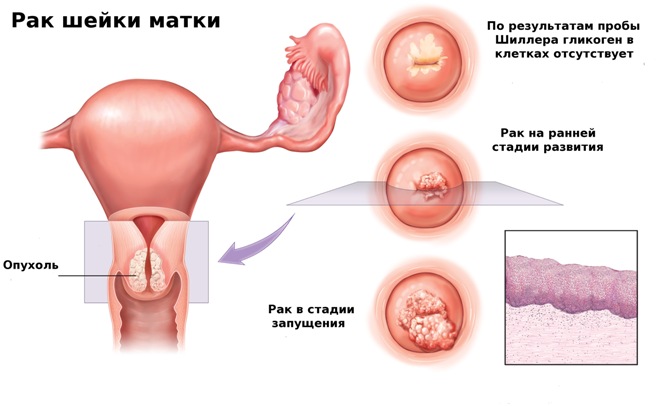
В ходе скрининга выявляются предраковые заболевания, повышающие вероятность развития рака. Если цитологический скрининг рака шейки матки проводятся регулярно, то даже злокачественная опухоль будет обнаружена на ранней стадии, когда есть возможность применения щадящих методов лечения, а шансы на достижение стойкой ремиссии высоки.
Кому из женщин следует проходить скрининг на рак шейки матки?
Особое внимание проведению онкологических скрининг-исследований следует уделить женщинам с наличием факторов риска его развития. Факторами риска считаются:
- раннее вступление в половую жизнь (до совершеннолетия),
- наличие признаков раннего полового созревания (начало первой менструации до 12 лет),
- ранняя первая беременность (в 18-19 лет и ранее),
- 2 и более медицинских аборта в анамнезе,
- наличие хронических воспалительных процессов в органах малого таза,
- большое число половых партнеров и частая их смена,
- наличие вредных привычек, в частности курения.
Повышает вероятность развития РШМ дисбаланс гормонального фона, поэтому женщинам с нерегулярным менструальным циклом и другими признаками гормональных нарушений также следует проявить бдительность.
Нельзя забывать и про основную причину развития РШМ , инфицирование вирусом папилломы человека. Если у женщины был выявлен этот вирус, особенно высокого онкогенного риска, визиты к гинекологу должны быть регулярными.

После первого полового акта в течение 3 лет женщина должна пройти первое профилактическое обследование на рак. Если половых контактов не было, то первый скрининг должен быть сделан в 21 год.
Согласно рекомендации специалистов Всемирной Организации Здравоохранения, прекратить регулярное прохождение скрининга могут женщины, которым исполнилось 65 лет, при условии, что:
- за последнее десятилетие в мазках из цервикального канала и с поверхности шейки матки отсутствовали патологические изменения,
- 2 последних исследования дали отрицательные результаты.
При наличии признаков предракового состояния, а также после перенесенных хирургических вмешательств по поводу новообразований шейки скрининги продолжаются независимо от возраста пациентки.
Особенности и разнообразие методов
Цитологическое исследование (цитология) , метод, направленный на выявление патологических изменений на клеточном уровне. Он основан на исследовании содержимого цервикального канала и мазков, взятых с влагалищной части поверхности шейки. В полученном материале выявляются клетки с признаками нарушения процессов деления, то есть клетки, которые могут дать начало злокачественной опухоли.
В зависимости от способа получения материала для исследования цитология подразделяется на традиционную и жидкостную.
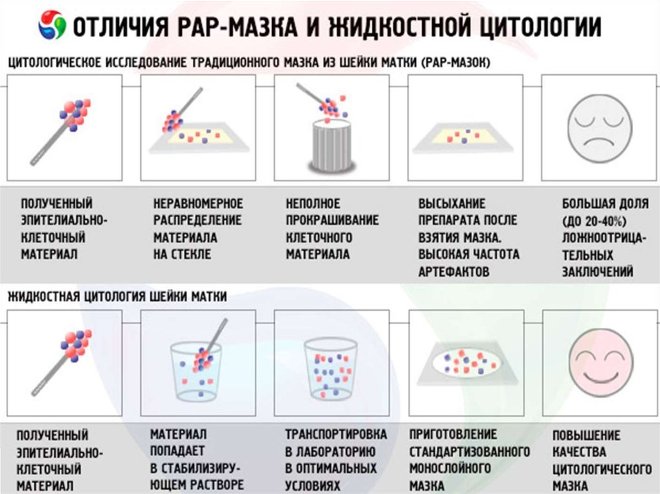
Традиционная цитология заключается в нанесении мазков на предметные стекла и последующем их изучении врачом-цитологом. Для того чтобы упростить изучение структуры клеток и повысить точность исследования, мазки перед просмотром окрашиваются специальными красителями по одному из принятых методов (по Романовскому-Гимзе, Лейшману, Папенгейму и т.д.).
Традиционная цитология имеет ряд недостатков, в их числе высокая вероятность получения ложноотрицательных результатов. Одна из причин ложноотрицательных тестов , неполноценное взятие материала. Поэтому более точным методом исследования считается цитология жидкостная.
Автоматизированный просмотр материала осуществляется с помощью автоматического цитоанализатора Брамберга. Мазки наносятся на предметное стекло в виде равномерного тончайшего слоя клеток. Они окрашиваются, и предметное стекло погружается в специальный аппарат.
Аппарат сканирует загруженные образцы и направляет данные в компьютер, который обрабатывает результаты. Они внимательно изучаются врачом-цитологом, и некоторые стекла просматриваются под микроскопом. Так как мазки с отклонением от нормы проходят двухэтапный анализ, повышается точность и достоверность полученных заключений.
В основе жидкостной цитологии лежит помещение препарата не на предметное стекло, а в специальный контейнер, наполненный жидкостью. Данная методика имеет более высокую чувствительность, чем традиционная цитология, поскольку:
- клетки, которые транспортируются в специальной жидкости, не утрачивают свою изначальную структуру и иммунохимические свойства,
- в полученном мазке отсутствует воспалительный экссудат и кровь,
- становится возможным исследование материала различными методами,
- есть возможность автоматизации процесса.
Многие доктора склоняются к тому, что эффективность скрининговой диагностики напрямую зависит от точности методов, которые при этом применяются. Учитывая, что традиционная цитология часто демонстрирует ложноотрицательный результат, ее нельзя считать достоверным методом исследования.
Поэтому целесообразно более активное внедрение жидкостной цитологии с автоматизированным просмотром. Если клиника имеет возможность применения современного оборудования и проведения жидкостной цитологии, то ее можно рекомендовать пациенткам, особенно входящим в группу риска.
Вирус папилломы человека считается одной из главных причин развития РШМ. Поэтому диагностика папилломавирусной инфекции относится к важнейшим элементам скрининга наряду с цитологическим исследованием.
Чувствительность теста на ВПЧ выше, чем чувствительность цитологии, но при этом его специфичность ниже. Более полную картину можно получить, сопоставляя результаты этих исследований.
Когда лучше всего сдавать цитологический анализ?
Мазок на цитологию можно сдать в любой день вне менструации при условии, что женщина за последние 2 суток:
- не вступала в половые контакты,
- не применяла влагалищные свечи, контрацептивы и т.д.,
- не спринцевалась,
- не проходила лечение по поводу гинекологических заболеваний.
При подозрении на кольпит, цервицит, воспаление матки и придатков мазок на цитологию следует забирать после исключения диагноза или лечения заболевания.
На результат исследования может повлиять наличие воспалительного экссудата, крови, спермы и компонентов лекарственных средств в исследуемом материале. Имеет значение наличие сопутствующих заболеваний (в частности эндометриоза, новообразования тела матки). Поэтому при получении неудовлетворительных результатов пациентке назначается обследование.

Результаты цитологического исследования
По результатам исследования врач может выдать следующее заключение:
- норма,
- воспалительный тип мазка,
- дисплазия низкой или высокой степени,
- наличие атипичных клеток,
- рак.
По возможности уточняется степень и характер выявленных изменений.
Ознакомиться с результатами исследования пациентка может у лечащего врача. Средний срок проведения анализа составляет 3-14 дней с момента забора материала. Сроки выполнения анализа устанавливаются клиникой. Некоторые лаборатории проводят исследование в экспресс-режиме (в течение нескольких часов).
Практика показывает, что чувствительность цитологических мазков по Папаниколау находится в пределах 30-80%. Чувствительность жидкостной цитологии выше.
Повышает достоверность результатов соблюдение техники забора материала и сдача анализов в подходящие дни. Правильная техника забора обеспечивается подготовкой медицинского персонала, а день для сдачи анализа выбирает женщина, учитывая рекомендации доктора.
Как часто необходимо проводить процедуру?
Наибольшее значение скриниговая диагностика имеет для пациенток в возрасте от 25 до 50 лет. Первые 2 скрининга проводятся с интервалом в 1 год, затем (при условии получения отрицательных результатов) с интервалом в 3 года. После 50 лет при отсутствии признаков патологии частота проведения скрининговых обследований сокращается до 1 раза в 5 лет.
При получении сомнительных результатов повторное исследование проводится через 3 месяца.
За 3 месяца могут самоустраниться изменения, связанные с дисбалансом половых гормонов. Станут более выраженными патологические изменения, что позволит их дифференцировать.
РШМ , наиболее часто выявляемая у беременных онкологическая патология. Изменение гормонального фона может провоцировать развитие опухолевых процессов, поэтому на стадии планирования беременности важно исключить предраковые состояния и рак.
В современной профилактической онкогинекологии выдвинута концепция двухэтапной системы обследования. На I этапе производится первичное выявление (скрининг). На II этапе методы углубленной диагностики применяются при подозрении на предрак или рак органов репродуктивной системы.
На I этапе (первичное выявление) проводят: собирание анамнеза, общий осмотр, обследование молочных желез, осмотр наружных половых органов, влагалища и шейки матки в зеркалах, цитолoгическое исследование мазков с поверхности шейки матки и цервикального канала, цитогормональное исследование мазков из бокового свода влагалища, бимануальное ректовагинальное исследование, при показаниях — цитологическое исследование эндометриального аспирата, формирование групп риска по раку эндометрия, яичников и молочной железы.
Эксперты ВОЗ сформулировали условия для популяционного скрининга:
1. Заболевание, являющееся предметом изучения, должно быть важной проблемой здравоохранения.
2. Должно существовать эффективное лечение выявленного заболевания.
3. Должны иметься возможности для дальнейшей верификации диагноза.
4. Заболевание должно иметь надежно распознаваемую преклиническую фазу.
5. Должен существовать надежный скрининг — тест, регистрирующий эту фазу.
6. Метод обследования должен быть приемлем для популяции (не давать побочных осложнений).
7. Развитие заболевания от преклинической до клинической фазы должно быть достаточно длительным.
8. Необходима общепринятая стратегия лечения выявленных больных.
9. Затраты на больных, включая уточнение диагноза и лечение, должны быть экономически оправданы в отношении общих затрат национальной службы здравоохранения.
Можно прямо сказать, что среди всех злокачественных опухолей только скрининг РШМ удовлетворяет всем рскомендованным ВОЗ условиям.
Общее представление о качестве и возможной эффективности популяционного скрининга дает уровень его достоверности, который выражается в рекомендованных ВОЗ показателях чувствительности, специфичности, предсказуемом значении положительного и отрицательного тестов и показателя частоты выявления заболевания. Чувствительность теста — это показатель его возможности идентифицировать заболевание, а специфичность — определение лиц, не страдающих этой опухолью.
Предсказуемое значение — это процент верифицированных случаев опухоли или здоровых среди лиц с положительными и отрицательными тестами. Частота выявления — число истинно положительных (гистологически верифицированных) больных раком на 1000 лиц, прошедших скрининг [Семиглазов В. Ф., 1983].
Многолетний опыт показывает, что профилактические осмотры без применения цитологического исследования могут снизить частоту выявления далеко зашедшего РШМ, но не в состоянии выявить предрак (дисплазию) и преклинические формы рака. В середине 60-х годов в СССР были созданы цитологические центры и появились исследования, посвященные первым итогам скрининга.
Достоверность цитологического скрининга достигла 98%, а среди ошибочных заключений преобладали ложноположительные. Реальное снижение показателей заболеваемости и смертности под влиянием скрининга достигается только при непременном условии регулярного цитологического обследования большинства женской популяции (80%) в возрасте старше 20 лет.
Скрининг предусматривает:
1. Организацию учета (желательно с помощью компьютерной техники) женской популяции старше 20 лет в данном регионе, создание специальных регистров прохождения цитологических исследований, системы приглашения женщин для скрининга, учета его результатов.
2. Определение стратегии скрининга, оптимальных интервалов возраста начала и окончании цитологических исследований.
3. Создание централизованных цитологических лабораторий, что обеспечивает высокое качество диагностики.
4. Организацию системы оповещения женщин с подозрительными или позитивными результатами цитологического исследования для проведения углубленной диагностики и лечения выявленных больных в определенных для этого стационарах.
5. Повышение онкологической квалификации гинекологов и усовершенствование знаний врачей-цитологов и лаборантов. Последние могут проводить проскрининг, т.е. отделение нормальных мазков от подозрительных и позитивных. Эту задачу в некоторых цитологических центрах (Латвийская ССР) решают с помощью автоматического цитоанализатора [Брамберга В. М., 1984].
6. Большое значение имеет санитарно-просветительная работа среди населения.
Наибольшее распространение получил цитологический скрининг среди работающих женщин, которые ежегодно проходят диспансеризацию. Организация скрининга затруднена среди неработающих женщин, в основном в возрасте старше 55 лет. Они приглашаются для профилактического обследования в женские консультации, расположенные по месту жительства.
В городских и сельских поликлиниках функционируют смотровые кабинеты, куда направляются женщины старше 20 лет, обратившиеся к специалистам любого профиля. В смотровых кабинетах работают квалифицированные средние медицинские работники, обученные в онкологических учреждениях. Они осматривают кожу, молочные железы, берут мазки с поверхности эктоцервикса и эндоцервикса для цитологического исследования.
Важная роль в ранней диагностике и профилактике РШМ принадлежит врачам женских консультаций. Они обязаны проводить цитологический скрининг всем гинекологическим больным, обращающимся по поводу сохранения или прерывания беременности, гормональной или внутриматочной контрацепции. Важное значение в стратегии скрининга имеет определение оптимальных возрастных границ, и интервалов между обследованиями.
В СССР принята точка зрения [Серебров А.И., 1968; Бохман Я.В., 1976] о желательности начинать скрининг с 20-летнего возраста. Время окончания скрининга находится в интервале 61—65 лет при условии негативных цитологических данных двух предшествовавших обследовании. В СССР цитологические исследования чаще всего проводятся 1 раз в 2 года.
Не подлежат цитологическому скринингу только 3 категории женщин: 1) в возрасте до 20 лет; 2) в любом возрасте, не жившие половой жизнью; 3) перенесшие в прошлом экстирпацию матки. Все остальные должны включаться в скрининг-программы. Если у женщины определяются факторы риска РШМ, то интервалы между обследованиями не должны превышать одного года. По охвату женщин цитологическим скринингом лучше обстоит дело в европейской части страны: Латвии, Украине, Молдавии, Ленинградской, Калининской и других областях, Удмуртской АССР. В указанных регионах цитологическим скринингом охватывается 60—80% женщин от 20 до 60 лет.
Так, например, в Латвийской ССР этот показатель равен 75% по отношению ко всей женской популяции старше 18 лет. Программа массового скрининга введена с 1968 г., когда интенсивный показатель заболеваемости составлял 31,7 на 100 000 женщин; в 1970 г. он снизился до 26,5; в 1978 г. — до 23; в 1984 г. — до 16.8. Во всех возрастных группах до 55 лет снижение уровня заболеваемости статистически достоверно, а в возрасте старше 70 лет констатируется рост заболеваемости. В 1983 г. цитологическим скринингом было охвачено 562405 женщин.
Характерно, что частота умеренной и тяжелой дисплазии на протяжении 15 лет остается стабильной — 1,2 — 1 % по отношению ко всем обследованным, в то время как уровень выявления РШМ снизился от 0,12% до 0,07%. Смертность от РШМ среди женщин репродуктивного возраста сведена к минимуму, но остается стабильной в возрасте старше 70 лет [Табачник Б.И., 1985]. Меньшее развитие получили программы скрининга PШM в среднеазиатских и закавказских республиках, в Сибири и на Дальнем Востоке.
В Украинской ССР ежегодно 50 централизованных цитологических лабораторий проводят скрининг 10 млн. женщин. Эти тенденции благоприятны, но нельзя не признать, что темпы снижения заболеваемости и смертности в целом по стране недостаточно высокие. Для решения проблемы ранней диагностики и профилактики существует только один реальный путь — существенное улучшение организации и эффективности скрининга во всех регионах СССР. Для этого надо, прежде всего, во всех республиканских и областных центрах разработать программу ранней диагностики РШМ до 2000 года.
На основании установленной численности женского населения старше 20 лет и имеющихся возможностей цитологической службы необходимо принять приемлемую тактику скрининга применительно к особенностям различных регионов. Там, где цитологическая диагностика РШМ обстоит удовлетворительно, необходимо решить ряд проблем: обследование старших возрастных групп; селективный скрининг среди беременных, пользующихся контрацепцией; всех гинекологических и венерических больных.
В регионах со слабым развитием цитологического скрининга следует решить главную задачу: добиться обследования не менее 80% женщин старше 20 лет. При этом суть дела заключается не в количестве взятых мазков и цитологических исследований, на которые ссылаются в отчетах, а в числе обследованных женщин по отношению к точной цифре проживающих в данных городах, областях и республиках.
Цель профилактики и раннего выявления РШМ не будет достигнута, если ежегодно будут обследоваться одни и те же женщины, тогда как значительная часть популяции (в которую обычно попадают женщины из групп риска) выпадает из программы скрининга. Поэтому первоочередную задачу молено определить так: добиться не менее 80% охвата женщин старше 20 лет в течение ближайших 5 лет. За этот период у каждой женщины необходимо провести дважды цитологическое обследование.
Читайте также:

