Для хронических лейкозов в фазу обострения характерно
Клинигеский анализ крови при хроническом миелолейкозе. В периферической крови на момент диагностики выявляется лейкоцитоз, обычно более 50 • 10 9 /л (возможен и более низкий уровень лейкоцитов — 15-20 • 109/л) со сдвигом влево за счет палочкоядерных нейтрофилов, метамиелоцитов, миелоцитов, редко — промиелоцитов.
Могут выявляться единичные бластные клетки (прогностически неблагоприятный признак). Характерна эозинофильно-базофильная ассоциация — увеличение количества эозинофилов и базофилов, часто морфологически аномальных. В 30% случаев определяется нормохромная нормоцитарная анемия легкой степени, у 30% больных выявляется тромбоцитоз; реже — тромбоцитопения (неблагоприятный признак).
Миелограмма при хроническом миелолейкозе. При исследовании миелограммы (которая не всегда необходима для постановки диагноза) выявляются гиперклеточный костный мозг и гиперплазия нейтрофильного ростка (лейкоэритробластическое соотношение достигает 10-20:1 и более). Гранулоциты при хроническом миелолейкозе обладают практически нормальной фагоцитарной и бактерицидной активностью.
Количество клеток базофильного и эозинофильного рядов увеличено, нередко встречаются аномальные формы; возможен мегакариоцитоз.

Гистологигеское исследование костного мозга при хроническом миелолейкозе. При исследовании костного мозга методом трепанобиопсии выявляется его гиперклеточность и выраженная миелоидная гиперплазия (лейко-эритробластическое соотношение более 10:1); количество предшественников эритроцитов уменьшено. Мегакариоцитоз отмечается у 40-50%, возможен морфологический атипизм клеток. При прогрессировании (фаза акселерации) нередко развивается ретикулиновый, реже — коллагеновый фиброз костного мозга.
Цитогенетическое и молекулярно-генетическое исследование при хроническом миелолейкозе. При цитогенетическом исследовании у 95-97% больных выявляется Ph-хромосома. При отсутствии Ph-хромосомы методом флюоресцентной гибридизации in situ (FISH) можно обнаружить 1 клетку с транслокацией BCR-ABL на 200-500 нормальных клеток. Метод удобен для мониторинга минимальной остаточной болезни, выполняется на образцах периферической крови, цитологических и морфологических препаратах крови и костного мозга, срезах гистологических препаратов.
Для диагностики и мониторирования заболевания используется также ПЦР, которая позволяет выявить одну патологическую клетку среди 10 4 -10 6 нормальных.
При отрицательных результатах обоих методов (цитогенетического и молекулярно-генетического) диагностируется один из вариантов МДС/МПЗ.
При молекулярно-генетических исследованиях у больных в фазе акселерации и бластном кризе выявляются повреждения ряда генов (ТР53, RBI, MYC, RAS, pl6, AML1, EVI1), однако их роль в трансформации заболевания пока не установлена.

Цитохимические исследования при хроническом миелолейкозе. Характерным цитохимическим признаком развернутой фазы хронического миелолейкоза является резкое снижение уровня щелочной фосфатазы нейтрофилов — до 2-4 ед. (норма — 8-80 ед.). Нормальные или повышенные показатели не исключают диагноза хронического миелолейкоза.
Биохимические исследования при хроническом миелолейкозе. Характерно увеличение уровня сывороточного витамина В12 и витамин В12-связывающей способности сыворотки крови вследствие увеличенной продукции транскобаламина гранулоцитами. Повышенное разрушение клеток приводит к гиперурикемии, особенно при цитостатической терапии. Может выявляться также повышение железосвязывающей способности сыворотки крови, уровня гистамина, снижение лейцинаминопептидазы.
Диагноз хронического миелолейкоза ставится на основании клинико-лабораторных данных (спленомегалия, лейкоцитоз со сдвигом в лейкоцитарной формуле влево и наличием промежуточных форм нейтрофилов, эозинофильно-базофильная ассоциация, усиленный миелопоэз в костном мозге, низкий уровень щелочной фосфатазы нейтрофилов) и подтверждается обнаружением Ph-хромосомы, t(9;22)(q34;qll.2) или гена BCR-ABL (цитогенетическими или молекулярно-генетическими методами).
Выделяют 3 стадии хронического миелолейкоза: хроническую, фазу акселерации и бластный криз.

- Хроническая фаза хронического миелолейкоза: нет признаков других фаз заболевания; нет симптомов (после лечения).
- Фаза акселерации (при наличии одного и более признаков) хронического миелолейкоза:
1) 10-19% бластов в крови или костном мозге;
2) количество базофилов в периферической крови не менее 20%;
3) персистирующая тромбоцитопения (меньше 100 • 10 9 /л), не связанная с лечением, или персистирующий тромбоцитоз больше 1000 • 10 9 /л, резистентный к терапии;
4) нарастающие спленомегалия и лейкоцитоз, резистентные к терапии (удвоение количества лейкоцитов меньше 5 дней);
5) новые хромосомные изменения (появление нового клона).
Наряду с одним из вышеперечисленных признаков фазы акселерации обычно выявляется пролиферация мегакариоцитов, ассоциирующаяся с ретикулиновым или коллагеновым фиброзом, или выраженная дисплазия гранулоцитарного ростка.
- Бластный криз хронического миелолейкоза:
1) не менее 20% бластов в крови или костном мозге;
2) экстрамедуллярная пролиферация властных клеток;
3) большое количество агрегатов бластных клеток в трепанобиоптате.
Основной лабораторный признак фазы акселерации и бластного криза — прогрессирующее увеличение промиелоцитов и бластов в периферической крови и костном мозге. При цитохимических исследованиях в фазе бластного криза у 70% пациентов определяется миелоидный, у 30% — лимфоидный вариант, которые имеют сходные черты соответственно с ОМЛ и ОЛЛ:
а) средний возраст больных с лимфоидным кризом меньше, чем больных с миелоидным;
б) нейролейкоз чаще развивается у больных с лимфоидным кризом;
в) непосредственные результаты лечения при лимфоидном варианте криза существенно лучше.
Как уже упоминалось, среди хронических лейкозов выделяют миело-пролиферативные и лимфопролиферативные заболевания. К числу хронических миелопролиферативных процессов относят хронический миелолей-коз, эритремию (истинную полицитемию), идиопатический миелофиброз (сублейкемический миелоз), эссенциальную тромбоцитемию (хронический мегакариоцитарный лейкоз, геморрагическая тромбоцитемия).
Для всей группы миелопролиферативных заболеваний (лейкозов) характерен дефект (мутация) на уровне полипотентной стволовой клетки, этот дефект далее продуцируется на следующем классе стволовых клеток (олигопотентных) — клетках-предшественницах смешанной культуры. Эти клетки дают начало трем линиям миелоидного кроветворения — эрит-роцитарного, гранулоцитарного и мегакариоцитарного. Создается миело-идная пролиферация — основной признак, характеризующий субстрат этих заболеваний, при этом продукция клеток осуществляется из одного или нескольких ростков миелоидного кроветворения (эритробластическо-го, гранулоцитарного, мегакариоцитарного). Все сказанное объединяет, казалось бы, внешне различные заболевания миелопролиферативной природы — эритремию, хронический миелолейкоз, идиопатический миелофиброз, мегакариоцитарный лейкоз (тромбоцитемию).
К числу хронических лимфопролиферативных заболеваний относят хронический лимфолейкоз (различные его формы), а также группу пара-протеинемических гемобластозов — заболеваний, при которых опухолевые клетки секретируют патологический белок (парапротеин); к ним относятся: множественная миелома (миеломная болезнь); болезнь Вальден-стрема (макроглобулинемия); болезнь тяжелых цепей.
Далее будут рассмотрены наиболее часто встречающиеся хронические лейкозы: хронический миелолейкоз, эритремия, хронический лимфолейкоз, множественная миелома.
Хронический миелолейкоз (ХМЛ) — миелопролиферативное хроническое заболевание, при котором наблюдается повышенное образование гранулоцитов (преимущественно нейтрофилов, а также про-миелоцитов, миелоцитов, метамиелоцитов), являющихся субстратом опухоли.
Этиология и патогенез.Причиной патологического роста клеток считается мутация клетки-предшественницы миелопоэза (частично детерминированная полипотентная клетка). Это доказывается обнаружением у больных ХМЛ специфического маркера — патологической Ph-хромосомы (филадельфийской) в клетках миелоидного, эритроидного, моноцитарно-го и тромбоцитарного рядов. Ph-хромосома является частым клеточным маркером, подтверждающим происхождение всего патологического клона клеток при ХМЛ от одной материнской. Несмотря на то что лейкозными являются все три ростка костного мозга, в развернутой стадии ХМЛ наблюдается безграничный рост, как правило, одного ростка — гранулоци-тарного. Существенно повышается в костном мозге продукция мегакарио-цитов, в периферической крови — тромбоцитов.
По мере течения болезни моноклоновая стадия сменяется поликлоно-вой, что доказывается появлением клеток с различным неправильным набором хромосом. В этом проявляется закон опухолевой прогрессии, которому подчиняется данный лейкоз.
ХМЛ чаще наблюдается у взрослых в возрасте 30 — 70 лет; отмечается небольшое преобладание мужчин.
Классификация.Как отмечалось, заболевание закономерно проходит в своем развитии две стадии — моноклоновую и поликлоновую. Этому соответствуют три стадии хронического миелолейкоза в клиническом отображении:
Стадия I — начальная — миелоидная пролиферация костного мозга + небольшие изменения в крови без явлений интоксикации.
Стадия II — развернутая — выраженные клинико-гематологические проявления (интоксикация продуктами распада лейкозных клеток, увеличение печени и селезенки, миелоидная пролиферация костного мозга + изменения в крови).
Стадия III — терминальная (соответствует развитию поликлоновой опухоли) — рефрактерность к проводимой цитостатической терапии, истощение, значительное увеличение селезенки и печени, дистрофические изменения внутренних органов, выраженные изменения крови (анемия, тромбоцитопения).
Для терминальной стадии ХМЛ характерно развитие так называемых бластных кризов — появление в периферической крови бластных клеток (до 30 — 90 %), в связи с чем заболевание приобретает черты острого лейкоза. Чаще всего в костном мозге и периферической крови бластный криз характеризуется появлением миелобластов, однако могут встретиться и недифференцируемые бластные клетки. При кариологическом исследовании выявляется поликлоновость патологических клеток. Одновременно происходит значительное угнетение тромбоцитопоэза, развивается геморрагический синдром. Встречается также лимфобластный вариант бластно-го криза (в костном мозге и периферической крови появляется большое количество лимфобластов).
Клиническая картина.Клинические проявления ХМЛ могут выражаться большими синдромами:
Миелопролиферативный синдром, в основе которого лежит миелоид-ная пролиферация костного мозга, включает:
а) общие симптомы, вызванные интоксикацией, разрастаниями лей-
козных клеток в костном мозге, селезенке и печени (потливость, слабость,
снижение массы тела, тяжесть и боль в области селезенки и печени), ос-
салгии;
б) увеличение печени и селезенки;
в) лейкемические инфильтраты в коже;
г) характерные изменения в костном мозге и периферической крови.
Синдром, обусловленный осложнениями:
а) геморрагический диатез (геморрагии и тромбозы вследствие нару
шения прокоагулянтного и тромбоцитарного звеньев гемостаза);
б) гнойно-воспалительные (пневмонии, плевриты, бронхиты, гной
ные поражения кожи и подкожной жировой клетчатки), обусловленные
резким снижением активности иммунитета;
в) мочекислый диатез (гиперурикемия вследствие повышенного рас
пада гранулоцитов).
Различная выраженность синдромов на разных стадиях болезни обусловливает достаточно полиморфную клиническую картину. Можно наблюдать больных, не предъявляющих никаких жалоб и вполне трудоспособных, и больных с тяжелыми поражениями внутренних органов, истощенных, полностью потерявших трудоспособность.
На I этапе диагностического поиска в начальной стадии болезни больные могут не предъявлять жалоб, и заболевание будет диагностировано на последующих этапах. Жалобы общего характера (слабость, потливость, снижение массы тела) могут встречаться при самых разных заболеваниях, поэтому рассматривать их на I этапе как специфические для ХМЛ нельзя. Лишь позже, при выявлении других симптомов, указывающих на ХМЛ, они могут быть интерпретированы как выражение миелопролифе-ративного синдрома.
Тяжесть и боли в области левого и правого подреберий обычно объясняются увеличением селезенки и печени. В сочетании с жалобами общего характера и болями в костях они могут ориентировать врача в отношении возможного объяснения этих симптомов миелопролиферативным синдромом.
В терминальной стадии болезни часть жалоб может быть обусловлена возникновением осложнений: гнойно-воспалительных, геморрагического диатеза, мочекислого диатеза.
На I этапе можно получить сведения об изменениях при исследовании крови и проводившемся ранее лечении (цитостатические препараты). Следовательно, если в поле зрения врача попадает больной, которому уже ставили диагноз ХМЛ, последующий диагностический поиск значительно упрощается. Важно выяснить у больных сведения о ранее проводившемся лечении и неэффективности препаратов, до данного момента улучшающих общее состояние, снижавших количество лейкоцитов. Такая информация заставит предположить переход в поликлоновую (терминальную) стадию болезни.
На II этапе диагностического поиска возможно получение сведений, позволяющих высказать предположение:
1) о характере патологического процесса, т.е. существе самого заболевания; 2) о стадии заболевания; 3) о возможных осложнениях.
В развернутой и терминальной стадиях выявляются признаки, в существенной мере подтверждающие предположение о ХМ Л: бледность кожных покровов (обусловлена нарастающей анемизацией), кожные геморрагии и инфильтраты (более характерны для терминальной стадии ХМЛ). Существенным признаком является спленомегалия (без увеличения лимфатических узлов), сочетающаяся с увеличением печени, что при соответствующих жалобах и анамнезе может быть расценено как проявление миелопролиферативного синдрома.
При развитии осложнений, например инфаркте селезенки, отмечается резкая болезненность ее при пальпации, шум трения брюшины над селезенкой. Постепенно селезенка становится плотной (ее масса составляет 6 — 9 кг, спускается нижним полюсом в малый таз).
Наиболее важные данные для диагноза ХМЛ получают на III э т а п е диагностического поиска. При исследовании периферической крови обнаруживают лейкоцитоз с появлением в лейкоцитарной формуле пролифе-рирующих форм (миелобласты и промиелоциты) и созревающих грануло-цитов (миелоциты, метамиелоциты); имеется базофильно-эозинофильная ассоциация. Число лейкоцитов колеблется в широких пределах, достигая в выраженных случаях 100 —20010 9 /л, однако в терминальной стадии лейкоцитоз может значительно уменьшиться и даже развивается лейкопения. В ранних стадиях болезни возможно обнаружение гипертромбоцито-за. Развитие нормомакроцитарной анемии, связанной в основном с вытеснением лейкозным клоном красного ростка кроветворения, можно наблюдать в развернутой клинико-гематологической стадии. В терминальной стадии анемия становится еще более выраженной.
При исследовании костного мозга обнаруживают миелоидную пролиферацию костного мозга, нормальный миелопоэз полностью замещен патологическим клоном. В мазке костного мозга преобладают гранулоциты: соотношение лейкоциты/эритроциты достигает 10:1, 20:1 за счет увеличения гранулоцитов. Если в периферической крови высокий тромбоцитоз, то в костном мозге отмечается большое количество мегакариоцитов.
Функциональные свойства лейкоцитов и содержание в них ферментов изменены: снижена активность щелочной фосфатазы нейтрофилов, нарушена способность к фагоцитозу. При пункции увеличенной селезенки в развернутой стадии болезни обнаруживается преобладание миелоидных клеток.
Данный этап оказывается решающим в идентификации бластного криза: нарастание количества бластных клеток в костном мозге и периферической крови (суммарное количество бластов и промиелоцитов равно 20 % и более, тогда как вне бластного криза это количество обычно не превышает 10-15 %).
Сцинтиграфия костей помогает обнаружить увеличение плацдарма кроветворения (исследование производят при неясном диагнозе и оно не является обязательным для всех больных ХМЛ).
Диагностика.Выявление ХМЛ в развернутой стадии болезни не представляет трудностей и основывается на характерных данных анализа крови, результатах исследования костного мозга, увеличении печени и селезенки.
14*
Диагностическими критериями заболевания являются:
• лейкоцитоз более 2010 9 /л;
• появление в лейкоцитарной формуле пролиферирующих форм (ми-
елобласты и промиелоциты) и созревающих гранулоцитов (миело-
циты, метамиелоциты );
• миелоидная пролиферация костного мозга (по данным миелограм-
мы и трепанобиопсии);
• снижение активности щелочной фосфатазы нейтрофилов (менее 25
ед.);
• обнаружение Ph-хромосомы в кроветворных клетках;
• увеличение размеров селезенки и печени.
Лечение.Основная задача лечения любого гемобластоза (в том числе и ХМЛ) — ликвидация или подавление роста патологического клона клеток. Однако применительно к хроническим лейкозам это не означает, что любого больного, у которого обнаруживается заболевание системы крови, сразу же нужно активно лечить цитостатическими препаратами, подавляющими опухолевый рост.
• В начальной стадии болезни (при хорошем самочувствии, но несо
мненных изменениях в периферической крови и костном мозге) не
обходимы общеукрепляющая терапия, правильное питание, соблю
дение режима труда и отдыха (очень важно избегать инсоляции).
Больной должен находиться под наблюдением врача; периодически
(1 раз в 3 — 6 мес) необходимо исследовать периферическую кровь.
• При появлении симптомов прогрессирования болезни необходимо
проводить цитостатическую терапию, при этом объем такого лече
ния зависит от стадии заболевания (схема 24). При появлении от
четливых симптомов опухолевого роста (увеличение размеров селе
зенки, печени, а также повышение количества лейкоцитов по срав
нению с предшествующим периодом болезни) проводят так назы
ваемую первично-сдерживающую терапию. Обычно лечение начи
нают при содержании лейкоцитов 50 —7010 9 /л. Амбулаторно при
меняют гидроксимочевину (гидреа) в невысоких дозах (при обяза-
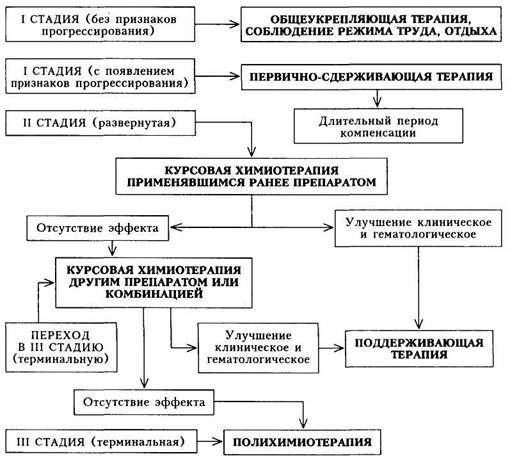 |
| Схема 24. Принципы лечения хронического миелолейкоза |
тельном гематологическом контроле); после достижения клинической и(или) гематологической ремиссии решается вопрос о поддерживающей терапии.
♦ лейкоцитоз более 20010 9 /л, бластемия более 3 %, сумма бластов
и промиелоцитов в крови более 20 %, количество базофилов в
крови более 10 %;
♦ снижение гемоглобина до уровня менее 90 г/л;
♦ тромбоцитоз более 500-10 9 /л или тромбоцитопения менее
10010 9 /л;
♦ сп леном егалия (селезенка пальпируется на 10 см ниже реберной
дуги и более);
♦ гепатомегалия (печень пальпируется на 5 см ниже реберной дуги
и более).
Низкий риск — наличие одного признака; промежуточный риск — наличие 2 — 3 признаков; высокий риск — наличие 4 признаков и более. При низком и промежуточном риске изначально показана монохимиотерапия, при высоком риске с самого начала рекомендуется полихимиотерапия (как следует из схемы 23, полихимиотерапию назначают также в IIIстадии болезни).
В развернутой стадии проводится курсовая химиотерапия. Используют тот же препарат, но в больших дозах (ежедневно 2 — 3 приема) под гематологическим контролем: при снижении количества лейкоцитов и тромбоцитов дозу препарата уменьшают, а при содержании лейкоцитов 10 —2010 9 /л и тромбоцитов 100-10 9 /л препарат отменяют. Если ранее эффективные препараты не оказывают действия в течение 3 — 4 нед, то следует провести курс лечения другим цитостатиком. Так, если гид pea оказывается неэффективной, то назначают миелосан (бусульфан, милеран), миелобромол.
• После курсовой химиотерапии проводится поддерживающая тера
пия по схеме, близкой к схеме первично-сдерживающей терапии.
Применяют препараты, оказавшие терапевтический эффект при
курсовой химиотерапии.
• Полихимиотерапия проводится курсами при высокой степени
риска, а также в терминальной стадии ХМЛ; при бластном кризе —
в объеме, соответствующем терапии при ОЛ. Используют препара
ты, оказывающие цитостатическое действие на пролиферирующие
элементы (цитозар, метотрексат, циклофосфан, 6-меркаптопурин,
противоопухолевый антибиотик — рубомицина гидрохлорид).
Курсы полихимиотерапии короткие — 5 —14 дней с перерывами в
7 — 10 дней.
• В настоящее время появились принципиально новые методы лече
ния ХМЛ — использование такого цитокина, как альфа-интерфе
рон (а-ИФН). Дело в том, что в процессе миелоидной пролифера
ции мегакариоциты и тромбоциты выделяют большое количество
ростовых факторов, которые сами по себе способствуют дальней
шей пролиферации мутантных полипотентных и олигопотентных
стволовых клеток, а кроме того, и стромальных клеток. Все это
ведет к дальнейшему прогрессированию болезни, а также развитию
фиброзных изменений костного мозга. Между тем доказано, что
а-ИФН по своему химическому строению и функциональным дей
ствиям является антагонистом ростовых факторов. а-ИФН выде
ляет субстанции, которые тормозят стимулирующее действие мега-
кариоцитов на кроветворение и обладают антипролиферативной
активностью по отношению к родоначальным клеткам кроветворе
ния, так что эти клетки выводятся из пролиферации. а-ИФНтакже
стимулирует противоопухолевый иммунитет. Следовательно, созда
ются условия сохранения нормального кроветворения (во всяком
случае, его преобладание), при этом а-ИФНне обладает цитостати-
ческим действием, что является весьма привлекательным его свой
ством, так как отсутствует депрессивное влияние на нормальные
клетки костного мозга.
вышение температуры, головная боль, ломота в мышцах, общее плохое самочувствие, однако прием парацетамола купирует эти явления.
Реаферон, интрон А иногда комбинируют с цитостатическим препаратом — гидреа или цитозин-арабинозидом (цитозаром), что позволяет улучшить результаты лечения; 5-летняя выживаемость при лечении Ин-троном А 82 —89 мес (у 50 % больных), тогда как при лечении миелосаном этот показатель равен 44 — 48 мес.
Весьма существенно, что при лечении а-ИФН может наступить не только гематологическая, но и цитогенетическая ремиссия, когда в клетках крови и костного мозга Ph-хромосома вообще не определяется, что позволяет говорить не столько о ремиссии, сколько о полном выздоровлении отХМЛ.
• При значительном увеличении селезенки иногда осуществляют об
лучение рентгеновскими лучами, что приводит к уменьшению ее
размеров.
• При гнойно-воспалительных осложнениях проводят антибиотикоте-
рапию. Гемотрансфузии при ХМ Л показаны при выраженном ане
мическом синдроме, не поддающемся цитостатической терапии, или
лечении препаратами железа при железодефицитном ее происхож
дении. Больных ХМЛ ставят на диспансерный учет, проводят пери
одические осмотры с обязательным гематологическим контролем.
Прогноз.Длительность жизни больных ХМЛ в среднем составляет 3 — 5 лет, у отдельных больных достигает 7 — 8 лет.
Профилактика.Точных мер предупреждения ХМЛ не существует, в связи с чем можно говорить лишь о вторичной профилактике болезни, которая состоит в предупреждении обострений болезни (поддерживающая терапия, исключение инсоляции, простудных заболеваний и пр.).
Содержание:
- Отличие лейкоза: острого и хронического
- Классификация лейкозов
- Симптоматика
- Диагностика
- Лечение
← Как происходит пересадка костного мозга при лейкемии?
Сведения об остром промиелоцитарном лейкозе →
Фазы развития заболевания
В развитии патологии медики выделяют три стадии. Первая стадия носит название медленной, или хронической, которая может протекать до трех лет. Ухудшение симптомов заболевания после этого периода говорит о вступлении болезни в новую фазу – фазу акселерации. В этой фазе при мощном и своевременном лечении рак крови можно перевести в предыдущую фазу. Обычно такая фаза длится до полутора лет. После чего либо проходит ухудшение состояния здоровья пациента, либо его здоровье стабилизируется. а опухоль поддается контролю.
Отличие лейкоза: острого и хронического
Ранняя стадия острого лейкоза характерна накапливанием незрелых клеток и отсутствием их роста. Их переизбыток в 80% случаев угнетает нормальное кроветворение ростков. Хронический лейкоз способствует синтезу развитых клеток — гранулоцитов для постепенного замещения в периферической крови здоровых клеток.
Важно знать. Лейкоз хронический НЕ становится острым лейкозом и наоборот.
Симптомы у взрослых в начальной стадии острого лейкоза нередко проходят незамеченными, поскольку в крови больших колебаний биохимических показателей в сторону повышения или понижения не бывает. Позднее:
- появится ощущение ослабленности;
- имеющиеся хронические болезни обострятся;
- возможно активирование вируса герпеса и иного вида вирусных и бактериальных инфекций.
Рекомендуем изучить по данной теме также:
Химиотерапия как способ лечения острого миелобластного лейкоза
В развернутом периоде начинают ярко выражаться клинические и гематологические проявления острого лейкоза. Обострения переходят в ремиссии. Болезнь полностью излечивается или переходит в терминальную стадию.
Важно. В течение 5 лет при отсутствии бластных клеток в периферической крови устанавливается клинико-гематологическое излечивание (полная ремиссия).
В терминальной стадии цитостатики, используемые для лечения острого лейкоза, перестают действовать. Это становится причиной полного угнетения кроветворной системы. Даже при трансплантации костного мозга в этот период крайне высока смертность людей.
Если лейкоз хронический, то в крови присутствуют дозревшие клетки, многие из которых не способны выполнять свою прямую функциональную работу. При исследовании лабораторных анализов в крови выявляют повышенный уровень бесполезных лейкоцитов. Они не защищают организм от инфекций.
Тогда у пациентов возникает вопрос: хронический лейкоз — болезнь проходит или нет? При переизбытке гранулоцитов, мешающих кровотоку, избыток лейкоцитов и онкоклеток удаляют посредством лейкофареза. Процедура обеспечивает быстрый, но временный эффект.
Начальной фазы у хронического заболевания может и не быть, в 50% его выявляют по анализу крови по другому поводу. Даже при подтверждении диагноза хроническая болезнь может протекать на моностадии доброкачественно, поскольку опухоль состоит из одного клона клеток.
На последующей стадии появляются вторичные клоны опухоли. Поликлоновая стадия протекает быстро на фоне увеличения количества бластов. Эту стадию еще называют бластным кризом, поскольку 80% пациентов при этом погибают.
Лейкоз хронический проявляется:
- сплено- и гепатомегалией — увеличиваются в размере печень и селезенка;
- общей анемией с хроническим течением;
- генерализованные поражения лимфоузлов.
Причины заболевания
Хронический лейкоз возникает чаще всего у людей зрелого возраста, заболевание диагностируется в большинстве случаев у пациентов старше сорока лет. Преимущественно страдают хроническим лейкозом мужчины. У детей белокровие диагностируется довольно редко – всего в одном проценте случаев.
Точные причины заболевания установить до сегодняшнего времени не удалось. Сейчас разрабатывается вирусно-генетическая теория гемобластозов, согласно которой пусковым механизмом для заболевания может стать проникновение в организм определенных вирусов, например, Эпштейна-Барра, ретровирусов, способных встраиваться в незрелые клетки крови и провоцировать их бесконтрольное деление.
Врачи утверждают, что определенную роль в заболевании играет и наследственный фактор, ведь по статистике у значительного числа пациентов с лейкозом подобные заболевания диагностировались и у ближайших родственников. Также может возникать хроническая лейкемия и по вине 22 хромосомы, которая может нести в себе аномалию.
Не последнюю роль играет и негативное внешнее воздействие на организм – получение высоких доз радиации, рентгеновское облучение, работа во вредной промышленности (например, производство лакокрасочных изделий, фармацевтических препаратов, работа на золотоприисках). Риск развития увеличивается при табакокурении, чрезмерном употреблении алкогольных напитков, контакте с химикатами, удобрениями.
Классификация лейкозов
Если подтверждены хронические лейкозы — классификация включает две подгруппы:
- миелоидную;
- лимфоидную.
Миелоидная подгруппа состоит из хронических миелопролиферативных лейкозов:
- миелолейкоза;
- миелоза сублейкемического (остеомиелосклероза, миелофиброза);
- эритремии (истинной полицетемии);
- миеломоноцитарного;
- моноцитарного;
- мегакариоцитарного (идиопатической тромбоцитемии).
Важно. При хроническом миелолейкозе происходит пролиферация стволовой клетки в сопровождении повышения уровня предшественников гранулоцитов, эритроцитов и тромбоцитов.
Лимфоидная подгруппа состоит из лимфопролиферативных лейкозов:
- лимфолейкоза хронического;
- плазмоцитомы (миеломной болезни);
- лимфогранулематоза;
- лимфомы неходжкинской.
Ранее мы уже писали о лейкозе у детей и рекомендовали добавить эту статью в закладки.
Важно. При лимфолейкозе хронической стадии происходит пролиферация малых лимфоцитов: мозга костей, ЛУ, печени, селезенки и периферической крови.
Симптоматика
Опасные симптомы у взрослых проявляются признаками лейкемии: соматическими и гематологическими. Первичные соматические проявления белокровия характерны:
- ощущением постоянного утомления, слабости и недомогания;
- постоянным желанием спать или бессонницей;
- нарушением деятельности мозга: больные жалуются на ухудшение памяти, невозможность сосредоточиться;
- изменением цвета кожи (она становится бледной), долгим заживлением ран, синяков и мелких царапинок, проявлением нагноений;
- кровотечениями из десен и носа;
- ломотой и болями в любом суставе или кости;
- увеличением печени, селезенки и лимфоузлов;
- настырными простудами, обострением хронических форм болезней, как герпес, тонзиллит, бронхит, пиелонефрит;
- снижением веса на фоне отсутствия аппетита.
- повышается или понижается СОЭ;
- повышаются лейкоциты и проявляется лейкоцитоз;
- снижается гемоглобин в крови (проявляется анемия).
Диагностика
По анализу крови узнают количество кровяных клеток. При хроническом лейкозе лейкоциты повышаются, эритроциты и тромбоциты — снижаются. По биохимическому анализу крови уточняется функция почек и состав крови.
- красного мозга костей подтверждается диагноз и оценивается лечение хронического лейкоза;
- спинномозгового экссудата (пункции) — выявляются онкоклетки и проводится химиотерапия.
Чтобы уточнить тип лейкоза, исследуют цитохимию, проточную цитометрию, иммуноцитохимию, цитогенетику и молекулярную генетику. По рентгенограмме грудины и костей выявляют пораженные лимфоузлы средостения, костных суставов.
По КТ обнаруживают пораженные ЛУ в грудине и животе. МРТ исследуют мозг головы и спины. УЗИ необходимо для отличия новообразований: опухолевых и кистозных, выявления поражений в почках, печени, селезенке и ЛУ.
Лечение
Тактику лечения выбирают, зависимо от группы риска. Пациентов в группе с низким риском наблюдают, а при появлении явных симптомов назначают лечение. Прогноз выживаемости — 20-25 лет.
В группе с промежуточным и высоким риском больным терапию временно не применяют, если отсутствуют симптомы. Далее основным лечением будет являться химиотерапия с применением мощных лекарств. Препараты уничтожают лейкозные клетки, которые быстро и бесконтрольно делятся, нарушая важные этапы цикла. При этом могут повредиться и нормальные клетки.
Лечение лимфобластного лейкоза проводится рядом агентов: L-аспарагиназой или PEG-L- аспарагиназой, Даунорубицином (Дауномицином), Винкристином, Преднизолоном. Из других препаратов — Доксорубицином, Цитарабином, Этопозидом, Дексаметазоном.
Применяют Хлорамбуцил, или заменяют его Циклофосфамидом с меньшими побочными эффектами Как рассчитывается для взрослых максимальная доза Дексаметазона при лечении хронических лейкозов?
Дозировку внутривенных струйных или капельных вливаний, инъекций внутримышечных назначает врач. За первые сутки вводят 4-20 мг 3-4 приемами. Курс — 3-5 дней. Для капельного введения пользуются раствором натрия хлорида изотонического или 5%-ного декстрозного раствора.
Если лейкоз хронический, лечение Дексаметазоном в таблетках назначают по 0,5 мг или 1,5 мг с едой. За сутки максимальная доза составляет 15 мг (не более), минимальная — 1 мг. При установлении стабильного состояния дозу снижают до 3 мг/сутки. Детям рассчитывают 83,3-333,3 мкг/кг.
Эффективно лечение хронического миелоидного лейкоза Мезилатом иматиниба (Гливеком). Хронического лимфолейкоза — Флударабином с Циклофосфамидом.
Нередко проводят трансплантацию костного мозга в самом начале комплексной терапии для улучшения результатов. При этом проводится химиотерапия и облучение (редко) для уничтожения онкоклеток, а также вливание стволовых клеток для прорастания в костный мозг и вырабатывания нормальных здоровых клеток.
Проводят радиоиммунотерапию, Т клеточную иммунотерапию для облучения онкоклеток с минимальным повреждением здоровых тканей, для минимилизации токсичности для больного и предотвращения рецидива. Лучевой терапией по спирали вокруг опухоли достигают эффекта и уменьшают травматизацию здоровых клеток, что снижает количество осложнений.
Для лечения хронического лейкоза необходимо применять комплексную терапию: химиотерапию, операции, радиоиммунотерапию, Т клеточную иммунотерапию, моноклональные антитела и стволовые клетки для трансплантации.
← Как происходит пересадка костного мозга при лейкемии?
Сведения об остром промиелоцитарном лейкозе →
Прогноз
Дальнейшая жизнь пациента, ее качество и длительность зависит от типа рака и своевременности лечения. В среднем при раннем диагностировании большинство больных живут 10 лет и больше, при средне запущенной болезни – 5-7, при поздней медицинской помощи – 1-3 года. Так же на прогноз влияет возраст. Чем меньше возраст пациента, тем больше шансов на длительную ремиссию или даже полное выздоровление.
Стоит отметить, что повторный криз еще не означает смерть – если прошлое лечение хорошо подействовало и прошло много времени, это же лечение может исцелить пациента снова. В крайнем случае врач может назначить другую химиотерапию, которая, возможно, окажется более эффективной.
Читайте также:

