Диссеминация опухоли по брюшине это
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
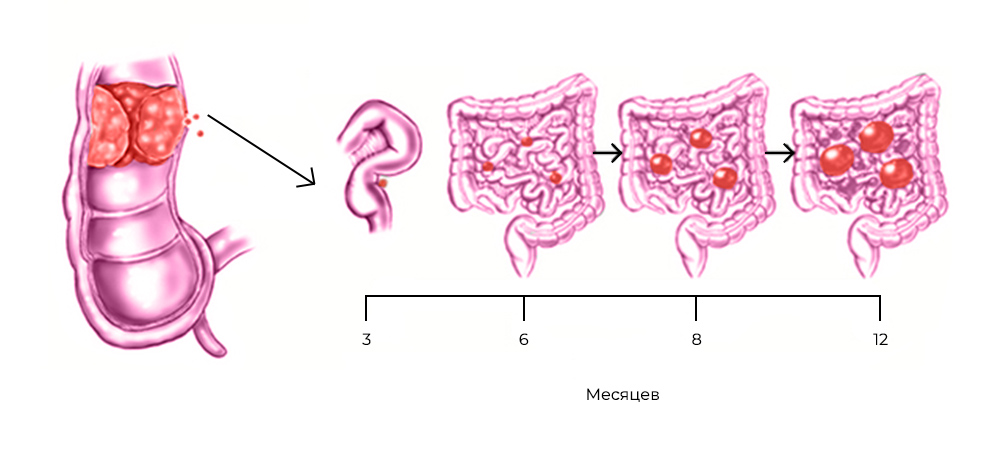
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
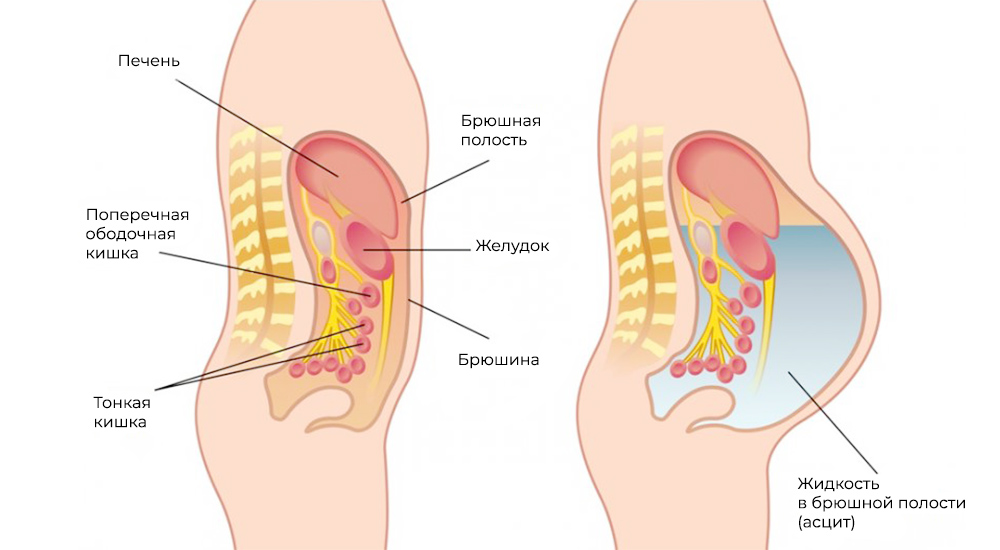
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
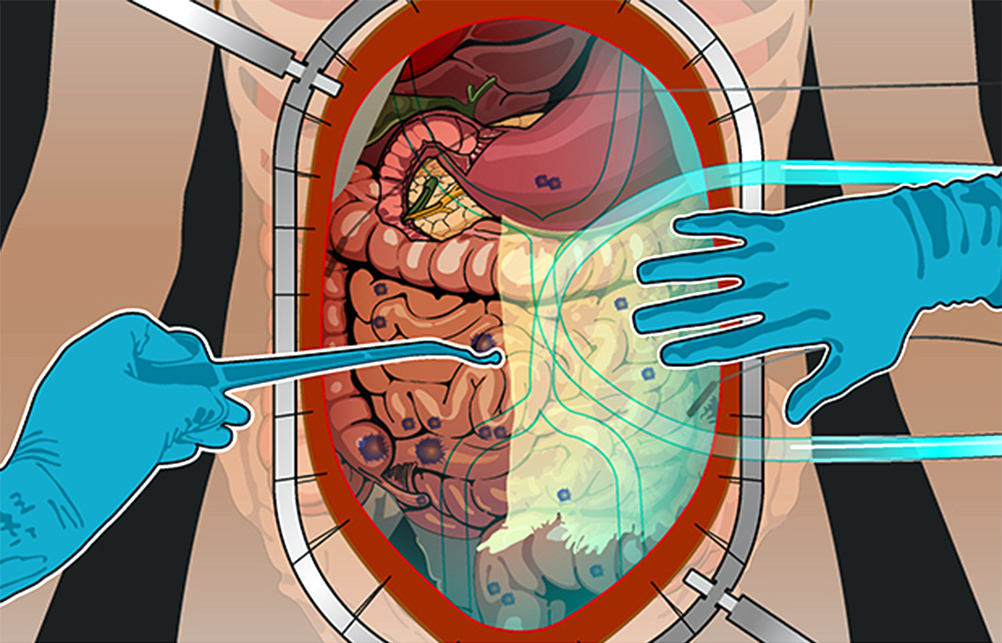
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
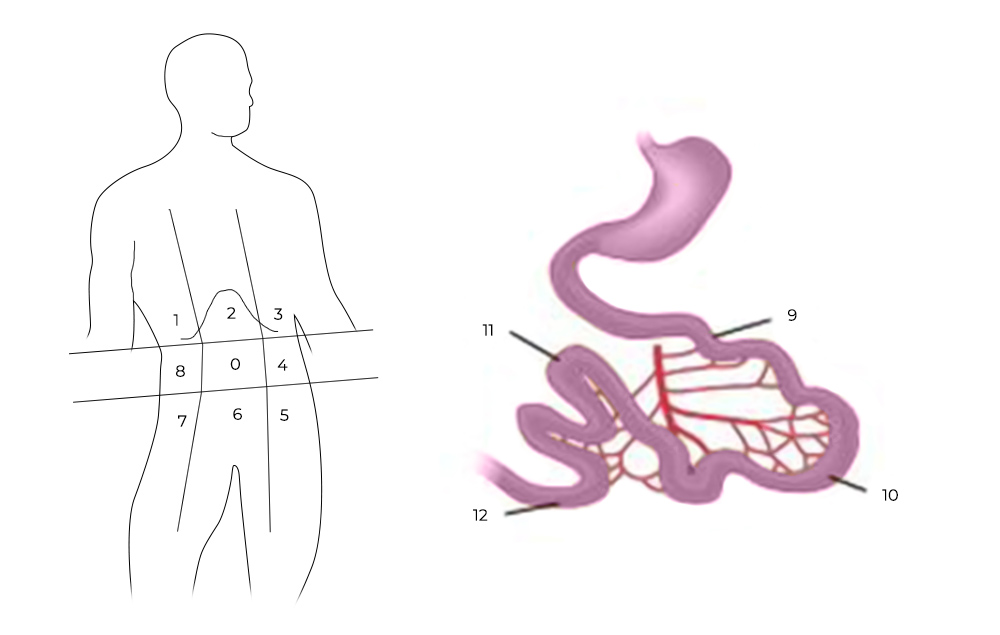
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
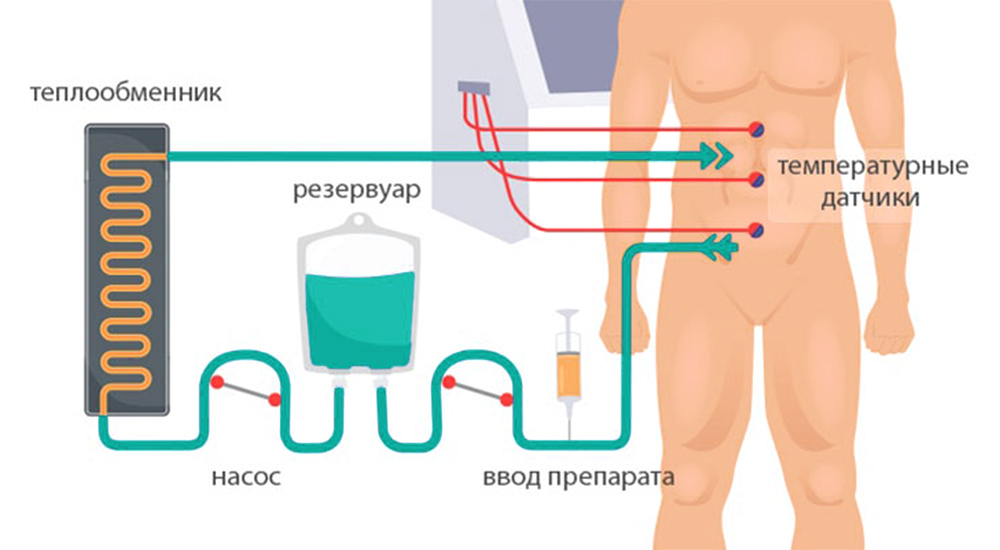
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
- Причины канцероматоза брюшины
- При каких заболеваниях развивается
- Диагностика канцероматоза брюшины
- Стадии канцероматоза брюшной полости
- Симптомы канцероматоза брюшной полости
- Как лечат канцероматоз брюшины
- Какие методики терапии дают лучший результат
- Прогноз при канцероматозном поражении
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.
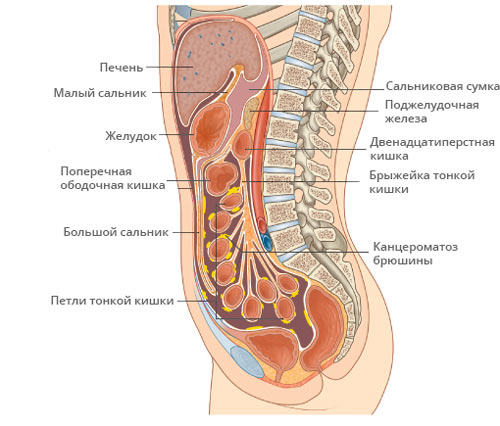
Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.

При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Опухоли брюшины – группа доброкачественных и злокачественных новообразований серозной оболочки, покрывающей внутренние органы и внутренние стенки брюшной полости. Злокачественные опухоли могут быть как первичными, так и вторичными, но чаще имеют метастатический характер. Доброкачественные новообразования протекают бессимптомно либо сопровождаются признаками сдавления близлежащих органов. Злокачественные опухоли брюшины проявляются болями и асцитом. Диагноз выставляется на основании жалоб, данных осмотра, результатов анализа на онкомаркеры, КТ, лапароскопии, иммуногистохимического и гистологического исследования. Лечение – операция, лучевая терапия, химиотерапия.
- Классификация опухолей брюшины
- Виды опухолевого поражения брюшины
- Доброкачественные опухоли брюшины
- Первичные злокачественные опухоли брюшины
- Псевдомиксома брюшины
- Одиночные вторичные злокачественные опухоли брюшины
- Канцероматоз брюшины
- Цены на лечение
Общие сведения
Опухоли брюшины – новообразования различного происхождения, локализующиеся в области висцерального и париетального листков брюшины, малого сальника, большого сальника и брыжеек полых органов. Доброкачественные и первичные злокачественные новообразования брюшины диагностируются редко. Вторичные опухоли брюшины являются более распространенной патологией, возникают при онкологическом поражении органов брюшной полости и забрюшинного пространства, внутренних женских и мужских половых органов. Прогноз при доброкачественных поражениях обычно благоприятный, при злокачественных – неблагоприятный. Лечение осуществляют специалисты в области онкологии и абдоминальной хирургии.

Классификация опухолей брюшины
Различают три основные группы новообразований брюшины:
- Доброкачественные опухоли брюшины (ангиомы, нейрофибромы, фибромы, липомы, лимфангиомы)
- Первичные злокачественные опухоли брюшины (мезотелиомы)
- Вторичные злокачественные опухоли брюшины, возникающие при распространении злокачественных клеток из другого органа.
Существуют также слизеобразующие новообразования (псевдомиксомы), которые одни исследователи рассматривают, как первичные, а другие – как вторичные опухоли брюшины различной степени злокачественности. В большинстве случаев вторичное поражение брюшины развивается в результате агрессивного местного роста новообразований и имплантационного распространения раковых клеток из органов, расположенных интраперитонеально, мезоперитонеально или экстраперитонеально.
Опухоли брюшины, возникшие в результате имплантационного метастазирования, могут выявляться при раке желудка, тонкого и толстого кишечника, печени, поджелудочной железы, желчного пузыря, почки, тела матки, шейки матки, яичников, предстательной железы, передней брюшной стенки и т. д. Реже наблюдается лимфогенное распространение метастазов опухолей грудной клетки (например, рака легких), обусловленное ретроградным движением лимфы по лимфатическим путям.
Виды опухолевого поражения брюшины
Являются очень редкой патологией. Причины развития неизвестны. Болезнь может годами протекать бессимптомно. В отдельных случаях опухоли брюшины достигают огромных размеров, не оказывая существенного влияния на состояние пациента. В литературе описан случай удаления липомы сальника весом 22 килограмма. При крупных узлах выявляется увеличение живота. Иногда доброкачественные опухоли брюшины становятся причиной сдавления близлежащих органов. Боли нехарактерны. Асцит возникает исключительно редко. Диагноз устанавливается по результатам лапароскопии. Показанием к операции является компрессионное воздействие новообразования на соседние органы.
Мезотелиомы брюшины встречаются редко. Обычно обнаруживаются у мужчин старше 50 лет. Фактором риска является длительный контакт с асбестом. Проявляются болевым синдромом, снижением массы тела и симптомами сдавления близлежащих органов. При достаточно крупных опухолях брюшины может выявляться асимметричное выпячивание в области живота. При пальпации обнаруживаются одиночные или множественные опухолевидные образования различного размера.
Характерно быстрое прогрессирование симптоматики. При сдавлении воротной вены развивается асцит. Из-за отсутствия специфических признаков диагностика злокачественных опухолей брюшины затруднительна. Нередко диагноз выставляется только после иссечения новообразования и последующего гистологического исследования удаленных тканей. Прогноз неблагоприятный. Радикальное удаление возможно только при ограниченных процессах. В остальных случаях пациенты с опухолями брюшины погибают от кахексии или от осложнений, обусловленных нарушением функций органов брюшной полости.
Возникает при разрыве цистаденомы яичника, псевдомуцинозной кисты аппендикса или дивертикула кишечника. Слизеобразующие эпителиальные клетки распространяются по поверхности брюшины и начинают производить густую желеобразную жидкость, заполняющую брюшную полость. Обычно темпы развития этой опухоли брюшины соответствуют низкой степени злокачественности. Болезнь прогрессирует в течение нескольких лет. Желеобразная жидкость постепенно вызывает фиброзные изменения тканей. Наличие слизи и опухолевидного образования препятствует деятельности внутренних органов.
Реже выявляются опухоли брюшины высокой степени злокачественности, способные к лимфогенному и гематогенному метастазированию. При отсутствии лечения во всех случаях наступает летальный исход. Причиной гибели пациентов становятся кишечная непроходимость, истощение и другие осложнения. О наличии слизеобразующей опухоли брюшины свидетельствует увеличение размеров живота при снижении массы тела, нарушения пищеварения и желеобразные выделения из пупка.
Диагноз устанавливается на основании КТ, лапароскопии, гистологического и иммуногистохимического исследования. При злокачественных опухолях брюшины может использоваться позитронно-эмиссионная томография. При доброкачественном варианте болезни данное исследование неинформативно. Тактика лечения опухолей брюшины определяется индивидуально. В ряде случаев возможно хирургическое иссечение пораженных участков в сочетании с интраперитонеальной внутриполостной химиотерапией. При своевременном начале лечения прогноз достаточно благоприятный, особенно – при опухолях брюшины низкой степени злокачественности.
Поражение возникает при прорастании злокачественных опухолей, расположенных в органах, частично или полностью покрытых брюшиной. Появление опухолей брюшины сопровождается усилением болевого синдрома и ухудшением состояния больного. При пальпации живота могут выявляться опухолевидные образования. При распаде очага в полом органе (желудке, кишечнике) наблюдаются явления прободного перитонита. В отдельных случаях первичная опухоль одновременно прорастает стенку полого органа, листки брюшины и переднюю брюшную стенку. При распаде образовавшегося конгломерата возникает флегмона мягких тканей.
Опухоли брюшины диагностируются на основании анамнеза (имеется злокачественное новообразование органа, покрытого брюшиной), клинических проявлений, данных УЗИ брюшной полости и других исследований. При ограниченном процессе возможно радикальное иссечение первичной опухоли вместе с пораженным участком брюшины. При наличии отдаленных метастазов проводится симптоматическая терапия. Пациентам с опухолями брюшины назначают обезболивающие препараты, при накоплении жидкости в брюшной полости выполняют лапароцентез и т. д. Прогноз зависит от распространенности процесса.
Различают три степени канцероматоза: локальный (выявляется одна зона поражения), с поражением нескольких участков (очаги поражения чередуются с зонами неизмененной брюшины) и распространенный (обнаруживаются множественные вторичные опухоли брюшины). При недиагностированной первичной опухоли и множественных узлах брюшины клиническая диагностика в ряде случаев представляет затруднения из-за сходства с картиной туберкулезного перитонита. В пользу вторичных опухолей брюшины свидетельствует геморрагический характер выпота и быстрое повторное возникновение асцита после проведения лапароцентеза.
Диагноз устанавливается с учетом анамнеза, клинических проявлений, данных УЗИ органов брюшной полости, МСКТ брюшной полости с контрастированием, цитология асцитической жидкости, полученной при проведении лапароцентеза, и гистологического исследования образца ткани опухоли брюшины, взятого в ходе лапароскопии. В качестве дополнительной диагностической методики может применяться тест на онкомаркеры, позволяющий более точно определять прогноз, своевременно выявлять рецидивы и оценивать эффективность терапии.
При возможности полного удаления первичного новообразования и опухолей брюшины выполняют радикальные операции. В зависимости от локализации первичного очага осуществляют перитонэктомию в сочетании с колэктомией, резекцией желудка или гастрэктомией, пангистерэктомией и другими хирургическими вмешательствами. Из-за опасности обсеменения брюшной полости раковыми клетками и возможного наличия визуально неопределяемых опухолей брюшины в процессе операции или после ее окончания осуществляют интреперитонеальную гипертермическую химиотерапию. Процедура позволяет обеспечить мощное локальное воздействие на раковые клетки при минимальном токсическом действии химиопрепаратов на организм пациента.
Несмотря на использование новых методов лечения, прогноз при диссеминированных вторичных опухолях брюшины пока остается неблагоприятным. Канцероматоз является одной из основных причин гибели больных с онкологическими поражениями брюшной полости и малого таза. Средняя выживаемость больных с раком желудка в сочетании с опухолями брюшины составляет около 5 месяцев. Рецидивы после радикальных хирургических вмешательств по поводу вторичных новообразований брюшины возникают у 34% больных. Специалисты продолжают поиск новых, более эффективных методов лечения вторичных опухолей брюшины. Используются новые химиопрепараты, иммунохимиотерапия, радиоиммунотерапия, генная антисенс-терапия, фотодинамическая терапия и другие методики.
Читайте также:

