Что такое неопределенный потенциал злокачественности
Резюме. Виявлення нейроендокринних пухлин у розвинутих країнах за останні 30 років зросло у 5 разів, що у поєднанні з адекватним лікуванням призвело до зростання медіани виживаності хворих більш ніж у 3 рази. Сьогодні в Україні виникнення нейроендокринних пухлин часто залишається нерозпізнаним. Причинами цього є, крім малопомітної симптоматики, недостатня інформованість і настороженість лікарів, обмежене використання спеціальних досліджень для верифікації нейроендокринних пухлин.
Резюме. Выявление нейроэндокринных опухолей в развитых странах за последние 30 лет увеличилось в 5 раз, что в сочетании с адекватным лечением, привело к увеличению медианы выживаемости больных более чем в 3 раза. Сегодня в Украине возникновение нейроэндокринных опухолей часто остается нераспознанным. Причинами этого являются, помимо малозаметной симптоматики, недостаточная информированность и настороженность врачей, ограниченное использование специальных исследований для верификации нейроэндокринных опухолей.

Среди многих разновидностей опухолевых поражений у человека, кроме первичных опухолей эндокринных органов, существует группа новообразований разной локализации, происходящих из клеток, которым присуща способность поглощать предшественники биогенных аминов и их декарбоксиллировать (ammine precursor uptake and decarboxilation), а также продуцировать биогенные амины и/или полипептидные гормоны. Пептидные гормоны, продуцируемые этими клетками, обнаруживаются в ряде нейронов и выступают в качестве медиаторов и/или комедиаторов. В свою очередь биогенные амины, являющиеся медиаторами нервной системы, продуцируются многими клетками диффузной эндокринной системы наряду с пептидами. В связи с тем что новообразования из этих клеток в большей или меньшей степени сохраняют свойства исходных, сегодня они чаще всего определяются как нейроэндокринные опухоли (НЭО) [13].
Количество выявляемых нейроэндокринных новообразований за последние 30 лет увеличилось в 5 раз [26]. Вместе с тем мировой опыт показывает, что проведение специальных диагностических и лечебных мероприятий приводит к увеличению более чем в 3 раза медианы выживаемости больных с НЭО [15].
Сегодня в Украине возникновение НЭО часто остается нераспознанным. Это происходит по ряду причин: симптомы НЭО часто проявляются в малозаметной неспецифической форме и болезнь обычно диагностируется на поздних этапах; в силу недостаточной информированности и настороженности врачей; из-за ограниченного применения специальных исследований с целью верификации НЭО.
НЭО могут возникать в органах, которые состоят или включают в себя диффузно-расположенные нейроэндокринные клетки: эпифиз (пинеалоциты), аденогипофиз, щитовидную железу (С-клетки), паращитовидные железы, тимус, грудные железы, симпатические ганглии и параганглии, слизистые оболочки пищеварительной трубки и воздухопроводящих путей (одиночные гормонопродуцирующие клетки), легкие, островки поджелудочной железы, почки, мозговое вещество надпочечников, предстательная железа, яички (клетки Лейдига), яичники, слизистая оболочка мочевыводящих путей, кожа [1, 16].
Ряд клинических и патологических проявлений НЭО, с одной стороны, специфичны для органа происхождения, а с другой — имеют ряд общих черт для новообразований этого типа независимо от их анатомической принадлежности. В целом, исследования НЭО были сосредоточены на опухолях конкретной органной принадлежности, таких как легкое, поджелудочная железа, желудочно-кишечный тракт и так далее. В связи с этим гистологические классификации опухолей ВОЗ включают НЭО как самостоятельные типы. Вместе с тем предлагаются различные уточнения и модификации относительно классификации и номенклатуры НЭО разных локализаций [2, 3, 6, 17, 18, 25 и др.]. Изучение предложенных классификаций показывает наличие в них многих общих черт, лежащих в их основе, а такие признаки, как пролиферативная активность и степень местного распространения являются общими для НЭО практически всех локализаций [12].
Исходя из общепринятых принципов патоморфологического исследования опухолей, при диагностике НЭО должны устанавливаться ее гистологический тип, степень злокачественности и распространенность.
Приступая к исследованию операционного материала или биоптатов, необходимо ознакомиться с клиническими данными и обратить внимание на наличие эндокринных нарушений (карциноидного синдрома, гипер- или гипогликемии, синдрома Золлингера — Эллисона, синдрома Кушинга (в том числе эктопического) и другое). Учитывая зачастую медленное развитие НЭО, симптомы могут нарастать и прослеживаться на протяжении нескольких лет [24]. Важное значение в определении направления исследования имеют данные об увеличении содержания полипептидных гормонов и биогенных аминов в крови, продуцируемых нейроэндокринными клетками. Так, у более чем 90% пациентов с НЭО обнаруживается повышенное содержание хромогранина А в крови [4].
Макроскопическая оценка опухоли должна включать обычные в таких случаях параметры: внешние изменения органа, локализацию, одиночная или множественная, размеры, состояние лимфатических узлов, расстояние до краев резекции (для неперитонизированных опухолей (колоректальных, пищевода и тому подобное), внешний хирургический край резекции представляет собой соединительную ткань, не покрытую серозной оболочкой); наличие перфорации опухоли (микроскопически видимый сквозной дефект опухоли, когда просвет кишки соединяется с внешней поверхностью резецированного образца; перфорация непосредственно кишки, как следствие сдавления опухолью, не считается перфорацией опухоли). Для ректальных опухолей и опухолей пищевода необходимо указывать их отношение к границе брюшины (полностью выше, полностью ниже и поверх этого ориентира). Для ректальных опухолей важно оценить расстояние до зубчатой линии (параметр необходим только для низко расположенных опухолей при брюшно-промежностном удалении прямой кишки, чтобы иметь представление о месте расположения опухоли относительно внутреннего сфинктера).
Вырезание кусочков для гистологического исследования должно обеспечить возможность не только типирования опухоли, но и дать оценку ее распространенности. Забранные кусочки должны отражать глубину проникновения через стенку органа, инвазию кровеносных сосудов (при подозрении), прорастание в соседние органы, расстояние до краев резекции, поражения серозной оболочки (отмечается, является ли это местным распространением опухоли или метастазом). Вовлечение серозной оболочки лучше всего выявляется в кусочках, взятых из темных, фибротизированных участков или из участков с кровоизлияниями, особенно в местах отхождения брюшины под острым углом от поверхности кишки (на брыжейке, в глубоких складках или между жировыми дольками). В обязательном порядке исследуются все обнаруженные лимфатические узлы.
НЭО может быть случайной находкой, например, обнаруженной в аппендиксе. В этом случае вырезку необходимо повторить для оценки присутствия опухоли в краях резекции и распространения на серозную оболочку, а также должны быть исследованы все обнаруженные лимфатические узлы.
Микроскопическая оценка НЭО начинается с постановки предварительного диагноза. Опытный патологоанатом, знакомый с НЭО, достаточно часто будет в состоянии при микроскопии диагностировать опухоль и оценить степень ее злокачественности в большинстве операционных образцов. Значительно сложнее верифицировать НЭО в биоптатах при ограниченном количестве материала. При подозрении на НЭО на светооптическом уровне следует провести первичную иммуногистохимическую (ИГХ) диагностику и оценить степень ее злокачественности. В случаях злокачественных НЭО для определения дальнейшей тактики лечения пациента целесообразно определение статуса рецепторов к соматостатину на их клетках.
В соответствии с морфофункциональной классификацией ВОЗ [11] определяются следующие общие гистологические типы НЭО:
- высокодифференцированные НЭО (доброкачественные);
- высокодифференцированные НЭО (неопределенная степень злокачественности);
- высокодифференцированные эндокринные карциномы (низкая степень злокачественности);
- низкодифференцированные (мелкоклеточные) эндокринные карциномы (высокая степень злокачественности);
- бокаловидноклеточные карциноиды и смешанные эндокринные аденокарциномы;
- некоторые более редкие типы.
Высокодифференцированные НЭО характеризуются низким пролиферативным потенциалом, способностью секретировать биологически активные вещества и низкой чувствительностью к химиотерапии. К этой группе могут быть отнесены: карциноиды разного происхождения, опухоли из хромафинных клеток (феохромоцитома), медуллярная карцинома щитовидной железы.
Эндокринные карциномы представлены высокозлокачественными опухолями с высоким пролиферативным потенциалом, чувствительные к химио- и лучевой терапии. К этой группе может быть отнесен мелкоклеточный рак легкого.
К группе эндокринных аденокарцином с экзо- и эндокринной секреторной функцией относят различные опухоли поджелудочной железы, исключение составляют карциноиды. Чувствительность к химиотерапии опухолей этого типа умеренная [11].
Для ИГХ диагностики НЭО рекомендуется небольшая панель [25], включающая антитела к 3 маркерам: синаптофизину (маркер мелких везикул), хромогранину (продукт нейросекреторных гранул) и CD56 (молекула нейрональной адгезии, N-CAM, мембраносвязывающий антиген). Применение в диагностической панели цитоплазматических маркеров, таких как протеиновый генный продукт (PGP) 9,5 и нейрон-специфическая энолаза, нецелесообразно, поскольку их специфичность неоднозначна.
Несмотря на существование ряда сообщений, что идентификация специфических гормонов в НЭО поджелудочной железы может дать прогностическую информацию, в настоящее время еще не доказана ее достоверная значимость для Grade-стадирования и типирования опухоли. В связи с существующими сложностями в ИГХ определении полипептидных гормонов и значительной его стоимости большая панель антител, плохо поддающаяся качественному контролю, не часто используется в рутинном выявлении специфичных гормонов как прогностического фактора. Однако эти исследования должны выполняться при клинической необходимости в интересах пациента. Для НЭО желудка это имеет определенное прогностическое значение [25] и может иметь отчетливую связь между клиническими и патологоанатомическими данными. ИГХ выявление специфических гормонов для дуоденальных и панкреатических НЭО целесообразно, если клинически распознаны соответствующие эндокринные нарушения [12]. Доказано, что позитивная реакция на определенные маркеры, такие как цитокератин 19, связана с негативным прогнозом при НЭО поджелудочной железы [7], однако этот показатель недостаточно стабилен для его использования как специфического.
Для дуоденальных НЭО, гастриномы или соматостатиномы, возникающих спорадически или на фоне множественной эндокринной неоплазии первого типа (MЭН1), правильно взятый кусочек опухоли имеет важную прогностическую информацию [25]. Соматостатинома может иметь железистое строение, в связи с чем необходимо проводить исследование предельно внимательно, чтобы не интерпретировать ее как аденокарциному. Наличие псамомных телец может указывать на эндокринную природу опухоли. При подозрении, что дуоденальная аденокарцинома, возможно, является НЭО, в обязательном порядке нужно применять ИГХ-исследование [25].
При выявлении элементов опухоли в неперитонизованном или брыжеечном краях резекции эта информация должна быть выдвинута на первый план заключения, поскольку может свидетельствовать о неполном удалении опухоли. Распространение опухоли на серозную оболочку, с учетом того, что она не является краем резекции, необходимо особо отмечать в заключении, поскольку оно может быть причиной транс-целомических метастазов, например при НЭО подвздошной кишки или аппендикса [19].
Неблагоприятными признаками при оценке НЭО являются наличие инвазии микрососудов, а также периневральная инвазия. Важнейшей характеристикой распространенности опухолевого процесса выступает гистологическое подтверждение наличия элементов опухоли в лимфатических узлах, а также отдаленных метастазов [23].
К важным характеристикам опухолевого процесса, которые должны указываться в соответствии с требованиями ВОЗ, относятся также фоновые и сопутствующие изменения [23]: синхронный рак(и) — каждый из которых требует отдельной верификации, гастрит, атрофия слизистой оболочки, метаплазия эпителия, гиперплазия ECL- или G-клеток в прилежащих к опухоли участках органа, микроаденоматоз панкреатического островка, хронический панкреатит, наличие других эндокринных опухолей. К дополнительным данным, характеризующим патологический процесс, относятся наличие амилоида, псамомных телец, экспрессия цитокератина 19 в НЭО поджелудочной железы.
В настоящее время ведущими европейскими патологами [20, 21] в соответствии с консенсусом, достигнутым на ENETS, было предложено делить НЭО желудочно-кишечного тракта на 3 группы, в зависимости от потенциала их злокачественности. Последний определяется по митотической и пролиферативной активности опухолевых клеток (таблица):
| Потенциал злокачественности (Grade) | Митотический индекс (10 полей зрения)* | Ki-67 индекс (%)** |
|---|---|---|
| G1 | ≤2 | |
| G2 | 2–20 | >2–20 |
| G3 | >20 | >20 |
В практических условиях опухоли G1 и G2 в целом высокодифференцированы и демонстрируют рассеянную и интенсивную экспрессию двух маркеров — хромогранина A и синаптофизина. Наличие любого участка некроза является признаком более агрессивной опухоли, указывая на статус G2, который должен быть подтвержден индексами митотической активности и Ki-67. G3 соответствует низкодифференцированному нейроэндокринному раку. Он имеет высокий митотический/Ki-67 индекс, часто выявляются участки некрозов, снижена экспрессия хромогранина А, сохраняется отчетливая экспрессия синаптофизина. G3 также характеризуется большими размерами, распространенной инвазией прилежащих тканей, инвазией сосудов и нервов, выраженным ядерным полиморфизмом, наличием множественных региональных и отдаленных метастазов. Преимущество при оценке злокачественности отдается первичной опухоли, но могут быть оценены и метастазы, если первичная опухоль недоступна.
Для определения митотического индекса необходимо определить площадь поля зрения микроскопа при увеличении объектива 40х, используя объект-микрометр. Современные микроскопы с широкой полевой оптикой могут иметь поле зрения площадью значительно больше, чем 0,2 мм, что требует выполнения перерасчета. Например, если площадь зрения составляет 0,22 мм, то есть на 10% больше, результат подсчета необходимо умножить на 100/110.
Митотический/Ki-67 индекс вполне оправдывает себя и при оценке злокачественности опухолей, не относящихся к пищеварительной системе. Однако конкретные значения этих показателей для НЭО разных органных систем могут отличаться [5, 8, 9, 10]. По этой причине рекомендуется указать в патогистологическом заключении фактический уровень пролиферативной активности в дополнение к степени злокачественности (G).
На основе гистологического заключения. Злокачественность опухоли напрямую влияет на исход болезни: чем выше степень, тем агрессивнее рак, и тем хуже прогноз для выздоровления.
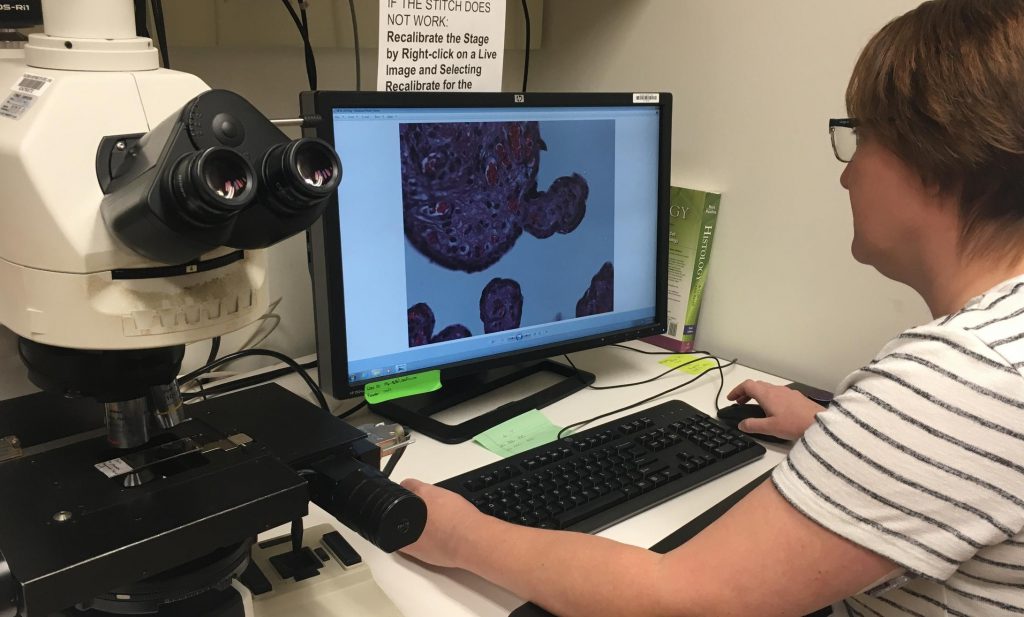
Врач-гистолог оценит степень злокачественности
Злокачественность опухоли
Морфологическое исследование удаленных раковых тканей, как обязательный этап диагностики, помогает определить злокачественность опухоли. В организме человека триллионы клеточных структур, основой которых являются около 100 различных типов клеток: каждая из них может переродиться в раковую. При этом результат перерождения-трансформации может быть морфологически очень близок к исходно нормальной клетке. Или настолько сильно отличаться, что, кажется, и сравнивать не с чем.
Злокачественность опухоли – это степень клеточных изменений, указывающая на агрессивность Карциномы: чем выше цифра после буквы G, тем сильнее отличается злокачественное новообразование от исходной ткани в месте возникновения рака.
Степени злокачественности
Гистологический диагноз – это морфологический вариант опухоли и степень злокачественности. Выделяют 3 степени:
- Высокая степень дифференцировки опухолевой ткани (G1) – клетки первичного очага отличаются от нормальных клеточных структур удаленного органа или ткани, но морфологически похожи: у врача-гистолога нет никаких сомнений в том, что основой злокачественного перерождения стали клетки именно из этого органа или ткани;
- Средняя степень дифференцировки (G2) – схожие черты исходной ткани сохраняются, но различий больше: гистологически опухоль сильно отличается от нормы, но отошла еще не так далеко;
- Низкая степень (G3) – раковые клетки имеют крайне мало сходства с органом или тканью в первичном очаге: гистолог сразу понимает, что это чужеродный и агрессивный зверь.
Необходимо обращать внимание на цифровое значение критерия G в диагнозе: низкодифференцированные опухоли всегда прогностически хуже, при G1 шансы на выздоровление значительно выше.
Значимость клеточных изменений опухоли
Важно понимать: злокачественность опухоли – это одно из значений диагноза, необходимое для реального понимания силы Карциномы. Это вовсе не означает, что при G3 нет никаких шансов для выживания, а при G1 можно радостно подбрасывать чепчики – типа, мы уже почти победили врага.
Высокодифференцированные опухоли – это:
- Сравнительно медленная скорость прогрессирования;
- Низкий риск быстрого и раннего метастазирования;
- Высокая чувствительность к лекарственной терапии;
- Высокие шансы на длительную ремиссию.
Низкодифференцированные раки – это:
- Быстрый рост первичного опухолевого очага;
- Ранние метастазы в лимфоузлы и отдаленные органы;
- Отсутствие положительного ответа на химиотерапию;
- Низкие шансы на выживаемость.
Казалось бы, все просто: G1 – это благоприятно, G3 – это плохо. Но в жизни все значительно сложнее, потому что на прогноз при онкологии влияют масса факторов. Злокачественность опухоли – это важный элемент диагностики, на который надо обращать внимание: низкая степень дифференцировки раковых клеток указывает на то, что враг силен, зол, беспринципен и агрессивен. Война будет изнурительно-длительной, не каждая битва будет успешной, после каждого боя будет казаться, что Карцинома становится сильнее, но, тем не менее, шансы на победу есть всегда.


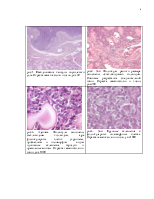
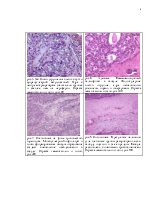

Морфологическая характеристика опухолей щитовидной железы неопределенного злокачественного потенциала
(Республиканский центр опухолей щитовидной железы, Минск, рук. – профессор, д.м.н. )
Несовершенство метода световой микроскопии и доброкачественное течение ряда опухолей не позволили категорично определиться с вопросом об их злокачественном потенциале – единых гистологических критериев, которые дали бы возможность дифференцировать доброкачественные и злокачественные неинвазивные и неметастазирующие неоплазмы, пока не существует. Новообразования, которые трудно отнести к определенно доброкачественным или определенно злокачественным, внесены в Международные гистологические классификации многих органов, однако для щитовидной железы такая попытка была сочтена неудачной. Если в 2000 г. на рассмотрение было выдвинуто предложение такие опухоли выделять, то в недавно вышедшей третьей редакции классификации опухолей эндокринной системы это суждение поддержано не было [8,13].
Не менее сложным и важным остается вопрос дифференциальной диагностики аденомы и инкапсулированного (микроинвазивного) варианта фолликулярного рака. Выраженная васкуляризация опухолей щитовидной железы, выпячивания капсулы, артифициальные смещения клеточных групп в мелкие сосуды, как в капсуле образования, так и за ее пределы, что особенно часто наблюдается при оксифильноклеточных аденомах (онкоцитомах), в ряде случаев создают проблему. Чтобы разрешить противоречия, возникающие при попытках интерпретировать неполную инвазию капсулы, сомнительную инвазию сосудов, клеточный полиморфизм и повышенную митотическую активность в полностью инкапсулированных опухолях с очагами, подозрительными к сосудистой и капсулярной инвазии, было предложено выделять для клинического наблюдения группу фолликулярных опухолей неопределенного злокачественного потенциала.
Материал и методы.
В архиве патологоанатомического отделения Минского городского клинического онкологического диспансера нами найдено 34 случая, где пациентам по результатам рутинного гистологического исследования диагностированы опухоли неопределенного злокачественного потенциала. Все эти наблюдения не вошли в Международный банк тканей и нуклеиновых кислот. Заключения формулировались одним либо двумя врачами-патологоанатомами и микропрепараты в дальнейшем никогда не обсуждались на Международной панели патологов.
Нами пересмотрены микропрепараты указанных больных с учетом критериев Международной гистологической классификации опухолей щитовидной железы (2004). В ряде случаев для уточнения диагнозов изготавливались дополнительные срезы толщиной 5 мкм, которые окрашивались по стандартным методикам гематоксилином и эозином, а также моноклональными антителами к тиреоглобулину, кальцитонину и хромогранину.
В 2017 г. Международное агентство по изучению рака (МАИР) выпустило в свет новое 4-е издание классификации ВОЗ опухолей эндокринных органов. Как и в предыдущем издании 2004 г., в новой классификации значительное место уделено опухолям щитовидной железы (ЩЖ). Экспертами ВОЗ пересмотрены критерии злокачественности инкапсулированных фолликулярных опухолей с ядрами папиллярного типа. Ранее такие опухоли относили к злокачественным новообразованиям (фолликулярному варианту папиллярного рака), а в новой классификации они получили статус пограничных, или опухолей неопределенного злокачественного потенциала (НЗП). Известно, что оценка злокачественного потенциала фолликулярных новообразований невозможна на этапе дооперационной цитологической диагностики в связи с отсутствием надежных соответствующих признаков. Она затруднена и в 10% случаев фолликулярных опухолей ЩЖ на этапе послеоперационной гистологической диагностики в связи с отсутствием очевидных морфологических проявлений инвазии в собственную капсулу и/или сомнительными для папиллярного рака изменениями ядер опухолевых клеток. В настоящей статье представлены критерии диагностики неинвазивной фолликулярной опухоли ЩЖ с ядрами папиллярного типа, а также еще двух классификационных категорий фолликулярных опухолей НЗП, к которым в соответствии с новой классификацией относятся фолликулярные и высокодифференцированные опухоли ЩЖ НЗП. Особое внимание уделено диагностической значимости инвазивного роста опухоли как основному морфологическому проявлению злокачественности фолликулярных опухолей. В связи с изменившимися критериями морфологической диагностики в статье вынесены на обсуждение вопросы качества гистологической диагностики, которое должно быть неизменно высоким, и влияния изменившейся классификации на лечебную тактику в случаях инкапсулированных фолликулярных опухолей.
Ключевые слова:
щитовидная железа, инкапсулированные фолликулярные опухоли, злокачественный потенциал, международная гистологическая классификация, thyroid, encapsulated follicular tumors, malignant potential, international histological classification
Литература:
1.1. Lloyd RV, Osamura RY, Klöppel G, Rosai J, editors. WHO Classification of Tumours of Endocrine Organs. Lyon: IARC; 2017.
2.2. Rosai J, Carcangiu ML, DeLellis RA. Atlas of Tumor Pathology: Tumors of the Thyroid Gland. Washington: Armed Forces Institute of Pathology; 1992.
3.3. Williams ED. Guest editorial: two proposals regarding the terminology of thyroid tumors. Int J Surg Pathol. 2000;8(3):181-183. doi: 10.1177/106689690000800304.
4.4. DeLellis RA, Lloyd RV, Hertz PU, Eng C, editors. WHO Classification of Tumours; Pathology and Genetics of Tumours of Endocrine Organs. Lyon: IARC; 2004.
5.5. Nikiforov YE, Seethala RR, Tallini G, et al. Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma: a paradigm shift to reduce overtreatment of indolent tumors. JAMA Oncol. 2016;2(8):1023-1029. doi: 10.1001/jamaoncol.2016.0386.
6.6. LiVolsi VA, Baloch ZW. The many faces of follicular variant of papillary thyroid carcinoma. Pathol Case Rev. 2009;14(6):214-218. doi: 10.1097/PCR.0b013e3181c75e9b.
7.7. Lindsay S. Carcinoma of thyroid gland: a clinical and pathological study of 239 patients at the University of California Hospital. Springfield: Charles C. Thomas; 1960.
8.8. Chem KT, Rosai J. Follicular variant of thyroid papillary carcinoma: a clinicopathologic study of six cases. Am J Surg Pathol. 1977;1(2):123-130.
9.9. Kakudo K, Bai Y, Liu Z, et al. Classification of thyroid follicular cell tumors: with special reference to borderline lesions. Endocr J. 2012;59(1):1-12. doi: 10.1507/endocrj.EJ11-0184.
10.10. Arora N, Scognamiglio T, Zhu B, Fahey TJ, 3rd. Do benign thyroid nodules have malignant potential? An evidence-based review. World J Surg. 2008;32(7):1237-1246. doi: 10.1007/s00268-008-9484-1.
11.11. Papotti M, Rodriguez J, De Pompa R, et al. Galectin-3 and HBME-1 expression in well-differentiated thyroid tumors with follicular architecture of uncertain malignant potential. Mod Pathol. 2005;18(4):541-546. doi: 10.1038/modpathol.3800321.
12.12. Prasad ML, Pellegata NS, Huang Y, et al. Galectin-3, fibronectin-1, CITED-1, HBME-1 and cytokeratin-19 immunohistochemistry is useful for the differential diagnosis of thyroid tumors. Mod Pathol. 2005;18(1):48-57. doi: 10.1038/modpathol.3800235.
13.13. Fischer S, Asa SL. Application of immunohistochemistry to thyroid neoplasms. Arch Pathol Lab Med. 2008;132(3):359-372. doi: 10.1043/1543-2165(2008)132[359:AOITTN]2.0.CO;2.
14.14. Scognamiglio T, Hyjek E, Kao J, Chen Y-T. Diagnostic usefulness of HBME1, Galectin-3, CK19, and CITED1 and evaluation of their expression in encapsulated lesions with questionable features of papillary thyroid carcinoma. Am J Clin Pathol. 2006;126(5): 700-708. doi: 10.1309/044v86jn2w3cn5yb.
15.15. Abrosimov AY, Dvinskikh NY, Sidorin AV. Cells of benign and borderline thyroid tumor express malignancy markers. Bull Exp Biol Med. 2016;160(5):698-701. doi: 10.1007/s10517-016-3253-1.
The new fourth edition of the WHO classification of tumors of endocrine organs published by the International agency for research of cancer (IARC) in 2017 as the previous third edition of 2004 pays substantial attention to the thyroid gland tumors. Experts revised criteria of malignancy in category of encapsulated non-invasive follicular thyroid neopasm with papillary-like nuclear features. The previous edition classified these tumors as malignant follicular variant of papillary thyroid carcinoma (PTC). The new edition considers their behavior status as borderline or tumors of uncertain malignant potential. An estimation of malignancy of follicular thyroid tumors is impossible in preoperative cytological smears due to unknown cytological markers of malignancy and in 10% tumors after surgery due to equivocal histological features of capsular/vascular invasion and/or doubtful PTC-like nuclear features. Criteria of non-invasive follicular thyroid neoplasm with papillary-like nuclear features as well as criteria of two classification categories of follicular and well differentiated tumors of uncertain malignant potential (UMP) are presented in this paper. A special attention is paid to diagnostic significance of invasive growth as a basic feature of malignancy. In connection with the revised criteria of international classification we discuss an importance of adequate histological examination and influence of new borderline categories on surgical treatment of encapsulated follicular thyroid tumors in the paper.
Keywords:
щитовидная железа, инкапсулированные фолликулярные опухоли, злокачественный потенциал, международная гистологическая классификация, thyroid, encapsulated follicular tumors, malignant potential, international histological classification
Нейроэндокринные опухоли – гетерогенная группа эпителиальных новообразований, происходящих из клеток APUD-системы. У большинства больных нейроэндокринными опухолями развивается карциноидный синдром, включающий в себя приливы, боли в животе, диарею, нарушения дыхания, поражение сердечных клапанов и телеангиэктазии. Возможны также гипогликемия, чувство голода, расстройства сознания, судороги, пептические язвы, похудание, диабет, дерматит, тромбозы и тромбоэмболии. Диагноз выставляется с учетом симптомов, данных лабораторных и инструментальных исследований. Лечение – операция, химиотерапия, симптоматическая терапия.
- Классификация нейроэндокринных опухолей
- Симптомы нейроэндокринных опухолей
- Нейроэндокринные опухоли ЖКТ
- Другие нейроэндокринные опухоли
- Диагностика и лечение нейроэндокринных опухолей
- Прогноз при нейроэндокринных опухолях
- Цены на лечение
Общие сведения
Нейроэндокринные опухоли (НЭО) – группа новообразований различной степени злокачественности, происходящих из клеток диффузной нейроэндокринной системы, способных продуцировать пептидные гормоны и биогенные амины. Нейроэндокринные опухоли относятся к числу редко встречающихся онкологических заболеваний. Обычно поражают пищеварительную и дыхательную системы, но могут выявляться и в других органах. Возникают спорадически или являются следствием одного из нескольких наследственных синдромов, сопровождающихся развитием множественных нейроэндокринных опухолей в различных органах.
Статистические показатели заболеваемости составляют 2-3 человека на 100 тыс. населения, однако специалисты указывают на то, что в процессе аутопсии нейроэндокринные опухоли обнаруживаются у 8-9 человек на 100 тыс. населения, что свидетельствует о низком уровне прижизненной диагностики. Обычно выявляются у взрослых, мужчины страдают чаще женщин. Лечение осуществляют специалисты в сфере онкологии, гастроэнтерологии, пульмонологии, эндокринологии и других областей медицины (в зависимости от локализации новообразования).

Классификация нейроэндокринных опухолей
С учетом особенностей эмбриогенеза различают три группы нейроэндокринных опухолей:
- Новообразования, происходящие из верхнего отдела первичной эмбриональной кишки, дающего начало легким, бронхам, пищеводу, желудку и верхней части двенадцатиперстной кишки.
- Нейроэндокринные опухоли, происходящие из среднего отдела первичной эмбриональной кишки, являющегося предшественником нижней части двенадцатиперстной кишки, тощей кишки и верхних отделов толстого кишечника, включая аппендикс, слепую, подвздошную и восходящую ободочную кишку.
- Нейроэндокринные опухоли, происходящие из нижнего отдела первичной эмбриональной кишки, дающего начало нижним отделам толстого кишечника и прямой кишке.
С учетом локализации выделяют бронхопульмональные нейроэндокринные опухоли и новообразования пищеварительной системы. НЭО бронхов и легких составляют около 3% от всех онкологических заболеваний дыхательной системы и примерно 25% от общего количества нейроэндокринных опухолей. НЭО пищеварительной системы составляют около 2% от всех онкологических процессов данной локализации и более 60% от общего числа нейроэндокринных опухолей. Поражения пищеварительной системы, в свою очередь, подразделяются на эндокринные карциномы (устаревшее название – карциноиды) и другие новообразования (инсулиномы, випомы, глюкагономы, соматостатиномы, гастриномы). Эндокринные карциномы чаще всего встречаются в аппендиксе и тонкой кишке, другие неоплазмы – в поджелудочной железе.
В отдельных случаях нейроэндокринные опухоли образуются из клеток, являющихся производными эндодермы, нейроэктодермы и эмбрионального нервного гребешка, и локализуются в передней доле гипофиза, щитовидной железе, паращитовидных железах, надпочечниках, предстательной железе, молочной железе, почках, коже или яичниках. Нейроэндокринные опухоли, расположенные за пределами дыхательной системы и желудочно-кишечного тракта, составляют около 15% от общего количества новообразований данной группы.
Согласно классификации ВОЗ, все нейроэндокринные опухоли пищеварительной системы вне зависимости от их вида и локализации подразделяются на три категории:
- Высокодифференцированные новообразования с доброкачественным течением или неопределенной степенью злокачественности.
- Высокодифференцированные нейроэндокринные опухоли с низким потенциалом злокачественности.
- Низкодифференцированные новообразования с высоким потенциалом злокачественности.
В отличие от новообразований ЖКТ, нейроэндокринные опухоли дыхательной системы сохранили старое название карциноид. В соответствии с классификацией ВОЗ выделяют четыре категории таких неоплазий:
- Карциноиды с низким потенциалом злокачественности.
- Карциноиды со средним потенциалом злокачественности.
- Крупноклеточные нейроэндокринные карциномы.
- Мелкоклеточный рак легкого.
Симптомы нейроэндокринных опухолей
Нейроэндокринные опухоли ЖКТ (эндокринные карциномы, карциноидные опухоли ЖКТ) чаще всего выявляются в области червеобразного отростка. Второе место по распространенности занимают неоплазии тонкого кишечника. Нейроэндокринные опухоли толстого кишечника и прямой кишки составляют 1-2% от общего количества онкологических процессов этой анатомической зоны. Новообразования желудка и двенадцатиперстной кишки встречаются относительно редко. У 10% пациентов выявляется генетическая предрасположенность к возникновению множественных нейроэндокринных опухолей.
Все эндокринные карциномы выделяют пептиды и биогенные амины, однако перечень биологически активных соединений и уровень активности секреторных клеток новообразований может существенно варьировать, что обуславливает возможные различия в клинической картине заболевания. Наиболее характерным признаком нейроэндокринных опухолей ЖКТ является карциноидный синдром, обычно возникающий после появления метастазов в печени, сопровождающийся приливами, диареей и болями в животе. Реже при данном синдроме встречаются поражения сердечных клапанов, расстройства дыхания и телеангиэктазии.
Приливы наблюдаются у 90% пациентов с нейроэндокринными опухолями. В качестве основной причины развития приступов рассматривают выброс в кровь большого количества серотонина, простагландинов и тахикининов. Приливы развиваются спонтанно, на фоне употребления алкоголя, эмоционального напряжения или физической нагрузки и длятся от нескольких минут до нескольких часов. Во время приливов у пациентов с нейроэндокринными опухолями выявляется гиперемия лица или верхней половины туловища в сочетании с гипотонией (редко – гипертонией), тахикардией и головокружением.
Диарея может отмечаться как на фоне приступов, так и в их отсутствие и выявляется у 75% больных нейроэндокринными опухолями. Поражение сердечных клапанов развивается постепенно, встречается у 45% пациентов. Патология обусловлена фиброзом сердца, возникающим в результате длительного воздействия серотонина. У 5% пациентов с карциноидным синдромом наблюдается пеллагра, проявляющаяся слабостью, нарушениями сна, повышенной агрессивностью, невритом, дерматитом, глосситом, фотодерматозом, кардиомиопатией и когнитивными расстройствами.
У 5% больных нейроэндокринными опухолями отмечается атипичное течение карциноидного синдрома, обусловленного выбросом в кровь гистамина и 5-гидрокситриптофана. Обычно этот вариант выявляется при НЭО желудка и верхней части двенадцатиперстной кишки. Атипичный карциноидный синдром при нейроэндокринных опухолях проявляется головной болью, приливами, бронхоспазмом и слезотечением. Во время приливов выявляется непродолжительная гиперемия лица и верхней половины туловища, сопровождающаяся жаром, потливостью и кожным зудом. По окончании приливов в области покраснения образуются многочисленные телеангиэктазии.
Опасным осложнением нейроэндокринных опухолей является карциноидный криз. Обычно такой криз развивается на фоне хирургического вмешательства, инвазивной процедуры (например, биопсии) или сильного стресса, но может возникать и без видимых внешних причин. Состояние сопровождается резким падением артериального давления, выраженной тахикардией и сильным брохноспазмом. Представляет опасность для жизни, требует проведения неотложных лечебных мероприятий.
Инсулиномы – нейроэндокринные опухоли, в 99% случаев возникающие в тканях поджелудочной железы, в 1% случаев – в области двенадцатиперстной кишки. Как правило, протекают доброкачественно, обычно бывают одиночными, реже – множественными. Женщины страдают чаще мужчин. У 5% больных нейроэндокринные опухоли развиваются на фоне генетических нарушений. Проявляются гипогликемией, чувством голода, нарушениями зрения, спутанностью сознания, гипергидрозом и дрожанием конечностей. Возможны судороги.
Гастриномы – нейроэндокринные опухоли, в 70% случаев локализующиеся в двенадцатиперстной кишке, в 25% - в поджелудочной железе, в остальных случаях – в желудке или тонком кишечнике. Обычно протекают злокачественно. Чаще встречаются у мужчин. У 25% пациентов обнаруживается генетическая предрасположенность. На момент постановки диагноза у 75-80% больных нейроэндокринными опухолями выявляются метастазы в печень, у 12% - метастазы в кости. Основным проявлением становятся одиночные или множественные пептические язвы. Часто наблюдается тяжелая диарея. Причинами летального исхода могут стать кровотечение, перфорация или нарушения функций органов, пораженных отдаленными метастазами.
Випомы – нейроэндокринные опухоли, обычно возникающие в поджелудочной железе, реже – в легких, надпочечниках, тонкой кишке или средостении. Панкреатические нейроэндокринные опухоли, как правило, протекают злокачественно, внепанкреатические – доброкачественно. Наследственная предрасположенность выявляется у 6% больных. Основным симптомом нейроэндокринной опухоли являются опасные для жизни, изнуряющие хронические поносы, вызывающие нарушения водно-электролитного баланса с развитием судорог и сердечно-сосудистых расстройств. Среди других проявлений болезни – гиперемия верхней половины тела и гипергликемия.
Глюкагономы – нейроэндокринные опухоли, всегда локализующиеся в поджелудочной железе. В 80% случаев протекают злокачественно, обычно метастазируют в печень, реже – в лимфоузлы, яичники и позвоночник. Возможна диссеминация брюшины. Средний размер нейроэндокринной опухоли на момент постановки диагноза составляет 5-10 см, у 80% больных при первичном обращении выявляются метастазы в печени. Глюкагономы проявляются снижением веса, диабетом, расстройствами стула, стоматитом и дерматитом. Возможны тромбозы, тромбоэмболии и психические нарушения.
Диагностика и лечение нейроэндокринных опухолей
Диагноз устанавливается на основании клинических симптомов, результатов лабораторных и инструментальных исследований. При эндокринных карциномах определяют уровень серотонина в крови и 5-ГИУК в моче. При инсуломах проводят исследование крови на содержание глюкозы, инсулина, проинсулина и С-пептида. При глюкагономах выполняют анализ крови на глюкоген, при випомах – на вазоактивный интестинальный пептид, при гастриномах – на гастрин. Кроме того, план обследования больных с подозрением на нейроэндокринную опухоль включает в себя УЗИ органов брюшной полости, КТ и МРТ органов брюшной полости, ПЭТ, сцинтиграфию и эндоскопические исследования. При подозрении на злокачественный характер опухоли осуществляют биопсию.
Радикальным методом лечения нейроэндокринной опухоли является ее оперативное иссечение в пределах здоровых тканей. Из-за множественности новообразований, затруднений при определении расположения небольших узлов и высокой частоты метастазирования полное удаление нейроэндокринных опухолей у значительной части больных не представляется возможным. Для уменьшения клинических проявлений заболевания назначают симптоматическое лечение с использованием октреотида и других аналогов соматостатина. При быстром росте злокачественных новообразований показана химиотерапия.
Прогноз зависит от типа, степени злокачественности и распространенности неоплазии. Средняя пятилетняя выживаемость больных эндокринной карциномой составляет 50%. У пациентов с карциноидным синдромом этот показатель снижается до 30-47%. При гастриноме без метастазов до пяти лет с момента постановки диагноза удается дожить 51% больных. При наличии метастазов пятилетняя выживаемость пациентов с такой нейроэндокринной опухолью снижается до 30%. Прогноз при глюкагономе неблагоприятен, однако средние показатели выживаемости точно не установлены из-за редкой встречаемости данного типа нейроэндокринной опухоли.
Читайте также:

