Что такое латентная форма рака

Предупреждающие знаки о начале ракового заболевания могут быть общими, а могут касаться только определенного органа или могут быть связаны с локализацией опухоли.
Большинство начальных симптомов рака не являются специфическими для него. По этой причине, болезнь может быть проигнорирована больным (и даже врачом), ссылаясь на другие возможные доброкачественные расстройства, или же не учитывает данные сигналы.
Как бы не было, при любых (даже не логических) признаках, рекомендуется обратиться к врачу за консультацией.
Только полное клиническое обследование пациента с лабораторными анализами, с радиографией и с эндоскопией может помочь правильнее поставить диагноз.
Общие симптомы онкологических болезней
Общие признаки рака могут быть очень разными от пациента к пациенту и могут сопровождать его долгое время без указания на рак (особенно в случае внутреннего органа).
Усиление или/и умножение сигналов должно подтолкнуть пациента на медицинскую консультацию.
Самыми вероятными первыми общими сигналами возникновения рака могут быть:
- небольшое повышение температуры, которая не подаётся на лекарственную терапию и не является результатом инфекции;
- заметная потеря веса тела;
- потеря аппетита (особенно к мясным продуктам питания);
- необычная усталость, которая со временем только усугубляется.

Важные признаки рака
Самыми важными симптомами онкологических расстройств считаются:
- кровотечение;
- боль;
- инфекция.
Любое кровотечение (незначительное или обильное) всегда должно быть сигналом тревоги для больного.
Оно может быть результатом повреждения кровеносных сосудов из-за опухоли или же результатом разрыва кровеносного сосуда внутри опухоли.
Кровохарканье и кровь из носа могут послужить сигналом таких онкологических расстройств:
- рак пищевода;
- рак носовых пазух;
- рак гортани;
- рак полости рта;
- рак легкого (присутствие крови в мокроте).
Присутствие крови в моче может быть сигналом таких онкологических болезней:
- рак предстательной железы (у мужчин);
- рак мочевого пузыря;
- рак почки.
Кровопотери у женщин вне менструации (месячных) или возникающие во время половых сношений, а также кровотечения, появляющиеся после менопаузы, могут указывать на такие раковые болезни:
- рак влагалища;
- рак матки.
Данный сигнал может быть первым симптомом рака кишечника.
Рвота с кровью может быть сигналом таких онкологических заболеваний:
Конечно же, боль тоже является важным сигналом раковых расстройств.
Как правило, она — постоянная, специфическая в конкретном месте и усиливается, вызывая у больного бессонницу. С течением времени её труднее и труднее устранить обычными болеутоляющими средствами.
Постоянная головная боль может быть единственным релевантным признаком рака головного мозга.
Боль в животе (постоянная или под видом колик) может указать на рак внутреннего органа (например, кишечника).
Повторные инфекции организма, которые очень трудно лечатся, даже используя антибиотикотерапию, могут быть признаком рака.
Обычно, раковые заболевания способствуют появлению бактериальных инфекций.
Это обусловлено тем, что опухоли вызывают такие изменение в организме:
- разрушение тканей;
- изъязвление слизистых оболочек таких частей тела:
- половых органов;
- ротовой полости;
- гортани.
- сужение внутренних органов (например, мочевыделительной системы или бронхов);
- ослабление иммунной системы.
На фоне данных изменений, повышается вероятность бактериальных инфекций.

В некоторых случаях, появление сгустка крови в вене (тромбофлебит) является первым признаком рака.
Тромбофлебиту нижних конечностей способствуют опухоли в области таза или живота.
Данное нарушение может повторяться, поражая различные (иногда необычные) области. Раковые клетки выделяют некоторые вещества, которые ведут к образованию сгустков крови в венах.
Характерные для органов симптомы рака
Предупреждающие сигналы рака для конкретного органа могут помочь быстрее выявить болезнь.
Главными признаками рака в данных областях являются:
- болезненная остановка еды в пищеводе, сопровождающаяся рвотой (в случае поражения пищевода);
- заметное изменение голоса с появлением хрипа (рак горла или ротовой полости);
- дискомфорт или боль во время жевания (боль отдаёт в уши).
Внезапные или постепенные затруднения в дыхании, вначале при физической нагрузке потом также и в состоянии покоя, часто указывают на рак легкого.
Курящим людям, при появлении или усугублении кашля, рекомендуется обращать особое внимание на лечение.
При раке головного мозга или мозговых оболочек пациент жалуется на такие признаки:
- постоянная головная боль;
- изменения поведения;
- проблемы со зрением;
- параличи;
- рвота утром при просыпании.
Увеличение одного или нескольких лимфатических узлов в подмышечной или в паховой области, а также в зоне шеи может быть признаком рака внутреннего органа или рак лимфатических узлов.
Рак предстательной железы или мочевыделительной системы у мужчин может сопровождаться такими симптомами:
- проблемы при мочеиспускании;
- задержка мочи.
Первыми симптомами рака пищеварительной системы являются:
- чувство тяжести в верхней части живота;
- прекращение кишечного транзита (запоры).
О раке прямой кишки могут говорить ректальные тенезмы (очень болезненные ощущения на уровне прямой кишки).
Быстро прогрессирующая желтуха может быть признаком рака печени или желчного тракта.
Видимые симптомы рака
Некоторые признаки онкологических расстройств могут быть замечены невооруженным глазом.
При появлении болезненного (или даже простого) узелка или другого ненормального образования на уровне кожи, мышц, яичек или молочной железы рекомендуется проконсультироваться с врачом по поводу его природы, особенно если он со временем увеличивается.
Выраженное изъявленное воспаление с неровными краями на уровне кожи, которое не заживает и расширяется, является важным сигналом рака кожи.
Если вы заметили изменения на уровне бородавки или родинки (изменение цвета, увеличение размеров или кровотечение), требуется немедленно проконсультироваться с врачом.
Проблема гипердиагностики в онкологии не нова. Еще в 30—40-е гг. XX в. патологоанатомы обращали внимание на существование так называемых латентных опухолей щитовидной и предстательной желез, которые обнаруживались при вскрытии больных, умерших не от онкологического заболевания. Сейчас эта проблема приобрела новое значение в связи с развитием высокочувствительных диагностических технологий, с помощью которых стало возможным выявлять такие образования уже при жизни человека
Гипердиагностика и последующее чрезмерное или вовсе ненужное лечение и связанные с ним риски – наиболее опасное последствие внедрения массового обследования населения или так называемой диспансеризации, которая набирает обороты в России. В западных странах программы скрининга для раннего выявления рака критически пересматривают и от некоторых из них просто отказываются.
Заболеваемость, выживаемость и смертность
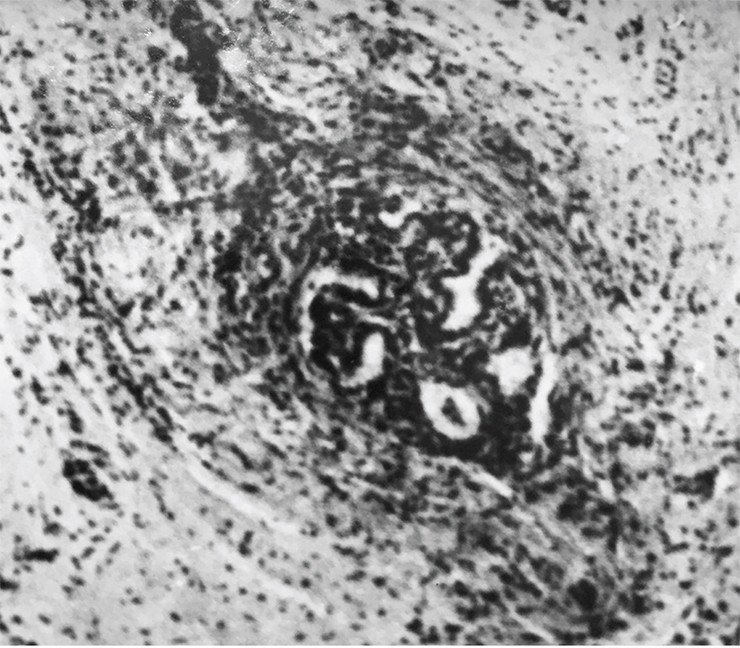
Папиллярная микрокарцинома щитовидной железы давно привлекла внимание патологов и клиницистов. Длительное наблюдение пациентов с диагнозом папиллярной микрокарциномы показало, что их продолжительность жизни не отличается от ожидаемой продолжительности жизни практически здоровых людей того же пола и возраста (Заридзе, 1973).
На основе данных, полученных при вскрытиях, можно предсказать частоту латентных раков в популяции и сравнить этот показатель с риском смерти от злокачественной опухоли того или иного органа. Латентный рак предстательной железы встречается очень часто: по данным разных авторов, он обнаруживается в 30—70 % случаев вскрытий мужчин старше 60 лет, умерших от неонкологических болезней (Breslow et al., 1977; Stamatiou et al., 2006). При этом популяционный риск умереть от рака простаты у мужчин в возрасте за шестьдесят всего 4 %.
Латентные раки щитовидной железы встречаются на вскрытии еще чаще, в 35—90 % случаев, а риск смерти от этой формы рака – всего 0,1 %. Клинически незначимый рак молочной железы может быть случайной находкой в 10—39 % случаев (Welch, Black, 2010), но риск смерти от этого заболевания не превышает 4 %. Таким образом, вероятность гипердиагностики этих заболеваний велика и по подсчетам составляет для рака простаты – около 90 %, рака щитовидной железы – 99 %, и рака молочной железы – 41—90 % (Harach et al., 1985; Welch, Black, 2010).
Судить о факте гипердиагностики крайне трудно в случае конкретного человека, но относительно легко – на уровне популяции: для этого надо сравнить статистические данные заболеваемости и смертности. Быстрый рост заболеваемости (или, точнее, выявляемости) той или иной формы рака в результате внедрения новых высокочувствительных методов диагностики при стабильной или уменьшающейся смертности указывает на возможность гипердиагностики. Например, в США рост заболеваемости раком щитовидной железы, почки, предстательной железы, молочной железы и меланомой кожи не только не сопровождался ростом смертности, но смертность от некоторых перечисленных форм рака даже снизилась (Welch, Black, 2010).
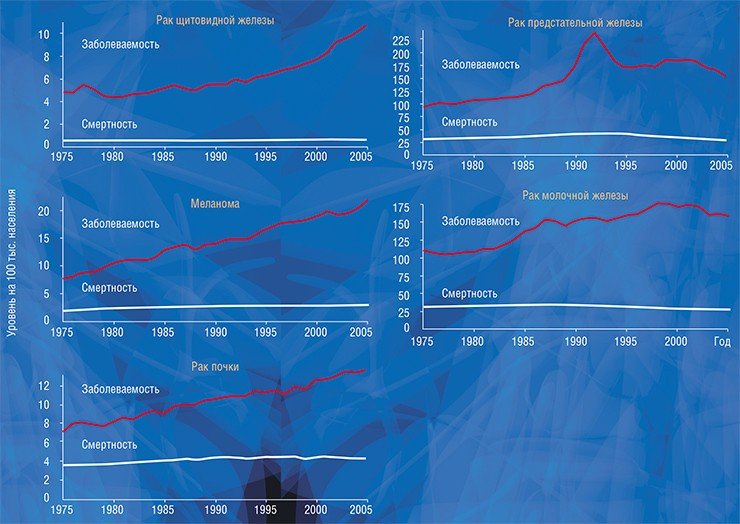
Американские авторы объясняют рост заболеваемости раком молочной железы гипердиагностикой, вызванной широким распространением маммографического скрининга, а предстательной железы – тестированием на простатический специфический антиген (ПСА). Анализ на ПСА, белковый маркер патологии предстательной железы, а не только рака, с 2014 г. не рекомендован к использованию в скрининговых программах из-за низкой специфичности и в результате гипердиагностики (Ibid). В то же время некоторое снижение смертности oт этих форм рака, по мнению тех же авторов, обусловлено не только прогрессом в лечении, но и ранней диагностикой клинически значимых опухолей.
Внутрипротоковый рак молочной железы in situ, до того как в 1980 г. получил распространение маммографический скрининг, встречался очень редко, составляя не более 2 % всех случаев рака молочной железы (Rosner et al., 1980). Но после внедрения скрининга выявляемость этой патологии резко выросла, составив к 2002 г. около 20 % случаев, диагностируемых на преинвазивной (ранней) стадии (Ernster et al., 2002), а применение магнитно-резонансной томографии увеличило эту цифру до 30 % (Kuhl et al., 2007).
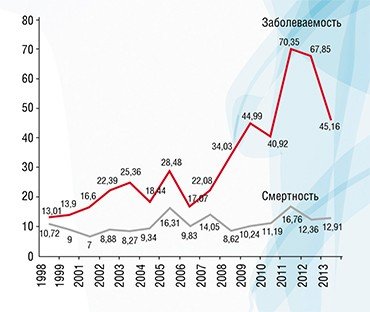
Рост заболеваемости раком щитовидной железы или, точнее, выявляемости клинически незначимых латентных образований – следствие широкого распространения ультразвукового исследования (УЗИ) органов шеи. Изучив динамику заболеваемости в развитых странах, исследователи из Международного агентства по изучению рака (МАИР) пришли к заключению, что в течение последних двух десятилетий количество случаев гипердиагностики рака щитовидной железы в двенадцати развитых странах достигло почти полумиллиона случаев: 470 тыс. мужчин и 9 тыс. женщин (Vaccarella at al., 2016). Рост заболеваемости раком почки тоже в большой степени объясняется распространением УЗИ – в этом случае органов брюшной полости. Так называемая онкологическая настороженность дерматологов и широкое применение диагностической процедуры дерматоскопии позволяет выявлять клинически незначимые меланомы кожи, динамика роста выявляемости которых в США отражает динамику роста частоты дерматоскопий.
В США выживаемость при раке молочной железы достигает 90 %, а при раке простаты – 100 %. Ожидаемая продолжительность жизни пациентов с папиллярной микрокарциномой щитовидной железы не отличается от ожидаемой продолжительности жизни людей того же пола и возраста. Эти очень высокие показатели выживаемости в значительной степени являются результатом гипердиагностики
И во всех этих случаях нет оснований говорить о том, что изменилось влияние известных факторов риска рака, за счет которых может расти заболеваемость, хотя нельзя полностью исключить истинный рост заболеваемости, например, раком почки за счет распространения в популяции таких факторов риска, как избыточный вес и недостаток физической активности.
В России и в Америке – одна картина
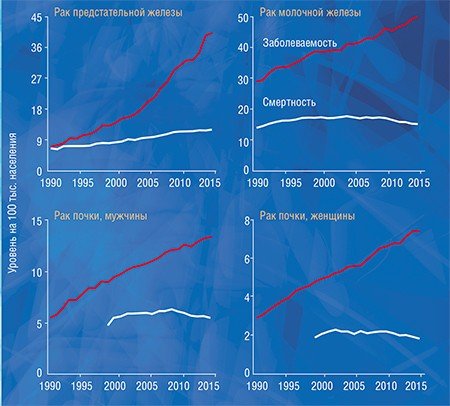
Чтобы понять, как влияет гипердиагностика на уровень заболеваемости раком в нашей стране, мы, используя данные статистики заболеваемости и смертности от рака, которые предоставили коллеги из МНИО им. П. А. Герцена, провели исследование, аналогичное американскому. Мы сравнили динамику заболеваемости меланомой, раком почки, предстательной, молочной и щитовидной желез с динамикой смертности от этих болезней и получили похожие результаты: резкий рост заболеваемости и незначительный рост смертности с дальнейшей стабилизацией или некоторым снижением.
Существует колоссальная разница между показателями заболеваемости раком предстательной и щитовидной железы в разных регионах России, а разница по смертности при этом далеко не так ярко выражена. Мы выяснили, что у пациентов с раком предстательной и щитовидной желез заболеваемость достоверно коррелирует с выживаемостью, т. е. в регионах с высокой заболеваемостью наблюдается высокая выживаемость. Это говорит о том, что заболеваемость растет за счет роста выявляемости клинически незначимых образований, а высокий показатель выживаемости указывает на то, что продолжительность жизни этих пациентов была бы такой же и без лечения.
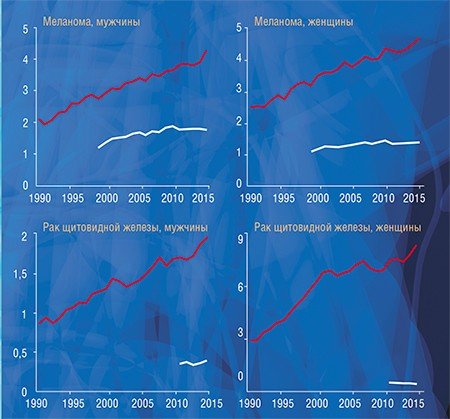
Как и в Америке, в России значительный рост заболеваемости раком за последние два десятилетия нельзя объяснить только ростом влияния известных или гипотетических факторов риска, а многократное увеличение разрыва между заболеваемостью и смертностью не может быть только следствием прогресса в лечении онкологических заболеваний. В эти годы и в нашей стране происходило широкое внедрение в практику высокочувствительных диагностических методов: ПСА, маммографии, УЗИ, компьютерной и магнитно-резонансной томографии, способных выявить латентные клинически незначимые новообразования.
Методом выбора ведения пациентов с бессимптомными, клинически незначимыми, латентными новообразованиями должен стать отказ от агрессивной терапии. Такая тактика позволит избежать ненужного, чрезмерного вмешательства, что, в свою очередь, предотвратит ухудшение качества жизни пациентов (сколько изуродовали мужчин на основании ПСА-тестирования!), а также приведет к сокращению расходов на лечение.
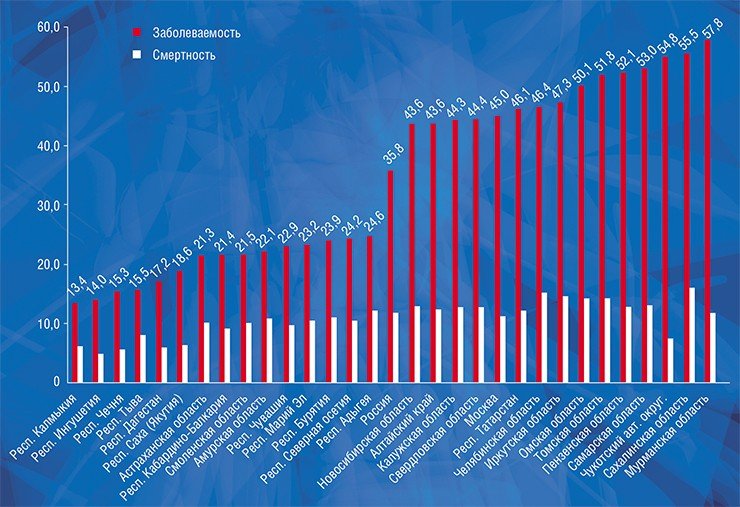
Показано, что в регионах, загрязненных радионуклидами в результате аварии на Чернобыльской АЭС, в рост заболеваемости раком щитовидной железы внес свой вклад скрининг УЗИ. До 40 % случаев рака щитовидной железы в этих регионах можно отнести к гипердиагностике (Ivanov et al., 2012)
К сожалению, у нас пока нет точных критериев, биомаркеров для определения прогноза, позволяющих отличить клинически незначимые образования от тех, которые прогрессируют. Необходимо проведение комплексных исследований, включая молекулярные, клинические, эпидемиологические. Крайне необходимо создание регистра пациентов с клинически незначимыми образованиями, с последующим длительным наблюдением за ними.
Такие исследования уже ведутся. Есть программа под названием Grand Challenge CRUK, которая финансируется британским онкологическим исследовательским фондом Cancer Research UK. Цель работы группы ученых из Великобритании, Нидерландов и США – выявить биологические маркеры прогрессии внутрипротокового рака молочной железы. Изучаются образцы тканей, взятые во время операции у женщин с этим диагнозом, собирается клиническая информация о пациентках, наблюдается развитие заболевания и дается его прогноз.
Пока нет четких критериев, нет ответа на вопрос, когда лечить необходимо, а когда нужно просто наблюдать. Но врачи должны знать об этой проблеме и одной из своих профессиональных задач ставить предотвращение практики чрезмерного агрессивного лечения, способного навредить пациенту.
Заридзе Д. Г., Пропп Р. М. О маленьком раке щитовидной железы // Архив патологии. 1973. Т. XXXV, № 12. С. 24—27
Breslow N., Chan C.W., Dhom G. et al. Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France // Int. J. Cancer. 1977. V. 15. N. 20. P. 680—688.
Ernster V. L., Ballard-Barbash R., Barlow W. E. et al. Detection of ductal carcinoma in situ in women undergoing screening mammography // J. Natl. Cancer. Inst. 2002. V. 16. P. 94. P. 1546—1554.
Ivanov V. K., Kashcheev V. V., Chekin S. Y. et al. Radiation-epidemiological studies of thyroid cancer incidence in Russia after the Chernobyl accident (estimation of radiation risks, 1991-2008 follow-up period) // Radiat Prot Dosimetry. 2012. V. 151. P. 489—499.
Kuhl C. K. Current status of breast MR imaging // Part. Clinical applications. Radiology. 2007. V. 244. N. 3. P. 672—691. Review.
Rosner D., Weiss L., Norman M. Ultrasonography in the diagnosis of breast disease // J. Surg. Oncol. 1980. V. 14. P. 83—96.
Stamatiou K., Alevizos A., Perimeni D. et al. Frequency of impalpable prostate adenocarcinoma and precancerous conditions in Greek male population: an autopsy study // Prostate Cancer Prostatic Dis. 2006. V. 9. P. 45—49.
Vaccarella S., Franceschi S., Bray F. et al. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis // N. Engl. J. Med. 2016. V. 18.N. 375. P. 614—617.
Welch H. G., Black W. C. Overdiagnosis in cancer // J. Natl. Cancer Inst. 2010. V. 102. N. 5. P. 605—613.
Лихорадочная форма рака желудка встречается нередко. В большинстве случаев рака измерение температуры позволяет обнаружить, как правило, субфебрильную, но иногда температура бывает резко повышена до 39 и 40°. Рак желудка можно иногда смешать с малярией, «аспространенный распад медуллярного рака желудка может дать картину, сходную даже с брюшным тифом . Иногда выраженная лихорадка бывает первым проявлением болезни.
Анемическая форма развивается в случаях длительных, обычно скрытых кровотечений; в части случаев это больные, страдающие анемией Бирмера, у которых развился рак желудка. Отечная форма рака желудка возникает при длительном нарушении питания, развитии выраженной гипопротеинемии и анемии; отеки ног, одутловатость лица — в этих случаях наиболее выразительный симптом, а иногда и первый симптом, обративший внимание больного.
Наибольший клинический интерес представляют начальные формы рака желудка. Их можно разделить на три большие группы: 1) латентные формы, 2) безболевые формы и 3) с болевым синдромом, включающим первично язвенную форму рака желудка.
Несколько чаще скрытые формы рака желудка выявляются впервые при обнаружении метастазов или симптомов, вызываемых прорастанием или отдаленными метастазами. Нередко метастатический рак печени бывает первым объективным признаком рака желудка, еще чаще лимфатический узел шеи (железа Вирхова) распознается до выявления желудочного поражения, иногда клиническое начало болезни обнаруживается в опухоли яичников (опухоль Крукенберга) или при поражении костей, в которых рентгенологически устанавливаются метастазы, наконец, отеки или фистула гастроколика открывают болезнь в ее последней стадии.
Нельзя не подчеркнуть, что латентная форма рака желудка может длиться 5 и даже 8 лет.
При обнаружении скрытых кровотечений, а при отсутствии кровотечений диагностика может быть в течение длительного времени неопределенной или ошибочной.
Рак желудка, начинающийся кишечными симптомами, встречается нередко; жалобы на запоры могут сопровождать различные желудочные проявления болезни. Иногда они доминируют в картине болезни; реже отмечаются поносы. Тяжелые поносы были поводом обращения к врачу в случае фистулы гастроколика .
1) изъязвленные карциномы, при которых изъязвление является вторичным и наступает в результате некроза и распада раковой опухоли,
2) так называемый рак из язвы или раковое превращение хронической доброкачественной язвы желудка и, наконец,
3) первично язвенную форму рака, т. е. такое злокачественное поражение желудка, которое с самого начала развивается в виде изъязвления.
Характерными морфологическими чертами этой формы рака желудка считают:
1) очень ранние сроки изъязвления,
2) плоский и преимущественно округлый вид изъязвления,
3) отсутствие опухоли в течение длительного времени болезни.
Если известные формы рака желудка могут длительное время протекать скрыто, без каких-либо показательных местных и общих клинических симптомов, или сопровождаться самыми разнообразными и не всегда отчетливыми клиническими проявлениями, то первично язвенная форма рака, в отличие от других форм, имеет — за малым исключением — вполне определенную клиническую картину с четким началом, открывающим болезнь в ранней стадии ее развития
Аннотация научной статьи по клинической медицине, автор научной работы — Федосенко Константин Владимирович, Карлов П. А.
Цель исследования ретроспективная клинико-морфологическая оценка результатов обследования 70 пациентов с оккультным раком предстательной железы (РПЖ). Полученные результаты указывают на целесообразность выделения латентного рака предстательной железы как особой клинико-морфологической формы, имеющей относительно благоприятный прогноз. Применение антиандрогенной блокады (хирургической или терапевтической), по нашим данным, не приводило к достоверному увеличению сроков выживаемости таких больных, достигавшей 9 лет, а причиной смерти являлось не прогрессирование опухоли, а развитие интеркуррентных заболеваний. Латентный рак характеризуется следующими признаками: обнаружение лишь единичных очагов малигнизации среди множества исследованных кусочков ткани (опухоль в 1-3 из 2030 тканевых фрагментов); индекс по шкале Глисона не более 4; выявление Кi-67 не более чем в 10% опухолевых клеток; активность ядрышковых организаторов до 3,8; сильная реакция на рецепторы андрогенов в большинстве опухолевых клеток; отсутствие гиперэкспрессии p53; слабая или умеренная инфильтрация тканей, прилежащих к опухоли лимфоидными и моноцитарными клетками. При планировании тактики лечения РПЖ показано проведение углубленного морфологического и молекулярно-генетического анализа.
Похожие темы научных работ по клинической медицине , автор научной работы — Федосенко Константин Владимирович, Карлов П. А.
The clinical and morphological features of latent prostate cancer
The purpose of the study was to provide a retrospective clinicomorphological assessment of the results of examining 70 patients with occult prostate cancer (PC). The findings show it expedient to identify latent prostate cancer as a special clinicomorphological form having a relatively good prognosis. According to the data, surgical or medical antiandrogen blockade had not caused a significant increase in the survival time up to 9 years in these patients and the cause of death was the development of intercurrent diseases rather than tumor progression. Latent cancer is characterized by the following signs: detection of only single foci of malignization among a great deal of study tissue pieces) (a tumor in 1-3 out of 20-30 tissue fragments); a Gleason score not more than 4; detection of Ki-67 in more than 10% of tumor cells; the activity of nucleolar organizers up to 3.8; a strong reaction to androgen receptors in the majority of tumor cells; no p53 hyperexpression; a slight or moderate lymphoid or monocytic cell infiltration of the tissues adjacent to the tumor. The planning of PC management should involve in-depth morphological and molecular genetic analyses.
Таким образом, сцинтиграфия с туморотроп-ным РФП с использованием разработанной и запатентованной нами программы для ЭВМ является высокочувствительным и специфичным тестом предварительной диагностики РПЖ, поскольку позволяет не только заподозрить, но и установить локализацию подозрительных очагов, что подтверждено посредством морфометрического исследования и имеет важ-
ное значение при выборе точек для биопсии ПЖ. Следовательно, использование сцинтиграфии ПЖ дает возможность улучшить показатели раннего выявления РПЖ, благодаря целенаправленному выявлению точек — повысить эффективность биопсии, а также с большими, чем ранее, основаниями исключить данное заболевание на добиопсийном этапе. Метод неинвазивен и может применяться для мониторинга за больными с подозрением на РПЖ.
1. Аксель Е.М. Заболеваемость злокачественными новообразованиями мочевых и мужских половых органов в России в 2003 г. Онкоурология 2005;(1):6—9.
2. Александров В.П., Карелин М.И.
Рак предстательной железы. СПб.: СПБМАПО, 2004.
3. Кушлинский Н.Е., Соловьев Ю.Н., Трапезникова М.Ф. Рак предстательной железы. М.: РАМН, 2002.
4. Лоран О.Б. Рак простаты: Современный взгляд на проблему. Материалы XI съезда урологов России, 6—8 ноября 2007 г. М., 2007. с. 5—13.
5. Roddam A.W., Duffy M.J., Hamdy F.C. et а1. Use of prostate-specific antigen (PSA) isoforms for the detection of prostate cancer in теп with а PSA level of 2—10 ng/ml: systematic review and meta-
analysis. Eur Urol 2005;48:386—99.
6. Лишманов Ю.Б., Чернов В.И. Радионуклидная диагностика для практических врачей. Томск: STT, 2004.
7. Чиглинцев А.Ю., Воронова С.В., Коренев И.В. и др. Сцинтиграфия простаты с туморотропным радиофармацевти-ческим препаратом Технетрилом 99mTc. Свидетельство об официальной регистрации программы для ЭВМ
8. Коган М.И., Лоран О.Б., Петров С.Б. Радикальная хирургия рака предстательной железы. М.: ГЭОТАР-Медиа, 2006.
9. Автандилов Г.Г. Основы количественной патологической анатомии. М.: Медицина, 2002.
10. Гланц С. Медико-биологическая
статистика. М.: Практика, 1998.
11. Metz С.Е., Herman В.А., Shen J-H. Maximum-likelihood estimation of receiver operating characteristic (ROC) curves from continuously-distributed data. Statistics in Medicine 1998;17:1033—53.
12. Youden D. Index for rating diagnostic tests. Cancer 1950;3(1):32—5.
13. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATIS-TICA. М.: МедиаСфера, 2002.
14. Хальд А. Математическая статистика с техническими приложениями. М.: ИИЛ, 1956.
15. Сивков А.В., Аполихин О.И. Рак предстательной железы. Материалы Х Российского съезда урологов, 2002. М., 2002. с. 351—71.
Клинико-морфологические особенности латентного рака предстательной железы
К.В. Федосенко, П.А. Карлов
Городской клинический онкологический диспансер, Санкт-Петербург
THE CLINICAL AND MORPHOLOGICAL FEATURES OF LATENT PROSTATE CANCER
K.V. Fedosenko, P.A. Karlov
City Clinical Cancer Dispensary, Saint Petersburg
The purpose of the study was to provide a retrospective clinicomorphological assessment of the results of examining 70 patients with occult prostate cancer (PC). The findings show it expedient to identify latent prostate cancer as a special clinicomorphological form having a relatively good prognosis. According to the data, surgical or medical antiandrogen blockade had not caused a significant increase in the survival time up to 9 years in these patients and the cause of death was the development of intercurrent diseases rather than tumor progression. Latent cancer is characterized by the following signs:
— detection of only single foci of malignization among a great deal of study tissue pieces) (a tumor in 1—3 out of20—30 tissue fragments);
— a Gleason score not more than 4;
— detection of Ki-67 in more than 10% of tumor cells;
— the activity of nucleolar organizers up to 3.8;
— a strong reaction to androgen receptors in the majority of tumor cells;
— no p53 hyperexpression;
— a slight or moderate lymphoid or monocytic cell infiltration of the tissues adjacent to the tumor.
The planning of PC management should involve in-depth morphological and molecular genetic analyses.
Key words: latent prostate cancer, diagnosis, treatment policy
Оккультный (случайно обнаруженный) рак предстательной железы (РПЖ) выявляется в 3—15% случаях при операциях, выполненных по поводу аденомы [1—4]. По результатам исследования многопрофильной больницы МСЧ № 7 Санкт-Петербурга, проведенного в период с 1995 по 2004 г., среди всех оперированных пациентов РПЖ был обнаружен у 6%. Успехи современной диагностики и скрининга на основе динамической оценки простатспе-цифического антигена (ПСА) и широкого распространения мультифокальных биопсий предстательной железы позволили существенно снизить число операций типа аденомэктомии при оккультном раке. Однако вопросы радикальности аденомэктомии, а также дальнейшей тактики ведения таких больных остаются открытыми [1, 5—9].
Цель исследования — ретроспективная клинико-морфологическая оценка оккультного РПЖ.
Материалы и методы
Из всех пациентов после операции 45 получали антиандрогенную терапию (терапевтическую и хирургическую), а у 25 — специфическая терапия не проводилась. На микропрепаратах, окрашенных гематоксилином и эозином, оценивался индекс по
шкале Глисона. Уровень экспрессии рецепторов андрогенов (РА), Ю-67, Вс1-2, р53 определялся иммуногистохимически с помощью первичных антител фирм Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Интеркуррентные заболевания — 100%
Прогрессирование опухолевого процесса — 100%
20% наблюдений 13,93+10,48 4,95+2,27 3,73+0,08
Интеркуррентные заболевания — 60%, прогрессирование опухолевого процесса — 40%
Редко (не более 8%) 11,00+5,33 и 8,35+4,32 4,88+0,22 и 4,75+0,43 3,77+0,09 и 3,00+ 0,1
РА Выявляются Выявляются в 80% случаев, Выявляются в 72% наблюдений,
в 75% наблюдений реакция слабее, чем при ЛР реакция слабее, чем при ЛР
Примечание. ЛР — латентный рак.
лись эстрогены. Два пациента были живы в течение 7 и 9 лет после операции, 12 — умерли от прогрессирования ишемической болезни сердца (ИБС) через 3—4 года. У 8 больных признаки прогрессирования РПЖ на протяжении 5 лет отсутствовали, а обращения в поликлинику были связаны с обострениями сердечно-сосудистых заболеваний — ИБС, цереброваскулярной болезнью (ЦВБ). Срок выживаемости в этой группе составил 5,8±1,8 года. Таким образом, все пациенты в группе ЛР умерли не от прогрессирования рака, а от интеркуррент-ных заболеваний. Очаги опухоли у этих больных были представлены высокодифференцированной аденокарциномой. Индекс Глисона составил 2—4. В группе ЛР зафиксирована более высокая пролиферативная активность эпителия опухоли по сравнению с ПТЗ ЛР и с группой НГПЖ (экспрессия Кі-67 составила 8,26+5,43, 3,77+0,22 и 2,76+0,45% соответственно). Следует отметить большую вариабельность экспрессии Кі-67 в опухолевой ткани (от 2,75 до 16,33%). Активность ЯО оказалась выше в микроочагах малигнизации по сравнению с прилежащими тканями и группой НГПЖ (3,15+0,07, 2,39+0,07, 2,25+0,06). Экспрессия маркера ингиби-ции апоптоза — Ьс1-2 в ткани опухоли была ниже, чем в ПТЗ или при НГПЖ (5,41+0,71, 6,41+1,81, 6,25+1,38). Гиперэкспрессии мутантного белка р53 в ткани опухоли не обнаружено ни в одном случае. РА выявлялись в большинстве (от 40 до 90%) эпителиальных клеток. Умеренная и сильная реакция на РА была в 15 из 20 случаев ЛР. В ПТЗ отмечалось нарастание доли клеток лимфоидного и макрофа-гального ряда и снижение числа фибробластов и эндотелиальных клеток. Корреляционных взаимоотношений между морфологическими и имму-ногистохимическими показателями состояния опухолевых клеток и выживаемостью больных обнаружить не удалось.
Из 25 больных РПЖ у 10 применялась антиан-дрогенная терапия, у 15 — терапии не было. 12 больных умерли в пределах 2 лет, 8 — через 3 года, 5 — через 5 лет после операции от генерализации опухолевого процесса. Выживаемость пациентов, получавших антиандрогенную блокаду, была выше, чем в группе без специфического лечения (4,5 + 1,1 и 2,9+0,9 года соответственно). В среднем выживаемость составила 3,4+0,8 года. Группа РПЖ была представлена опухолями различной степени диф-ференцировки. Индекс по шкале Глисона колебался от 3 до 9, преобладали опухоли с индексом 4—6 (выше, чем при ЛР). При РПЖ в ткани опухоли экспрессия Кі-67 и активность ЯО была выше, чем в 1-й группе (13,93+10,48 и 3,73+0,08). Экспрессия Ьс1-2 в ткани опухоли была еще ниже, чем ЛР (4,95+2,27). У 5 из 25 пациентов с РПЖ выявлена
гиперэкспрессия р53. При распространенном раке в 10 случаях экспрессия РА была выраженной, в 10 — слабой, а в 5 — отсутствовала. В целом экспрессия РА при РПЖ была менее выраженной, чем при ЛР. Экспрессия Ю-67 (3,35+0,37) и активность ЯО (2,52+0,06) ПТЗ РПЖ была выше по сравнению с ПТХ микрофокуса рака (МФР) и НГПЖ. В тканях вблизи РПЖ нарастала доля лимфоцитов и макрофагов, снижалось число эндотелиоцитов и фиб-робластов по сравнению с МФР. Увеличивалось отношение количества лимфоцитов к макрофагам, особенно, их доля в сравнении с эндотелиоцитами и фибробластами. В группе РПЖ возросло число клеток макрофагального ряда по отношению к фи-бробластическим клеткам. Нами выявлены достоверные отрицательные корреляции между индексом Глисона, уровнем экспрессии Ю-67 опухоли, количеством лимфоцитов и макрофагов в ПТЗ и сроком выживаемости (г=-0,73, ^=0,01; г=-0,67, p=0,01; г=-0,7, p=0,01; г=-0,8, p=0,01 соответственно). У больных с распространенным раком при применении антиандрогенного лечения корреляций между уровнем экспрессии РА в ткани опухоли и выживаемостью не выявлено, однако при высокой экспрессии андрогенов в ткани опухоли выживаемость пациентов оказалась выше (3,9+1,2 года), чем при низкой (2,8+1,1 года). Больные с высокой экспрессией Ю-67 ткани опухоли, высоким уровнем РА, большим числом макрофагов и лимфоцитов в ПТЗ клинически лучше реагировали на анти-андрогенное лечение.
В 3-й группе были выделены 2 подгруппы — 1-я (п=10), умершие от прогрессирования опухолевого процесса в течение 3—5 лет после операции, и 2-я (п=15) — умерли от сопутствующих заболеваний — ИБС, ЦВБ, хронической обструктивной болезни легких (ХОБЛ) в промежутке до 5 лет после операции. Выживаемость составила 3,7+0,7 и 4,2+0,9 года соответственно, однако различия оказались недостоверными. Средняя выживаемость в группе — 3,9+0,8 года. Индекс Глисона варьировал в больших пределах — от 3 до 9. В 1-й подгруппе по сравнению со 2-й индекс Глисона оказался достоверно выше: 6,7+1,8 и 4,3 + 1,3 ^ Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
При прогрессировании опухоли (группа РПЖ) еще больше возрастает пролиферативная активность опухолевых клеток в условиях дефицита РА и снижения уровня апоптоза. В ПТЗ повышается число свободных клеток стромы, увеличивается отношение количества лимфоидных клеток к макрофагам. Еще больше, чем при ЛР, возрастает доля лимфоцитов и макрофагов. Исчезает естественная взаимосвязь между процессами пролиферации и элиминации эпителиальных клеток в условиях измененного стромального микроокружения.
Остается не вполне понятной тактика при переходном морфологическом диагнозе. Мы считаем, что при выявлении опухоли в небольшом количестве исследованных образцов ткани, наличии низких значений индекса Глисона, Ю-67, ЯО и уровня РА, отсутствии гиперэкспрессии р53 и наличии в прилежащих тканях умеренной инфильтрации лимфоидными и моноцитарными клетками более приемлема консервативная терапия. Такие опухоли следует расценивать как латентные.
Полученные результаты указывают на целесообразность выделения латентного РПЖ как особой клинико-морфологической формы, имеющей относительно благоприятный прогноз. Из исследованных морфологических параметров прогностическое значение имеет индекс по шкале Глисона и, в меньшей степени, Ю-67, ЯО, р53, РА, характер клеточного инфильтрата прилежащей к опухоли стромы. Иммуногистохимические маркеры и состояние свободных клеток стромы обладают прогностической значимостью лишь при распространенном РПЖ.
При планировании тактики лечения РПЖ показано проведение углубленного морфологического и молекулярно-генетического анализа.
1. Humphrey P.A., Prostate Pathology. Chicago: ASCP Press, 2003.
2. Karube K. Study of latent carcinoma of the prostate in Japanese based on necropsy material. Tohoku J Exp Med 1961;74: 265—85.
3. Sakr W., Permick N., Butler C. et al. The prevalence of high grade, clinically occult prostatic adenocarcinoma and its relationship to high grade PIN. Mol Pathol 2000;13:109A.
4. Senderoi Z., Balogh F. Der Prostatakrebs. Verlag Theodor Steinkopff. Dresden und Leipzig, 1965.
5. Amling C.L., Blute M.L., Lerner S.E.
et al. Influence of prostate specific antigen testing on the spectrum of patients with prostate cancer undergoing radical prostatectomy at a large referral practice. Mayo Clin Proc 1996;73:401-6.
6. Bostwick D.G., Foster C.S. Predictive factors in prostate cancer: Current concepts from the 1999 College of American Pathologists Conference on Solid Tumor Prognostic Factors and the 1999 WHO International Consultation on Prostate Cancer. Semin Urol Oncol 1999;17: 222-72.
7. Buchanan G., Irvine R.A.,
Coetzee G.A., Tilley W.D. Contribution of
the androgen receptor to prostate cancer predisposition and progression. Cancer Metastasis Rev 2001;20(3—4):207—23.
Читайте также:

