Чекпоинт ингибиторы лекарство от рака

Приглашаем врачей, чья деятельность связана с онкоурологией, к активному сотрудничеству.
Важно отметить, что цикл также может запускаться альтернативными (внешними) причинами гибели опухолевых клеток: цитотоксическим действием химиотерапии, лучевой терапией или хирургическим вмешательством, за исключением апоптоза клеток [3].
Регулирование иммунного цикла на множественных точках обеспечивается сложным взаимодействием ко-стимуляторных и ингибиторных сигналов. В физиологических условиях это взаимодействие позволяет подавлять чрезмерную активацию иммунного цикла, развитие аутоиммунной агрессии и повреждения собственных тканей. К сожалению, те же механизмы негативной регуляции опухолевые клетки используют для ускользания от иммунного ответа [4, 5]. Например, секреция паракринных цитокинов (аденозин, простагландин Е2, фактор роста эндотелия сосудов VEGF, интерлейкины IL-10, IL-4, IL-13) подавляет активацию эффекторных Т-лимфоцитов и препятствует инфильтрации опухоли. Экспрессия на поверхности опухолевых клеток лигандов PD-L1 и PD-L2 за счет повышенной регуляции подавляет цитотоксическую активность опухоль-инфильтрирующих Т-лимфоцитов.
Рецептор CTLA-4 (CD152) — мембранный белок, принадлежит к ингибиторным регуляторам Т-лимфоцитов, имеет сходную с CD28 (ко-стимуляторным рецептором на поверхности Т-клеток) структуру и служит ключевым элементом в процессе активации эффекторных Т-лимфоцитов. Кодируется геном CTLA4. Экспрессия CTLA-4 усиливается на активированных Т-клетках. Конкурирует с CD-28 за взаимодействие со стимуляторными молекулами B7-1 и B7-2 на поверхности антигенпрезентирующих клеток. Вместо усиления активации Т-клеток, взаимодействие B7:CTLA-4 приводит к ингибированию их активации, преимущественно в лимфатических узлах.
Рецептор PD-1 (CD279) — мембранный белок, принадлежит к семейству CD28/CTLA-4 регуляторов Т-лимфоцитов, предотвращает активацию сигнального каскада PI3K [6]. Кодируется геном PDCD1. Индукция экспрессии белка PD-1 может происходить на поверхности Т- и В-лимфоцитов, натуральных киллеров (NK-клетками), активированных моноцитов и дендритных клеток. Аналогично CTLA-4, экспрессия PD-1 усиливается на активированных Т-клетках. Взаимодействие PD-1 c его лигандами (PD-L1:PD-1 сигнал) не только подавляет активность Т-клеток во время прайминга (выполняет узнавание антигенпрезентирующих клеток и Т-клеток), но и играет ключевую роль — модулирует активность эффекторных Т-лимфоцитов на периферии — либо в процессе миграции к опухоли, либо в самой опухоли (узнавание Т-клетками опухоли) [7]. В отличие от CTLA-4, действие PD-1 направлено преимущественно на опухолевое микроокружение, способствуя снижению Т-клеточного эффекторного ответа (цитолиз опухолевых клеток).
PD-L1 (B7-H1, или CD274) – лиганд к рецептору PD-L1, трансмембранный белок, имеет сродство к CD80 (ко-стимуляторным рецептором на поверхности дендритных клеток), участвующим в активации и выживания Т-лимфоцитов за счет взаимодействия с CD-28. По механизму действия конкурирует с CD80, который вызывает активацию и повышает выживание Т-клеток посредством взаимодействия с CD28 на их поверхности. Белок PD-L1 постоянно экспрессируется на поверхности антигенпрезентирующих клеток, дендритных клеток и макрофагоподобных клеток периферических органов, клеток плаценты, островков поджелудочной железы и сетчатки. Индукция экспрессии PD-L1 может происходить на активированных Т- и В-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. Экспрессия PD-L1 усиливается воспалительными цитокинами (интерферон-гамма, IL-4, IL-10), сигнальными путями активации онкогенов (ALK, PI3K, MEK), фактором роста эндотелия сосудов (VEGF), гипоксическим фактором HIF-1α (основным фактором при почечноклеточном раке). Экспрессия PD-L1 на поверхности опухолевых клеток приводит к подавлению эффекторной фазы иммунного ответа (цитотоксической активности T-лимфоцитов), ингибированию пролиферации и стимулированию апоптоза Т-клеток.
При направленном блокировании (ингибировании) сигнального пути контрольных точек иммунного ответа PD-1/PD-L1 достигается усиление противоопухолевого иммунного ответа, восстановление активности эффекторных Т-лимфоцитов, снижение количества и активности иммуносупрессивных Т-клеток.
Современные препараты с механизмом блокирования контрольных точек иммунного ответа:
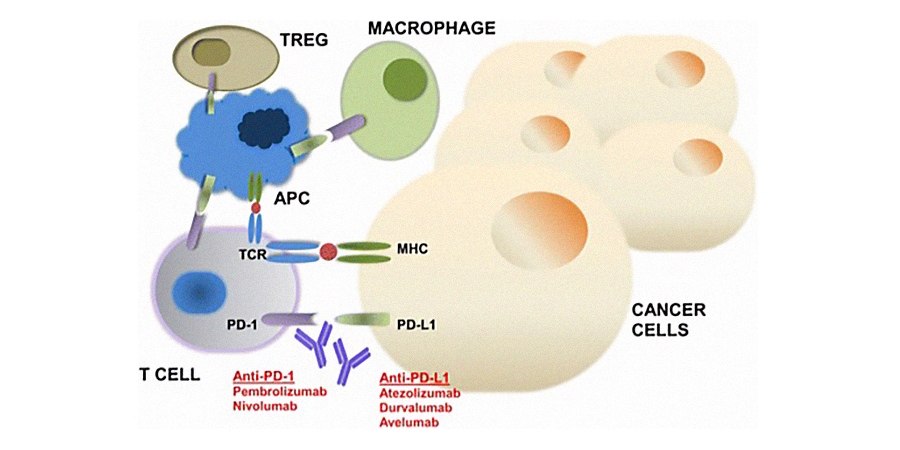
Анти-PD-1 препараты: ниволумаб, пембролизумаб
Анти-PD-L1 препараты: атезолизумаб, авелумаб, дурвалумаб.
Анти-CTLA-4 препараты: ипилимумаб, тремелимумаб
НИВОЛУМАБ
Ниволумаб — полностью гуманизированное моноклональное IgG4 антитело к рецептору PD-1.
FDA одобрило применение ниволумаба для лекарственной терапии меланомы, немелкоклеточного рака легкого, почечноклеточного рака, лимфомы Ходжкина, плоскоклеточного рака головы и шеи, уротелиального рака, колоректального рака, гепатоцеллюлярной карциномы, мелкоклеточного рака легкого.
Клиническое исследование III фазы CheckMate-214 продемонстрировало эффективность и безопасность комбинации ниволумаба (3 мг/кг, 1 раз в 3 недели, 4 цикла) и ипилимумаба (1 мг/кг, 1 раз в 3 недели, 4 цикла) с последующей монотерапией ниволумабом (3 мг/кг, 1 раз в 2 недели) у больных метастатическим светлоклеточным почечноклеточным раком при промежуточном и плохом прогнозе IMDC, ранее не получавших противоопухолевого лечения [8]. Комбинированный режим иммунотерапии обеспечивает преимущество общей выживаемости и частоты объективных ответов, по сравнению с таргетной терапией сунитинибом. Преимущество комбинации иммунопрепаратов наблюдается независимо от PD-L1 статуса опухоли. Профиль безопасности также в пользу комбинированной иммунотерапии.
Клинические исследования I/II фазы CheckMate-032 и II фазы CheckMate-275 продемонстрировали эффективность и безопасность монотерапии ниволумабом (3 мг/кг, 1 раз в 2 недели) у больных местно-распространенным или метастатическим уротелиальным раком, имеющих прогрессирование на платиносодержащей химиотерапии либо в течение 12 месяцев после завершения неоадъювантной или адъювантной платиносодержащей химиотерапии 9.
АВЕЛУМАБ
Авелумаб – полноразмерное гуманизированное моноклональное IgG1 антитело к рецептору PD-L1.
FDA одобрило применение авелумаба в лекарственной терапии карциномы Меркеля, уротелиального рака, почечноклеточного рака.
Клиническое исследование II фазы JAVELIN продемонстрировал эффективность и безопасность монотерапии авелумабом (10 мг/кг, 1 раз в 2 недели) у больных с местно-распространенным или метастатическим уротелиальным раком, имеющих прогрессирование после платиносодержащей химиотерапии или при прогрессировании болезни, наступившем в течение года после адъювантной/неоадъювантной платиносодержащей химиотерапии [11].
Клиническое исследование III фазы JAVELIN Renal 101 продемонстрировало эффективность и безопасность комбинации авелумаба (10 мг/кг, 1 раз в 2 недели) и акситиниба (5 мг, 2 раза в день) у больных распространенным почечноклеточным раком, ранее не получавших противоопухолевого лечения [12]. Комбинация иммунотерапии и таргетной терапии обеспечивала преимущество выживаемости больных без прогрессирования заболевания, по сравнению с таргетной терапией сунитинибом.
АТЕЗОЛИЗУМАБ
Атезолизумаб – полностью гуманизированное антитело к PD-L1, блокирущее взаимодействие с PD-1 и рецепторами CD80.
FDA одобрило применение атезолизумаба в лекарственной терапии уротелиального рака, немелкоклеточного рака легкого, рака молочной железы, мелкоклеточного рака легкого.
Клиническое исследование II фазы IMvigor210 продемонстрировало эффективность и безопасность монотерапии атезолизумабом (1200 мг, 1 раз в 3 недели) сразу в 2 когортах больных местно-распространенным и метастатическим уротелиальным раком. В предлеченной когорте монотерапия атезолизумабом обеспечила высокую частоту объективных ответов, полных регрессий опухоли, продолжительность ответа и общей выживаемости у больных местно-распространенным и метастатическим уротелиальным раком, имеющих прогрессирование заболевания после предшествующей платиносодержащей химиотерапии [13]. В когорте первой линии лечения монотерапия атезолизумабом обеспечила высокую частоту и длительность объективных ответов, полных регрессий опухоли и общую выживаемость у больных местно-распространенным и метастатическим уротелиальным раком, имеющих противопоказания к лечению цисплатином [14]. В обеих когортах был продемонстрирован контролируемый удовлетворительный профиль безопасности атезолизумаба.
Клиническое исследование III фазы IMvigor211 показало, что монотерапия атезолизумабом обеспечивает частоту объективных ответов и выживаемость больных, не отличающиеся чем при стандартной химиотерапии второй линии, у больных местно-распространенным и метастатическим уротелиальным раком с прогрессированием заболевания после предшествующей платиносодержащей химиотерапии, имеющих гиперэкспрессию PD-L1 [15]. Профиль безопасности был в пользу атезолизумаба, по сравнению с химиотерапией второй линии. В группе атезолизумаба были отмечены хорошо переносимые длительные ответы на лечение.
ПЕМБРОЛИЗУМАБ
Пембролизумаб – высокоселективное гуманизированное моноклональное IgG4 антитело к PD-1.
FDA одобрило применение пембролизумаба в лекарственной терапии меланомы, немелкоклеточного рака легкого, плоскоклеточного рака головы и шеи, лимфомы Ходжкина, уротелиального рака, рака желудка, рака шейки матки, гепатоцеллюлярной карциномы, карциномы Меркеля, почечноклеточного рака, мелкоклеточного рака
Клиническое исследование III фазы KEYNOTE-045 продемонстрировало эффективность и безопасность монотерапии пембролизумабом (200 мг, 1 раз в 3 недели), по сравнению со стандартной химиотерапией второй линии, у больных местно-распространенным и метастатическим уротелиальным раком мочевого пузыря, имеющих прогрессирование на платиносодержащей химиотерапии либо в течение 12 месяцев после завершения неоадъювантной или адъювантной платиносодержащей химиотерапии [16]. Монотерапия пембролизумабом обеспечила значимо большую общую выживаемость больных и значимо меньшую частоту развития нежелательных явлений, по сравнению со стандартной химиотерапией второй линии.
Клиническое исследование II фазы KEYNOTE-052 продемонстрировало эффективность и безопасность монотерапии пембролизумабом (200 мг, 1 раз в 3 недели) в первой линии лечения у больных местно-распространенным и метастатическим уротелиальным раком мочевого пузыря, имеющих противопоказания к лечению цисплатином [17]. Монотерапия пембролизумабом в первой линии лечения обеспечила хорошую переносимость, высокую частоту и длительность объективных ответов, в том числе у пожилых пациентов, пациентов с факторами неблагоприятного прогноза и пациентов с тяжелыми сопутствующими заболеваниями.
Клиническое исследование III фазы KEYNOTE-426 показало эффективность и безопасность комбинации пембролизумаба (200 мг, 1 раз в 3 недели) и акситиниба (5 мг, 2 раза в день) у больных распространенным почечноклеточным раком, ранее не получавших противоопухолевого лечения [18]. Комбинация пембролизумаба и акситиниба обеспечивает преимущество общей и беспрогрессивной выживаемости и частоты объективных ответов, по сравнению с таргетной терапией сунитинибом. Преимущество комбинации пембролизумаба и акситиниба наблюдается во всех группах риска заболевания по IMDC и независимо от PD-L1 статуса опухоли. Профиль безопасности комбинации признан контролируемым и приемлемым.
ДУРВАЛУМАБ
Дурвалумаб – полностью гуманизированное моноклональное IgG1 антитело к PD-L1, блокирующее взаимодействие с PD-1 и CD-80.
FDA одобрило применение дурвалумаба в лекарственной терапии уротелиального рака, немелкоклеточного рака легкого.
Клиническое исследование I/II фазы 1108 показало безопасность и эффективность монотерапии дурвалумабом (10 мг/кг, 1 раз в 2 недели) в различных когортах больных неоперабельными или метастатическим солидными злокачественными новообразованиями с PD-L1-положительным статусом опухоли. В когорте исследования уротелиального рака монотерапия дурвалумабом обеспечила высокую частоту и длительность объективных ответов на лечение при контролируемом благоприятном профиле переносимости, а также показатели общей и беспрогрессивной выживаемости у больных местно-распространенным и метастатическим уротелиальным раком, имеющих прогрессирование заболевания на фоне или после платиносодержащей химиотерапии 19.
ИПИЛИМУМА
Ипилимумаб – полностью гуманизированное моноклональное IgG1 антитело к CTLA-4.
FDA одобрило применение ипилимумаба в лекарственной терапии меланомы, почечноклеточного рака, колоректального рака.
Клиническое исследование III фазы CheckMate-214 продемонстрировало эффективность и безопасность комбинации ниволумаба (3 мг/кг, 1 раз в 3 недели, 4 цикла) и ипилимумаба (1 мг/кг, 1 раз в 3 недели, 4 цикла) с последующей монотерапией ниволумабом (3 мг/кг, 1 раз в 2 недели) у больных метастатическим светлоклеточным почечноклеточным раком при промежуточном и плохом прогнозе IMDC, ранее не получавших противоопухолевого лечения [8]. Комбинированный режим иммунотерапии обеспечивает преимущество общей выживаемости и частоты объективных ответов, по сравнению с таргетной терапией сунитинибом. Преимущество комбинации иммунопрепаратов наблюдается независимо от PD-L1 статуса опухоли. Профиль безопасности также в пользу комбинированной иммунотерапии.
ССЫЛКИ:
[1]. Chen DS, Mellman I. Oncology meets immunology: The cancer-immunity cycle. //Immunity. — 2013. – Т. 39. — № 1. С. 1–10. DOI: 10.1016/j.immuni.2013.07.012
[2]. Sharma P, Allison JP. The future of immune checkpoint therapy. //Science. — 2015 – Т. 348 — № 6230. С. 56–61. DOI: 10.1126/science. aaa8172
[3]. Kakimi K, Karasaki T, Matsushita H, Sugie T. Advances in personalized cancer immunotherapy. //Breast Cancer. — 2017 — Т. 24 — №. 1. С. 16–24. DOI: 10.1007/s12282–016–0688–1
[4]. Predina J, Eruslanov E, Judy B, et al. Changes in the local tumor microenvironment in recurrent cancers may explain the failure of vaccines after surgery. //Proc Natl Acad Sci USA. — 2013 — Т. 110 — № 5. С.415–24. DOI: 10.1073/pnas.1211850110
[5]. Wang L, Qian J, Lu Y, et al. Immune evasion of mantle cell lymphoma: expression of B7‑H1 leads to inhibited T‑cell response to and killing of tumor cells. //Haematologica. — 2013 – Т. 98 — № 9. С. 1458–66. DOI: 10.3324/haematol.2012.071340.
[6]. Ishida Y., Agata Y., Shibahara K., Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. //EMBO J – 1992. – Т. 11 — № 11. С. 3887–95. PMID: 1396582.
[7]. Riella L.V., Paterson A.M., Sharpe A.H., Chandraker A. Role of the PD-1 pathway in the immune response. //Am J Transplant – 2012. – Т. 12 — № 10. С.2575–87. DOI: 10.1111/j.1600-6143.2012.04224.x.
[8]. Motzer R.J., Tannir N.M., McDermott D.F., et al. Nivolumab plus Ipilimumab versus sunitinib in advanced renal-cell carcinoma. //N Engl J Med – 2018. – Т. 378 — № 14. С.:1277–90. DOI: 10.1056/NEJMoa1712126.
[9]. Sharma P., Callahan M.K., Bono P., et al. Nivolumab monotherapy in recurrent metastatic urothelial carcinoma (CheckMate 032): a multicentre, single-arm, phase 2 trial. // Lancet Oncology – 2016. – T. 17. — № 11. C. 1590-1598. DOI: 10.1016/S1470-2045(16)30496-X
[10]. Sharma P., Retz M., Siefker-Radtke A., et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. // Lancet Oncology – 2017. – T. 18. — № 3. C. 312-322. DOI: 10.1016/S1470-2045(17)30065-7
В США на ежегодной конференции Общества иммунотерапии рака (Society for Immunotherapy of Cancer) иммунолог Йельского университета Кеван Херольд (Kevan Herold) рассказал о нескольких случаях диабета первого типа, ставших, как полагают врачи, побочным эффектом применением нового класса перспективных онкологических препаратов.
Так называемые ингибиторы контрольных точек иммунного ответа (immune checkpoint inhibitors) сейчас все чаще применяются в противораковой терапии. Опухоли используют особые молекулы – именно их называют контрольными точками иммунного ответа – для того, чтобы защитить себя от действия иммунной системы организма. При помощи ингибиторов врачи активизируют иммунную систему, направляя ее клетки на борьбу с опухолями.
Однако Кеван Херольд и другие врачи все чаще замечают, что активация иммунной системы в этих случаях повышает риск заболеваний щитовидной железы, колита и диабета первого типа. Все эти расстройства в данном случае имеют аутоиммунную природу, то есть вызваны атакой иммунных клеток на собственные ткани организма.
Первый такой случай Херольд обнаружил несколько лет назад. У пациентки 55 лет начался диабет первого типа – редкий диагноз для такого возраста. Херольд выяснил, что у этой пациентки есть также меланома и что несколько недель назад она получила препарат ниволумаб – ингибитор контрольной точки, который блокирует активность рецептора PD-1 на Т-клетках. Этот рецептор и связанный с ним белок PD-L1 помогают контролировать Т-клетки, ограничивая их активность и предотвращая возможные аутоиммунные заболевания. Клетки опухолей часто воздействуют на PD-L1, так как подавление активности иммунных клеток им выгодно: Т-клетки перестают уничтожать опухоль. Поэтому с 2014 года в клинической практике применяются ингибиторы, которые блокируют PD-L1 или PD-1, активизируя борьбу с Т-клеток с клетками опухоли.
Подозрение, что атака Т-клеток может затронуть и нормальные ткани организма, возникло еще раньше. В 2003 году группа исследователей из Бостона обнаружила, что мыши, у которых блокированы PD-1 или PD-L1, часто становятся жертвами диабета.
Сейчас становится известным все больше таких случаев из клинической практики. В Теннесси мужчина и женщина старше 60 лет, участвовавшие в клиническом испытании двух два ингибиторов контрольных точек в лечении меланомы на поздней стадии, умерли от лимфоцитарного миокардита – воздействия собственной иммунной системы на сердце. У других пациентов возник колит аутоиммунного происхождения. Если случаи диабета связаны с блокаторами PD-1 и PD-L1, другие аутоиммунные заболевания имели место при использовании иного ингибитора контрольной точки, ипилимумаба, который блокирует рецептор CTLA-4 на Т-клетках. Херольд обратился к онкологам из Йельского университета и Калифорнийского университета в Сан-Франциско за сведениями о случаях диабета первого типа среди онкологических больных, которым давали ингибиторы контрольных точек. В итоге он составил список из 22 случаев.
Поскольку компании, производящие ингибиторы контрольных точек, хранят клиническую информацию об участниках испытаний, а также результаты биопсий и образы крови, ученые рассчитывают выявить признаки, которые говорят о предрасположенности пациента к возникновению аутоиммунного заболевания. Эту работу сейчас проводит Джеффри Блюстоун (Jeffrey Bluestone), иммунолог из Калифорнийского университета в Сан-Франциско и глава Института иммунной терапии рака имени Паркера (Parker Institute for Cancer Immunotherapy). Также Блюстоун готовит сейчас исследование, в ходе которого пациенты с онкологическими заболеваниями, проходящие иммунную терапию в Института Паркера, будут обследоваться до и после лечения, чтобы выявить начало возможных аутоиммунных болезней и определить факторы риска.
Ученые также заинтересованы в том, чтобы выяснить при помощи ингибиторов контрольных точек, как рецептор PD-1 связан с начало аутоиммунных заболеваний у других пациентов. Группа во главе с иммунологом Бостонской детской больницы Паоло Фиориной (Paolo Fiorina) обнаружила, что лабораторные мыши с диабетом первого типа избавились от болезни после получения стволовых клеток крови с повышенным выделением PD-L1. Дальнейшие исследования показали, что у мышей был дефект молекул РНК, которые контролируют экспрессию PD-L1, и что клетки людей с диабетом первого типа имеют аналогичный дефект. Исследование опубликовано в журнале Science Translational Medicine. Его результат еще раз показывает, насколько опасной может быть блокировка PD-L1 противораковыми препаратами.
Вероятно, в будущем онкологи должны будут научиться при применении этого класса лекарств выдерживать очень тонкий баланс между лечением опухоли и вызыванием аутоиммунной болезни.
Для лечения рака можно использовать иммунную систему человека, и этот подход уже подтвердил свою эффективность.
В 2016 году агентство Clarivate Analytics, которое составляет прогноз на основе цитируемости работ учёных, включило его в свой список потенциальных лауреатов. Разработки Эллисона и Хондзё привели к появлению нового принципа лечения злокачественных опухолей, основанного на способности нашего собственного иммунитета распознавать и уничтожать раковые клетки.
Тормоза иммунитета
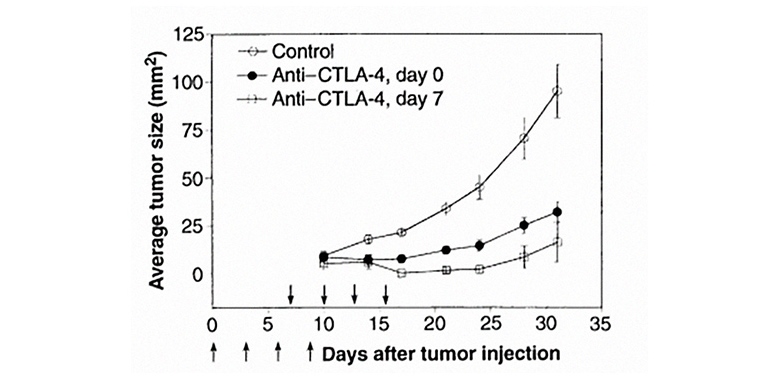
Leach et al / Science, 1996
Лечение антителом против CTLA-4 замедляет рост опухоли у мышей. Изменение размера опухоли у контрольных животных, которым вводили не относящееся к рецептору антитело, обозначено белыми кружками. Экспериментальным группам вводили терапевтическое антитело одновременно с опухолевыми клетками (чёрные кружки) или на седьмой день после введения опухолевых клеток (белые квадраты).
За эту работу Эллисон был удостоен множества наград — среди них и премия Ласкера, самая престижная после Нобелевской в области медицины, и приз Национального фонда исследования рака, и награды от различных фармацевтических компаний. Можно сказать, что Эллисон с 2011 года ежегодно получал какую-нибудь премию, так что эта череда закончилась Нобелем вполне закономерно.

Джеймс Эллисон и Тасуку Хондзё
Тот факт, что PD-1 играет роль негативного регулятора иммунитета, был установлен Engagement of the Pd-1 Immunoinhibitory Receptor by a Novel B7 Family Member Leads to Negative Regulation of Lymphocyte Activation только в 2000 году. Кроме того, в этой работе был обнаружен партнёр (лиганд) PD-1 — белок, который так и назвали, PD-L1 (ligand of PD-1). Было обнаружено, что раковые клетки нередко продуцируют много белка PD-L1 на своей поверхности. Идея, что блокировка как PD-1, так и PD-L1 может привести к активации противоопухолевого иммунитета, была подтверждена на мышах в публикации PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells 2005 года.
Уже в 2006 году было запущено первое клиническое испытание на людях, однако первый анти-PD-1 препарат ниволумаб был одобрен Opdivo Approval History для лечения рака только в 2014 году. Одновременно был одобрен и второй препарат — пембролизумаб Keytruda Approval History от компании Merck. Среди типов рака, против которых действуют анти-PD-1 антитела, — прогрессирующая меланома, немелкоклеточный рак лёгкого, почечная карцинома, лимфома Ходжкина и другие.
Jun Gong et al / Journal for Immunotherapy of Cancer, 2018
Что изменилось в лечении рака
До недавнего времени терапия рака базировалась на трёх основных принципах — хирургическом вмешательстве, облучении опухоли радиацией и противоопухолевой химиотерапии, целью которой является относительно неспецифичное, за редкими исключениями, уничтожение быстро делящихся опухолевых клеток токсичными веществами.
Пембролизумаб / Wikimedia Commons
Не панацея

Доктор медицинских наук,
Зав. отделением онкологической гинекологии клиники Бад Триссль (Германия),
Врач высшей квалификации по акушерству, гинекологии и медикаментозному лечению злокачественных новообразований Виктория Айвазова-Фукс.
К терапевтическим субстациям, CHECKPOINT-ингибиторам, относятся так называемые PD-1 и PD-L1 антитела. PD-1 = programmed cell death 1 protein.
Анти-PD-1-антитело блокирует взаимодействие между программированной гибелью клетки и его лигандой PD-L1.
Программированная гибель (PD-1) является важным рецептор-протеином, который экспримируется из активированных Т-клеток. PD-1 функционирует, в первую очередь, в тканях, в которых Т-клетки сталкиваются с иммуносупрессивно действующей лигандой PD- L1.
Эти PD-1- лиганды (PD-L1 и PD-L2) продуцируются как самими раковыми клетками, так и клетками стромы опухоли. Если взаимодействие между PD-1 и его лигандами блокируется, то в связи с этим, снижается действие лиганд.
Их иммуносупрессивный эффект ослабляется. Ответная реакция Т-клеток (например, против раковой ткани) усиливается, иммуносупрессивный ответ подавляется.
Анти-PD-1/PD-L1-антитела, таким образом, перемещают иммунную систему пациента в состояние самостоятельно атаковать опухоль.
Анти-PD-1 или анти-PD-L1-антитела угнетают зависящую от раковых клеток ин-активацию иммунных клеток и способствуют апоптозу раковых клеток.¹,²
Частыми побочными действиями на фоне лечения CHECKPOINT-ингибиторами являются общая слабость, снижение аппетита, тошнота, диарея, кашель, диспное, запоры, рвота, экзантемы, повышение температуры тела и головная боль. Такие осложнения, как тиреоидит или пневмония, также возможны.
Поскольку повышенная секреция PD-L1 в раковой ткани способствует ингибированию апоптоза раковых клеток, пациенты с повышенной секрецией PD-L1 имеют значительно худший прогноз.³
На сегодняшний день имеются положительные результаты исследования фазы I b, которое подтвердило действие и безопасность Pembrolizumab в лечении пациентов с PD-L1 продуктивным запущенным раком яичников.⁴ Результаты исследования III-ей фазы следуют.
Еще одно анти-PD-L1-антитело Avelumab находится в данный момент в стадии клинического исследования. Оно способствует зависящему от антител клеточному токсицитету.
Дальнейшие исследования изучают действия анти-PD-L1-антитела Atezolizumab в лечении запущенной формы рака яичников. Особенно интересны эти методы лечения при трипль-негативной форме рака молочной железы с химиотерапией. Например, Atezolizumab и nab-Paclitaxel.⁵
Pembrolizumab является также многообещающим препаратом в иновационном лечении метастазированного рака молочной железы.⁶
На ASCO 2016 были представлены результаты исследования KEYNOTE-028, которое показало действие CHECKPOINT-ингибитора Pembrolizumab в лечении пациентов с метастазированной формой PD-L1-положительного рака шейки матки.⁷ В данном исследовании Pembrolizumab оказывал многообещающий эффект, при хорошей переносимости общая выживаемость составляла 9 месяцев, с 6-месячным выживанием в 67% случаев.
Эта терапия, возможно, станет стандартом в лечении пациентов с гинекологическими опухолями в самом ближайшем будущем.
Клиника Бад Триссль уже на сегодняшний день обладает большим клиническим опытом в применении CHECKPOINT-ингибиторов в лечении рака.
1. Hamanishi J, Mandai M, Konishi I.(2016) Immune checkpoint inhibition in ovarian cancer. Int Immunol ;28(7):339-48.
2. Mabuchi et al. – Basic Science Perspective, ISBN: 978-953-307-812-0
3. Hamanishi J, mandai M, Iwasaki M et al. (2007) Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer. Proc Natl Acad Sci USA ;104(9):3360-5.
4. Varga A, Piha-Paul SA, Ott PA et al.(2015) Antitumor activity and safety of pembrolizumab in patients (pts) with PD-L1 positive advanced ovarian cancer: Interim results from a phase Ib study. J Clin Oncol 33 (suppl; abstr 5510).
5. Adams S et al. (2015) Safety and clinical activity of atezolizumab (anti-PDL1) in combination with nab-paclitaxel in patients with metastatic triple-negative breast cancer. SABCS P2-11-06.
6. Adams S et al. SABCS 2015; OT1-03-20 A phase 2 study of pembrolizumab (MK-3475) monotherapy for metastatic triple-negative breast cancer (mTNBC):KEYNOTE-086.
7. Jean-Sebastien Frenel, Christophe Le Tourneau, Bert H. O’Neil et al. (2016) Pembrolizumab in patients with advanced cervical squamous cell cancer: Preliminary results from the phase Ib KEYNOTE-028 study. J Clin Oncol 34 (suppl; abstr 5515).
Специализированная онкологическая Клиника Бад Триссль
Тем не менее иммунотерапия рака стоит в этом ряду особняком и по революционности, возможно, может сравниться с изобретением ЭКО.
Иммунная система — наша естественная защита от болезней, ее фундаментальная особенность — умение отличать своих от чужих перед тем, как уничтожать чужих. Науке было известно, что за распознавание врага отвечают Т-клетки иммунной системы — около 100 млн разных Т-клеток путешествуют по нашему телу и ищут чужеродные образования. Чтобы избежать ошибки в работе рецептора и не нападать на своих, у Т-клеток, как оказалось, есть две системы, простым языком ученые называют их в терминах автолюбителя — газ и тормоз.
Иммунитет против рака
Как известно, есть три традиционных направления лечения рака. Первое — хирургическое удаление. Оно возможно, когда опухоль локализована в одном отдельном органе, то есть так не вылечишь рак крови и некоторые типы рака мозга. Кроме того, часто сам орган сохранить не удается. Второе направление — лучевая терапия, это воздействие на раковые клетки тем или иным типом излучения. Работа здесь идет вокруг того, как направить излучение именно на раковые клетки, распознать их, чтобы не повредить здоровые. Обычно такое повреждение происходит. Третье направление — различные варианты химиотерапии.
Идея, высказанная в сделанной на государственные деньги работе, принадлежит всем. Ее внедрение в клиническую практику начинается с патентования и может вестись авторами открытия, однако может и совершенно другими людьми. Фармацевтические и биотехнологические компании — крупные и стартапы — обладают связями с больницами, материальной базой и прочей инфраструктурой, чтобы сделать одобренное лекарство из красивой идеи. Поэтому то, для каких именно видов рака быстрее появится в клинической практике работающее лекарство, зависит от прагматических соображений. Компаниям, чтобы получить одобрение на производство лекарства, нужно показать его преимущества перед уже применяемой терапией и приемлемость возникающих побочных эффектов, причем сделать это на статистически удовлетворительном количестве пациентов.
Но, как и любая терапия такого тяжелого заболевания, чек-пойнт метод не лишен побочных эффектов. Они связаны с тем, поясняет онколог, резидент Высшей школы онкологии Полина Шило, что иммунная система начинает работать без тормозов и атакует не только опухолевую ткань, но и здоровые органы, вызывая так называемое аутоиммунное поражение. Поэтому наличие активного аутоиммунного заболевания, например ревматоидного артрита или системной красной волчанки, может стать серьезным ограничением в применении этих препаратов.
Ситуация в России
Создатели препаратов должны скомпенсировать многолетние и многомиллиардные затраты на них. Основные затраты идут на клинические испытания таких препаратов и в меньшей степени — на их разработку на этапе чистой науки, подчеркивает Дмитрий Мадера. Само производство уже не столь дорого. Российские биотехнологические компании не обошли своим вниманием перспективные препараты. В том же BIOCAD один препарат уже проходит клинические испытания, а еще два к ним готовятся.
Пока мы наблюдаем лишь начало практического применения чек-пойнт терапии. В ближайшие десятилетия, а возможно, и годы, стоит ждать и новых лекарств для большего числа типов рака, и снижения их стоимости — многие капитальные расходы уже позади.
Читайте также:

