Билирубин при раке кишки
![]()
- Наверх
![]()
- Наверх
![]()
- Наверх


Вопрошающая (13 Ноябрь 2016 - 01:18) писал:
- Наверх
![]()
Нина Константинова (13 Ноябрь 2016 - 17:17) писал:
- Наверх


Вопрошающая (14 Ноябрь 2016 - 17:49) писал:
- Наверх










Цель лечения: удаление опухоли ободочной кишки или уменьшение опухолевой массы.
Тактика лечения
Схемы лечения больных раком ободочной кишки в зависимости от стадии заболевания
0 стадия:
1. Операция:
— полипэктомия;
— сегментарная резекция.
2. Лапароскопическая резекция ободочной кишки.
3. Наблюдение.
I стадия:
1. Операция – широкая резекция с наложением анастомоза (объем операции в зависимости от локализации опухоли).
2. Наблюдение.
II стадия:
1. Операция — широкая резекция с наложением анастомоза (объем операции в зависимости от локализации опухоли и распространенности опухолевого процесса).
2. Послеоперационная химиотерапия или лучевая терапия (при степени местного распространения опухоли, соответствующей Т4, и/или высокий риск, молодой возраст).
III cтадия:
1. Операция — широкая резекция с наложением анастомоза (объем операции в зависимости от локализации опухоли и распространенности опухолевого процесса).
2. Послеоперационная лучевая терапия (при степени местного распространения опухоли, соответствующей Т4).
3. Адъювантная химиотерапия.
IV стадия:
1. Операция (чаще паллиативная; при резектабельной опухоли и наличии солитарных и единичных метастазов в отдаленных органах – операция с одномоментным или отсроченным удалением метастазов).
2. После комбинированных операций:
— послеоперационная химиотерапия или лучевая терапия (химио-лучевая) при степени местного распространения опухоли, соответствующей Т4;
— адъювантная химиотерапия (при солитарных и единичных метастазах в отдаленных органах);
— наблюдение;
— симптоматическое лечение.
Немедикаментозное лечение: режим II, безшлаковая диета.
Медикаментозное лечение
Химиотерапия
1. Проведение адъювантной полихимиотерапии после ранее проведенной радикальной операции. Обоснованием необходимости применения химиотерапии при раке ободочной кишки служит тот факт, что в момент выполнения 25-30% хирургических вмешательств, клинически оцениваемых как радикальные, уже имеются субклинические метастазы. В настоящее время 5-фторурацил в комбинации с лейковорином считается главным (базовым) химиотерапевтическим препаратом при колоректальном раке.
2. Проведение самостоятельной полихимиотерапии при наличии рецидива опухоли или метастазирования (прогрессирование, генерализация процесса).
3. Проведение самостоятельной химиотерапии при IV стадии заболевания (неоперабельные и генерализованные формы).
4. Клиническая тактика: химиотерапия при колоректальном раке применяется в качестве адъювантной терапии после хирургического или комбинированного лечения (операция + лучевая терапия), в комбинации с лучевой терапией и как самостоятельный метод лечения при распространенном процессе.
Адъювантная химиотерапия
Химиотерапия должна начинаться сразу после восстановления пациента после операции, должна обязательно включать в себя фторпиримидины.
Схемы выбора: FOLFOX4, FOLFOX6, XELOX, FLOX, XELOX, кселода в монорежиме.
Лечение в адъювантном периоде должно длиться не менее 6 месяцев и не должно включать в себя иринотекан, бевацизумаб, цетуксимаб.
1. Режим клиники Мейо:
— кальция фолинат* 20 мг/м 2 , в/в струйно с последующим болюсом;
— фторурацила 425 мг/м 2 , в/в, с 1-го по 5-й дни.
Повторять курс каждые 4 недели до общих 6 курсов.
2. Roswell Park (недельный режим, высокие дозы):
— кальция фолинат* 500 мг/м 2 , в/в 2-часовая инфузия с последующим болюсом;
— фторурацила 500 мг/м 2 , в/в, еженедельно, 6 недель.
Повторять цикл каждые 8 недель (перерыв 2 недели) до общих 4 циклов.
3. De Gramont (упрощенный):
— кальция фолинат* 400 мг/м 2 , в/в 2-часовая инфузия с последующим болюсом;
— фторурацила 400 мг/м 2 в/в и с последующей 46-часовой инфузией фторурацила 2400-3000 мг/м 2 в/в.
Повторять курс каждые 2 недели.
— оксалиплатин 85 мг/м 2 в/в, 2-часовая инфузия, в 1-й день;
— кальция фолинат* 200 мг/м 2 , в/в 2-часовая инфузия, в 1-й и 2-й дни;
— фторурацил 400 мг/м 2 , струйно, в/в, в 1-й и 2-й дни;
— фторурацил 600 мг/м 2 , в/в 22-часовая инфузия в 1-й и 2-й дни.
Повторять курс каждые 2 недели до общего количества 12 курсов.
— оксалиплатин 100 мг/м 2 в/в, 2-часовая инфузия, в 1-й день;
— кальция фолинат* 400 мг/м 2 , в/в 2-часовая инфузия, в 1-й день;
— фторурацил 400 мг/м 2 , струйно, в/в, в 1-й день;
— фторурацил 2400 мг/м 2 , в/в 46-часовая инфузия в 1-й день.
Повторять курс каждые 2 недели до общего количества 12 курсов.
— оксалиплатин 85 мг/м 2 в/в, 2-часовая инфузия, в 1-й, 15-й, 29-й дни;
— кальция фолинат* 500 мг/м 2 , в/в струйно с последующим болюсом;
— фторурацила 500 мг/м 2 , в/в в 1-й, 8-й, 15-й, 22-й, 29-й дни.
Повторение цикла каждые 8 недель (перерыв 2 недели).
— оксалиплатин 135 мг/м 2 в/в, капельно в 1-й день;
— капецитабин 2000 мг/м 2 /сут., внутрь в два приема в день (утром/вечером), с 1-го по 14-й дни.
Повторение курса каждые 3 недели, в течение 6 месяцев.
8. Капецитабин 1250 мг/м 2 , внутрь, дважды в день, с 1-го по 14-й дни. Повторять курс каждый 21 день до общего количества 8 курсов. В случае развития явлений токсичности доза может быть редуцирована до 850-1000 мг/м 2 , внутрь, дважды в день, с 1-го по 14-й дни, для уменьшения риска токсичности без снижения клинической эффективности.
9. Тегафур 800-1000 мг/м 2 внутрь в два приема ежедневно до суммарной дозы 30 г. Повторение курса через 2 недели.
10. УФТ 400 мг/м 2 внутрь в два приема ежедневно в течение 3-4 недель. Повторение курса через 1-2 недели.
* В режимах, включающих в себя фторпимидины, наравне с кальция фолинатом возможно применение его биоэквивалента натрия фолината.
Химиотерапия метастатического процесса
Выбор схемы для I линии терапии зависит от степени выраженности клинических симптомов: мало выраженные клинические симптомы — монотерапия фторпиримидинами либо оксалиплатин+фторпиримидины, иринотекан ± фторпиримидины; при выраженных клинических симптомах — оксалиплатин + фторпиримидины, иринотекан+фторпиримидины, иринотекан+ оксалиплатин, оксалиплатин+ иринотекан+фторпиримидины.
Режимы: клиники Мейо, Roswell Park, De Gramont, FOLFOX4, FOLFOX6, FLOX, XELOX, в монорежиме капецитабин, тегафур, УФТ.
1. IFL (режим Saltz):
— иринотекан 125 мг/м 2 , в/в в течение 90 минут, 1 раз/нед., 4 недели (в 1, 8, 15, 22-й дни);
— кальция фолинат* 20 мг/м 2 , в/в, струйно, 1 раз/нед., 4 недели (в 1, 8, 15, 22-й дни);
— фторурацил 500 мг/м 2 , в/в, 1 раз/нед., 4 недели (в 1, 8, 15, 22-й дни).
Повторять курс каждые 6 недель.
2. Модифицированный IFL (режим Saltz):
— иринотекан 125 мг/м 2 , в/в, в течение 90 минут, 1 раз/нед., 2 недели (в 1-й и 8-й дни);
— кальция фолинат* 20 мг/м 2 , в/в, струйно, 1 раз/нед., 2 недели (в 1-й и 8-й дни);
— фторурацил 500 мг/м 2 , в/в, 1 раз/нед., 2 недели (в 1-й и 8-й дни).
Повторять курс каждые 3 недели.
— иринотекан 180 мг/м 2 , в/в 90 минут в 1-й день;
— кальция фолинат* 400 мг/м 2 , в/в 2 часа, 1-й день;
— фторурацил 400 мг/м 2 , в/в, струйно, 1-й и 2-й дни;
— фторурацил 2400 мг/м 2 , в/в, 46-часовая инфузия.
Повторять курс каждые 2 недели.
— оксалиплатин 130 мг/м 2 , 1-й день;
— кальция фолинат* 400 мг/м 2 , в/в 2 часа в 1-й день, затем фторурацил 2400 мг/м 2 , в/в 46-часовая инфузия.
Повторять курс каждые 2 недели.
— оксалиплатин 85 мг/м 2 , в/в 2 часа в 1-й, 15-й и 29-й дни;
— кальция фолинат* 20 мг/м 2 , в/в струйно с последующим болюсом в 1-й, 8-й, 15-й, 22-й, 29-й и 36-й дни;
— фторурацила 500 мг/м 2 , в/в в 1-й, 8-й, 15-й, 22-й, 29-й и 36-й дни.
Повторение цикла каждые 8 недель.
— оксалиплатин 100 мг/м 2 , 1-й день;
— кальция фолинат* 400 мг/м 2 , 1 дн., 2-х часовая инфузия;
— фторурацил 3000 мг/м 2 , в/в, в/в 46-часовая длительная инфузия.
Повторять курс каждые 2 недели.
— оксалиплатин 130 мг/м 2 , в/в, 1-й день;
— капецитабин 1000 мг/м 2 , внутрь, дважды в день, с 1-го по 14-й дни.
Повторять курс каждые 3 недели.
— оксалиплатин 70 мг/м 2 , в/в капельно, 1-й и 8-й дни;
— капецитабин 1000 мг/м 2 , внутрь, дважды в день, с 1-го по 14-й дни.
Повторять курс каждые 3 недели.
— иринотекан 200-250 мг/м 2 , в/в 90-минутная инфузия в 1-й день;
— капецитабин 1000 мг/м 2 , внутрь, дважды в день, с 1-го по 14-й дни.
Повторять курс каждые 3 недели.
— оксалиплатин 85 мг/м 2 , в/в, 1-й день;
— иринотекан 200 мг/м 2 , 1-й день.
Повторять курс каждые 3 недели.
11. Режим Douillard:
— иринотекан 180 мг/м 2 , в/в 90-минутная инфузия в 1-й день;
— кальция фолинат* 200 мг/м 2 , в/в 2-часовая инфузия в 1-й и 2-й дни;
— фторурацил 400 мг/м 2 , в/в, струйно 1-й и 2-й дни;
— фторурацил 600 мг/м 2 , в/в, 22-часовая инфузия в 1-й и 2-й дни.
Повторять курс каждые 2 недели.
— иринотекан 80 мг/м 2 , в/в 2-часовая инфузия, 1-й день;
— кальция фолинат* 500 мг/м 2 , в/в 2-часовая инфузия в 1-й день;
— фторурацил 2000 мг/м 2 , в/в 24-часовая инфузия, еженедельно, 4 недели.
Повторение цикла через 2 недели.
13. Режим FOLFOXIRI:
— иринотекан 165 мг/м 2 , в/в, в 1-й день;
— оксалиплатин 85 мг/м 2 , в 1-й день;
— кальция фолинат* 200 мг/м 2 , в/в 2-часовая инфузия в 1-й день;
— фторурацил 3200 мг/м 2 , в/в 48-часовая инфузия.
Повторение курса каждые 2 недели.
— митомицин С 5 мг/м 2 , 1 раз в 3 нед. или 10 мг/м 2 , 1 раз в 6 недель;
— капецитабин 2000 мг/м 2 /сут., в два приема, с 1-го по 14-й дни, 3 недельный цикл.
— УФТ (тегафур+урацил) 250 мг/м 2 /сут., ежедневно, внутрь, с 1-го по 14-й дни;
— кальция фолинат* 90 мг/м 2 /сут., ежедневно, внутрь, с 1-го по 14-й дни.
Повторение курса каждые 3 недели.
16. Иринотекан в монорежиме:
- иринотекан: 125 мг/м 2 , в/в, в течение 90 минут, еженедельно, в течение 4 недель. Повторять каждые 6 недель;
- иринотекан: 125 мг/м 2 , в/в, в течение 90 минут, еженедельно, в течение 2 недель. Повторять каждые 3 недели;
- иринотекан: 175 мг/м 2 , в/в, в 1-й и 10-й дни. Повторять каждые 3 недели;
- иринотекан: 350 мг/м 2 , в/в, в 1-й день. Повторять каждые 3 недели.
*В режимах, включающих в себя фторпимидины, наравне с кальция фолинатом возможно применение его биоэквивалента натрия фолината.
Примечание. При достижении резектабельности метастаза(ов) первичной или рецидивной опухоли хирургическое лечение может быть выполнено не ранее чем через 3 недели после последнего введения химиопрепаратов.
Таргетная терапия метастатического процесса
В лечении распростарненного рака ободочной кишки, метастатического или рецидивного, оптимальным является сочетание цитостатиков с моноклональными антителами (таргетной терапией).
Бевацизумаб — моноклональные антитела к VEGF (эндотелиальный фактор роста). Назначается в качестве 1-й и 2-й линии лекарственной терапии до прогрессирования процесса.
Режимы:
| Схема химиотерапии | Схема таргетной терапии |
| FOLFOX | Бевацизумаб 5,0 мг/кг, в/в, 30-90 минутная инфузия, 1 раз в 2 недели |
| FOLFIRI | |
| IFL | |
| De Gramon | |
| Rosvell Park | |
| XELOX | Бевацизумаб 7,5 мг/кг, в/в, 30-90 минутная инфузия, 1 раз в 3 недели |
| XELIRI |
Примечание. При достижении резектабельности метастаза(ов) первичной или рецидивной опухоли оперативное лечение может быть выполнено не ранее чем через 6 недель после последнего введения бевацизумаба.
Режимы:
- стартовая доза 400 мг/м 2 , 2-часовая инфузия
- затем 250 мг/м 2 , в/в, 1-часовая инфузия еженедельно
Панитумумаб — моноклональные антитела к EGFR. На момент разработки данных Протоколов не зарегистрирован в Республике Казахстан.
Примечание. Сочетание моноклональных антител к EGFR и к VEGF ухудшает результаты лечения и допустимо только в рамках специальных исследований.
Другие виды лечения
Лучевая терапия
Послеоперационная лучевая терапия показана при степени местного распространения колоректального рака, соответствующей Т4 (распространение опухоли на стенки живота), через 3-4 недели после комбинированных операций.
Лучевая терапия проводится в конвенциальном (стандартном) или конформном режиме облучения в статическом многопольном режиме РОД 2-2,5-3,0 Гр до СОД 40-60 Гр на зону врастания опухоли. При проведении лучевой терапии возможно применение препаратов, защищающих организм от лучевого повреждения.
Облучение проводят на гамма-терапевтических аппаратах или линейных ускорителях.
Хирургическое вмешательство
Основным методом лечения рака ободочной кишки является хирургический.
Принципы радикальной операции:
1. Дистальный и проксимальный края отсечения кишки должны быть на достаточном расстоянии от опухоли, чтобы при микроскопическом исследовании они не содержали опухолевых клеток.
2. Вместе с опухолью должны быть удалены все регионарные лимфатические узлы.
3. Объем и характер хирургического вмешательства зависят от ряда факторов, важнейшими из которых являются локализация опухоли, степень распространенности процесса, наличие или отсутствие осложнений основного заболевания.
4. При расположении опухоли в правой половине ободочной кишки (червеобразный отросток, слепая кишка, восходящая ободочная кишка, печеночный изгиб, правая половина поперечной ободочной кишки) показана правосторонняя гемиколэктомия.
5. Если опухоль локализуется в левой половине поперечной ободочной кишки, селезеночном изгибе, нисходящей ободочной кишке, проксимальной части сигмовидной кишки, выполняют левостороннюю гемиколэктомию.
6. При небольших опухолях, локализующихся в средней части поперечной ободочной кишки, возможна ее резекция. При расположении опухоли в средней и нижней части сигмовидной кишки показана ее резекция.
7. При осложненном течении опухолевого процесса (кишечная непроходимость, перфорация опухоли и др.) может быть выполнена обструктивная резекция ободочной кишки с последующим возможным восстановлением непрерывности толстой кишки.
8. При распространении опухоли толстой кишки в прилежащие органы и ткани, показано проведение комбинированных операций, а при наличии солитарных и единичных метастазов (в печени, легких, яичниках и т.д.) – одномоментное или отсроченное их удаление.
9. Критерием радикально выполненной операции является гистологическое заключение об отсутствии злокачественного роста:
— в дистальном и проксимальном краях отсечения кишки;
— по окружности резецированного сегмента кишки (периферический клиренс).
10. При нерезектабельных опухолях толстой кишки и множественных метастазах в отдаленных органах по показаниям необходимо выполнение паллиативных операций (формирование обходных анастомозов, наложение колостом).
Профилактические мероприятия
1. Питание – малошлаковая пища с преобладанием животных жиров, белков и рафинированных углеводов (сахар).
2. Малоподвижный образ жизни (гипокинезия, ожирение, возраст старше 50 лет).
3. Курение, злоупотребление алкоголем.
4. Нестероидные противовоспалительные препараты.
5. Хронические воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенных колит), нарушение моторики кишечника (запоры).
6. Отягощенный семейный анамнез раком желудочно-кишечного тракта. Семейный аденоматозный полипоз.
7. Злокачественная опухоль в анамнезе.
8. Метаболический синдром (сахарный диабет, артериальная гипертензия, увеличение объема живота) у мужчин.
Обнаружение аденоматозных полипов, на фоне которых развивается большинство опухолей, наряду с хорошим прогнозом при ранних стадиях делает колоректальный рак идеальным кандидатом для проведения скрининга.
Дальнейшее ведение
Режим наблюдения:
— первый год — 1 раз в 3 мес.;
— второй год — 1 раз в 6 мес.;
— в последующем, пожизненно — 1 раз в год.
Объем обследования:
- лабораторное (по показаниям);
- ирригоскопия (по показаниям);
- колоноскопия (по показаниям);
- рентгенологическое исследование легких;
- МРТ, КТ органов брюшной полости и забрюшинного пространства;
- ультразвуковое исследование брюшной полости, забрюшинного пространства;
- другие методы исследования (компьютерная томография, экскреторная урография и т.д.) и консультации специалистов (гинеколог, уролог и др.) по показаниям.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе
Удовлетворительное состояние при условии отсутствия осложнений и заживления п/о раны.
Данные, свидетельствующие об отсутствии признаков прогрессирования процесса, полученные клиническими и/или визуализирующими методами исследования, а также повышение качества жизни больного.
Желтуха является вторым по значимости признаком рака поджелудочной железы (после боли). В ряде случаев она сочетается с болевым синдромом, но может выступать и как самостоятельный первый и единственный признак заболевания.
Чаще всего развитие желтухи наблюдается при локализации опухоли в головке поджелудочной железы. Это связано с тем, что опухоль прорастает или сдавливает желчный проток, приводя к застою желчи, со всеми вытекающими последствиями.
Несколько реже желтуха возникает при опухолевом поражении тела и хвоста поджелудочной железы. В этом случае наиболее частой причиной ее развития является сдавление желчного протока лимфатическими узлами, пораженными метастазами.
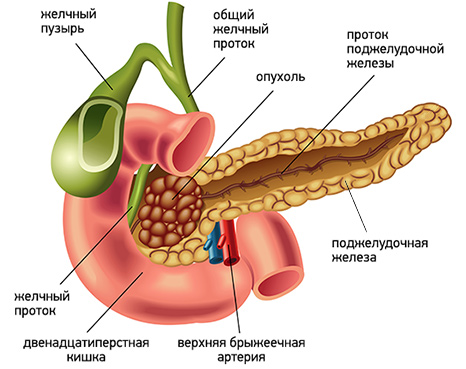
В целом возникновение желтухи наблюдается у 70-80% больных раком поджелудочной железы. Это грозное состояние, которое влияет на работу всего организма, в том числе сердечно-сосудистой системы, обмена веществ, нервной системы и др. Возможность компенсации данного осложнения влияет на общую продолжительность жизни таких больных.
Многие клиницисты считают, что развитие желтухи при раке поджелудочной железы является признаком неоперабельности опухоли. Однако на практике встречаются случаи, когда нарушение оттока желчи возникает при небольшой опухоли, расположенной около желчного протока. У таких пациентов удается своевременно обнаружить рак и провести радикальное лечение. Таким образом, желтуха для них оказывается своего рода спасительным симптомом.
- Причины и механизм развития желтухи при раке ПЖ
- Симптомы желтухи
- Осложнения желтухи
- Диагностика желтухи
- Лечение желтухи при раке поджелудочной железы
Причины и механизм развития желтухи при раке ПЖ
Причины развития желтухи при раке поджелудочной железы следующие:
- Прорастание опухоли в желчный проток и обтурация (закупорка) его просвета.
- Сдавление желчных протоков пораженными лимфатическими узлами.
- Нарушение моторики желчных протоков из-за опухолевого поражения их стенки. В этом случае формально желчные протоки остаются проходимыми, но дренаж желчи осуществляется не в полной мере.
- Метастатическое поражение печени с обтурацией внутрипеченочных протоков.
Желтуха при раке поджелудочной железы носит механический характер и обусловлена застоем желчи в желчных протоках. Это, в свою очередь, приводит к нарастанию давления в них, расширению и даже разрыву желчных капилляров и обратному всасыванию желчи в кровоток. Из-за этого в крови повышается уровень прямого билирубина, который попадает в ткани организма, пропитывает их и приводит к образованию желтушного цвета кожи, слизистых и склер.
Желчные кислоты, при поступлении в кровь, оказывают системное токсическое действие, что сопровождается нарушением сердечно-сосудистой деятельности (возникает брадикардия, снижение артериального давления) и деятельности нервной системы. Больные становятся вялыми, сонливыми, у них меняется характер, могут появляться признаки депрессии и повышенной раздражительности. При тяжелой желтухе возникает токсическое действие на головной мозг, что сопровождается развитием энцефалопатии, сопора и даже комы.
Определенные патологические эффекты оказывает и прекращение поступления желчи в кишечник:
Симптомы желтухи
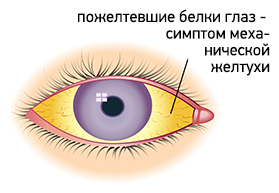
Основным симптомом механической желтухи является пожелтение кожи, слизистых оболочек и белков глаз. В начале заболевания кожа приобретает желтый или желто-коричневый цвет. Но по мере нарастания уровня билирубина и его окисления, цвет меняется на лимонно-желтый или зеленоватый. Также желтый цвет приобретают все биологические жидкости организма за исключением слез и слюны. Моча приобретает темно-коричневый цвет, а кал, наоборот, обесцвечивается.
Причины возникновения кожного зуда при желтухе до конца не ясны. Считается, что он возникает из-за раздражения рецепторов кожи желчными кислотами. У больных раком поджелудочной железы зуд может возникать по мере нарастания желтухи, или до ее начала, усиливаясь по мере нарастания гипербилирубинемии. Он серьезно ухудшает качество жизни больных, может носить нестерпимый характер, мешать нормальному сну, вызывать раздражительность. У многих пациентов на коже образуются расчесы, которые со временем могут инфицироваться.
Осложнения желтухи
Механическая желтуха является очень грозным состоянием. При отсутствии лечения приводит к гибели больного.
По мере развития процесса неизбежно возникает поражение гепатоцитов, нарушаются детоксикационные функции печени и в организме образуется большое количество токсических веществ, которые поражают все органы и системы. Развивается синдром эндотоксемии.
Параллельно с этим происходит нарушение функции почек из-за развития микрососудистых тромбозов и спазма кровеносных сосудов. Нарушается функция нефронов, нарастает почечная недостаточность, в крови повышается уровень мочевины и креатинина. Развивается печеночно-почечный синдром, на фоне которого развивается множество тяжелых патологических реакций:
- Токсические вещества проникают через гемато-энцефалический барьер, приводя к развитию энцефалопатии, которая сопровождается спутанностью сознания, сопором и, в конце концов, приводит к коме и гибели больного. Действие токсических веществ на нервные волокна приводит к нарушению работы сердца, что сопровождается снижением частоты сердечных сокращений (брадикардией).
- Нарушается синтез факторов свертывания крови, что приводит к развитию ДВС-синдрома — жизнеугрожающего состояния, при котором сначала возникает множество внутрисосудистых тромбов, а потом, при истощении кровесвертывающих факторов на этом фоне развивается кровотечение, которое очень сложно остановить.
- Под воздействием желчных кислот происходит разрушение сурфактанта — основного вещества легочной ткани, который обеспечивает обогащение крови кислородом. Из-за этого нарастает гипоксия, и развивается острая дыхательная недостаточность.
Диагностика желтухи
Диагностические мероприятия при желтухе носят комплексный характер и направлены на определение степени тяжести самой патологии, а также причин, вызвавших ее. Применяются следующие методы исследования:
Лабораторные исследования. Главным лабораторным маркером желтухи является увеличение билирубина. В крови он существует в виде двух фракций — свободной и связанной. При механической желтухе на начальном этапе происходит увеличение именно связанного, прямого билирубина, затем нарастает количество и непрямого. Также определяются показатели, которые изменяются при развитии холестаза — холестерин, липиды, щелочная фосфатаза, ГГТП и др.
Ультразвуковое исследование брюшной полости, печени, желчных протоков и забрюшинного пространства. При механической желтухе будут обнаруживаться расширенные желчные протоки, гиперплазия их стенки. В ряде случаев удается визуализировать наличие опухоли поджелудочной железы и определить ее прорастание в желчный проток, или его сдавление опухолевыми массами.
Более информативным методом визуализации опухоли поджелудочной железы является КТ и/или МРТ с контрастированием. Данные методы позволяют более детально визуализировать опухоль и ее взаимоотношение с окружающими тканями, обнаружить метастазы, в том числе в регионарных лимфоузлах или печени.
Исследование проходимости желчных протоков. Позволяет визуализировать просвет протоков и обнаружить места их сужения или обструкции. С этой целью проводят ретроградную холангиопанкреатографию — с помощью эндоскопической техники в просвет большого дуоденалного сосочка (место, которым открываются желчный и панкреатический протоки в просвет 12-перстной кишки) вводят рентгеноконтрастное вещество и делают снимки, на которых визуализируется протоковая система. Эндоскоп вводится через рот. Перед началом процедуры пациент получает легкую седацию, а для ослабления рвотного рефлекса глотку орошают раствором анестетика.
Еще одним методом визуализации протоковой системы является чрескожная чреспеченочная холангиография. В этом случае контраст вводится посредством пункции печеночных протоков через переднюю брюшную стенку. Чтобы правильно попасть в необходимую область, используют ультразвуковой контроль. После того, как контраст заполнит протоки, делают рентгеновские снимки, на которых хорошо видны печеночные протоки и места их обструкции.
Лечение желтухи при раке поджелудочной железы
Радикальное лечение рака поджелудочной железы возможно только с помощью хирургических операций, остальные методы — химио- и радиотерапия являются вспомогательными и применяются либо как дополнительные методы, которые позволяют стабилизировать процесс, либо как паллиативное лечение для облегчения симптомов заболевания.
Однако в условиях наличия механической желтухи проводить специфическое противоопухолевое лечение (в том числе радикальные хирургические операции) очень рискованно, поскольку состояние пациента является декомпенсированным и высоки риски летальности. По данным некоторых клиник, она достигала 10-34%. Поэтому на первый план выходит купирование желтухи, снижение интоксикации, снижение уровня билирубина с помощью декомпрессии желчных протоков малоинвазивными хирургическими методиками.
Основными методами декомпрессии и восстановления пассажа желчи является стентирование, которое может выполняться либо во время эндоскопической ретроградной холангиопанкреатографии (ЭРПХ), либо во время чрескожной чреспеченочной холангиографии (ЧЧХГ).
Необходимым условием проведения данной операции является расширение желчных протоков. При механической желтухе это не представляет проблемы, но бывают случаи, когда обтурация неполная, и для расширения протоков нужно немного больше времени.
- ЧЧХД проводится в условиях рентгеноперационной под местной анестезией. Место пункции стенки живота определяется для каждого пациента индивидуально с учетом места локализации обструкции.
- Кожа обрабатывается антисептиком и надсекается скальпелем для облегчения прохождения пункционной иглы. После этого игла под контролем УЗИ вводится на глубину 5-10 см, пока не попадет в расширенный желчный проток (диаметр иглы около 1 мм). После этого через иглу в проток вводят несколько миллилитров контрастирующего вещества для контроля попадания именно в желчный проток, а не в сосуды печени. Если все в порядке, через иглу в просвет протока вводят мягкий проводник, диаметром 0,3 мм, после чего иглу удаляют. С помощью проводника устанавливают гибкий катетер диаметром около 2 мм, через который вводят контрастирующий препарат и проводят серию снимков для обнаружения места обструкции, ее протяженность и степень блокирования пассажа желчи. После этого определяют тактику дальнейших действий:
- По возможности, через место сужения в просвет тонкой кишки проводят проводник, через который устанавливается дренаж — пластиковая трубка с множеством отверстий. Его ставят так, чтобы часть отверстий находилась выше места опухоли, а часть ниже ее. Таким образом, желчь будет попадать в дренаж до места обструкции и выходить после него. Наружный конец дренажа выводят на поверхность кожи и присоединяют к нему резервуар, куда будет оттекать избыток желчи.
- Если обтурация непроходима, дренирование желчи будет отводиться только наружно, чтобы снизить токсический эффект гипербилирубинемии. Для компенсации дефицита желчи в желудочно-кишечном тракте, ее придется принимать перорально, запивая водой или соком. Когда воспалительный процесс утихнет, и состояние пациента компенсируется, проводят повторную попытку реканализации или проведения радикальной операции по удалению опухоли поджелудочной железы.
Следует учитывать, что дренирование — это временная мера, направленная на разрешение экстренной ситуации, которая на фоне механической желтухи очень быстро усугубляется. После стабилизации состояния пациента, решается вопрос о возможности проведения радикального удаления опухоли поджелудочной железы. Если это невозможно, проводят стентирование желчных протоков — в месте обтурации устанавливается специальный каркас (стент), который более прочно фиксируется к стенкам протока и поддерживает их в расправленном состоянии.
Установка стента проводится следующим образом:
- Через имеющийся дренаж, к месту стентирования подводят тонкий проводник, а сам дренаж удаляют.
- Если имеется выраженный стеноз, который мешает установке стента, проводят баллонную дилятацию — по проводнику к месту стеноза подводят баллон и расправляют его на несколько минут (в раскрытом состоянии его диаметр около 6-8 мм). Это приводит к временному расширению просвета протока. После этого баллон сдувают и удаляют.
- Через тот же проводник в место стеноза подводится стент в сложенном состоянии. Его диаметр определяют заранее во время проведения холангиографии. После контроля правильности установки стента, его расправляют и извлекают проводящую систему. После этого пациента наблюдают в течение нескольких дней, и если все хорошо, выписывают из стационара.
Эндоскопическое стентирование проводится во время процедуры эндоскопической ретроградной холангиографии. После того как будет проведено исследование протоковой системы, в место стеноза через фатеров сосочек, находящийся 12-перстной кишке вводят проводник и по нему аналогичным образом устанавливают стент. После контроля правильности его расположения, стент раздувают и удаляют вспомогательное оборудование.
При невозможности выполнения стентирования проводят открытые операции по наложению обходных анастомозов между желчными протоками и кишечником в обход опухоли.
Операции при раке поджелудочной железы являются одними из самых сложных в современной хирургии, поскольку требуют удаления большого объема тканей. Удаляется не только сама железа, пораженная опухолью, но и рядом расположенные органы: часть тонкой кишки, часть желудка, желчный проток, регионарные лимфатические узлы, висцеральная жировая клетчатка. Разумеется, после такого объема вмешательства требуется серьезная реконструкция и восстановление проходимости желудочно-кишечного тракта и желчных протоков.
Однако оперативное лечение возможно далеко не у всех пациентов, поскольку в подавляющем большинстве случаев рак поджелудочной железы диагностируется, когда опухоль имеет нерезектабельное состояние. В этом случае назначаются другие методы противоопухолевого лечения для перевода новообразования в резектабельное состояние, после чего делают попытку радикальной операции.
Химиотерапия (ХТ) при раке поджелудочной железы может назначаться в предоперационном и послеоперационном периоде. В первом случае, ее целью будет уменьшение опухолевой массы и достижение резектабельности. В послеоперационном периоде ХТ назначается для поддержания результата лечения и предотвращения прогрессирования и метастазирования рака.
Основным препаратом, используемым при адъювантной ХТ рака поджелудочной железы, является гемцитабин. Его могут применять как в монорежиме, так и в комплексных схемах совместно с капецитабином или фторурацилом. При лечении метастатического рака или при прогрессировании, после адъювантной ХТ применяются более агрессивные 4-х компонентные схемы.
Радиотерапия в основном применяется в качестве паллиативной терапии для облегчения болевого синдрома. Но есть данные о ее эффективности в рамках проведения химиолучевой терапии на этапе подготовки к радикальному хирургическому вмешательству.
Читайте также:

