Бертолетова соль с хлором

Изучая по химии кислород, вы дошли до раздела "Получение кислорода в лаборатории путем разложения неорганических веществ". "Разложение воды, марганцовки, перекиси водорода, оксидов тяжелых и нитратов активных металлов. так, вроде бы все понятно. Получение кислорода из бертолетовой соли? Это еще что за зверь?!" - стандартный ход мыслей каждого учащегося, просматривающего этот параграф в учебнике. В школе бертолетову соль не учат, так что приходится наводить справки о ней самостоятельно. Сегодня в этой статье я попытаюсь как можно подробнее ответить на вопрос о том, что такое бертолетова соль.
Происхождение названия
Сначала поговорим о ее названии. Соль - это отдельный класс неорганических веществ, в химической формуле которых такая схема расположения элементов: Ме-n- кисл.ост., где Ме - металл, кисл.ост - кислотный остаток, n - число атомов (может не присутствовать, если валентность металла и кислотного остатка одинакова). Кислотный остаток берут из какой-либо неорганической кислоты. Химическая формула этой соли - KClO3. Металл, который в ней присутствует, - калий, значит, она является калиевой. Источник остатка ClO3 - хлорноватая кислота HClO3. Итого, бертолетова соль является калиевой солью хлорноватой кислоты. Также ее еще называют хлоратом калия, а прилагательное "бертолетова" к ней приписывают из-за имени ее первооткрывателя.
История открытия
Впервые была получена в 1786 году французским химиком Клодом Бертолле. Он пропустил хлор сквозь горячий концентрированный раствор гидроксида калия (фото).
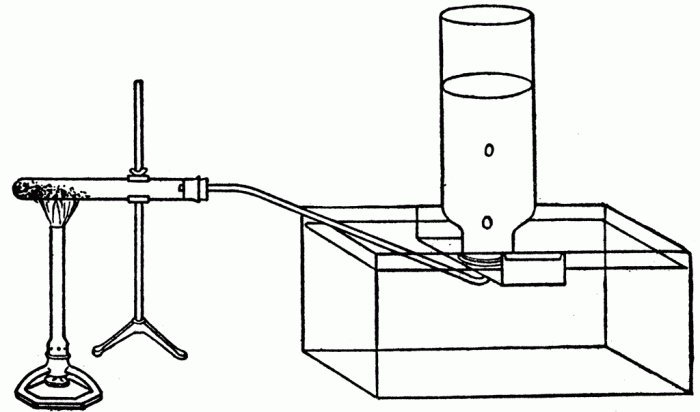
Бертолетова соль: получение
Получение хлоратов промышленным способом (в том числе и бертолетовой соли) основывается на реакции диспропорционирования гипохлоритов, которые получаются при взаимодействии хлора с растворами щелочей. Оформление процесса может быть разным: из-за того что самый многотоннажный продукт - гипохлорит кальция, из которого состоит хлорная известь, наиболее распространенным процессом является осуществление реакции обмена между хлоратом кальция (он получается при нагревании гипохлорита кальция) и хлоридом калия (он кристаллизуется из маточного раствора). Еще хлорат калия можно получить благодаря модифицированному методу Бертолле бездиафрагменным электролизом хлорида калия. Образующиеся хлор и гидроксид калия тут же взаимодействуют. Продутом их реакции является гипохлорит калия, который далее диспропорционирует на исходный хлорид калия и хлорат калия.
Химические свойства

Если температура нагревания достигает 400 о С, происходит разложение бертолетовой соли, при котором выделяется кислород и промежуточно образуется перхлорат калия. С катализаторами (оксид марганца (4), оксид железа (3), оксид меди и т.п.) температура, при которой происходит этот процесс, становится гораздо меньшей. Бертолетова соль и сульфат аммония могут реагировать в водно-спиртовом растворе и образовывать при этом хлорат аммония.
Применение
Смеси восстановителей (фосфора, серы, органических соединений) и хлората калия являются взрывчатыми и чувствительными к ударам и трению (фото выше). Чувствительность увеличивается, если присутствуют броматы и соли аммония. Из-за высокой чувствительности составы, в которых присутствует бертолетова соль, почти не применяются в производстве военных и промышленных взрывчатых веществ. Иногда ее используют в пиротехнике в качестве источника хлора для составов с цветным пламенем.

Заключение
Теперь вы знаете про бертолетову соль всё. Она может быть как полезной, так и чрезвычайно опасной для человека. Если вы имеете дома спички, то каждый день наблюдаете одну из отраслей применения бертолетовой соли в быту.
Что такое хлорат калия?
Калиевую соль хлорноватой кислоты (одна из четырех кислородсодержащих кислот, образованных хлором: хлорноватистая — HClO, хлористая — HClO2, хлорноватая — HClO3 и хлорная — HClO4) принято называть хлорат калия, его формула — KClO3. Эта соль по внешнему виду представляет собой кристаллы (бесцветные), которые слабо растворяются в воде (при 20 ºС в 100 см3 воды растворяется всего 7,3 г соли), но с повышением температуры растворимость растет. Другое ее известное название — бертолетова соль. Молекулярная масса вещества составляет 122,55 атомных единиц массы, плотность - 2,32 г/см3. Соль плавится при 356 ºС, разлагается примерно при 400 ºС.
Открытие бертолетовой соли
Впервые (в 1786 году) хлорат калия получил французский химик Клод Бертолле. Он пропускал хлор через концентрированный горячий раствор гидроокиси калия. Уравнение реакции, по которому была получена соль, выглядит следующим образом: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O. В результате этой реакции хлорат калия выпадает в виде белого осадка. Так как он слабо растворяется в холодной воде, то легко отделяется от остальных солей при охлаждении раствора. С момента своего открытия бертолетова соль являлся наиболее распространенным и полезным продуктом из всех хлоратов. В настоящее время KClO3 выпускается в промышленных масштабах.
Химические свойства
Бертолетова соль — сильный окислитель. При взаимодействии ее с концентрированной соляной кислотой (HCl) выделяется свободный хлор. Этот процесс описывается уравнением химической реакции: 6HCl + KClO3 → 3Cl↑ + KCl + 3 H2O. Как и все хлораты, это вещество сильно ядовито. В расплавленном виде KClO3 энергично поддерживает горение. В смеси с легко окисляющимися веществами (восстановителями), такими как сера, фосфор, сахар и другие органические вещества хлорат калия взрывается от удара или трения. Чувствительность к этим воздействиям усиливается в присутствии солей аммония и броматов. При осторожном (нагревание до 60 ºС) окислении калия хлората с кислотой щавелевой получают двуокись хлора, процесс протекает по уравнению реакции: 2KClO3 + H2C2O4 → K2CO3 + CO2 + H2O + 2ClO2. Окись хлора находит применение при отбеливании и стерилизации различных материалов (бумажной массы, муки и прочее), а также может быть использована для обесфеноливания сточных вод химических заводов.
Применение калия хлората
Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
Получение калия хлората
Одним из следующих способов: хлорированием гидроокиси калия, в результате обменной реакции хлоратов с другими солями, электрохимическим окислением в водных растворах хлоридов металлов — может быть получена бертолетова соль. Получение ее в промышленных масштабах чаще осуществляют по реакции диспропорционирования гипохлоритов (солей хлорноватистой кислоты). Технологически процесс оформляют по-разному. Чаще в его основе лежит реакция между хлоратом кальция и хлоридом калия: Ca(ClO3)2 + 2KCl → 2KClO3 + CaCl2. Затем образовавшаяся бертолетова соль из маточного раствора выделяется методом кристаллизации. Также хлорат калия получают по модифицированному методу Бертолле при электролизе хлорида калия: образующийся при электролизе хлор взаимодействует с калия гидроксидом, образовавшийся гипохлорит калия KClO диспропорционирует затем на калия хлорат KClO3 и исходный калия хлорид KCl.
Разложение хлората калия
При температуре примерно 400 ºС происходит разложение бертолетовой соли. В результате выделяется кислород и перхлорат калия: 4KClO3 → KCl + 3KClO4. Следующая стадия разложения протекает при температуре от 550 до 620 ºС: KClO4 → 2O2↑ + KCl. На катализаторах (ими могут быть оксид меди CuO, оксид железа (III) Fe2O3 или оксид марганца (IV) MnO2) разложение протекает при более низкой температуре (от 150 до 300 ºС) и в одну стадию: 2KClO3 → 2KCl + 3O2.
Меры безопасности
Бертолетова соль является неустойчивым взрывоопасным химическим веществом, которое может взорваться при перемешивании, хранении (например, рядом с восстановителями на одной полке в лаборатории или в одном складском помещении), измельчении или других операциях. В результате взрыва может наступить увечье или даже последовать летальный исход. Поэтому при получении, использовании, хранении или транспортировке хлората калия должны соблюдаться требования ФЗ 116. Объекты, на которых организованы эти процессы, относятся к опасным производственным объектам.

Хлорат калия или, как еще называют это вещество, бертолетова соль - полупрозрачные кристаллы белого цвета, которые используют для изготовления военных и промышленных взрывчатых веществ, а также пиротехники. Сам по себе порошок безопасен, но если смешать его с органикой, например, просто с сахарной пудрой, то получим взрывоопасное вещество.
Вещь, которая имеет в составе эту соль, возможно, находится у вас дома: головка спичек как раз-таки состоит в большей части из бертолетовой соли. Кстати, некоторое время существовало мнение, что хлорат калия является очень хорошим антисептиком и его можно было применять для орошения горла. Однако вещество это достаточно токсично, смертельная доза для человека составляет 1 грамм на килограмм массы тела. Также был и еще один способ использования бертолетовой соли: с помощью нее химики-экспериментаторы пытались получить кислород. Но использовать эту соль для опытов из-за взрывоопасности небезопасно, поэтому ученые начали искать другой способ получения кислорода.
Открытие бертолетовой соли
Французский химик, доктор медицины Клод Луи Бертолле, стал первооткрывателем хлората калия, поэтому белые кристаллы до сих пор носят фамилию этого ученого. В конце XVIII века Клод Луи начал работать над созданием соли: он пропустил хлор (Cl₂) через горячий раствор гидроксида калия (KOH), тем самым получил вещество с формулой KClO₃ или хлорат калия.

Кристаллическая структура хлората калия
Получение хлората калия в промышленности
Сейчас распространенным способом получения хлоратов является реакция диспропорционирования гипохлоритов, которая возникает при взаимодействии хлора с щелочами. Но нельзя описать единый процесс изготовления бертолетовой соли, ибо на современных предприятиях применяется разное оборудование, следовательно, каждый открывает для себя подходящий способ получения данного вещества. Но наиболее распространенный способ - реакция обмена между хлоратом кальция и хлоридом калия.
Еще один популярный способ - получение бертолетовой соли при помощи электролиза хлорида калия. Можно сказать, что это подобный процесс тому, который описывал в своих трудах Бертолле.
Смесь Армстронга
Интересная и опасная взрывчатая смесь готовится на основе бертолетовой соли и красного фосфора. Химики для опытов смешивают эти два порошка только мягкой кистью на специальном стекле, потому что даже от простого трения может возникнуть взрывоопасная реакция. Если ударить по небольшому количеству смеси Армстронга молотком, результат будет просто ошеломительный: возникнет небольшой взрыв с громким хлопком и искрами. Данную смесь часто используют для изготовления пиротехники.

Горение Армстронговой смеси
Получение бертолетовой соли самостоятельно
Для эксперимента может понадобиться:
· много спичек (20 коробков);
· катушка ниток и ножницы;
(бертолетова соль), КС1О 3 , бесцв. кристаллы. Растворим в воде. Сильный окислитель. Применяют в спичечном произ-ве и пиротехнике. Ядовит.
Хлорат калия - неорганическое соединение с химической формулой KClO 3 .
Описание: Хлорат калия - один из наиболее распостраненных распостраненных в пиротехнике окислителей. Причина популярности этой соли в коммерческой пиротехнике - ее дешевизна и легкая доступность. Хлорат калия стали использовать в феерверках более столетия назад.
Опасности: Хлорат калия ядовит, в случае если вы работаете с мелким порошком необходимо использовать респиратор. Составы на хлоратах более чувствительны чем составы на нитратах и перхлоратах, работая с ними следует соблюдать осторожность. Хлораты несовместимы с серой и сульфидами а так же с фосфором, возможно самовоспламенение и сильные взрывы. Более детальную информацию можно найти на странице посвещенной безопасности.
Источники: Хлорат калия может быть получен обменом хлорида калия с хлоратом натрия, который может быть получен электролизом.
Калийная соль хлорноватой кислоты НСlO3. Используется как окислитель во многих пиротехнических составах. Представляет собой прозрачные кристаллы пластинчатой формы, реже бесцветные моноклинные призмы. При быстрой кристаллизации насыщенного раствора выпадают мелкие игольчатые кристаллы. Структурная формула представлена тремя атомами кислорода, связанными с атомом хлора ковалентной связью и атомом калия, связь которого с хлором имеет ионный характер.
Имеет следующий процентный состав: калий - 31,92% , хлор - 28,92%, кислород - 39,16% . Плотность кристалла - 2,344 г/см3, гравиметрическая плотность (порошок) - 2,1 - 2,25 г/см3. Молярная масса - 122,55 г/моль. Не гигроскопичен. Растворимость в воде: 0°C - 33 г/л, 10°C - 52 г/л, 20°C - 73 г/л, 25°C - 86 г/л, 30°C - 101 г/л, 40°C - 139 г/л, 60°C - 238 г/л, 80°C -376 г/л, 100°C - 562 г/л. Температура плавления чистого вещества - 356 °C. Температура разложения сильно зависит от наличия примесей и для чистого вещества составляет между 395 и 420°C. Примеси таких веществ как перекись марганца, окись меди, окись железа (Fe2O3), окись кремния (песок), окись хрома, хлорид калия сильно снижают температуру разложения хлората калия, тем самым повышая чувствительность составов. Тип примесей так же влияет на состав продуктов разложения (при нагреве без топлива):
4KClO3 - 3KClO4 + KCl , при дальнейшем нагреве - KClO4 - KCl + 2O2; либо -
2KClO3 - 2KCl = 3O2
Интересен так же тот факт, что разложение хлората калия имеет экзотермический характер (с выделением тепла), а разложение перхлората калия - эндотермический (с поглощением тепла). Это объясняется тем, что при окислении хлората в перхлорат (присоединение четвертого атома кислорода) идет процесс с выделением энергии. По этой причине не смотря на то, что у хлората меньше кислорода, чем у перхлората (39,16 против 46,2) составы на хлорате более энергичны (и более опасны) чем на перхлорате.
Впервые хлорат калия был получен в 1786 г. французским химиком Клодом Бертолле. Метод получения заключался в пропускании хлора через раствор гидроксида калия с выпадением кристаллов хлората. Он же случайно обнаружил и взрывчатые свойства хлората - когда растирал его в ступке, где на стенках осталась сера от предыдущих экспериментов. Современные методы получения заключаются либо в термическом разложении гипохлоритов, либо методом электролиза растворов хлоридов. Чаще всего гипохлорита натрия и хлорида натрия в виду хорошей растворимости солей натрия, с последующей реакцией обмена с хлоридом калия.
Работа с хлоратом калия требует осторожности. Данный химикат ядовит. Смертельная доза составляет от 2 до 30 г при попадании внутрь организма. Это обусловлено как наличием иона калия, так и иона хлората. Та же хлорат действует раздражающе на слизистые ротовой и носовой полостей, а так же на кожу. Поэтому работать необходимо в респираторе и перчатках. Признаки отравления - рвота, боли в желудке, поносы, темный цвет мочи, расстройство дыхания, головная боль, сердечная слабость, судороги, синюха лица и губ. Первое действие при отравлении: промывание желудка, рвотные, слабительные, мочегонные, кроме кислого и углекислого питья. Немедленно обратится к врачу.
Еще более опасным фактором в работе с бертолетовой солью является ее взрывоопасность в смесях с горючими веществами, а так же с нитратами. Не допускается смешивание сухих составов, особенно с активными горючими - серой, фосфором, сульфидом сурьмы, алюминием, магнием, и др. Так же нужно помнить о чувствительности составов, в которых применяется пылеобразные горючие, например сажа или даже древесная мука. При работе нужно так же избегать действия сильных кислот, при попадании которых на чистый хлорат протекает реакция с выделением окислов хлора в основном ClO2, который может произвольно взрываться уже при температуре в 60 °C. Он же поджигает горючее в смеси на основе хлората. Известен так называемый состав Кибальчича - смесь бертолетовой соли с сахаром, которая моментально воспламеняется при попадании серной кислоты. Не допускается контакт хлората со щелочными металлами, который заканчивается взрывом. Так же не следует использовать в составах смесь хлората с перманганатом калия (KMnO4 - марганцовка), такие составы крайне неустойчивы и сильно чувствительны к механическим нагрузкам. При работе с бертолетовой солью всегда нужно продумывать порядок смешивания компонентов - по возможности ее лучше вводить в последнюю очередь, тщательно перемешав остальные компоненты и увлажнив смесь этиловым спиртом. После работы все инструменты тщательно вымыть, в помещении провести влажную уборку.
Научное название бертолетовой соли - хлорат калия. Это вещество имеет формулу KClO3. Впервые хлорат калия получил французский химик Клод Луи Бертолле в 1786 году. Бертолле решил пропускать хлор в нагретый раствор щелочи . Когда раствор остыл - на дно колбы выпали кристаллы хлората калия.
Хлорат калия
Бертолетова соль представляет собой бесцветные кристаллы, которые разлагаются при нагревании. Сначала хлорат калия разлагается на перхлорат и хлорид калия, а при более сильном нагревании перхлорат калия разлагается на хлорид калия и кислород.
Примечательно, что добавление к бертолетовой соли катализаторов (оксиды марганца, меди, железа) в несколько раз снижает температуру ее разложения.
Применение бертолетовой соли
Еще один промышленный способ получения бертолетовой соли состоит в электролизе водных растворов хлорида калия. На электродах сначала образуется смесь гидроксида калия и хлора, затем из них образуется гипохлорит калия, из которого, в конце концов и получается бертолетова соль.
Клод Бертолле
Изобретатель хлората калия Клод Бертолле был врачом и аптекарем. В свободное от работы время он занимался химическими опытами. Клод достиг больших научных успехов - в 1794 году его сделали профессором двух высших парижских школ.
Бертолле стал первым химиком, которому удалось установить состав аммиака, сероводорода , болотного газа и синильной кислоты. Он придумал гремучее серебро и процесс хлорного отбеливания.
Позже Бертолле занимался вопросами национальной обороны и служил советником у Наполеона. По окончании службы Клод основал научный кружок, в который вошли такие известные французские ученые, как Гей-Люссак, Лаплас и Гумбольдт.
Сотрудники БА-БАХ предупреждают: прежде чем проводить какие-либо опыты, связанные с пиротехникой, необходимо получить химическое образование. Нужные теоретические знания и практические навыки может дать только ВУЗ. ИСПОЛЬЗОВАТЬ БЕРТОЛЕТОВУ СОЛЬ, НЕ ИМЕЯ ЛИЦЕНЗИИ ПИРОТЕХНИКА, СМЕРТЕЛЬНО ОПАСНО.
Бертолетова соль или хлорноватокислое кали (Kali chloricum chlorsaures Kali potasse chlorique)
Знаменитый французский химик Клод Луи Вертолет (Berthollet) открыл в 1788 г. соль, названную по его имени и приготовляемую пропусканием хлора через раствор кали. В настоящее время соль эта добывается различными путями: обработкой хлористого калия и жжёной извести посредством хлора, пропусканием хлорного газа через известковое молоко и добавкой хлористого калия, действием хлористого кали на хлорноватокислый кальций и т.д. В результате получается белая прозрачная соль в виде чешуйчатых, тонких пластинок (собственно ромбических кристаллов). В абсолютно чистом виде соль эта никогда не встречается: в ней постоянно находится некоторая доля хлористого кальция и хлористого калия, и, конечно, чем меньше, тем лучше. Но у хороших дрогистов соль можно получить достаточно чистой, чтобы не требовалось дополнительной очистки посредством выпаривания, хотя и не особенно затруднительного, но не всегда удобного. Поэтому Зальцман совершенно основательно советует убедиться в чистоте продукта посредством опыта в пробирке: к 1 грамму бертолетовой соли, разведённой в дистиллированной воде, подливают несколько капель химически чистой азотной кислоты и от 5 до 10 капель 5 %-ного раствора ляписа (сплав 1ч. AgNO3 с 2ч. KNO3) - 1 часть ляписа на 20 частей воды. Если после взбалтывания образуется лёгкий молочный (опаловый) колер, то соль годится в дело; но если молочная окраска очень густа, то лучше не терять время кристаллизированием, а обратиться к другому поставщику.
Бертолетова соль не гигроскопична, не отзывает хлором, в холодной воде растворяется туго, в горячей - до 11/2 объёмов, на вкус горька и остропрохладительна.
При нагревании соль эта (формула её: HClO3) сначала плавится в белую прозрачную жидкость; несколько большее тепло вызывает сильное выделение кислорода, причём жидкость сгущается и, по достижении 400°С (в закрытом сосуде), перестаёт выделять кислород. В таком виде она состоит только из хлористого калия и хлорнокислого кали. При дальнейшем нагревании происходит внезапно сильнейшее выделение всего остального запаса кислорода, в остатке же получится один чистый хлористый калий.
Эта-то способность моментального окисления при высокой температуре, в высшей степени способствующая горению, придаёт бертолетовой соли существенное значение там, где требуется оживить (т.е. усилить) пламя пассивных огней, в то же время не придавая им никакой посторонней окраски. Но, при всей своей применимости, соль эта обладает и весьма неприятным качеством: она в высшей степени опасна для тех, кто не умея или как попало берётся за неё.

Опасность взрыва при смеси с другими телами значительно уменьшается, если смочить помесь безводным спиртом. Но, при высыхании, опасность от самовоспламенения или от взрыва вследствие толчка - та же, как и прежде. А при 36°R взрыв неминуем. Мельчение же бертолетки самой по себе можно производить и без смачивания.
Зальцман, много возившийся с бертолетовою солью, указывает, что в отношении взрывчатости самая сильная детонация происходит при смеси бертолетки с сернокислым антимонием; по словам Эшенбахера, достаточно малейшего удара, чтобы произвести страшный взрыв этой смеси, которую следует составлять с крайней осторожностью на глянцевитой бумаге и никак не более крошечной щепотки зараз.
Следующая по силе взрыва смесь - соединение бертолетки с фосфором; если положить кусочек фосфора величиной с булавочную головку на соответствующей слой бертолетки и затем ударить молотком, то произойдет удар не слабее сильного ружейного выстрела. Состав Армстронга состоит из смеси красного фосфора с бертолеткой; в Англии для той же смеси применяется аморфный фосфор.
Небольшой кусочек серы (величиной с просяное зерно) в соединении с маленькой щепоткой бертолетки образует такой же взрыв, если смесь эту потереть пестиком; и почти то же происходит при соединении этой соли с сернокислой медью, сахаром, крахмалом, декстрином, углём или мукой. Об ударном составе из серы, угля и бертолетки или - ещё сильнее - из бертолетки с порохом будет сказано ниже. Для быстрого сообщения огня пороху в больших орудиях военная пиротехника применяет смесь из сернистой сурьмы с чистой бертолеткой. Такой состав воспламеняется от трения, удара или толчка и употребляется для запала в больших орудиях при помощи скорострельных трубок. Ещё сильнее Армстронгов состав, о котором упомянуто выше. Ударный состав для игольчатых ружей делается из бертолетки с сернистой сурьмой, сначала промытым серным цветом и угольным порошком (16:8:4:1); смесь смачивается раствором аравийской камеди или белого сахара, после чего прибавляют капель 5 азотной кислоты. В пистон помещается небольшое количество ударного состава - выстрел следует под действием иглы.
Если требуется образовать состав для бенгальских огней, то опасность все ещё не крайняя: имея под рукой металлическую ложку, можно мешать бертолетку (предварительно измельчённую) с остальными ингредиентами и при этом нажимать довольно сильно; если же случится вспышка, то необходимо тут же выбросить запалившийся состав ложкой. Но если требуется приготовить состав для кугелей или для активных огней, то ложка уже немыслима: легко обжечь руку - взрыв успеет состояться раньше, чем возможно отдёрнуть руку. В таких случаях требуется тихое, осторожное, лёгкое мешание деревянным пестиком.
В соединении с шеллаком бертолетка никогда не производит взрыва.
Сохранять бертолетку необходимо в отдельных, герметично закупоренных сосудах, но оклеивать стекло чёрной бумагой незачем: бертолетка боится тепла, а не света и от действия последнего не разлагается. Сохранять готовые фейерверочные составы, в которые входят бертолетка и серный цвет, можно только очень короткое время: серный цвет как уже сказано, вследствие окисления выделяет серную кислоту, которая, войдя в соприкосновение с бертолеткой, неминуемо производет взрыв, в крайнем случае - через несколько недель.
Наконец, опасность, грозящая от самовоспламения составов, содержащих бертолетову соль, узнается, по совету Чиколева, следующим образом: данный состав слегка смачивают водой и ставят на тёплое место; если состав при таких условиях меняет цвет или распространяет сильный запах, то он опасен, а потому в дело не годится: его следует выбросить.
Хлорнокислое кали (перхлорат калия) (Kali hyperehloricum - uberchlorsaures Kali, potasse surchlorique)
Это кали содержит ещё более кислорода, чем хлорноватокислое (а именно: бертолетка = KClO3, хлорнокислое кали = KClO4); но т.к. хлорнокислое кали устойчивее бертолетки, т.е. разлагается при более высокой температуре и расстаётся с углеродом не так легко, то его можно смешивать и растирать с сахаром, серой и сернокислыми металлами, не опасаясь взрыва, если только трение не слишком сильно. Поэтому хлорнокислое кали, сохраняя главные качества бертолетки, далеко не так опасно и огонь его даёт не слишком большое, но яркое пламя, притом горящее совершенно спокойно.
Неудобство же этого кали заключается в том, что оно трудно загорается; но, тем не менее, его вместо бертолетки можно употреблять всюду, где в состав смеси входит сера, с тем, чтобы сверх требуемого по рецепту количества серы прибавить ещё её 1/9 часть веса наличного контингента кали. Т.е. если, например, в состав входит по рецепту 18 частей кали, весящих 18 золотников, и 9 частей серы, то прибавить нужно еще 2 золотника серы. Делается это ввиду того, что для разложения 3 весовых долей бертолетки требуется лишь 1 доля серы, а для полного разложения кали - на 1/3 больше, т.е. 1,33 доли.

Хлорнокислое кали, несмотря на эти качества, всё-таки употребляется довольно редко, но не в силу медленности огня или трудности воспламенения, т.к. дополнительная доза серы восстанавливает эти недостатки, а только потому, что кали почти вдесятеро дороже, что для любителей и при небольших фейерверках, конечно, с избытком искупается возможностью обойтись без дешёвой, но страшно опасной бертолетки.
НАШИ МАГАЗИНЫ В МОСКВЕ: (схема проезда)
1. Пр-т Вернадского, 109 (20 метров от м."Юго-Западная")
2. Лужнецкая наб., д.2/4 стр.78 (м."Воробьевы горы")

Хлорат калия (бертолетова соль, калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
Содержание
- 1 История
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 4.1 Взрывчатые вещества
- 4.2 В медицине
- 4.3 Для получения кислорода
- 4.4 Для получения диоксида хлора
- 5 Токсичность

История
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O 
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
Cl2 + 2OH − → ClO − + Cl − + H2O 3ClO − → ClO3 − + 2Cl −
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.

Химические свойства
- При температуре
400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия: 4KClO3 → 400oC 3KClO4 + KCl KClO4 → 550−620oC KCl + 2O2
-
В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до
200 °C).
- Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:

Применение
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.

Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
Токсичность
Токсичен. Смертельная доза хлората калия составляет 1 г/кг.
Читайте также:

