Аутологичная трансплантация стволовых клеток при множественной миеломе
Множественная миелома (ММ) характеризуется выраженной вариабельностью течения, прогноза и результатов терапии. До недавнего времени применение мелфалана в комбинации с преднизолоном (схема МП) было наиболее распространенным методом лечения. Однако у многих больных на фоне этой терапии не удается достичь состояния полной клини-ко-гематологической ремиссии в течение длительного периода.
В настоящее время наметилась тенденция к увеличению частоты и длительности ремиссии, общей продолжительности жизни на фоне интенсивной химиотерапии при множественной миеломе. В последние годы альтернативным методом лечения является использование различных протоколов полихимиотерапии и прежде всего схем VAD (винкристин, адриамицин, дексаметазон), комбинации идарубицина с дексаметазоном, VMCP (винкристин, мелфалан, циклофосфан, преднизолон), BVAP (кармустин, винкристин, адриамицин, преднизон), Dexa-BEAM (BCNU, этопозид, цитозар, мелфалан, дексаметазон) или первичной высокодозной терапии мелфаланом (60—100 мг/м2).
Особый интерес представляет моно- или комбинированная терапия принципиально новыми классами препаратов: ингибиторами диацетилазы гистонов, ангиогенеза (талидомид, леналидомид), протеасом (велькейд), индукторами апоптоза (триоксид арсения).
Положительное влияние этих программ уже доказано. Полученные многими авторами данные воспринимаются как достаточно убедительные для более широкого применения не только химиотерапии, но и трансплантации гемопоэтических стволовых клеток у больных множественной миеломой. В связи с этим рассматривается использование следующиих видов трансплантации гемопоэтических стволовых клеток : аутологичной, аллогенной от родственного и неродственного доноров, сингенной.
Это связано с более легкой доступностью гемопоэтических стволовых клеток из крови больных множественной миеломе, меньшей примесью злокачественных клеток и травматичностью при сборе трансплантата. Однако для получения аутотрансплантата ГСК важно добиться редукции количества плазматических клеток в костный мозг по крайней мере до 20 % от исходного уровня. При уровне плазматических клеток в костный мозг не более 20 % ауто-трансплантации гемопоэтических стволовых клеток может быть выполнена больным множественной миеломой на любом этапе лечения.
Больные с множественной миеломой наиболее часто являются кандидатами на проведение двойных (тандем) трансплантаций. Это связано с отсутствием данных о преимуществе однократной ауто-трансплантации гемопоэтических стволовых клеток по сравнению со стандартной химиотерапией при множественной миеломе.
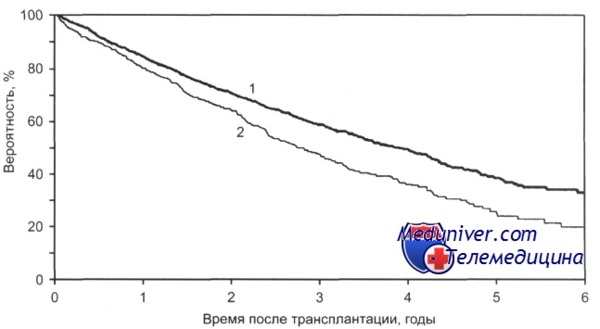
Общая выживаемость после ауто-ТГСК больных с множественной миеломой в зависимости от срока выполнения трансплантации с момента постановки диагноза.
1 — 18 мес и менее (n = 3277); 2 - более 18 мес (n = 1038); р = 0,0001.
Сравнивали эффективность стандартной и высокодозной цитостатической терапии с ауто-трансплантацией гемопоэтических стволовых клеток. Были получены следующие отдаленные результаты — достижение ПР и ПР + ЧР (частичная ремиссия) соответственно: после VAD — у 5 и 34 % больных, после однократной ауто-трансплантации гемопоэтических стволовых клеток — у 26 и 75 % больных, после тандема ауто-трансплантации гемопоэтических стволовых клеток —у 41 и 83 % больных.
Медиана общей и безрецидивной выживаемости после тандема ауто-трансплантации гемопоэтических стволовых клеток составила 68 и 43 мес, а 5-летняя общая и безрецидивная выживаемость были равны соответственно 58 и 42 %.
Общеизвестных критериев, определяющих показания к трансплантации гемопоэтических стволовых клеток при множественной миеломе, не существует. Принятие решения в пользу выполнения трансплантации гемопоэтических стволовых клеток во многом зависит от индивидуальных взглядов авторов, их опыта в этой области и наличия необходимых условий для проведения трансплантации гемопоэтических стволовых клеток.
Основными прогностическими факторами, влияющими на отдаленные результаты при выполнении трансплантации гемопоэтических стволовых клеток у больных с множественной миеломой, являются возраст, стадия болезни, повышенный уровень b2-микроглобулина в плазме крови и моче, повреждение функции почек, индекс Карновского, верификация цитогенетических нарушений, к которым относятся t(4;11), изменения в хромосомах 11q, -13 и 13q, гиподиплоидия.
Наиболее часто используемым режимом кондиционирования при ауто-трансплантации гемопоэтических стволовых клеток у больных с множественной миеломой является мелфалан в дозе 180—220 мг/м2, назначение которого предпочтительнее по сравнению с режимом кондиционирования тотальное облучение тела (ТОТ) + мелфалан.
По данным CIBMTR, 3-летняя общая выживаемость у больных с множественной миеломой при проведении ауто-трансплантации гемопоэтических стволовых клеток в первые 18 мес с момента постановки диагноза составила 55 %, в то время как после 18 мес — 43 %, однако эти показатели не имеют статистически достоверного различия.
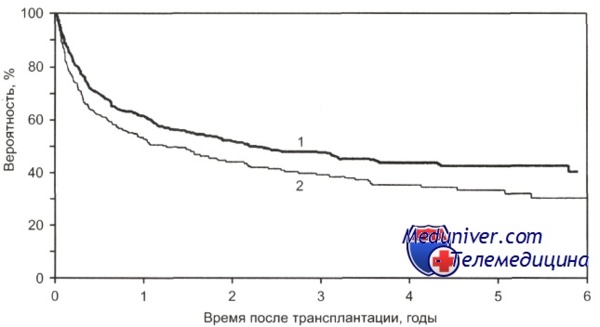
Общая выживаемость больных с множественной миеломой в зависимости от срока выполнения алло-ТГСК. от HLA-совместимого сиблинга с момента постановки диагноза.
1 — 18 мес и менее (n = 642);
2 — более 18 мес (n = 258); р = 0,0035.
Таким образом, несмотря на имеющиеся успехи в лечении больных множественной миеломой, достижение ПР при множественной миеломе до сих пор остается трудноразрешимой задачей. С этим связано стремление к совершенствованию методов терапии в первую очередь путем внедрения алло-ТГСК, несмотря на отсутствие в прошлом данных о преимуществе алло-ТГСК по сравнению с ауто-ТГСК у больных с множественной миеломой.
Вероятность достижения полной ремиссии может быть увеличена с 18 % после однократной ауто-трансплантации гемопоэтических стволовых клеток до 70 % у больных, получивших тандем ауто-трансплантации гемопоэтических стволовых клеток и алло-трансплантации гемопоэтических стволовых клеток с режимом кондиционирования с уменьшенной интенсивностью дозы от неродственного донора.
Для наиболее эффективного применения алло-трансплантации гемопоэтических стволовых клеток при множественной миеломе анализируют следующие факторы: миелоаблативные режимы кондиционирования против режимов кондиционирования с уменьшенной интенсивностью дозы, сроки проведения трансплантации (терапия первой линии или отсроченное выполнение).
Для профилактики развития рецидива после ауто-трансплантации гемопоэтических стволовых клеток возможно назначение иммуномодулирующей терапии: интерферон, талидомид, велькейд. В качестве адоптивной иммунотерапии больным множественной миеломой после алло-трансплантации гемопоэтических стволовых клеток вводят донорские лимфоциты, при этом достижение длительной ремиссии у значительного количества больных, вероятно, связано с инфузией CD4+-клеток.
О.В. Пирогова, Е.И. Дарская, В.В. Порунова, О.В. Кудяшева, А.Г. Смирнова, И.С. Моисеев, Е.В. Бабенко, Б.В. Афанасьев
Для переписки: Ольга Владиславовна Пирогова, канд. мед. наук, ул. Льва Толстого, д. 6/8, Санкт-Петербург, Российская Федерация, 197022; e-mail: dr.pirogova@gmail.com.
Для цитирования: Пирогова О.В., Дарская Е.И., Порунова В.В. и др. Трансплантация аутологичных гемопоэтических стволовых клеток при множественной миеломе в эпоху новых лекарственных средств. Клиническая онкогематология. 2018;11(2):187–91.
РЕФЕРАТ
Актуальность и цели. В настоящем ретроспективном одноцентровом исследовании анализу подвергнуто влияние высокодозной химиотерапии мелфаланом с последующей трансплантацией аутологичных гемопоэтических стволовых клеток (аутоТГСК) на выживаемость пациентов со множественной миеломой (ММ) в эпоху новых индукционных режимов.
Материалы и методы. В исследование включено 133 пациента с ММ в возрасте 31,2–78,2 года (медиана 55,3 года). Женщин было 66, мужчин — 67. В качестве терапии первой линии 133 больных ММ получали бортезомиб-содержащие схемы, из них 74 больным в рамках консолидации выполнена высокодозная химиотерапия мелфаланом и либо одна (n = 25), либо двойная (n = 49) аутоТГСК с 2006 по 2016 г.
Результаты. Общая 5-летняя выживаемость (ОВ) составила 86,5 % в группе аутоТГСК и 72,9 % в группе без аутоТГСК (p = 0,03); 5-летняя выживаемость без прогрессирования (ВБП) — 64,9 vs 39 % в группах аутоТГСК и без аутоТГСК соответственно (p = 0,0016). Частота рецидивов/прогрессирования ММ была выше в группе пациентов, не получивших аутоТГСК (52,5 vs 28,4 %; p = 0,0016). При многофакторном анализе возраст старше 60 лет определен как фактор неблагоприятного прогноза в отношении ВБП и частоты рецидивов/прогрессирования заболевания (p = 0,004 и p = 0,04 соответственно). Вариант моноклонального белка (миелома Бенс-Джонса) определен как фактор хорошего прогноза в отношении ОВ и частоты рецидивов/прогрессирования (p = 0,02 и p = 0,04 соответственно). Отсутствие полного ответа на индукционную терапию стало независимым предиктором неблагоприятного прогноза в отношении как ОВ, так и ВБП (p = 0,04 и p = 0,041 соответственно). Проведение 2-летней поддерживающей бортезомиб-содержащей терапии после аутоТГСК статистически значимо улучшало показатели 5-летней ВБП (67,4 vs 60,7 %; p = 0,03) и снижало частоту рецидивов/прогрессирования заболевания (26,1 vs 32,1 %; p = 0,05).
Заключение. Высокодозная химиотерапия мелфаланом с последующей аутоТГСК остается эффективным методом лечения пациентов с ММ, а последующая длительная поддерживающая терапия улучшает показатели ВБП и снижает частоту рецидивов/прогрессирования.
Ключевые слова: множественная миелома, трансплантация аутологичных гемопоэтических стволовых клеток, поддерживающая терапия.
Получено: 20 ноября 2017 г.
Принято в печать: 9 февраля 2018 г.

Впервые сталкиваясь с таким страшным диагнозом, как, лейкоз, или лейкемия, лимфома – у человека после первого шока начинается хаос в голове из огромного количества вопросов: как, почему я, или мой ребенок, что делать, как лечить, какие шансы, нужна ли пересадка костного мозга, где найти донора…
Ниже мы выстроили систему из этих вопросов и попробуем ответить на каждый. Это и будет неким планом действий для человека, которому поставили диагноз – рак крови.
Как диагностировать рак крови?
Как лечить лейкоз, лейкемию или лимфому? Можно ли вылечить навсегда?
Какая бывает пересадка костного мозга? Где найти донора?
Как происходит пересадка костного мозга? Что делают перед ТКМ? Сколько времени занимается вся процедура пересадки?
Сколько стоит пересадка костного мозга?
Где лучше делать трансплантацию?
Какой прогноз после пересадки костного мозга?
Как определить рак крови: лейкоз, лейкемию. Как выявить лимфому?
Виды рака крови:
- лейкоз (острый и хронический)
- лейкемия
- лимфома (Ходжкина, неходжкинская)
- миелома
Как диагностировать рак крови на ранней стадии, как он проявляется и как его заметить самостоятельно?
Внимание на симптомы:
- Постоянные головокружения
- Периодическая слабость и сонливость
- Температура постоянно держится на 37 градусах и выше
- Ломота в суставах, костях, как при гриппе
- Кровотечение из носа и десен
- Тошнота, рвота, потеря веса
- Увеличенные лимфоузлы
Вы заметили эти симптомы у себя? У ребенка? Если испытываете подобные симптомы больше 1-2 недель, срочно проходите первичное обследование, а именно:
- Общий анализ крови. Обращайте внимание на: снижение количества тромбоцитов от нормы, увеличение количества бластных (незрелых) клеток от нормы, увеличение лимфоцитов, лимфобластных клеток, появление в крови моноклональных иммуноглобулинов.
- Рентген грудной клетки и головы.
- УЗИ брюшной полости. Внимание на: внимание на увеличение селезенки, печени и лимфоузлов.
Именно по общему анализу крови врач может распознать серьезные отклонения от нормы. Если это случилось, необходимо делать пункцию и проводить иммуногистохимический анализ клеток костного мозга для определения вида рака крови.
Далее, в зависимости от типа рака крови, грамотный врач должен обследовать пациента с помощью ПЭТ КТ, или МРТ, КТ, сцинтиграфии.
Как лечить лейкоз, лейкемию или лимфому? Можно ли вылечить навсегда?
- Цитостатики – лекарственные препараты
- Химиотерапия, таргетная терапия
- Моноклониальные антитела
- Иммунотерапия (Т-киллеры)
- Облучение (только перед трансплантацией, ТКМ)
- Пересадка костного мозга (особенно, когда случается рецидив)
Ранняя стадия рака лейкоза, лейкемии или лимфомы: у 75% пациентов ремиссия наступает уже при первой линии лечения цитостатиками и химиотерапией.
Важно: первая линия лечения может длиться от 3 до 9 месяцев.
Вторая и третья стадии лимфомы, лейкемии и остром лейкозе: кроме цитостатиков и химиотерапии, применяют таргетную терапию и иммунотерапию. Комплексное лечение серьезно повышает шансы онкологического пациента на выход в ремиссию.
Важно: иммунотерапия не применяется как самостоятельный метод лечения рака крови, этот новейший метод биологического лечения является сильным вспомогательным лечением.
Четвертая, терминальная стадии, рецидив: требуется пересадка костного мозга, от донора или собственных стволовых клеток.
Важно: Некоторые виды лейкоза, лейкемии и лимфом даже на ранних стадиях предполагают впоследствии пересадку костного мозга. Поэтому если полученный диагноз по протоколу предполагает в будущем ТКМ (трансплантацию), сразу сдавайте анализы на типирование антигенов HLA сами и все ваши родные. Заранее определитесь, подходит ли кто-то из родственников как донор.
Какая бывает пересадка костного мозга? Где найти донора?
- Аллогенная трансплантация костного мозга. То есть от донора.
- Позволяет пациенту выйти в длительную ремиссию и вылечиться.
- Всего у 10% пациентов обнаруживаются совпадения по антигенам HLA с родственниками. Остальным 90% приходится ожидать очереди на донора в общей базе данных, с которым будет совпадение.
- Осложнения во время и после пересадки в виде не приживаемости, отторжения донорских клеток, вплоть до летального исхода.
- Выживаемость пациентов после аллогенной трансплантации составляет 3-4 пациента из 10. Тем не менее, это лучше, когда без трансплантации вообще ноль шансов выжить.
- Пожизненный прием иммуносупрессоров, препаратов, подавляющих иммунную систему больного, чтобы она не атаковала донорские клетки. Подобная терапия серьезно влияет на качество жизни и вызывает массу сопутствующих заболеваний.
- Аутологичная трансплантация собственных стволовых клеток костного мозга пациента. Метод самый современный, практически всегда используется как единственный в Израиле, в Германии, в Южной Корее, в Таиланде, Китае, Индии, Испании.
- Позволяет пациенту выйти в длительную ремиссию и вылечиться.
- Отсутствие осложнений, прогноз полной приживаемости, так как это собственные клетки.
- Отсутствие последующей иммуно-подавляющей терапии в течение всей жизни.
- Трансплантация может быть недоступна пациенту в связи с тяжестью состояния его организма.
- Выживаемость пациентов при аутологичной трансплантации гемопоэтических клеток 9 из 10. Смертность возможна из-за инфекции во время приживаемости клеток, когда организм почти не защищен, или от токсичности высокодозной химиотерапии, в связи индивидуальной непереносимостью.
Пересадка костного мозга является либо завершающим этапом лечения, когда предыдущие методы не дали 100% положительного результата, либо основным при рецидиве рака крови.
В случае аллогенной трансплантации забор клеток костного мозга производится у донора. Напомним, что 9 пациентам из 10 необходимо ожидать в очереди на получение донора из общей базы при совпадении антител HLA.
Если планируется пересадка собственных стволовых клеток костного мозга, то забор этих клеток делают заранее. Если от донора, то незадолго до процедуры. Особая подготовка не требуется, только обследование.
Стволовые клетки для пересадки берут из тазовой кости пункцией, однако, наиболее современный и щадящий способ – это фильтрование стволовых клеток из периферийной крови после лекарственной стимуляции выброса нужных клеток в кровь (недельный прием препарата). Болезненные последствия для донора или самого пациента отсутствуют. Не больно.
Операция по пересадке костного мозга не что иное, как переливание, ведь костный мозг выглядит просто как пакет крови для переливания.
На 2-4 недели после пересадки пациента помещают в стерильную палату клиники, так как он находится в состоянии цитопении: старый костный мозг убит и не работает, новый костный мозг еще не прижился. В этот период для пациента опасны любые возможные инфекции, даже самые незначительные.
Еще в течение 2 месяцев после выписки из стерильной палаты пациента наблюдают или стационарно или амбулаторно. Каждую неделю он сдает анализы крови, мочи, находится под контролем своего онколога.
По окончании всего этапа лечения, пациент проходит обследование каждые 3 месяца в течение 1 года. Далее еще 4 года – каждые 6 месяцев. Перешагнув 5-летний рубеж выживаемости, пациент вступает в период длительной ремиссии, что в 80% случаях означает полное излечение. Обследование раз в год!
Итак, вся процедура трансплантации костного мозга при лейкозе крови, лейкемии, при множественной миеломе (миеломной болезни), лимфоме Ходжкина и неходжкинской лимфоме занимает 3-4 месяца.
- ДОБАВИТЬ В ДРУЗЬЯ
- RSS
Научно-популярный блог о медицине
Сегодня расскажу для чего и как выполняется трансплантация стволовых клеток костного мозга пациентам с онкологическими заболеваниями крови - лейкоз, лимфома, миелома и др.
Для лечения данных заболеваний применяется химиотерапия, которая уничтожает все частоделящиеся клетки, прежде всего - опухолевые. Однако быстро делятся и здоровые стволовые клетки, за счет которых происходит обновление тканей и органов - они также чувствительны к химиотерапии. Поэтому в результате химиотерапии останавливается регенерация эпителия желудочно-кишечного тракта, органов дыхания, кожи и волосяных фолликулов, а также временно прекращается обновление крови. Но если остановку регенерации в большинстве органов пережить можно, то прекращение кроветворения может стать причиной опасных для жизни осложнений. Снижение количества тромбоцитов ведет к кровотечениям, а снижение лейкоцитов - к тяжелым инфекциям. Поэтому для восстановления кроветворения после высокодозной химиотерапии необходимо выполнить трансплантацию кроветворных стволовых клеток. Для внедрения данного метода терапии в Ханты-Мансийском округе был создан НИИ клеточных технологий, сотрудником которого является ваш покорный слуга.
(1 - криохранилище и лаборатории расположены в Ханты-Маснийске в этом здании, который мы любя называем коттедж)
Чаще всего стволовые клетки заготавливаются заранее у самого пациента, ведь собственные клетки лучше всего приживаются в родном организме. Выделение стволовых клеток из организма на время химиотерапии выводит их из под "удара" больших доз химиопрепаратов.
Получают клетки не напрямую из костного мозга, так как данный орган у больного содержит онкогенные клетки. С помощью специальных препаратов стволовые клетки "выгоняют" из костного мозга в кровообращение. Данные препараты аналогичны эндогенным веществам, которые в естественных условиях синтезируются организмов при кровопотере и заставляют костный мозг регенерировать новые клетки крови.
Затем путем постоянного отбора крови из вены пациента стволовые клетки осаждают с помощью центрифугирования, а оставшиеся фракции крови возвращают в кровообращение. Данную процедуру проводят сотрудники НИИ клеточных технологий на выезде в Гематологическом центре г. Сургута или в Онкологическом центре г. Ханты-Мансийска и выглядит это следующим образом:
(2 - пакет с заготовленными клетками в правом верхнем углу кадра)
Данную процедуру продолжаем 4-8 часов, пока не наберем необходимое количество кроветворных стволовых клеток - не менее 3-4 миллионов на килограмм массы пациента. Такое количество клеток достаточно для успешного восстановления кроветворения после высокодозной химиотерапии.
Затем полученный трансплантат необходимо сохранить на несколько недель, пока будет выполняться химиотерапия. Для этого клетки замораживают в жидком азоте и хранят при температуре -195 С. Однако кристаллизация трансплантата во время замораживания может повредить значительную часть клеток, и дальнейшая трансплантация не позволит восстановить кроветворение у пациента. Для снижения кристаллообразования в трансплантат добавляется криопротектор - специальный препарат, молекулы которого блокируют формирование кристаллической структуры воды. Добавление криопротектора к трансплантату выполняется через "закрытую систему", которая исключает контакт биоматериала с окружающей средой. Кроме того, трансплантат будет введен пациенту после химиотерапии, которая угнетает клетки иммунитета, и попадание малейшей инфекции влечет опасные для жизни осложнения. Поэтому данная процедура выполняется в условиях "чистой зоны", стерильность в которой выше, чем в операционных:
(3 - подготовка стволовых клеток к замораживанию в чистой зоне в НИИ клеточных технологий)
После каждой манипуляции с трансплантатом отбираются пробы для лабораторного контроля количества стволовых клеток, их способности к кроветворению и контроля стерильности. Все пробы передаются в лабораторию через шлюз, исключающий загрязнение чистой зоны:
(4 - расфасовка трансплантата и добавление криопротектора, шлюз в лабораторию)
Затем выполняется замораживание трансплантата с помощью программного замораживателя, который позволяет управлять подачей паров жидкого азота по оптимальной программе для снижения кристаллообразования:
(5 - программный замораживатель)
Далее замороженный трансплантат помещают в хранилище с жидким азотом. При температуре -195 С трансплантат хранится, пока пациент получает химиотерапию. Обычно хранение длится недели-месяцы, но потенциально стволовые клетки могут храниться вечно без снижения их жизнеспособности, так как при данной температуре никакие биохимические процессы невозможны.
(6 - криохранилище в НИИ клеточных технологий)
После химиотерапии пациент находится в стерильном помещении до тех пор, пока не восстановится кроветворение. Здесь же происходит трансплантация. Трансплантат извлекается из жидкого азота и размораживается в течение 1 минуты на водяной бане при +40 С:
(7 - размораживание)
Собственно трансплантация - это струйное введение стволовых клеток в кровообращение пациента:
(8 - трансплантация)
Проходя через костный мозг пациента, гемопоэтические стволовые клетки способны закрепляться в специальных нишах, где, получая разного рода биохимические сигналы от организма, начинают активно делиться и превращаться в эритроциты, лейкоциты и тромбоциты. Как правило, через пару недель пациента переводят в обычную палату.
Скорость восстановления кроветворения зависит от количества стволовых клеток и их способности к кроветворению. Данные параметры трансплантата оцениваются в лаборатории проточной цитометрии, так как под микроскопом невозможно отличить стволовые клетки от лимфоцитов. С помощью специальных красителей и лазерной технологии анализатор распознает стволовые клетки и считает их количество:
(9 - подсчет стволовых клеток проточной цитометрией в НИИ клеточных технологий)
Если заготовленное количество клеток недостаточно для успешного восстановления кроветворения, то процедуру их получения повторяют. Кроме того в культуральной лаборатории оценивается способность стволовых клеток к делению и созреванию. На следующем фото я как раз вношу стволовые клетки в питательной среде на чашку Петри:
(11)
Кроме питательных субстратов среды содержит стимуляторы деления и созревания стволовых клеток, аналогичные тем веществам, которые вырабатываются организмом. Вот так через 2 недели выглядят колонии из тысяч клеток, выращенных всего из одной стволовой клетки. В данном случае - молодые эритроциты:
(12 - колонии созревающих клеток, увеличено в 200 раз)
Полученные результаты позволяют оценивать способность стволовых клеток восстанавливать кроветворение, а также оптимизировать процессы их получения и криоконсервации, что как раз являлось целью моей диссертации.
В перспективе планируется внедрение донорской трансплантации гемопоэтических стволовых клеток. Для этого на базе НИИ клеточных технологий запущена лаборатория генотипирования для подбора совместимых пар "донор-реципиент".
(13 - моя супруга в лаборатории генотипирования)
Всего за 6 лет жителям округа выполнено более 100 трансплантаций. Все пациенты были выписаны в состоянии ремиссии. Например, самый первый наш пациент с множественной миеломой уже 6 лет ведет активный образ жизни, работает, у него появилось двое детей!
Между тем, без трансплантации клеток костного мозга медиана продолжительности жизни таких пациентов составляет всего около 3-х лет. К сожалению, данный вид терапии выполняется лишь в четырех регионах России за пределами федеральных центров. В результате в других регионах России лечение получает только 1 из 10 пациентов с показаниями. Остальные либо уезжают на лечение за границу, либо преждевременно погибают, даже не подозревая о возможности жить дальше. В настоящий момент мною готовится Руководство по внедрению трансплантации костного мозга в региональных стационарах. Надеюсь, оно поможет специалистам и организаторам здравоохранения в регионах России спасти кому-нибудь жизнь. Знания исцеляют!
Уважаемые читатели, мне нужна ваша помощь! В своем блоге я планирую развивать научно-популярный проект "фоторепортажи из операционной". В рамках данного проекта готовится фоторепортаж какой-либо операции, а затем в научно-популярном стиле от лица врача, который выполнял операцию, комментируется каждая фото-иллюстрация. Если вам понравилась данная статья и вы желаете увидеть новые материалы об операциях на сердце, глазах или о протезировании зубов (жду пожелания в комментариях), пожалуйста, помогите распространить данную публикацию в своих аккаунтах в соцсетях в качестве моего портфолио. Я ищу медицинские организации, готовые к сотрудничеству в рамках данного проекта. Представители медицинской организации могут связаться со мной в Фэйсбук, Вконтакте или по email: glagolas@yandex.ru
Чтобы не пропустить новые фоторепортажи, подписывайтесь на самый популярный блог о медицине! А если у вас нет аккаунта в ЖЖ, подписывайтесь на обновления в Фэйсбук, Вконтакте, Телеграм или Твиттер.
Впервые ученый мир замахнулся на невозможное: победить неизлечимое заболевание — рак крови
02.06.2011 в 15:20, просмотров: 72520
Страх смерти рано или поздно, пожалуй, посещает каждого. Но еще страшнее умирать молодым. Миелома, хотя и поражает в основном пожилых, в последние годы нередко настигает тех, кому бы жить и жить. Увы, болезнь считается неизлечимой. Коварство миеломы еще и в том, что она чаще преследует мужчин. Почему? И что это за напасть такая — миелома? Не путать с меланомой (рак кожи)! Хотя обе болезни не подарок, миелома (рак крови) особенно опасна, так как против этого “лома” пока нет стопроцентно эффективного приема. Но ученым уже кое-что удалось.
И это “кое-что” мировые знатоки болезни в течение трех дней обсуждали в Париже. И не где-нибудь, а в самом Лувре, на специальном международном конгрессе по миеломе, где впервые были представлены уникальные исследования и инновационные методы терапии этого тяжелого и пока неизлечимого онкогематологического заболевания. Число заболеваний миеломой в мире неуклонно растет, и, вместе взятые, они приводят к смерти чаще, чем все другие виды рака, за исключением рака легких. Увы, уровень пятилетней выживаемости для людей, больных множественной миеломой (ММ), как было заявлено на конгрессе, составляет около 35%.
Миелома — буквально это oma, то есть опухоль, поражающая myelo, то есть кроветворные клетки костного мозга. Миелому обычно называют множественной, т.к. зачастую в костях обнаруживается сразу несколько очагов новообразований, которые могут приводить к переломам. А именно: в костях позвоночника, таза, грудной клетки, плечевого и тазобедренного пояса и даже черепа. К счастью, при этом не поражаются конечности: кости кистей рук и стоп, предплечий и голеней. Множественная миелома (ММ) — один из видов рака крови, при котором плазматические клетки, являющиеся важным компонентом иммунной системы, начинают бесконтрольно размножаться и накапливаться в костном мозге.
Отсчет начинается в тот момент, когда клетка становится злокачественной (раковой) — обычно из-за нарушений в клеточном генетическом материале (хромосомах). По мере того как появляется все больше злокачественных клеток, они накапливаются и вытесняют здоровые, ослабляя иммунитет.
“Официальная медицина пока не всем дает надежду”
Бедные, бедные российские мужчины. Их и так-то осталось только на развод, то есть на восполнение популяции. А тут еще и пожирающая коварная “дама” — миелома. Но на мой вопрос, почему миелома чаще своей жертвой выбирает представителей сильного пола, не смогли ответить даже исследователи из Америки, организовавшие конгресс в Париже. Наверное, потому, что наука об этом заболевании тоже сравнительно молодая. Хотя ученым уже давно — с середины XIX века — известны симптомы, признаки этой формы рака. В этом году исполняется 150 лет со времени первого ее описания.
С одним из представителей “мужского братства” — Евгением Витальевичем Гольбергом, председателем правления Общества пациентов с онкогематологическими и онкологическими заболеваниями, — удалось встретиться. Евгений Витальевич сам инвалид II группы по онкогематологическому заболеванию и один из самых активных защитников прав пациентов с множественной миеломой. Он живет в Питере, но лечиться ездит… в Смоленск: “Там есть хороший гематологический центр, причем очень многое делается бесплатно”. Вообще разговор с ним многое объясняет относительно проблем с лечением миеломы в России.
— Я начал заниматься онкогематологией на общественных началах по одной простой причине: понял, что иначе не буду иметь никаких шансов лечиться, а значит, и жить, — сказал Евгений Витальевич. — Специалистов данного профиля недостаточно, и с лекарствами для раковых больных — огромная проблема. Нет постоянства в поставке препаратов. И пока официальная медицина не всем больным с миеломой дает надежду. Зачастую им выписывают не те лекарства, которые нужны, и не столько, сколько их нужно для постоянного лечения. Выписывают только то, что есть в льготной аптеке или на аптечном складе. Как это ни нелепо звучит, но врачи решают, кому нужно лекарство, а кому нет. По сути, решают, кому жить, а кому умирать. А все дело в том, что в нашей стране нет единой федеральной программы для лечения таких тяжелых больных. Поэтому в регионах лечат ровно на столько, на сколько хватает денег. По-хорошему должен быть единый федеральный документ по лекарствам, который пройдет экспертизу в Минюсте и будет гарантировать лекарственное обеспечение всех без исключения больных с миеломой. А пока жизнь человека зависит от чего угодно, но только не от логики лечения.
У России есть свой шанс
Удалось встретиться и с одним из российских знатоков множественной миеломы — Ольгой Михайловной ВОТЯКОВОЙ, принимавшей участие в международном конгрессе по миеломе в Париже.
— Продолжительность жизни россиян с миеломой можно увеличить, — сказала при встрече Ольга Михайловна, кандидат медицинских наук, старший научный сотрудник отделения химиотерапии гемобластозов РОНЦ им. Н. Н. Блохина РАМН.
Действительно, история лечения миеломы в России насчитывает более полувека. Уже на первом этапе лечения этого редкого и тяжелого заболевания, который относят к 1953 году, именно в России, в онкоцентре на Каширке, в это время был синтезирован препарат сарколизин, одновременно, кстати, с англичанами. Он широко применялся в России, использовался для лечения больных с множественной миеломой в том числе и давал хорошие результаты. В России же в 1953 году был синтезирован и алкеран (аналог мелфалана). Он до сих пор в сочетании с преднизолоном и новыми лекарствами используется для лечения первичных больных. Вторым важным этапом в лечении множественной миеломы стало введение высокодозного лечения с одновременным применением стволовых клеток. Но мировые ученые, выделяя три важных этапа в лечении множественной миеломы, Россию даже не упоминают.

А вот третьим важным этапом в лечении миеломы и стало использование в клинической практике новых лекарственных средств — ингибиторов апоптоза и иммуномодулирующих препаратов, о которых и шла речь на международном конгрессе в Париже. Американские исследователи, основываясь на данных регистров по смертности и заболеваемости в США, доказали, что смертность от миеломы больных моложе 65 лет стала отчетливо снижаться в 90-е годы. И это связано с введением в клиническую практику высокодозного лечения. Для больных же более пожилого возраста, старше 65 лет, отмечено снижение смертности с 2000 года, что произошло благодаря введению новых лекарственных препаратов.
Принципиально новым на конгрессе было то, что впервые на мировом уровне обсуждалось реальное увеличение продолжительности жизни больных с миеломой. 5-летняя выживаемость пациентов с впервые выявленной болезнью в разных возрастных группах увеличилась от 5–6% до 38%. То есть в 70-е годы 5-летняя выживаемость составляла 27%, а с 1999 года по 2006 год она увеличилась почти до 40%. Впервые были представлены данные о снижении смертности больных по этому заболеванию.
Надо отдать должное ученым из США — они проанализировали данные лечения таких больных с 1969 года по 2002 год. И предлагают лечение миеломы препаратами новейшего поколения. Правда, это лечение относится к высокозатратным видам терапии, и во всех странах Европы и США его компенсирует государство или страховые фонды, в зависимости от устройства системы здравоохранения. На конгрессе обсуждалась идея целенаправленного воздействия на миелому, шел поиск мишени для воздействия химиопрепаратов на опухоль. Были представлены фундаментальные исследования. Но пока еще не выявлена та мишень, которая позволила бы остановить рост опухоли при миеломе. Такого еще нет нигде в мире.
А что касается России…
Должна быть государственная программа по разработке новых подходов к лечению миеломы и в нашей стране. Надо привлечь внимание людей к симптоматике болезни, чтобы они знали, под какими масками прячется миелома. В онкоцентре им. Блохина первичный прием гематологи ведут в день обращения. Люди об этом должны знать. Если у вас обнаружились симптомы, указывающие на миелому, надо идти к специалисту. При себе нужно иметь страховой полис и выписку из истории болезни. В этом центре можно лечиться и амбулаторно: врач распишет пациенту лечение, а на контроль придется приезжать каждые три месяца или один раз в полгода. По мнению специалистов, Москва нормально обеспечена гематологической службой.
Но главное — у больных появились перспективы и они стали жить чуть дольше.
Свет в конце тоннеля
“Как вылечить множественную миелому, еще неизвестно. Хотя болезнь и поддается терапии, полное излечение пока невозможно”, — констатировали на конгрессе самые продвинутые в этой области мировые светила. Но первый шаг сделан. “При поддерживающей терапии, например леналидомидом, после трансплантации собственных клеток увеличивается выживаемость пациентов”, — подтвердили в ходе исследования американские ученые по изучению рака и лейкозов. Профессор Туринского университета (Италия) Антонио Паломбо ожидает таких же результатов в двух других исследованиях этого лечебного средства. Профессор университета Саламанки (Испания) Виктория Матеос также считает результаты исследования такой терапии многообещающими, так как они демонстрируют существенное увеличение времени до развития онкозаболевания — вдвое по сравнению с плацебо.
Еще более важным открытием ученые считают увеличение продолжительности жизни. “Мы думаем, что полученные данные могут изменить стандарты терапии миеломы, — заявил Филипп Маккарти, профессор Института рака Росвелл-Парк (США), возглавляющий это исследование. — Длительное лечение препаратами нового поколения эффективно сдерживает развитие болезни. Наблюдаемое при этом увеличение продолжительности жизни пациентов является самым значимым результатом как для пациентов, так и для врачей”. Правда, пока уровень пятилетней выживаемости для людей, больных миеломой, составляет около 35%.
Существующие стандарты терапии миеломы, принятые в странах с развитой системой онкогематологической помощи, предусматривают применение препаратов нового поколения, что и гарантирует такие обнадеживающие результаты. Что касается отечественной практики, то выбор терапии в большей степени зависит от квалификации специалиста, от его информированности о препаратах новейшего поколения и, конечно, от наличия этих препаратов. В то время как для прогноза эффективности лечения важно, насколько тщательно были уничтожены миеломные клетки и велся контроль за течением болезни, чтобы предотвратить дальнейшее развитие болезни. А также был ли обеспечен контроль за ростом опухолей. Иными словами, пациентам с миеломой должны быть доступны все терапевтические опции. И тогда российские пациенты с миеломой обретут надежду…

Симптомы миеломы
Одними из первых симптомов могут быть утомляемость, боли в пояснице, костях, частые инфекции, реже — повышенная кровоточивость из носа, из десен — при чистке зубов… Если такие симптомы появились, надо срочно обратиться к терапевту, который может заподозрить болезнь и направить к гематологу. В анализах — признаки анемии, ускоренная скорость оседания эритроцитов, высокое содержание белка в сыворотке крови или в моче, кальция — в крови, в костном мозге — повышенное содержание плазматических клеток. Аномально высокая вязкость крови. Нарушение функции почек. Но только гематолог может корректно поставить диагноз множественной миеломы.
Как вовремя заподозрить миелому?
К сожалению, на практике от момента появления первого недомогания до постановки диагноза проходят месяцы и консультации не у одного, а у 4–5 врачей разного профиля. Чтобы как можно раньше был поставлен диагноз, необходимо помнить, что:
— у 80% больных с миеломой наблюдаются патологические изменения в костях, переломы или остеопороз, которые сопровождаются болями;
— и примерно у 40% пациентов развивается почечная недостаточность.
Факторы риска
У афроамериканцев множественная миелома встречается в два раза чаще, чем, например, у европейцев. И чаще наблюдается у больных, имеющих близких родственников, страдающих данным заболеванием, а это дает право предположить, что определенную роль здесь играют генетические факторы.
Точная причина возникновения миеломы неизвестна, однако есть ряд факторов риска, которые способствуют развитию этой болезни. Среди причин, которые специалисты выдвигают в качестве потенциальных, названо частое воздействие химикатов (например, пестицидов, бензола, красителей, аэрозольных красок, контакт с химическим оружием). Отмечено увеличение риска развития миеломы у пожарных, работников сельского хозяйства, парикмахеров, участников относительно недавних войн. В ряде исследований была установлена связь между развитием миеломы и вирусными инфекциями… И наследственное нарушение обмена веществ увеличивает риск развития миеломы.
Но… Большинство людей, у которых выявлена миелома, не сталкиваются ни с какими факторами риска, кроме возраста. Средний возраст пациентов на момент постановки диагноза составляет примерно 65–70 лет, в США большинство из заболевших ММ — в возрасте за 40, причем более высокая заболеваемость у мужчин.
Как удержать рак под контролем?
К счастью, сегодня в клинической практике есть немало способов, чтобы помочь больным перенести этот тяжелый недуг.
Трансплантация костного мозга. В лечении рака крови, в частности миеломы, сегодня используются и стволовые клетки, чаще свои, реже — взятые у здорового донора. Трансплантация донорских клеток чаще дает осложнения, бывает более высокой смертность (от 30 до 50%) и требуется более длительный период восстановления, чем при трансплантации собственных стволовых клеток. Как показывает опыт, трансплантация стволовых клеток делается после того, как пациент пройдет курс высокодозной химиотерапии, которая разрушает раковые клетки гораздо эффективнее, чем традиционные методы лечения, но одновременно убивает нормальные клетки крови. Такую процедуру чаще проводят молодым пациентам и тем, у кого хорошее здоровье. При этом бывают и серьезные побочные эффекты, так как высокодозная химиотерапия токсична. Трансплантация костного мозга проводится в специализированных высокотехнологичных центрах, относится к высокозатратным методам лечения. В России трансплантация проводится 5% пациентов с миеломой.
Основным методом лечения ММ остается все же химиотерапия. Хотя примерно от 10 до 30% больных, у кого впервые диагностирована миелома, не отвечают и на стандартную химиотерапию (то есть не поддаются лечению). Более того, почти все пациенты, страдающие миеломой и получившие хороший результат, подвержены рецидивам. Поэтому очень важно держать рак под контролем как можно дольше без прогрессирования болезни. Это возможно с помощью иммуномодуляторов нового поколения. Конечно, если они имеются в наличии. Для пациентов, не отвечающих на “химию”, также применяются препараты новейшего поколения, в том числе иммуномодуляторы.
Симптоматическая терапия. Врачи научились воздействовать на осложнения, которые дает это заболевание (боли в костях, анемия, частые инфекции); уже есть препараты, которые снижают активность клеток, вызывающих разрушение костей, уменьшают боль в костях, образование новых очагов. В тяжелых случаях прибегают к хирургии — она показана в тех случаях, когда опухоль давит на позвоночный столб. Тогда, чтобы снять боль и укрепить позвоночник, в позвонки закачивают костный цемент. Некоторым пациентам может быть назначена лучевая терапия, помогающая снять боли, предупредить переломы костей. Больным с хронической анемией показаны гормоны, стимулирующие выработку и созревание красных кровяных телец. А больным с анемией тяжелой степени проводят переливание крови. В арсенале этого метода лечения есть антибиотики, болеутоляющие средства и ортопедические аппараты — бандажи, корсеты и др.
Врага надо знать в лицо
По классификации ВОЗ, есть более 20 видов рака, поражающих один или сразу несколько компонентов крови. Множественная миелома, занимая третье место среди наиболее часто встречающихся видов рака крови после неходжкинской лимфомы и всех видов лейкозов, каждый год уносит жизнь примерно 11 000 американцев. В России эта цифра в разы меньше, потому что в разы меньше и обследуется больных, но известно, что в первый год от постановки диагноза умирают 25% больных. Поэтому важно помнить о симптомах миеломы, чтобы вовремя был поставлен диагноз и начато лечение, тем более что для этого появились эффективные лекарственные средства.
Опубликован в газете "Московский комсомолец" №25658 от 3 июня 2011
Читайте также:

