Asco рак молочной железы
Рандомизированное исследование 3 фазы PERSEPHONE при HER2-позитивном раннем раке молочной железы (РМЖ): 6 мес. адъювантной терапии трастузумабом не уступают по эффективности 12 мес. трастузумаба при значимо меньшей кардиотоксичности (abstr. 506).
В представленном на ASCO 2018 рандомизированном исследовании 3 фазы PERSEPHONE с дизайном non-inferiority сравнили 6 и 12 мес. адъювантной терапии трастузумабом у больных с HER-2-позитивным РМЖ, которые получали нео- или адъювантную химиотерапию (ХТ) с антрациклинами (режимы FEC, EC, ECMF), таксанами (TC, TCH), антрациклинами и таксанами (FEC-T, EC-T) или только CMF. Включено 4088 пациенток, группы были стратифицированы в соответствии со статусом гормональных рецепторов, предшествующим режимом ХТ, временем ее начала (нео- или адъювантная), а также начала терапии трастузумабом (одновременно с ХТ или последовательно). Необходимо отметить, что значительная часть пациенток не имела метастазов в регионарные лимфоузлы (58% и 60% в группах 12 мес. и 6 мес. трастузумаба соответственно), кроме того, по 53% больных в каждой группе начали трастузумаб после окончания ХТ (известно, что такое последовательное назначение снижает выигрыш от его применения).
Первичной конечной точкой была выбрана 4-летняя безрецидивная выживаемость (БРВ). При медиане наблюдения 5,4 года показатель 4-летней БРВ в группе 6 месяцев трастузумаба составил 89,4%, в группе 12 месяцев – 89,8% (абсолютные различия 0,4%; отношение рисков (ОР) 1,05; 90% ДИ 0,93-1,24; non-inferiority р=0,01). Подгрупповой анализ БРВ показал преимущества более продолжительного 12-месячного курса трастузумаба при отрицательных гормональных рецепторах (ОР 1,26; 95% ДИ 0,97-1,64), ХТ только с таксанами (ОР 2,47; 95% ДИ 1,31-4,62), неоадъювантной ХТ (ОР 1,43; 95% ДИ 1,00-2,04) и конкурентном назначении ХТ и трастузумаба (ОР 1,53; 95% ДИ 1,16-2,01).
Показатель 4-летней общей выживаемости (ОВ) в группе 6 месяцев трастузумаба составил 93,8%, в группе 12 месяцев – 94,8% (абсолютные различия 1,0%; ОР 1,14; 90% ДИ 0,95-1,37; non-inferiority р=0,0006). Подгрупповой анализ ОВ показал преимущества более продолжительного 12-месячного курса трастузумаба в в тех же группах: при отрицательных гормональных рецепторах (ОР 1,51; 95% ДИ 1,10-2,06), ХТ только с таксанами (ОР 2,05; 95% ДИ 1,01-4,23), неоадъювантной ХТ (ОР 1,55; 95% ДИ 0,99-2,41) и конкурентном назначении ХТ и трастузумаба (ОР 1,61; 95% ДИ 1,13-2,29).
Сокращенный курс применения трастузумаба характеризовался значимо более низкой кардиотоксичностью: количество пациенток, которые прекратили лечение из-за развития серьезных сердечно-сосудистых осложнений, было в 2 раза меньшим – 4% против 8% в группах 6 и 12 месяцев соответственно.
Авторы исследования планируют продолжить свою работу. В данный момент они собирают данные по качеству жизни пациентов и по финансово-экономическим затратам на лечение. На будущее запланирована работа по выделению из образцов опухоли и крови пациентов биомаркеров, которые помогут вычислить когорту больных, которым нужна более продолжительная терапия.
Рандомизированное исследование 3 фазы TAILORx (адъювантная химиотерапия (ХТ) и гормонотерапия (ГТ) по сравнению с одной ГТ у больных с гормонозависимым (ГР+) HER2-негативным РМЖ без метастазов в лимфоузлы (N0) и промежуточным прогнозом по данным анализа 21 гена (тест OncoTypeDx)): большинство больных ранним ГР+ РМЖ N0 не нуждаются в адъювантной химиотерапии.
Эти данные были представлены на ASCO 2018 (abstr. LBA1), параллельно вышла статья в New England Journal of Medicine.
Половину всех случаев РМЖ составляет гормонозависимый HER2-негативный подтип без поражения подмышечных лимфоузлов. Адъювантная ХТ снижает риск рецидива у молодых женщин с ГР+ HER2- РМЖ, статус лимфоузлов или степень злокачественности не оказывают значимого влияния. Однако различные панели экспертов включают в клинические рекомендации обязательную адъювантную ХТ для таких пациенток.
В представленном на ASCO 2018 исследовании TAILORx израильские ученые оценили риск развития рецидива у 10 тысяч больных ранним (N0) гормонзависимым HER2-негативным РМЖ с помощью анализа экспрессии 21 опухолевого гена (тест OncoType Dx). Около 70% пациенток (6711 человек) попали в группу промежуточного прогноза. Эти пациентки были рандомизированы на две группы: адъювантной химио- и гормонотерапии или только гормонального лечения.
Исследование показало, что эффективность эндокринной терапии нисколько не уступает комбинированному лечению. Отношение рисков рецидива инвазивного РМЖ, повторного первичного РМЖ или летального исхода в группах ГТ/ХТ+ГТ составило 1,08; 95% ДИ 0,94-1,24, р=0,26. В течение 9 лет в обеих группах больных наблюдались примерно одинаковые показатели ВБП (83,3% в группе ГТ и 84,3% в группе ХТ-ГТ), отсутствия локорегионарного рецидивирования (92,2% против 92,9%) и отдаленного метастазирования (94,5% против 95,0%).
Подгрупповой анализ показал, что возраст моложе 50 лет является дополнительным фактором неблагоприятного прогноза, в результате чего удалось выделить когорту больных, которым, скорее всего, нужна профилактическая химиотерапия. Это женщины моложе 50 лет с риском развития рецидива 16-25 баллов по данным OncoType Dx (р=0,004). Если сумма баллов составляла 16-20, риск отдаленного рецидива у таких пациенток при проведении ХТ был ниже на 2%, если сумма 21-25 – ниже на 7%.
Следующий шаг – провести похожее исследование у больных, у которых опухоль распространилась на подмышечные лимфоузлы. В соответствующее исследование уже закончился набор женщин, у которых поражено от 1 до 3 аксиллярных лимфоузлов, а риск развития рецидива по результатам OncoType Dx менее 25. Профессор Shapiro полагает, что итоговые данные могут быть вполне похожи на результаты TAILORx.
Сразу в двух представленных на ASCO 2018 исследованиях оценили роль дополнительной овариальной супрессии у больных ранним ГР+ РМЖ в пременопаузе (abstr. 502, 503).
В одном из них были доложены обновленные результаты объединенного анализа рандомизированных исследований 3 фазы TEXT и SOFT.
Авторы оценили абсолютное увеличение выживаемости без отдаленных метастазов (ВБМ) при проведении адъювантной гормонотерапии (ГТ) у больных с гормонозависимым (ГР+) HER2-негативным РМЖ в пременопаузе. Показано, что в группе пациенток после адъювантной ХТ, которая назначалась в соответствии с известными клинико-морфологическими факторами риска, проведение адъювантной ГТ эксеместаном в комбинации с овариальной супрессией (ОС) увеличивает 8-летнюю ВБМ на 5% по сравнению с тамоксифеном + ОС или одним тамоксифеном. Различий в ВБМ между двумя последними подгруппами не выявлено. Также не различались показатели ВБМ в зависимости от назначенного вида ГТ у пациенток, которым не проводилась адъювантная ХТ (то есть в группе более низкого риска рецидива) (abstr. 503).
TEXT и SOFT – это рандомизированные клинические исследования III фазы, в которые в период с 11.2003 по 04.2011 было включено соответственно 2672 и 3066 женщин в пременопаузе с ранним ГР+ РМЖ. В обоих исследованиях суммарно 4690 пациенток были рандомизированы на группы адъювантной ГТ эксеместаном в комбинации с ОС или тамоксифеном + ОС. Для подавления функции яичников использовали ежемесячные инъекции агониста GnRH трипторелина в течение 5 лет (наиболее распространенный выбор в SOFT и TEXT), хирургическое удаление яичников или облучение яичников. В исследовании SOFT была также третья группа – 5 лет одного тамоксифена. В обоих исследованиях пациентки могли получать ХТ в качестве части адъювантного лечения так, как это было принято в клинической практике (около 55% включенных пациенток получали адъювантную ХТ, которая назначалась и проводилась до рандомизации на ГТ или ГТ+ОС в соответствии с общепринятыми клинико-морфологическими факторами риска).
Как было показано в первом анализе этих исследований, добавление ОС к терапии тамоксифеном статистически значимо увеличило бессобытийную (без рецидива РМЖ, инвазивного рака второй молочной железы и злокачественных опухолей других локализаций) и общую выживаемость. Замена тамоксифена на эксеместан в комбинации с ОС дополнительно снижала частоту рецидивов, включая отдаленные рецидивы, в особенности у женщин с HER2-негативным РМЖ. В то же время различий в общей выживаемости при замене тамоксифена на эксеместан не наблюдали.
На ASCO 2018 были отдельно проанализированы случаи с HER2-негативным гормон-рецептор-позитивным РМЖ (86% от всех пациенток). Исследователи изучили влияние режима адъювантной гормонотерапии на выживаемость без отдаленных рецидивов заболевания (то есть безметастатическую выживаемость) при медианах времени наблюдения 8 и 9 лет для исследований SOFT и TEXT соответственно. При этом все пациентки были разделены на группы в зависимости от исходного риска отдаленного рецидива. При оценке исходного риска рецидива учитывали возраст (с интервалом 5 лет), число пораженных регионарных лимфатических узлов (0, 1-3, ≥4), размер первичной опухоли (≤2 см, >2 см), экспрессию рецепторов эстрогенов ( 12 месяцев после окончания предшествующей (нео)адъювантной эндокринотерапии. Таким образом, комбинация рибоциклиба с фулвестрантом может быть новой опцией первой и второй линий терапии для женщин в постменопаузе с гормоночувствительным HER2-негативным мРМЖ.
Анализ биомаркеров в исследовании MONALEESA-2 (abstr. 1022).
На конференции ASCO 2018 проф. GN Hortobagyi представил анализ данных ВБП из исследования MONALEESA-2 [3] в зависимости от уровня экспрессии различных генов. Результаты исследования MONALEESA-2 (NCT01958021) были опубликованы ранее [2]. Пациенты были рандомизированы в соотношении 1:1 на получавших рибоциклиб (600 мг/д; 3 недели прием / 1 неделя перерыв в течении 28-дневного цикла) + летрозол (2,5 мг/д; непрерывно) или плацебо + летрозол. Для оценки корреляции между уровнем экспрессии генов и ВБП пациенты были классифицированы на подгруппы с низким и высоким уровнем экспрессии мРНК с определением медианы экспрессии (50%) на момент анализа.
К моменту анализа данных 96 из 197 пациентов в группе рибоциклиба и 99 из 194 пациентов в группе плацебо имели высокий уровень экспрессии гена эстрогеновых рецепторов (ESR1). Отмечалась тенденция к увеличению ВБП у пациентов с высоким уровнем экспрессии ESR1 в обеих группах (рибоциклиб + летрозол и плацебо + летрозол). Преимущество добавления рибоциклиба было выше у пациентов с высоким уровнем экспрессии ESR1 (ОР 0,39) в сравнении с низким уровнем (ОР 0,74).
ВБП в зависимости от уровня экспрессии гена ESR1:
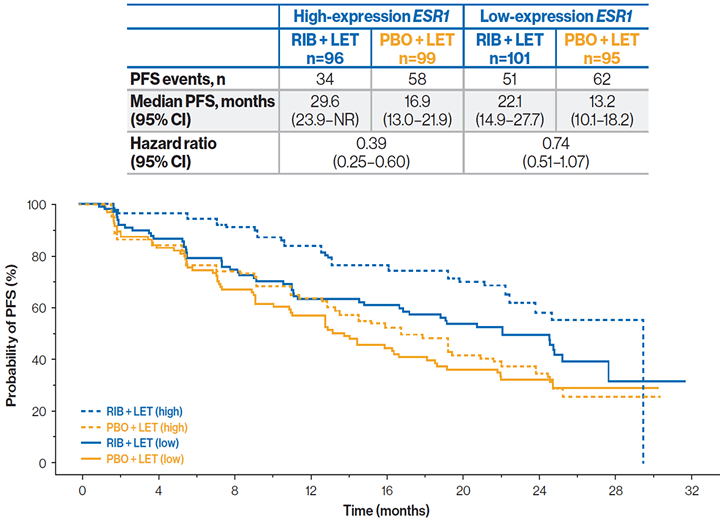
Комбинация рибоциклиб + летрозол увеличивала ВБП в сравнении с использованием плацебо + летрозол как для пациентов с высоким, так и с низким уровнем экспрессии гена E2F1 сигнального пути CDK. Отмечалась тенденция к удлинению ВБП у пациентов с низким уровнем экспрессии E2F1.
ВБП в зависимости от уровня экспрессии гена E2F1:
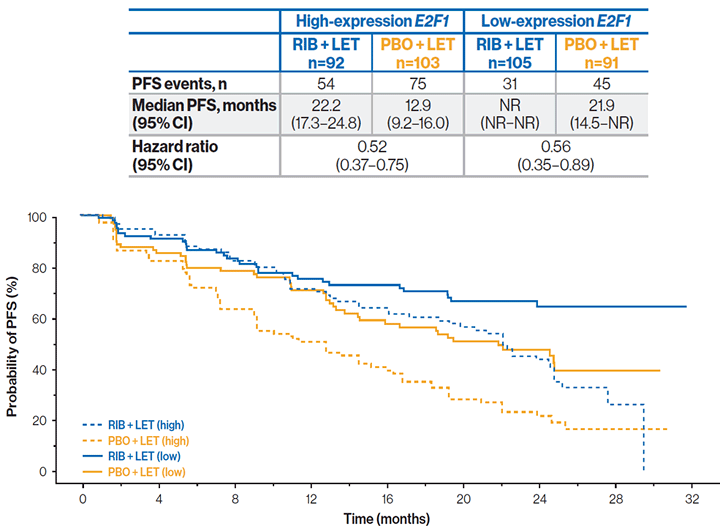
Добавление рибоциклиба к летрозолу в первой линии терапии гормоночувствительного HER2- мРМЖ обеспечивало увеличение ВБП во всех подгруппах экспрессии генов.
Подгрупповой анализ ВБП в зависимости от уровней экспрессии генов:
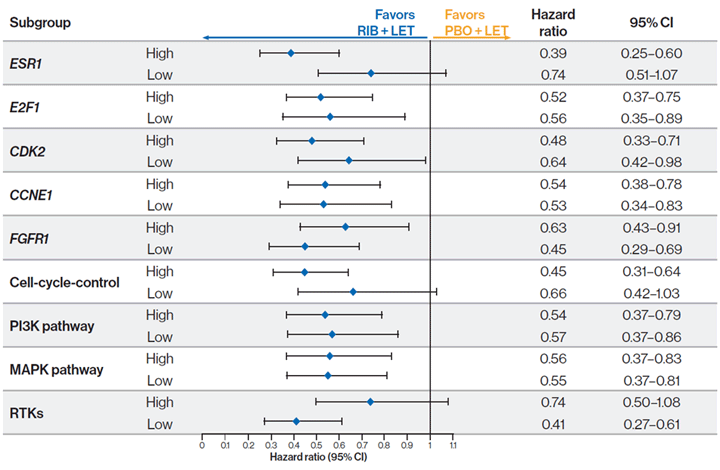
Выводы авторов: тенденция к большей эффективности рибоциклиба наблюдалась у пациентов с высокой экспрессией в сравнении с низкой экспрессией гена рецепторов эстрогена (ESR1), с высокой экспрессией в сравнении с низкой экспрессией гена, контролирующего клеточный цикл, и с низкой экспрессией в сравнении с высокой экспрессией гена рецепторов тирозинкиназы (RTK).
В заключении авторы отметили, что более короткая медиана ВБП для группы плацебо + летрозол у пациентов с высокой и низкой экспрессией генов, контролирующих клеточный цикл, указывает на то, что высокая экспрессия генов, контролирующих клеточный цикл, может вызывать резистентность к лечению одним только летрозолом. Гены, предположительно участвующие в механизмах резистентности к ингибиторам CDK 4/6, требуют дальнейшего изучения в более крупных клинических исследованиях с использованием дополнительных методов.
- Slamon DJ, et al. Ribociclib + fulvestrant in postmenopausal women with hormone receptor-positive, HER2-negative advanced breast cancer: Results from MONALEESA-3. Presented at 2018 ASCO Annual meeting. June 1-5, 2018, Chicago, IL. Poster 1000.
- Hortobagyi GN, et al. N Engl J Med. 2016; 375: 1738-1748.
- Hortobagyi GN, et al. American Society of Clinical Oncology, June 1-5, 2018, Chicago, IL. Poster 1022.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
На правах рукописи
ШАТОВА Юлиана Сергеевна
Клинико-эпидемиологические и гормонально-метаболические закономерности развития рака молочной железы у женщин в различные репродуктивные периоды жизни
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
доктора медицинских наук
Научный консультант:
- доктор медицинских наук, профессор, Кит Олег Иванович
Официальный оппонент:
Автореферат разослан "_____"_______________ 2016 г.
Ученый секретарь совета
по защите докторских и кандидатских диссертаций,
доктор медицинских наук, профессор Позднякова В.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Рак молочной железы (РМЖ) – представляет собой группу гетерогенных опухолей различных биологических подтипов (Семиглазов В.Ф., 2011; 2012). По сути, при одной локализации процесса в молочной железе имеются несколько заболеваний, которые различаются причинами возникновения злокачественного роста, генетическими нарушениями, клиническим течением, разным прогнозом болезни (Kris M.G. etal., 2011) и различными биологическими свойствами опухоли(Цырендоржиева Е.С., 2003; Енгай Д.А., 2007;Имянитов Е.Н., 2007; Van‘tVeerL.S., 2002;IorioM.V., 2009). Современные исследования указывают на различия в патогенезе опухолевого процесса у больных с разным состоянием менструальной функции даже в пределах одной молекулярно-генетической группы опухолей (Завьялова М.В. и соавт., 2013).При этом переход к персонифицированному их лечению невозможен без фундаментальных исследований биологических характеристик опухоли.
Вопрос о гормональном обеспечении основных подтипов РМЖ, ассоциированных с возрастом, этнической принадлежностью и некоторыми особенностями менструальной и репродуктивной функции (AndersonW.F.etal., 2006; KurianA.W. etal., 2010) привлекает к себе все большее и большее внимание (Берштейн Л.М., 2013). Исследования последних лет показали несостоятельность теории о том, что основной причиной развития онкопатологии репродуктивных органов является гиперэстрагения (Ашрафян Л.А., Киселев В.И., 2008). Очевидно, что причины возникновения и развития гормон-зависимого рака как болезни в организме намного сложнее. Даже в условиях гипоэстрогении опухолевая клетка выживает за счёт других гормон-независимых путей (Коновалова В.Н., Сметник В.П., 2011). В аутокринной и паракринной регуляции пролиферации клеток РМЖ кроме гормонов участвуют различные ростовые факторы: пептиды группы эпидермального фактора роста EGF, VEGF, TGFβ1, взаимодействующие с общим рецептором, инсулиноподобные факторы роста (ИФР1 и ИФР2), соматостатин (LippmanM.E. etal., 1988). Рецепторы этих ростовых факторов были обнаружены в опухолях больных РМЖ, и их клиническое значение изучается в последние годы достаточно активно (Герштейн Е.С. исоавт., 2001; Шевченко А.В. и соавт., 2013; CarmelietP., Jain R., 2000; Brouwer-VisserJ. andHuangG.S., 2015).
Автономное поведение опухоли, ее неконтролируемый рост и распространение, по-видимому, может быть реализовано при нарушениях, возникающих на различных уровнях: молекулярном (экспрессия генов пролиферации, апоптоза, адгезии и пр.), клеточном (способность реагировать на поступающие сигналы), тканевом (межклеточные взаимодействия, в т.ч., с клетками иммунной системы). С учетом этого для понимания особенностей ее биологического поведения представляется важной комплексная оценка пролиферативных свойств опухоли, иммуногистохимических (ИГХ) характеристик ее клеток и присутствия в ней, а также в прилежащей к ней перитуморальной области лимфоцитов различных субпопуляций.Можно надеяться, что и традиционные, и новые подходы, направленные на устранение нарушений эндокринной и метаболической природы, при их большей, чем ранее, адресации к уже устоявшемуся подразделению РМЖ на отдельные подтипы окажутся важным средством повышения эффективности превентивных и лечебных мер воздействия при этом серьёзном и имеющем большую социальную значимость заболевании (Берштейн Л.М., Семиглазов В.Ф., 2011).
Степень разработанности темы
В литературе имеется большое число данных проведенных исследований по изучению гетерогенности биологических подтипов РМЖ. Однако не все представленные результаты сопоставимы друг с другом, так как критерии распределения опухолей по подтипам менялись с течением времени по мере того, как расширялись знания по этому вопросу.На сегодняшний день считается необходимым проведение дальнейших эпидемиологических исследований в этом направлении с целью выявления роли того или иного фактора риска в развитии различных подтипов РМЖ (Синкина Т.В. исоавт., 2009; DavisA.A. andKaklamaniV.G., 2012). Перспективным представляется стратификация гетерогенной выборки пациентов РМЖ и поиск ассоциаций не во всей совокупности, а в пределах отдельных молекулярных подтипов (Garcia-GlosasM. etal., 2008). Несомненная важность данных о связи половых гормонов в системной циркуляции с отдельными подтипами карцином и их относительная немногочисленность свидетельствуют о желательности дальнейшего анализа этого вопроса в сопоставлении, как с прикладными, так и с фундаментальными аспектами проблемы. До настоящего времени интенсивность биосинтеза эстрогенов в ткани различных подтипов РМЖ редко бывала предметом изучения, хотя подобное развернутое исследование могло бы представить несомненный и значимый интерес (Берштейн Л.М., Семиглазов В.Ф., 2011).За последнее десятилетие стало очевидно, что поиск вероятных факторов прогноза должен быть сосредоточен на клеточном и молекулярном уровнях. В частности, в стране и в мире интенсивно изучается роль циркулирующих опухолевых клеток (ЦОК) в распространении опухолевого процесса путем гематогенного метастазирования (PachmannK. etal., 2008; PiergaJ.Y. etal., 2008; Bidard F.C.etal., 2012; 2013). Однако, данные о влиянии биологического подтипа РМЖ, а тем более репродуктивного статуса на этот показатель скудны (Giordano A. etal., 2012; MunzoneE. etal., 2012).Итак, изучение отечественной и зарубежной литературы показало, что поиск возможных закономерностей развития биологических подтипов РМЖ, формирующихся у женщин в различные репродуктивные периоды жизни, является перспективным научным направлением, отражающим современные тенденции к индивидуализации диагностических, лечебных и профилактических подходов.
Цель исследования
Выявить особенности развития различных подтипов рака молочной железы, а также их биологических свойству женщинв разные репродуктивные периоды жизни.
Задачи исследования
Изучить закономерности развития биологических подтипов рака молочной железы в условиях разных внутренних и внешних факторов в различные репродуктивные периоды жизни.
Изучить морфологические и иммуногистохимические особенности различных биотипов опухолей в разные репродуктивные периоды.
Изучить гормонально-метаболические нарушения в крови и тканях опухоли молочной железы, перифокальной зоны и интактной ткани у женщин с различным состоянием менструальной функции и биологическим подтипом опухоли.
Изучить факторы роста и неоангиогенеза в опухолевой ткани и ее перифокальной зоне у женщин с различным состоянием менструальной функции и биологическим подтипом опухоли.
Изучить особенности иммунологического микроокружения опухолей разных биологических подтипов у женщин с различным состоянием менструальной функции.
Изучить пролиферативную активность опухолей различных биологических подтипов у женщин с различным состоянием менструальной функции.
Изучить особенности выявления циркулирующих опухолевых клеток у больных разными биологическими подтипами рака молочной железы.
Новизна исследования
В диссертационной работе впервые на большом материале изучены закономерности развития биологических подтипов РМЖ с учетом факторов внешней и внутренней среды в различные репродуктивные периоды жизни.
Впервые изучены морфологические, иммуногистохимические, пролиферативные, гормонально-метаболические особенности опухолей различных биологических подтипов с учетом состояния менструальной функции женщины.
Впервые изучены особенности неоангиогенеза и локального иммунитета в опухоли и ее перифокальной зоне с учетом биотипа опухоли и состояния менструальной функции женщин.
Теоретическая и практическая значимость
1. Заложена база для разработки мер первичной и вторичной профилактики с учетом биологических характеристик опухоли и состояния репродуктивной функции женщины.
2.Разработанный подход, учитывающий не только биологический подтип опухоли, определенный по стандартной ИГХ-панели, но и другие внешние и внутренние факторы, определяющие биологическое поведение опухоли в сочетании с состоянием менструальной функции женщины, позволяет перейти к персонифицированной тактике лечения этой категории больных и, соответственно, улучшить его результаты.
3. Выявленные ИГХ, гормонально-метаболические, иммунологические и пролиферативные особенности РМЖ различных биотипов, а также распределение факторов роста и неоангиогенеза у женщин с различным репродуктивным статусом являются предпосылкой для дальнейшей разработки вариантов таргетной терапии.
4. Разработанный способ лечения раннего РМЖ, основанный на определении ЦОК исходно и через сутки после операции, позволит улучшить ближайшие и отдаленные результаты лечения (патент РФ № 2554749 от 01.06.2015 г.).
5. Разработанные способы прогнозирования химиочувствительности (патент РФ№ 2551232от 20.04.2015 г.) и гормонозависимости опухоли (патент РФ №2559152от 10.07.2015 г.), применение которых возможно в любых технических условиях медицинского учреждения, позволяют своевременно начать специфическую терапию.
Методология и методы исследования
Диссертация логически структурирована, представленные результаты основаны на изучении большого клинического материала. Клинико-эпидемиологическое исследование проведено с применением современных методов статистического анализа, что делает полученные данные убедительными и достоверными.Лабораторные исследования выполнены с использованием лабораторно-инструментальных, морфологических, иммуногистохимические, биохимических, иммунологических, гормональных, статистических методов, а также с применением проточной цитометрии, в том числе изучения ДНК-цитометрических показателей опухоли, технологии анализа в системе CellSearchSystem™ (JanssenDiagnostics, LLC) для детекциициркулирующих опухолевых клеток.
Научные положения, выносимые на защиту
Факторы риска развития биологического подтипа РМЖ, а также морфо-функциональные особенности, локальная насыщенность гормонами и факторами роста опухоли и перифокальной зоны, обусловлены не только биологическим подтипом РМЖ, определенным по стандартной ИГХ-панели, но и состоянием менструальной функции женщины на момент ее развития.
Люминальный В РМЖ занимает промежуточное положение между люминальным А и нелюминальными опухолями по исследованным параметрам. Несмотря на рецепторный статус, характерный для благоприятного течения, заболевание носит достаточно агрессивный характер и кардинально отличается по своим клинико-биологическим характеристикам от люминального А РМЖ, приближаясь к тройному негативному раку (ТНР) и HER2neu+РМЖ.
РМЖ нельзя рассматривать только с позиции биологического подтипа, определенного на основании стандартной ИГХ-панели, или только с позиции сохранности менструальной функции. Необходимо учитывать и другие параметры, определяющие биологическое поведение опухоли: экспрессию рецепторов белков bcl-2, p53, Topo2α, Е-кадгерина, экспрессию рецепторов андрогенов, локальный гормональный и иммунологический фон опухоли, уровень факторов роста, а также ее пролиферативные свойства. Именно такой подход позволит перейти к персонифицированной тактике лечения этой категории больных и, соответственно, улучшить его результаты.
Степень достоверности и апробация результатов работы
Автором лично изученыв сравнительном аспектезакономерности развития биологических подтипов РМЖ в условиях разных внутренних и внешних факторов в различные репродуктивные периоды; морфологические, ИГХ и иммунологические особенности различных биотипов опухолей в разные репродуктивные периоды; гормонально-метаболические нарушения в крови и тканях опухоли молочной железы, перифокальной зоны и здоровой ткани, а также факторы роста и неоангиогенеза в опухолевой ткани и ее перифокальной зоны у женщин с различным состоянием менструальной функции и биологическим подтипом опухоли; изучена пролиферативная активность опухолей различных биологических подтипов у женщин с различным состоянием менструальной функции, а также особенности выявления циркулирующих опухолевых клеток у больных различными биологическими подтипами РМЖ. Полученные результаты исследований подвергались статистической обработке и научному анализу, что позволило автору сделать объективные выводы и практические рекомендации.
По теме диссертации опубликованы 27 печатные работы, из них 12 вжурналах, рекомендованных ВАК, получено 3 патента Российской Федерации.
Объем и структура диссертации
Диссертация изложена на 326 страницах машинописного текста, состоит из введения, обзора литературы, материала и методов, 5 глав собственных исследований, заключения, выводов, практических рекомендаций, указателя литературы, включающего 151 отечественных и 324 зарубежных источника, иллюстрирована 91 таблицей и 60 рисунками.
Соответствие диссертации паспорту научной специальности
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Характеристика клинического материала и методов исследования
Все пациентки до начала обследования дали свое письменное согласие на использование их персональных данныхи биологического материала для научно-исследовательских целей.
* – различия достоверны по отношению к больным в постменопаузе (p Скачали: 1395
Читайте также:

