Антибиотик для детей при лейкозе
У многих пациентов уже до начала лечения выявляются лихорадка и нейтропения. Нераспознанные инфекции могут быстро диссеминировать и закончиться фатально, поэтому недопустима отсрочка назначения антибиотиков до появления развернутой клинической картины.
Наиболее важным предрасполагающим фактором развития инфекций является нейтропения. Риск инфекции зависит от уровня и длительности постцитостатической нейтропении и возрастает при количестве нейтрофилов меньше 1 • 10 9 /л.
При развитии агранулоцитоза (нейтрофилов меньше 0,5 • 10 9 /л) вероятность инфекции очень велика, а при количестве нейтрофилов меньше 0,1 • 10 9 /л инфекции развиваются у большинства пациентов и имеют чрезвычайно тяжелое течение.
До середины 1980-х годов грамотрицательные бактерии кишечного происхождения были причиной 70-80% бактериальных инфекций у больных острым лейкозом. В настоящее время 60-80% бактериальных инфекций вызывается грамположительными микроорганизмами. Это обусловлено:
1) использованием сосудистых катетеров;
2) проведением деконтаминации кишечника, подавляющей грамотрицательную микрофлору;
3) выбором антибактериальных препаратов для эмпирической антибактериальной терапии.
Наряду с бактериальными инфекциями большое значение у больных с нейтропенией имеют грибковые (кандидоз, аспергиллез), вирусные (вызванные herpes simplex и zoster, ЦМВ) и протозойные инфекции.
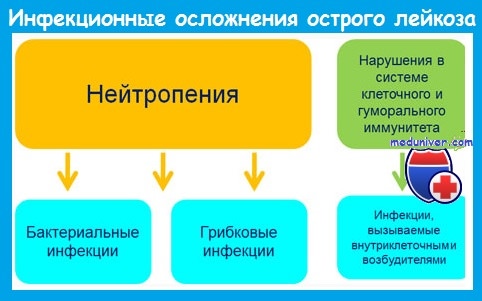
Инфекционные осложнения при остром лейкозе отличаются атипичным течением. Это обусловлено следующими обстоятельствами:
1) агранулоцитоз существенно изменяет реакцию организма на инфекционный агент, что клинически чаще всего проявляется развитием фебрильной температуры без других признаков локальной или системной инфекции;
2) многие антибиотики нарушают микрофлору больного, подавляют чувствительные микроорганизмы и способствуют пролиферации резистентных бактерий и грибов рода Candida (суперинфекция);
3) большое влияние на защитные механизмы оказывает химиотерапия, вызывающая миелосупрессию и повреждение эндотелия;
4) глюкокортикостероиды, часто вводимые больным как часть специфической терапии, также отрицательно влияют на защитные механизмы;
5) интубация, зондовое энтеральное питание и использование сосудистых катетеров вызывают нарушение целостности кожных покровов и/или повреждение слизистых оболочек.
В связи с высокой вероятностью развития инфекционных осложнений у больных острым лейкозом разработан комплекс профилактических мероприятий:
1) изоляция больного в период нейтропении, которая обеспечивает снижение частоты инфекций, передающихся воздушно-капельным путем;
2) обработка кожи и слизистых оболочек дезинфицирующими растворами (хлоргексидин и др.);
3) деконтаминация кишечника (per os назначаются неабсорбируемые антибактериальные препараты, например канамицин, и противогрибковые средства, чаще всего нистатин или суспензия амфотерицина В), позволяющая снизить количество грамотрицательных организмов кишечного происхождения;
4) гигиена ротовой полости (регулярное полоскание и использование мягких зубных щеток с целью предотвращения травмирования десен);
5) системная профилактика (бисептол или фторхинолоны);
6) отказ от ректальных и вагинальных манипуляций (кроме проводимых по неотложным и жизненным показаниям);
7) назначение препаратов гранулоцитарного или гранулоцитарно-моноцитарного колониестимулирующего фактора (КСФ) для более быстрого восстановления нейтрофилов и уменьшения вероятности инфекционных осложнений.
Показанием к назначению эмпирической антибактериальной терапии на фоне агранулоцитоза является фебрильная температура тела (выше 38 °С) более 2 часов, не связанная с инфузиями или аллергическими реакциями. Оптимально сочетание антипсевдомонального пенициллина или цефалоспорина с аминогликозидом.
Допустима монотерапия цефалоспорином 3-го или 4-го поколения или карбепенемом, например имепенемом. При отсутствии эффекта в течение 2-3 суток необходимо дополнение эмпирической антибактериальной терапии ванкомицином; в случае сохранения лихорадки в течение 4-6 дней назначается амфотерицин В в связи с высокой вероятностью системной грибковой инфекции. После идентификации возбудителя проводится целенаправленная антибактериальная, противовирусная и антимикотическая терапия.
Антибактериальная терапия проводится до повышения абсолютного содержания нейтрофилов в крови больше 0,5 • 10 9 /л и нормализации температуры тела. Длительность терапии у пациентов с документированной инфекцией должна быть не менее 10-14 дней.
Трансфузии гранулоцитов используются крайне редко. Единственным показанием к трансфузии является развившийся на фоне агранулоцитоза бактериальный сепсис при отсутствии ответа на адекватную антибактериальную терапию.
Как развивается острый лимфобластный лейкоз у детей
Клетки крови (лейкоциты, эритроциты, тромбоциты) производятся костным мозгом и затем разносятся по кровеносной системе.
Двумя основными типами лейкоцитов являются миелоидные и лимфоидные клетки. Они главным образом сконцентрированы в лимфатических узлах, селезенке, вилочковой железе (тимусе) и желудочно-кишечном тракте, обеспечивая наш иммунитет для борьбы с инфекциями.
В норме костный мозг продуцирует три типа лимфоцитов, борющихся с инфекциями:
B-лимфоциты – они формируют антитела против болезнетворных микробов;
T-лимфоциты – уничтожают инфицированные вирусом или инородные клетки, раковые клетки. Они также помогают вырабатывать антитела;
Натуральные киллеры (NK-клетки) – их задача уничтожать вирусы и раковые клетки.
При ОЛЛ костный мозг начинает вырабатывать слишком много дефектных лимфоцитов. Эти клетки, называемые бластами, несут в себе аномальный генетический материал и не могут бороться с инфекциями так же эффективно, как обычные клетки. Кроме того, бласты довольно быстро делятся и вскоре начинают вытеснять здоровые лейкоциты, эритроциты и тромбоциты из крови и костного мозга. Как результат, развивается анемия, инфекции, или даже легкое кровотечение.
Аномальные лимфоциты, характерные для острого лимфобластного лейкоза, довольно быстро разносятся кровотоком и могут затронуть жизненно-важные органы: лимфоузлы, печень, селезенку, центральную нервную систему, половые органы (яички у мужчин или яичники у женщин).
В Международном классификаторе болезней 10-го пересмотра выделяют три разновидности ОЛЛ:
C91.0 Острый лимфобластный лейкоз
C92 Миелоидный лейкоз [миелолейкоз]
C93.0 Острый моноцитарный лейкоз
Всемирная организация здравоохранения (ВОЗ) выделяет несколько разновидностей этого заболевания. Основывается оно на типе лейкоцитов, которые являются источниками бластных клеток:
Острый лимфобластный лейкоз у детей: причины
Онкологи выделяют несколько факторов, которые значительно повышают риск развития ОЛЛ у детей:
родной брат (сестра), перенесший лейкемию;
воздействие радиации или рентгеновских лучей до рождения;
лечение химиотерапией или другими препаратами, ослабляющими иммунную систему;
наличие некоторых наследственных заболеваний, таких как синдром Дауна;
определенные генетические мутации в организме.
У острого лимфобластного лейкоза есть несколько подтипов. Они зависят от трех факторов:
из каких лимфоцитов (группы B или T) начали образовываться бластные клетки;
наличие генетических изменений внутри клеток.
Симптомы острого лимфобластного лейкоза у детей
появление синяков и кровоподтеков;
темно-красные пятна под кожей;
узелки под мышками, на шее или в паху;
трудности с дыханием;
жалобы на боль в суставах;
общая слабость и быстрая утомляемость;
потеря аппетита и необъяснимая потеря веса.
Наличие этих симптомов может и не означать ОЛЛ и указывать на иное заболевание. Однако в любом случае что-либо из этого перечня уже повод обратиться к врачу.
Первым шагом в постановке диагноза ОЛЛ является осмотр и сбор семейного анамнеза. В первую очередь онколог проверит наличие характерных опухолей в районе шеи, проведет опрос о прошлых заболеваниях и лечении.
Однако, чтобы убедиться в наличии болезни, врачу потребуется анализ крови и костного мозга, а также, вероятно, образцы других тканей.
Наиболее распространенные методики:
Подсчет количества эритроцитов и тромбоцитов в крови, а также проверка количества и типа лейкоцитов и их внешний вид.
Биопсия и аспирация костного мозга – небольшой образец спинномозговой ткани и жидкости берется из бедренной кости или грудины. Затем он проверяется под микроскопом на наличие аномальных клеток.
Молекулярно-цитогенетический анализ. Он необходим, чтобы отследить аномалии в генетическом материале лимфоцитов.
Проточная цитометрия (иммунофенотипирование). Исследуются определенные характеристики клеток пациента. При ОЛЛ помогает определить, с чего началось появление бластов – T-лимфоцитов или B-лимфоцитов.
Помимо этих анализов могут быть и дополнительные лабораторные тесты. Онколог также может назначить другие процедуры, чтобы определить, распространился ли рак за пределы крови и костного мозга. Эти результаты будут важны, чтобы спланировать курс лечения.
Дополнительные тесты могут включать в себя:
рентген грудной клетки, компьютерную томографию или УЗИ;
поясничную пункцию (забор спинномозговой жидкости из позвоночника).
Основные риски для детей с острым лимфобластным лейкозом
Лечение ОЛЛ может иметь долгосрочные последствия для памяти, способности к обучению и других аспектов здоровья. Помимо прочего это также может увеличить шансы развития иных онкологических заболеваний, особенно опухоли мозга.
ОЛЛ, как правило, очень быстро прогрессирует, если не приступить к лечению немедленно.
Как избежать острого лимфобластного лейкоза у детей
Медицине не известны способы профилактики ОЛЛ. Болезнь может развиваться и абсолютно здоровых малышей, которые до этого ничем не болели. О факторах рисках мы написали выше.
Лечение острого лимфобластного лейкоза у детей
Лечение ОЛЛ обычно проходит в несколько этапов:
Первый этап - индукционная терапия (лечение при помощи электромагнитных волн). Цель этой фазы - убить как можно больше бластных клеток в крови и костном мозге;
Второй этап – консолидирующая химиотерапия. Во время этой фазы необходимо уничтожить бласты, оставшиеся после первого этапа. Они могут быть неактивными, однако, обязательно начнут размножаться и вызовут рецидив;
Третий этап – поддерживающая терапия. Цель здесь та же самая, что и на втором этапе, но дозы лекарств значительно ниже. При этом поддерживающая терапия крайне важна, чтобы избавиться от негативных последствий химиотерапии.
На протяжении всего курса лечения у ребенка будут регулярно брать новые анализы крови и костного мозга. Это необходимо, чтобы выяснить насколько хорошо организм реагирует на лечение.
Стратегия борьбы с ОЛЛ будет варьироваться в зависимости от возраста ребенка, подтипа заболевания и степени риска для здоровья. В общих чертах для лечения острого лимфобластного лейкоза у детей используют пять видов лечения:
Лучевая терапия. Представляет собой метод лечения ионизирующей радиацией, которая убивает раковые клетки и останавливает их рост. Источником излучения может быть специальный аппарат (внешняя лучевая терапия) или радиоактивные вещества, доставляемые в организм или непосредственно к источнику раковых клеток (внутренняя лучевая терапия). При лечении ОЛЛ онкологи назначают лучевую терапию только в самых крайних случаях с высоким риском, поскольку радиация крайне негативно сказывается на развитии мозга, особенно у детей младшего возраста.
Таргетная (молекулярно-таргетная) терапия. Используется для целевого выявления и уничтожения раковых клеток без ущерба для всего организма. Препараты, называемые ингибиторами тирозинкиназы, блокируют фермент, который стимулирует рост бластных клеток, вызванный специфическими генетическими мутациями.
Кортикостероиды. Детям с ОЛЛ часто назначают курс кортикостероидных препаратов, таких как преднизон или дексаметазон. Однако у этих препаратов могут быть различные побочные эффекты, включая набор веса, повышение сахара в крови, опухание лица.
Новым подходом при лечении острого лимфобластного лейкоза у детей является так называемая CAR-T терапия, или адаптивная клеточная терапия. Препарат изготавливается из крови самого пациента. Клетки модифицируются таким образом, чтобы позволить им идентифицировать аномальные бластные клетки и устранить их.
Нужно понимать, что лечение острого лимфобластного лейкоза всегда рискованно и сопровождается множеством побочных эффектов. Они могут включать:
Острые лейкозы у детей — наиболее частое злокачественное новообразование (38-40%), они обусловливают высокую летальность, уступая 1-е место среди причин смертностиудетей старше 2 лет лишь травмам.
Частота лейкозов составляет 3,2-4,4 случая на 100 000 детского населения.
Чаще болеют дети в возрасте 2-5 лет.
Острый лейкоз встречается в 95-98 % случаев, редко наблюдается хронический миелолейкоз (ХМЛ) (2-5 %). Хронический лимфолейкоз (ХЛЛ) у детей не описан.
По морфологическим критериям бластных клеток различают лимфобластные (ОЛЛ) и нелимфобластные (ОНЛЛ) варианты острого лейкоза (аналогично острым лейкозам взрослых).
В детском возрасте чаще встречаются лимфобластные варианты острого лейкоза (78-80%).
Нелимфобластные варианты более характерны для детей старшего возраста и составляют 17-20%, ау детей раннего возраста — до 40%.
Выделяют иммунные подварианты заболевания. Различные морфологические варианты острых лейкозов характеризуются специфическими хромосомными аномалиями, что важно для дифференциальной диагностики и прогноза заболеваний.
При назначении лечения при остром лейкозе у детей ориентируются на прогностические факторы. Первостепенное значение для прогноза имеет цитогенетический тип лейкоза.
Выделяют благоприятный, промежуточный и неблагоприятный прогноз заболевания. Наиболее разработаны прогностические факторы, влияющие на выживаемость больных при ОЛЛ у детей (табл. 12.1).
Таблица 12.1. Прогностические факторы при остром лимфобластном лейкозе

При остром нелимфобластном лейкозе (ОНЛЛ) у детей, так же как и у взрослых, для прогноза имеет значение морфологический вариант, иммунофенотипические признаки бластных клеток и хромосомные аберрации.
Химиотерапия острого лимфобластного лейкоза
В настоящее время широко используется терапия острого лимфобластного лейкоза по программам БФМ, предусматривающим интенсификацию на всех этапах лечения.
Программа ОЛЛ-мБФМ 90 (стандартный и средний риск — больные ОЛЛ с благоприятным и промежуточным прогнозом)
Дексаметазон — 10 мг/м2 внутрь в 1-21-й день с отменой за 2-3 дня.
Винкристин — 1,5 мг/м2 в/в в 8, 15, 22 и 29-й дни.
Доксорубицин — 30 мг/м2 в/в в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 10 000МЕ/м2в/вв 8, 11, 15 и 18-й дни.
Циклофосфамид — 1000 мг/м2 в/в капельно + месна в 36-й день.
Цитозин-арабинозид — 75 мг/м2 в/в капельно в 38-41-й и 45-48-й дни.
Тиогуанин — 60 мг/м2 внутрь в 36-49-й день.
Лучевая терапия на область головного мозга 12 Гр (при стандартном риске не проводится).
Поддерживающая терапия в ремиссии (до 104-й недели от начала лечения) 6-меркаптопурин — 40 мг/м2/сут внутрь. Метотрексат — 20 мг/м2/нед. внутрь.
Программа ОЛЛ-мБФМ 95 (для детей со стандартным и средним риском острого лимфобластного лейкоза) имеет следующие особенности в сравнении с программой ОЛЛ-мБФМ 90.
Больным со стандартным и средним риском ОЛЛ:
1) в протоколе I L-аспарагиназа вводится в меньшей дозе (в/в 5000 МЕ/м2);
2) лучевая терапия не проводится (за исключением больных с Т-клеточным острым лимфобластным лейкозом — 12 Гр и при инициальном поражении ЦНС — 18 Гр).
Больным со средним риском ОЛЛ:
1) в протокол М добавляется цитозин-арабинозид 200 мг/м2/сут, вводимый в течение 24 ч (9, 23, 37 и 51-й дни). Препарат применяется сразу же после окончания инфузии метотрексата;
2) в поддерживающей терапии используются реиндукционные курсы (в течение 7 дней) 1 раз в 2 мес.:
Дексаметазон — 6 мг/м2 внутрь ежедневно.
Винкристин — 1,5 мг/м2 в/в еженедельно, всего 2 раза.
Мальчикам со стандартным риском ОЛЛ поддерживающее лечение 6-меркаптопурином и метотрексатом проводится до 156-й недели от начала лечения.
Программа ALL IC-BFM 2002 в сравнении с предыдущими программами у больных со стандартным и средним риском ОЛЛ характеризуется следующим:
1) стратификация больных осуществляется на основании первичного уровня лейкоцитов, возраста, данных цитогенетики и степени санации костного мозга к 15-му дню терапии;
2) в протоколе I уменьшено количество введений даунорубицинау пациентов из стандартной группы риска;
3) в протоколе М доза метотрексата в основном составляет 2000 мг/м2, за исключением больных с Т-клеточным острым лимфобластным лейкозом, получающих метотрексат 5000 мг/м2.
Индукция ремиссии (30 дней)
Преднизолон — 60 мг/м2 внутрь в 1-22-й день.
Винкристин — 1,5 мг/м2 в/в в 8, 15, 22 и 29-й дни.
Даунорубицин (Рубомицин) — 30 мг/м2 в/в в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 10 000 МЕ/м2 в/в в 12, 15, 18, 21, 24 и 27-й дни.
Метотрексат — эндолюмбально в 0,18 и 30-й дни: в возрасте 1 года — 8 мг, > 2 лет — 10 мг, > 3 лет — 12 мг.
Перерыв 2 нед., затем проведение 9 блоков Rl-M, R2-M и R3 последовательно с интервалом 2 нед.
Дексаметазон — 20 мг/м2 внутрь в 1-6-й день.
Винкристин — 1,5 мг/м2 в/в в 1-6-й день.
L-аспарагиназа — 20 000 МЕ/м2 в/в в 6-й день.
Метотрексат — 1 г/м2 в/в капельно (10% дозы в течение 30 мин, 90% дозы в течение 23 ч 30 мин) в 5-й день.
Лейковорин — 15 мг/м2 в/в через 48 и 54 ч от начала введения метотрексата.
Цитозар — 2 г/м2 в/в капельно каждые 12 ч в 4-й день.
6-меркаптопурин — 100 мг/м2 внутрь в 1-5-й день.
Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения у детей в зависимости от возраста даны в табл. 12.2.
Таблица 12.2. Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения

Дексаметазон — 20 мг/м2 внутрь в 1-5-й день.
6-меркаптопурин (6-тиогуанин) — 100 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 в/в в 1-й день за 1 ч до введения метотрексата.
Рубомицин — 50 мг/м2 в/в капельно 24-часовая инфузия в 4-й день.
Метотрексат — 1 г/м2 в/в капельно (10% дозы в течение 30 мин, 90% дозы в течение
23 ч 30 мин) в 1-й день.
Лейковорин — 15 мг/м2 в/в через 48 и 54 ч от начала введения метотрексата. Ифосфамид — 400 мг/м2 в/в капельно в 1-5-й день.
L-аспарагиназа — 25 000 МЕ/м2 в/в в 6-й день.
Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения у детей в зависимости от возраста — см. табл. 12.2.
Дексаметазон — 20 мг/м2 внутрь в 1-6-й день.
Цитозар — 2 г/м2 в/в капельно каждые 12 ч в 1-й и 2-й дни.
Этопозид — 150 мг/м2 в/в капельно в 3-5-й день.
L-аспарагиназа — 25 000 МЕ/м2 в/в в 6-й день.
Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения у детей в зависимости от возраста — см. табл. 12.2.
После 9 блоков лучевая терапия на область головного мозга 12 Гр. Поддерживающая терапия в ремиссии (104 нед.)
6-меркаптопурин — 50 мг/м2/сут внутрь.
Метотрексат — 20 мг/м2/нед. внутрь.
Программа ОЛЛ-мБФМ 95 (для детей с высоким риском ОЛЛ) имеет следующие особенности по сравнению с программой ОЛЛ-мБФМ 90:
1) индукция ремиссии аналогична протоколу мБФМ-90, а затем проводится лечение 6 блоками последовательно (HR-1, HR-2, HR-3) с интервалом в 2 нед.;
В сравнении с предыдущими программами у больных со стандартным и средним риском ОЛЛ, а также из группы высокого риска осуществляют две фазы протокола I, а не одну, как в BFM ALL 95.
С целью консолидации проводится 6 блоков XT (HR1, HR2 и HR3), после которых следует протокол II. В каждом блоке увеличена доза L-аспарагиназы до 25000 МЕ/м2, которая вводится 2 раза — в 6-й и 11-й дни.
Показания к аллогенной трансплантации костного мозга у больных с высоким риском развития рецидива следующие:
1) отсутствие ремиссии к 33-му дню терапии;
2) плохой ответ на преднизолон в сочетании со следующими факторами: Т-линейный или про-В иммунный подвариант, лейкоцитоз периферической крови более 100 х 109/л, изменения генетические и молекулярно-биологические: t(9;22) или BCR/ABL; t(4;11) или MLL/AF4;
3) состояние МЗ костного мозга к 15-му дню индукции ремиссии у детей с высоким риском рецидива;
4) хороший ответ на преднизолон при наличии t(9;22) или BCR/ABL.
Общие принципы лечения рецидивов
Спинномозговая пункция позволяет диагностировать поражение нервной системы даже в отсутствие клинической симптоматики. При анализе ликвора в качестве нормы принимаются следующие показатели: цитоз 0-6 лимфоцитов/мкл, белок 0,2-0,3%, сахар 50-75 мг%, мочевая кислота 0,2-0,5 мг (по методике Мюллера-Зейферта).
При увеличении количества ядерных элементов в ликворе следует думать о нейролейкозе, чаще всего в этих случаях повышен и уровень белка. Однако возможны случаи, когда клинически имеются неврологические симптомы, а в ликворе отсутствует цитоз. При этом следует обращать внимание на увеличение количества белка.
ЦНС статус I (негативный):
■ Нет клинических проявлений поражения центральной нервной системы (ЦНС).
■ Нет данных за поражение ЦНС по результатам компьютерной томографии (КТ) / магниторезонансной томографии (МРТ).
■ Нормальное глазное дно.
■ В ликворе полностью отсутствуют бластные клетки. ЦНС статус II (негативный):
■ Бласты в ликворе не определяются. Соотношение эритроцитов и лейкоцитов 100:1 по препаратам, сделанным на цитоспине. Количество клеток в 1 мл ликвора не превышает 5. Пункция визуально не была травматичной.
■ Определяются лимфобласты, но соотношение эритроцитов и лейкоцитов более 100:1 по препаратам, сделанным на цитоспине. Данное соотношение эритроцитов и лейкоцитов рассматривается как результат травматичной пункции (ликвор был контаминирован кровью).
■ Травматичная пункция (ликвор на глаз контаминирован кровью). Количество лейкоцитов в 1 мл ликвора более 50.
ЦНС статус III (позитивный):
■ Массивное поражение мозга или мозговых оболочек по данным КТ/МРТ.
■ Лейкозное поражение сетчатки даже при отсутствии бластов в ликворе.
■ Нетравматичная люмбальная пункция, более 5 клеток в 1 мл ликвора, при этом большинство клеток по данным цитологического исследования (цитоспин) — бласты.
■ Если контаминация ликвора кровью сомнительная, лейкозное поражение ЦНС должно быть констатировано при следующих показателях:
а) более 5 клеток в 1 мл ликвора + большинство из них бласты (цитоспин) + соот-
ношение лейкоцитов к эритроцитам 100:1 (ЦИТОСПИН);
б) более 5 клеток в 1 мл ликвора + более высокий процент бластов в ликворе, чем в периферической крови (цитоспин).
При исследовании ликвора методом иммунофореза с полимеразной цепной реакцией (ПЦР) при первичной диагностике ОЛЛ у всех детей выявляется наличие бластов в ликворе даже в случаях отрицательного результата при цитологическом исследовании.
С целью диагностики поражения нервной системы проводятся также дополнительные исследования: рентгеновская КТ, МРТ, электроэнцефалограмма (ЭЭГ) и ЭхоЭЭГ.
В случаях нейролейкоза эндолюмбально вводят метотрексат (12 мг) или метотрексат в сочетании с цитарабином (30 мг) и преднизолоном (10 мг) до получения трех нормальных анализов спинномозговой жидкости. В последующем рекомендуется эндолюмбальное введение химиопрепаратов 1 раз в 1-1,5 мес с целью поддерживающей терапии.
Одновременно проводят высокодозную системную химиотерапию (XT) (программа мБФМ для больных с рецидивом ОЛЛ). При показаниях с терапевтической целью осуществляют повторную гамма-терапию на область головного мозга (суммарна очаговая доза (СОД) 30 Гр).
Химиотерапия острых нелимфобластных лейкозов
С целью индукции ремиссии применяется два курса XT: AIE и НАМ.
Цитозин-арабинозид (Ага-С) — 100 мг/м2/сут в/в 48-часовая инфузия в 1-й и 2-й дни.
Ага-С — 100 мг/м2 в/в 30-минутная инфузия каждые 12 ч в 3-8-й день.
Идарубицин — 12 мг/м2/сут в/в в 3, 5 и 7-й дни.
Этопозид — 150 мг/м2/сут в/в 30-минутная инфузия в 6-8-й день.
Ага-С — эндолюмбально в 1-й и 8-й дни: в возрасте 3 лет — 40 мг.
Ага-С — 3 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Митоксантрон — 10 мг/м2 в/в 30-минутная инфузия через 3 ч после окончания Ага-С в 3-й и 4-й дни.
Ага-С — эндолюмбально в 6-й день: в возрасте 3 лет — 40 мг.
С целью консолидации проводят еще 2 курса из нижеперечисленных.
Ага-С — 500 мг/м2/сут в/в 96-часовая инфузия в 1-4-й день.
2-хлордеоксиаденозид (2-CDA) — 6 мг/м2/сут в/в 30-минутная инфузия в 1-й и 3-й дни.
Идарубицин — 7 мг/м2/сут в/в 60-минутная инфузия в 3-й и 5-й дни.
Ага-С — эндолюмбально в 1-й и 6-й дни: в возрасте 3 лет — 40 мг.
Ага-С — 500 мг/м2/сут в/в 96-часовая инфузия в 1-4-й день.
Идарубицин — 7 мг/м2/сут в/в 60-минутная инфузия в 3-й и 5-й дни.
Ага-С — эндолюмбально в 1-й и 6-й дни: в возрасте 3 лет — 40 мг.
Ага-С — 1 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Митоксантрон — 10 мг/м2 в/в 30-минутная инфузия через 3 ч после окончания Ага-С в 3-й и 4-й дни.
Ага-С — эндолюмбально в 1-й и 6-й дни: в возрасте 3 лет — 40 мг.
Ага-С — 3 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Этопозид (VP-16) — 125 мг/м2 в/в 60-минутная инфузия через 3 ч после окончания Ага-С во 2-5-й день.
Ага-С — эндолюмбально в 1-й день: в возрасте 3 лет — 40 мг.
Ага-С — 1 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Этопозид (VP-16) — 125 мг/м2 в/в 60-минутная инфузия через 3 ч после окончания Ага-С во 2-5-й день.
Ага-С — эндолюмбально в 1-й день: в возрасте 3 лет — 40 мг.
Г-КСФ (Граноцит или Нейпоген) — 5 мкг/кг/сут п/к в 1-7-й день.
Флударабин (Флудара) — 30 мг/м2 в/в капельно 30-минутная инфузия во 2-6-й день. Препарат развести в концентрации, не превышающей 1 мг/мл.
Ага-С — 2 г/м2/сут в/в капельно 4-часовая инфузия во 2-6-й день. Препарат развести в 200 мл 0,9% раствора натрия хлорида. Инфузию начать через 4 ч от окончания введения флударабина.
Ага-С — эндолюмбально в 1-й день: в возрасте 3 лет — 40 мг.
Поддерживающая терапия (до 78-й недели от начала терапии индукции ремиссии) 6-меркаптопурин — 40 мг/м2/сут внутрь ежедневно.
Ага-С — 40 мг/м2 в/в 1 раз в сутки 4-дневным курсом каждые 28 дней.
Лейкоз у детей – патологический процесс в красном костном мозге, который отвечает за выработку клеток крови (эритроцитов, лейкоцитов, тромбоцитов). Заболевание, известное как белокровие или лейкемия, возникает вследствие образования опухолевой ткани. Треть всех злокачественных опухолей, возникающих у детей до 15 лет – лейкоз.

Происходит нарушение количественного баланса кровяных клеток, отклонение от нормы. Эритроцитов стает больше. А из незрелых клеток, отвечающих за кроветворение, или из созревающих образуются злокачественные опухоли. Они называются лейкозами.
Из-за того, что проблема связана с лейкоцитами (белыми тельцами), данное заболевание еще называют болезнью белой крови.
Симптомы
Клиника и симптомы заболевания дают о себе знать постепенно. Приблизительно через два месяца после начала болезни, больные дети уже жалуются на первые симптомы недомогания. Важно, чтобы родители не игнорировали непонятное изменение поведения ребенка. Первые признаки помогут на ранних стадиях выяснить причины болезни, точнее составить прогноз по заболеванию, определить хронический это вид или острый, первичный или вторичный.
Клиника или симптомы лейкемии, которые могут иметь больные дети на начальных стадиях:
- частая усталость, слабость;
- рвота;
- безразличие к играм;
- отказ общаться со сверстниками;
- отсутствие аппетита;
- нарушение сна;
- плохая сворачиваемость крови;
- частые заболевания простудой;
- частое повышение температуры.

После того, как у малыша проявятся первые свидетельства недуга, позднее диагностируются другие, более выраженные, симптомы и признаки:
- регулярная боль в позвоночнике, ногах (болевые очаги постоянно меняют место своего проявления), могут ошибочно говорить о признаках полиартрита;
- увеличение печени, селезенки;
- увеличение лимфоузлов
- побледнение кожи;
- одышка;
- потеря веса;
- часто появляются синяки.
После дополнительного обследования могут быть выявлены другие симптомы наличия лейкоза. Анализ крови покажет:
- снижение уровня тромбоцитов, эритроцитов;
- повышенные показатели скорости оседания эритроцитов (СОЭ);
- наличие бластных тел.
Если анализ крови показывает наличие бластных тел – это верный признак лейкемии. В крови здорового ребенка бластов (лейкозных клеток) быть не должно. Анализ может показать большое количество лейкоцитов, но окажется, что на самом деле это бласты – они очень похожи.
Чтобы уточнить диагноз, потребуется сделать пункцию костного мозга.
Эта процедура поможет врачам не опираться только на клинические симптомы, но точно определить форму лейкоза и назначить адекватный курс лечения. Только тогда можно будет сделать прогноз касательно дальнейшего состояния больного.

Появление различных воспалений, повышенная температура, которую не в состоянии сбить даже антибиотик – верные признаки лейкоза.
Высокая температура – наиболее типичное клиническое проявление болезни (вместе с другими конкретными свидетельствами).
При первичном лейкозе опухоль зарождается в красном костном мозге. Затем кровоток распространяет опухолевые ткани по всему организму.
При вторичном – источником опухоли может быть любой орган, затем раковые клетки через кровь попадают в костный мозг.
Острый лейкоз у детей – быстро прогрессирует, подразделяется на лимфобластный и миелобластный.
Острый лимфобластный лейкоз у детей – наиболее распространенное злокачественное заболевание, когда вырабатывается множество разновидностей лейкоцитов. Факторы развития острого лимфобластного лейкоза у детей:
- мужской пол;
- возраст 2-5 лет;
- восприимчивость плода в утробе матери к диагностическому рентгеновскому облучению;
- воздействие лучевой терапии;
- заболевание синдромом Дауна;
- заболевание синдромом Блума, Швахмана-Даймонда, Ниймеген;
- наличие нейрофиброматоза I типа;
- большая масса плода при рождении.
Острый миелобластный лейкоз – вырабатывается множество аномальных кровяных клеток. Происходит процесс преобразования миелоидных стволовых клеток в незрелые лейкоциты, получившие название миелоидных бластов (миелобластов).
Из-за увеличения количества миелобластов здоровые клетки вытесняются. Миелоидные клетки распространяются по организму, оседают в его различных частях, поражая даже центральную нервную систему. Иногда аномальные образования приводят к появлению гранулоцитарной саркомы.
Хронический лимфолейкоз – прогрессирует медленно. Также как острый лейкоз, хронический подразделяется на лимфобластный и миелобластный.
Хронический лимфобластный лейкоз – медленно протекающее заболевание, сопровождающееся выработкой большого количества лейкоцитов.
Хронический лимфолейкоз отличается тем, что на ранних стадиях болезнь себя не проявляет, что усложняет диагностирование. Хронический вид лейкоза детей случается крайне редко. Основная возрастная группа риска, у которых диагностируют симптомы заболевания – люди старше 40.
Хронический миелобластный лейкоз – наиболее часто проявляется у детей старшего возраста. Из всех видов заболевания этот – случается у 3% больных. Причина его появления у детей не ясна. Известна единственная причина, по мнению медиков – воздействие ионизирующего излучения.

В зависимости от того, какие клетки стали причиной болезни, так и будет называться вид лейкоза. Лимфобластный лейкоз возникает из-за патологии лимфоцитов, миелоидный – проблем с подгруппами белых кровяных телец, гранулоцитами или моноцитами.
Практически каждый случай лейкемии у детей протекает в острой форме. В возрасте до двух лет дети заболевают миелоидным лейкозом, после двух – чаще случается лимфобластный.
Общие причины
Почему маленькие дети болеют лейкемией? Причины лейкоза у детей современная медицина не может однозначно объяснить. Общей причиной называют генетические нарушения клеток мозга, отвечающих за кроветворение.
Вместо того, чтобы вырабатывать в нужной пропорции необходимые крови клетки, костный мозг производит аномальные клетки-мутанты, которые незамедлительно распространяются по всему телу через кровоток. Таким образом, организм ребенка быстро заполняют раковые клетки и ведут деструктивную деятельность.
Факторы, приводящие к появлению лейкемии:
- наследственность или нарушения на генетическом уровне;
- радиоактивное излучение
- повышенная солнечная активность из-за озоновых дыр;
- плохая экология;
- вирусы, нарушающие структуру ДНК;
- вредные привычки (включая пассивное курение).
Диагностика
Диагностика лейкоза осуществляется путем наблюдения за основными видимыми проявлениями заболевания. Полная, всеобъемлющая диагностика возможна благодаря следующему комплексу процедур:
- общий и биохимический анализ крови;
- общий анализ мочи;
- рентгенография;
- ультразвуковое исследование;
- компьютерная томография;
- биопсия лимфоузлов;
- спинномозговая пункция;
- пункция красного костного мозга.
Лечение
Лечение лейкоза – очень сложное, ответственное дело, должно осуществляться в специализированных медицинских центрах, клиниках. В последнее время было замечено, что процент успешного лечения лейкемии у детей увеличился. Почему? Успех обусловлен повышением квалификации персонала, а также фактом, что у детей данный недуг лечится легче, чем у взрослых.
Основные методы лечения лейкоза следующие: облучение, химиотерапия, таргентная терапия и пересадка костного мозга.
Лечение посредством облучения заключается в уничтожении злокачественных клеток и опухолей. Данный способ также используют как профилактику развития заболевания в будущем.
Химиотерапия требует назначения малышу курса лечения оральными препаратами одновременно с введением лекарств через вену, ткани мышц или спинномозговую жидкость. Химиотерапия, как курс лечения, назначается с периодичностью в 2-3 года.
Таргентная терапия – прием медицинских препаратов, способных блокировать рост и дальнейшее распространение злокачественных клеток. Задача препарата деструктивно воздействовать на молекулы, которые находятся непосредственно в лейкозной клетке.
В отличие от других способов лечения, таргентная терапия оказывает гораздо меньшее негативное воздействие на остальные клетки организма, не тронутые лейкозом. При некоторых видах детского лейкоза данный метод лечения эффективен и не имеет ярко выраженных побочек.

К пересадке прибегают тогда, когда облучение, химиотерапия, таргентная терапия, как основные методы лечения лейкоза у детей, не повлияли на течение заболевания. После сеансов химиотерапии или облучения, уничтожающих существующий костный мозг, применяют метод пересадки здорового. После замены клеток мозга корень проблемы устранен.
Каков дальнейший прогноз по состоянию здоровья и жизни получат больные дети после этой процедуры – может сказать только лечащий врач, достаточно изучивший проблему. Постоянно подвергаясь различным видам терапии при лечении лейкемии, организм станет ослабленным. Чтобы не усугублять его состояние, ребенку рекомендуется диета.
Прогноз
Если у ребенка острый лейкоз, анализ заболевания обычно гарантирует более благоприятный прогноз. Как показывает статистика, у детей до 15 лет состояние улучшается в 94% случаев. У детей же, которые старше 15 лет, прогноз ремиссии не высокий – 80%. Выживаемость детей с различными видами заболевания спрогнозировать сложно.

Врачи делают следующий прогноз: дети, больные острым лимфобластным лейкозом, в течение пяти лет выживают в 85% от общего числа случаев, миелоидным – в 45%.
Но, эта статистика с течением времени меняется. На то, насколько верным будет прогноз, влияют несколько факторов – характер заболевания, быстрота реакции родителей на признаки болезни, а также анализ общего состояния организма малыша.
Тем, кто здоров, но знает о случаях лейкоза в своей семье, можно ставить прогноз возможности заболеть этим недугом – 50х50. Также высока вероятность возникновения лейкоза, если ребенок проходил курс лечения другого заболевания с применением облучения.
Сейчас на статью оставлено число отзывов: 85 , средняя оценка: 4,08 из 5
Читайте также:

