Анализ на мутацию генов при лейкозе
К концу 80-х — началу 90-х годов XX в. были накоплены данные, свидетельствующие о том, что определенные хромосомные изменения, обнаруженные до начала терапии острого нелимфобластного лейкоза, могут иметь прогностическое значение. Этот вывод подтвержден большими многоцентровыми исследованиями самых последних лет.
Необходимо подчеркнуть, что если речь идет о прогностическом значении того или иного показателя при любом новообразовании, как правило, имеется в виду ответ на лечение.
При использовании конкретных терапевтических программ 70 % больных острыми нелимфобластными лейкозами и с прогностически благоприятными аномалиями кариотипа имеют шанс пережить пятилетний рубеж; в группе с неблагоприятным прогнозом этот шанс значительно ниже (5—15 %).
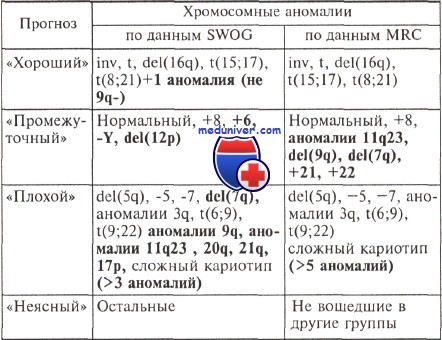
Некоторые противоречия в оценке прогностического значения хромосомных аномалий при остром миелолейкозе (ОМЛ) иллюстрирует таблица. В этой таблице представлена ретроспективная оценка результатов лечения больных острым миелолейкозом (609 человек) по данным SWOG (США) и MRC (Европа).
Приведенные данные и ряд других публикаций свидетельствуют о необходимости продолжения исследований, направленных на выяснение прогностического значения отдельных первичных и вторичных хромосомных аномалий. Такие исследования должны проводиться на больших сериях одинаково леченых больных.
В последние годы появились факты, свидетельствующие о том, что наряду с особенностями кариотипа ряд лабораторных показателей может оказаться полезным для прогноза острого миелобластного лейкоза. К прогностически неблагоприятным показателям относятся следующие: исходно высокий уровень лейкоцитов в крови, экспрессия антигена CD56 на бластных клетках, более 10 % бластных элементов в костном мозге на 14—21-й день лечения, присутствие некоторых дополнительных аномалий кариотипа до начала терапии, экспрессия маркера FLT3/ITD на бластных клетках.
Неблагоприятное прогностическое значение экспрессии антигена CD56 на поверхности миелобластов продемонстрировано неоднократно. Так, при обследовании 29 больных с t(8;21) М. R. Ваег и соавт. обнаружили, что частота и продолжительность полных ремиссий в группе больных с CD56-позитивными бластами достоверно ниже, чем в группе пациентов, у которых бласты CD56-негативные.
Аналогичные результаты получены C. K. Myrray и соавт. при изучении группы пациентов с промиелоцитарным лейкозом и характерной t(15;17): у больных с экспрессией антигена CD56 были обнаружены более низкие показатели выживаемости по сравнению с пациентами, у которых этот антиген не экспрессировался.
В публикациях 2001 г. приводятся весомые доказательства в пользу неблагоприятного прогностического значения мутаций гена FLT3. Мутантный ген используется как один из маркеров лейкозных клеток. По данным S. Meshinchi и соавт., в группе детей с ОМЛ, у которых лейкозные клетки были маркированы мутантным геном FLT3/ITD, ремиссии удавалось достичь значительно реже, чем при лейкозах без этой мутации (40 и 74 % случаев соответственно).
Общая выживаемость оказалась существенно ниже в группе пациентов с названной мутацией. Прогностическое значение мутаций гена FLT3 при остром миелобластном лейкозе с различными аномалиями кариоти-па изучается во многих зарубежных лабораториях.
С помощью различных молекулярно-биологических методик показано, что эта группа генетически гетерогенна, однако прогностическое значение отдельных конкретных мутаций еще недостаточно изучено. Некоторые характерные субмикроскопические перестройки уже обсуждались, в частности инсерции при ОПЛ (5—10 % случаев от всех ОМЛ с нормальным кариотипом), субмикроскопические перестройки различных генов, в частности гена MLL. Присутствие последних прогностически неблагоприятно. Обнаружены и другие повторяющиеся субмикроскопические изменения при ОМЛ. Их прогностическое значение еще предстоит установить.
В 2002 г. опубликованы результаты большого многоцентрового исследования, проведенного в США и посвященного уточнению роли хромосомного анализа в прогнозировании острого нелимфобластного лейкоза. ОПЛ был исключен, поскольку проводился анализ лечения пациентов, получивших одинаковую индукционную терапию, а больных ОПЛ, как известно, лечат иначе. Клинико-цитогенетические сопоставления проведены у 1213 пациентов. Оценивали частоту полных ремиссий, кумулятивный риск рецидива за пятилетний период и общую выживаемость.

Итоговые результаты этой работы суммированы в таблице и близки показателям 1998 г. из публикации Европейской группы. Приведенные данные показывают необходимость дальнейшего изучения вопроса о прогностическом значении особенностей кариотипа при остром нелимфобластном лейкозе.
Молекулярно-биологическое исследование, направленное на выявление точечных мутаций в гене BCR-ABL, которые могут обуславливать резистентность хронического миелолейкоза к некоторым ингибиторам тирозинкиназ.
Определение мутаций киназного домена BCR-ABL.
BCR/ABL1, Tyrosine Kinase Inhibitor Resistance, Kinase Domain Mutation Screen; Kinase domain mutation, ABL.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Хронический миелолейкоз является опухолевым заболеванием кроветворной системы, в результате которого в периферической крови наблюдается повышение уровня определенного вида лейкоцитов. Развитие заболевания связано с возникновением в стволовой клетке крови генетической аномалии, которая получила название филадельфийской хромосомы. У человека на девятой хромосоме локализуется ген ABL, который кодирует образование белка, стимулирующего рост и деление клеток. При хроническом миелолейкозе часть гена ABL перемещается на хромосому 22, такая мутация называется транслокацией. Место разрыва 22-й хромосомы, куда чаще всего встраивается перемещенная часть гена ABL, называется M-bcr (от английского major breakpoint claster region). В норме в этом участке хромосомы расположен ген BCR, кодирующий белок, функция которого в настоящее время достоверно не изучена, однако есть сведения, что он участвует в процессах деления и дифференцировки клеток. В результате транслокации на 22-й хромосоме образуется сливной, или химерный, ген BCR-ABL, при считывании информации с которого продуцируется белок р210. От части гена ABL этот белок получает способности тирозинкиназы – внутриклеточного фермента, участвующего в передаче сигналов пролиферации, а часть, кодируемая геном BCR, способствует его активации. Таким образом, в результате описанной мутации на 22-й хромосоме формируется ген, белковый продукт которого – тирозинкиназа с повышенной активностью – стимулирует деление клеток с полной независимостью от внешних регуляторных механизмов. Лейкозные клетки становятся нечувствительными к сигналам самоуничтожения, приобретают способность выходить из костного мозга в периферическую кровь, не дожидаясь созревания.
В первое время лейкозные клетки полностью контролируются геном BCR-ABL, они сохраняют способность к дифференцировке и функционируют практически полноценно. Однако в процессе течения заболевания ген BCR-ABL индуцирует нестабильность генома, вследствие неконтролируемой пролиферации возникают точечные мутации, в том числе в самом гене BCR-ABL. Некоторые мутации могут приводить к перестройке той части молекулы BCR-ABL-тирозинкиназы, к которой присоединяются таргетные лекарственные препараты, подавляющие её активность. В результате этого препарат теряет способность связываться с мутантной тирозинкиназой и ингибировать её. По этой причине, несмотря на продолжающийся постоянный прием лекарства, отмечается прогрессирование заболевания. К настоящему времени обнаружено свыше 50 различных мутаций гена BCR-ABL, которые могут обуславливать резистентность опухолевого клона к одному или нескольким ингибиторам тирозинкиназ.
Для чего используется исследование?
- Для выявления точечных мутаций в химерном гене BCR-ABL, которые могут менять структуру кодируемого им белка и приводить к резистентности к отдельным препаратам группы ингибиторов тирозинкиназ.
Когда назначается исследование?
- У пациентов с хронической фазой хронического миелолейкоза:
- неудача лечения в установленные контрольные временные точки: недостижение большого цитогенетического ответа к 3 месяцам терапии, недостижение большого молекулярного ответа к 12 месяцам терапии;
- любые признаки утраты ответа (гематологический или цитогенетический рецидив);
- повышение уровня BCR-ABL на 1 логарифм (в 10 раз) и утрата большого молекулярного ответа.
- При прогрессировании заболевания в фазу акселерации или бластного криза.
Что означают результаты?
Результат исследования представляет собой название обнаруженной мутации гена BCR-ABL и сведения о её влиянии на чувствительность к определенным ингибиторам тирозинкиназ.
- Исследование позволяет обнаружить только известные на настоящий момент мутации. В связи с этим отрицательный результат не означает отсутствие редкой, неизученной мутации гена BCR-ABL и, соответственно, резистентности к терапии, особенно если на это указывают другие клинические и лабораторные данные.
- Мутация T315I обуславливает резистентность ко всем существующим ингибиторам тирозинкиназ, кроме понатиниба.
- Помимо точечных мутаций гена BCR-ABL, есть и другие механизмы формирования резистентности к ингибиторам тирозинкиназ: активация дополнительных сигнальных путей, которые в обход BCR-ABL-тирозинкиназы усиливают деление и подавляют гибель опухолевых клеток, избыточное связывание препаратов с транспортными белками крови (например, связывание иматиниба с α1-кислым гликопротеидом приводит к повышению концентрации лекарства в плазме и снижению его поступления в опухолевые клетки), повышенная экспрессия белка множественной лекарственной устойчивости PGP (он подобно насосу выкачивает из цитоплазмы клеток лекарственные препараты). Таким образом, при отрицательных результатах исследования на мутации в гене BCR-ABL лечащий врач может порекомендовать дополнительное обследование для исключения других причин неэффективности терапии.
- Значимость выявленной мутации для смены ингибитора тирозинкиназ определяется исключительно лечащим врачом.
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с обязательной микроскопией мазка крови)
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
Литература
- Wintrobe’s clinical hematology / editors, John P. Greer, Daniel A. Arber, Bertil Glader, Alan F. List, Robert T. Means Jr., Frixos Paraskevas, George M. Rodgers. – 13th edition. Lippincott Williams & Wilkins, 2014. Pages 1711-1712.
- наследственная предрасположенность — чаще всего характерна для хронических лейкозов;
- радиационное поражение — одна из форм лучевой болезни;
- неблагоприятная экологическая обстановка — воздействие канцерогенных факторов;
- синдром иммунодефицита.
- миелобластная — стволовые клетки;
- монобластная — моноциты (агранулоциты);
- лимфобластная — лимфоциты (гранулоциты);
- эритромиелобластная — предшественники эритроцитов;
- мегакариобластная — тромбоциты (мегакариоциты);
- недифференцированная — ростки всех клеток крови.
- миелоцитарные, нейтрофильные, эозинофильные, базофильные, миелоидные, тромбоцитемические, эритремические;
- лимфоцитарные — лимфолейкоз, парапротеинемические формы — миеломная и болезнь Сезари, макроглобулинемия Вальденстрема, болезнь Франклина;
- моноцитарные, миеломоноцитарные, гистиоцитоз X.
- боли в костях и суставах;
- кровоточивость;
- увеличение лимфатических узлов, печени, селезенки;
- состояние иммунодефицита — снижение сопротивляемости к инфекциям;
- менингит и энцефалит вследствие метастазов в головной мозг;
- общие явления интоксикации, лихорадка, быстрое похудение, слабость.
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
![]()
![]()
![]()
![]()
- EGFR, ALK, BRAF — немелкоклеточный рак легкого;
- BRAF — меланома;
- HER2 — рак молочной железы (РМЖ);
- KRAS — колоректальный рак.
- мутации BRCA1, BRCA2 — рак молочных желез, яичников;
- мутации p53 — до 50% различных видов раковых опухолей, саркомы;
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Гематология: национальное руководство / под ред. О. А. Рукавицына. - М. : ГЭОТАР-Медиа, 2015. С. 381-398.
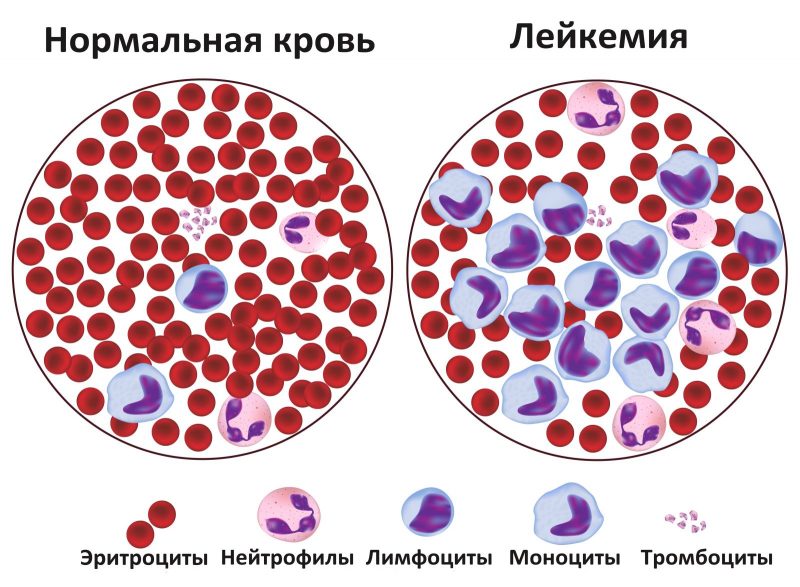
Кровь представляет собой жидкую ткань организма, которая состоит из красных и белых клеток. К первым относятся эритроциты и тромбоциты. Белые представлены гранулоцитами и агранулоцитами. Свое название они получили в результате микроскопического исследования: те клетки, в которых обнаружены гранулы, — гранулоциты. Соответственно, агранулоциты их не имеют. Каждая из фракций крови выполняет определенную функцию. При лейкозе нарушаются функции всех органов и систем человеческого организма.
В составе крови существует четкая пропорция соотношения красных клеток к белым. Ее изменение определяется как лейкоз, то есть разрастание клеток крови одного из ростков — белого или красного. Чаще всего опухолевым изменениям подвергаются белые ростки, поэтому лейкоз иначе называют лейкемией. Опухоль злокачественная, но не называется раком, потому что раковые клетки зарождаются только в эпителиальной ткани.
Причины развития лейкозов
Поражение ростков крови приводит к повреждениям зрелых клеток, которые имеют все признаки опухоли, следовательно, не выполняют полезных функций. Ростки называются мегалобластами, поэтому лейкозы имеют второе название — мегалобластозы. Их изменения происходят на генном уровне в результате необратимых мутаций. Этому способствуют следующие факторы:
Опухоль зарождается в красном костном мозге. По мере развития лейкоза опухолевые клетки замещают здоровые ростки кроветворения. Попадая в общий кровоток, они метастазируют во все органы и ткани организма. Продолжая размножаться на новых местах локализации, клетки вновь циркулируют по кровеносной системе. В зависимости от того, на каком этапе кроветворения происходит генная мутация, лейкозы подразделяются на острые и хронические.
Классификация лейкозов
Классификация гемобластозов основана на морфологических признаках. Острый лейкоз развивается при поражении унипотентной, стволовой клетки крови. Названия хронических форм зависят от того, какие зрелые клетки крови поражены опухолью. Острая форма лейкоза никогда не станет хронической, которая, в свою очередь, по характеру течения ничем не отличается от острой.
Формы острых лейкозов в зависимости от уровня поражения системы кроветворения:
Симптомы лейкоза:
Диагностика лейкозов
Диагностические критерии определяются в лаборатории. В зависимости от того, какая именно клетка поражена, выставляется верный диагноз. Генетические исследования позволяют определить стадию и тяжесть опухолевого процесса. Обнаружение экспрессии определенных групп генов и филадельфийской хромосомы имеет значение для выбора препаратов для химиотерапии и своевременного решения о трансплантации красного костного мозга.
Лечение лейкоза
Независимо от формы заболевания, в первую очередь производится уничтожение всех опухолевых клеток — как в месте образования, так и в метастазах. При лейкозах применяется химиотерапия цитостатиками — препаратами, прекращающими рост опухоли. Подбираются средства, к которым чувствительны злокачественные клетки крови. После курса химиотерапии при острых лейкозах производится трансплантация красного костного мозга или проводится повторный курс лечения цитостатиками такой же длительностью и в такой же дозировке. Третий курс химиотерапии — профилактический. При хронических формах лейкоза применяется оперативное лечение и радиотерапия.

Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Показания:
Генетические исследования в онкологии помогают решать важные задачи:
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Анализы для людей, у которых уже диагностирован рак
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Анализы для здоровых людей, направленные на оценку рисков
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Что показывает анализ?
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
Существуют ли противопоказания?
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Как происходит сдача анализа?
Насколько достоверны результаты?
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Что может повлиять на точность результата?
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.

Расшифровка анализа
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
Генетические исследования на рак в Европейской клинике
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь. Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению — сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента — не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют тестирование — определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида
2. Хромосомные аберрации.
Делеция — утрата участка хромосомы. Происходят обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё — этот ген в хромосоме больше не экспрессируется.
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы — в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Каждый этап клеточного цикла контролируется
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) — две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
опухоли (антионкогены) — напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация в результате мутации — резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Иматиниб связывается с активным участком молекулы белка , и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, , иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Кому это нужно?
В этом случае исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:





