Алкан с хлором при освещении
Несмотря на то, что алканы малоактивны, они способны на выделение большого количества энергии при взаимодействии с галогенами или другими свободными радикалами. Алканы и реакции с ними постоянно используют во многих сферах промышленности.
Факты об алканах
В органической химии алканы занимают важное место. Формула алканов в химии - CnH2n+2. В отличие от ароматических веществ, у которых есть бензольное кольцо, алканы считаются алифатическими (ациклическими).

Вам будет интересно: Чем отличается тушь от чернил: создание и применение в современном мире
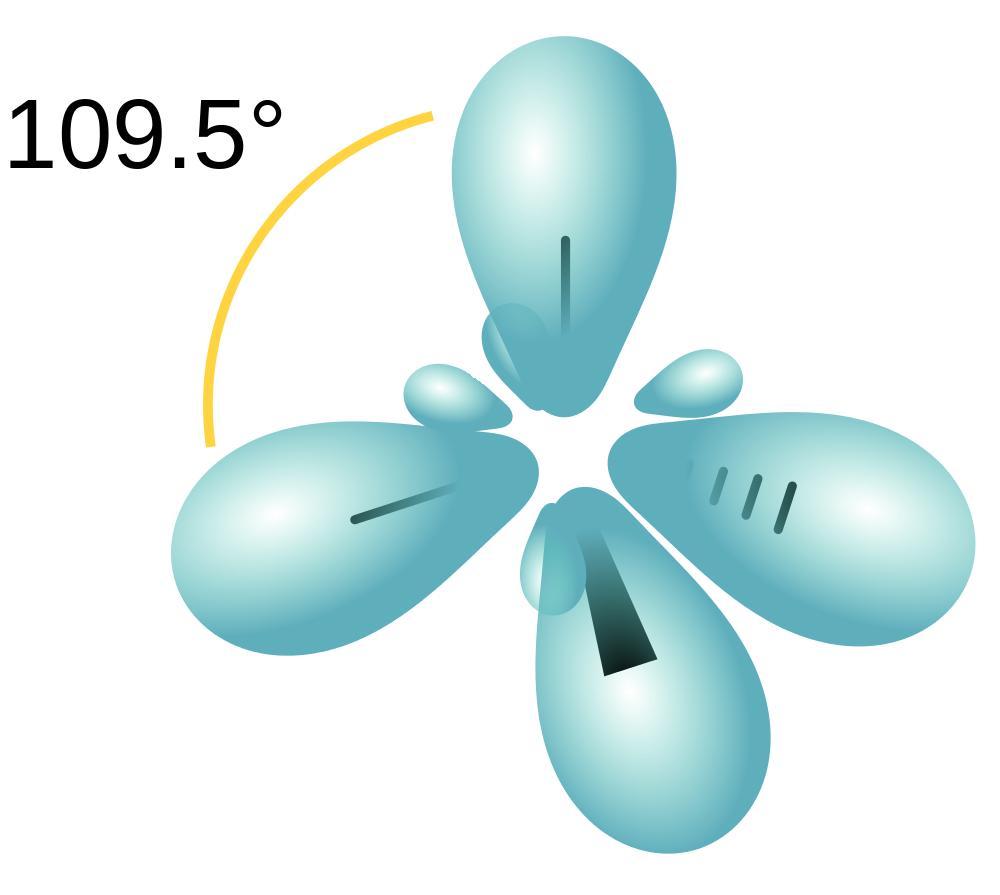
Алканы - насыщенные углеводороды. То есть в них находится максимальное количество атомов Н (водорода). Все атомы углерода в алкане состоят в положении sp3 – гибридизации. Это значит, что молекула алкана строится по правилу тетраэдра. Молекула метана (СН4) напоминает тетраэдр, а остальные алканы имеют зигзагообразную структуру.
Все атомы С в алканах соединены с помощью ơ – связи (сигма – связи). Связи С―С являются неполярными, связи С―Н – слабополярными.
Свойства алканов
Как уже говорилось выше, группа алканов обладает маленькой активностью. Связи между двумя атомами С и между атомами С и Н прочные, поэтому их сложно разрушить воздействием извне. Все связи в алканах являются ơ – связями, поэтому, если они разрываются, это обычно приводит к появлению радикалов.

Вам будет интересно: Что такое синтаксическое средство выразительности? Лексические и синтаксические средства выразительности
Галогенирование алканов
Ввиду особых свойств у связей атомов, алканам присущи реакции замещения и разложения. В реакциях замещения у алканов атомы водорода сменяют другие атомы или молекулы. Алканы хорошо реагируют с галогенами – веществами, находящимися в 17 группе периодической таблицы Менделеева. Являются галогенами фтор (F), бром (Br), хлор (Cl), йод (I), астат (At) и теннессин (Ts). Галогены очень сильные окислители. Они реагируют практически со всеми веществами из таблицы Д. И. Менделеева.
Реакции хлорирования алканов
На практике участие в галогенировании алканов принимают обычно бром и хлор. Фтор слишком активный элемент – с ним реакция будет взрывной. Йод - слабый, поэтому реакция замещения с ним идти не будет. А астата очень мало в природе, поэтому сложно собрать достаточное его количество для проведения экспериментов.
Стадии галогенирования
Все алканы проходят три стадии галогенирования:

Бромирование алканов
При галогенировании высших алканов, идущих после этана, сложность представляет образование изомеров. Из одного вещества под действием солнечного света могут образоваться разные изомеры. Происходит это в результате реакции замещения. Это доказательство того, что при галогенировании свободным радикалом может быть замещен любой атом Н в алкане. Сложный алкан распадается на два вещества, процентное содержание которых может сильно варьироваться в зависимости от условий реакции.

Бромирование пропана (2-бромпропан). При реакции галогенирования пропана молекулой Br2 под воздействием высоких температур и солнечного света выходят 1-бромпропан – 3 % и 2-бромпропан – 97 %.
Бромирование бутана. При бромировании бутана под действием освещения и высоких температур выходит 2 % 1-бромбутана и 98 % 2-бромбутана.
Различие хлорирования и бромирования алканов
Характер реакции хлорирования
При хлорировании алканов изомеры образуются примерно в равном количестве в своей массовой доле. Например, хлорирование пропана при катализаторе в виде повышения температуры до 454 градусов выдает нам 2–хлорпропан и 1-хлорпропан в соотношении 25 % и 75 % соответственно. Если реакция галогенирования проходит только при помощи ультрафиолетового излучения, 1–хлорпропана получается 43 %, а 2-хлорпропана – 57%. В зависимости от условий проведения реакции соотношение полученных изомеров может меняться.
Характер реакции бромирования
В результате реакций бромирования алканов легко выходит почти чистое вещество. Например, 1-бромпропан – 3 %, 2-бромпропан – 97% из молекулы н-пропана. Потому бромирование часто применяют в лабораториях для синтеза определенного вещества.
Сульфирование алканов
Алканы сульфируются также по механизму радикального замещения. Чтобы произошла реакция, на алкан одновременно воздействуют кислород и оксид серы SO2 (сернистый ангидрид). В итоге реакции алкан превращается в алкилсульфокислоту. Пример сульфирования бутана:
СН3СН2СН2СН3 + О2 + SO2 → CH3CH2CH2CH2SO2OH
Общая формула сульфоокисления алканов:
R―H + О2 + SO2 → R―SO2OH

Сульфохлорирование алканов
В случае сульфохлорирования вместо кислорода в качестве окислителя используется хлор. Таким способом получают алкансульфохлориды. Реакция сульфохлорирования привычна для всех углеводородов. Она происходит при комнатной температуре и солнечном освещении. Также в качестве катализатора применяют органические пероксиды. Такая реакция затрагивает только вторичные и первичные связи, относящиеся к атомам углерода и водорода. До третичных атомов дело не доходит, так как происходит обрыв цепи реакции.
Реакция Коновалова
Реакция нитрования, как и реакция галогенирования алканов, проходит по свободно-радикальному механизму. Проводят реакцию, используя сильно разбавленную (10 – 20 %) азотную кислоту (HNO3). Механизм реакции: в результате реакции алканы образуют смесь соединений. Для катализации реакции используют повышение температуры до 140⁰ и нормальное или повышенное давление окружающей среды. При нитровании разрушаются связи С―С, а не только С―Н в отличие от предыдущих реакций замещения. Это значит, что происходит крекинг. То есть реакция расщепления.
Реакции окисления и горения
По свободнорадикальному типу проходят и реакции окисления алканов. Для парафинов существует три вида переработки с помощью окислительной реакции.
В процессе окисления свободный радикал О2 полностью или частично замещает водородную составляющую. Полное окисление - это горение.

Хорошо сгорающие алканы используются как топливо для теплоэлектростанций и двигателей внутреннего сгорания. Горящие алканы производят очень много тепловой энергии. В двигатели внутреннего сгорания помещают сложные алканы. Взаимодействие с кислородом у простых алканов может привести к взрыву. Из продуктов отхода, образующихся в результате реакций с алканами, делают асфальт, парафин и различные смазки для промышленности.



Тема 6. Алканы. Реакции горения и галогенирования
- При сжигании 12,32 л смеси метана и пропана получили 34,72 л (н.у.) углекислого газа. Определите состав исходной смеси.
- Продукты полного сгорания 6,72 л (н.у.) смеси этана и пропана обработали избытком известковой воды. При этом образовалось 80 г осадка. Определите состав исходной смеси газов (в литрах).
- Для сжигания паров алкана объемом 20л потребовался кислород, объемом 160 л. Установите, какой алкан вступил в реакцию.
- При горении некоторого количества алкана образовалось 13,2 г углекислого газа. Вычислите массу воды, которая образовалась при этом.
- Имеется 28 л смеси пропана и кислорода с объемной долей пропана 10%. Вычислите массовые доли веществ в указанной смеси после ее сжигания и охлаждения.
- Углеводород имеет элементный состав: 85,714%С и 14,286% Н (по массе). При радикальном хлорировании этот углеводород образует два монохлорида – третичный и первичный. Определите строение исходного углеводорода и назовите его.
- При сгорании алкана образуется 94,08 л (н.у.) углекислого газа и 86,4 г воды. Определите его молекулярную формулу, приведите две его возможные структурные формулы и дайте названия по систематической номенклатуре.
- Смесь метана и кислорода с объемной долей метана 10% сожгли и продукты реакции охладили. Вычислите массовые доли веществ в образовавшейся смеси газов.
- Какой объем воздуха (н.у.), содержащего 20% по объему кислорода, необходим для сжигания 50 г смеси, состоящей из паров гептана, 2,4-диметилпентана и 2,2,3-триметилбутана?
- На полное сгорание 1 объема газа Х израсходовано 5 объемов кислорода. При этом соотношение масс образовавшихся углекислого газа и воды составило 4,89. Изобразите структурные формулы всех возможных Х, укажите, какие из них нестабильны.
- В каких объемных соотношениях следует смешать бутан с озонированным кислородом, имеющим плотность 1,785 г/л (в пересчете на н.у.), чтобы обеспечить полное сгорание углеводорода?
- Какой минимальный объем этана (измеренный при 25 °C и 1 атм) необходимо сжечь, чтобы нагреть 1 л воды от 25 °C до кипения? Теплоты образования диоксида углерода, воды и этана равны 393.5 кДж/моль, 285.8 кДж/моль и 84.68 кДж/моль соответственно. Теплоемкость воды примите равной 4.184 Дж/К·г.
- Алкан с разветвленным углеродным скелетом смешали с воздухом в объемном соотношении 1:35. После поджигания смеси алкан сгорел полностью и избытка кислорода не осталось. Установите строение этого алкана и назовите его.
- Алкан смешали с воздухом в объемном соотношении 2 : 65. После поджигания смеси алкан сгорел полностью и избытка кислорода не осталось. Установите строение этого алкана, если известно, что он содержит только первичные и третичные атомы углерода и назовите его.
- Содержание углерода в газообразной смеси пентана с углеводородом Х составляет 85% по массе. Объем кислорода, необходимый для полного сгорания этой смеси, в 6,5 раза превышает объем смеси. Напишите структурные формулы всех возможных углеводородов, удовлетворяющих условию задачи.
- Смеси природного газа с воздухом взрывоопасны, поэтому необходимо тщательно следить за отсутствием утечек в газовой плите. Нижняя граница взрывоопасных концентраций природного газа в воздухе составляет 2 % по объёму. Кухня имеет площадь 9 м 2 и высоту потолков 2,7 м. Расход газа через полностью открытую горелку газовой плиты стандартной мощности составляет в среднем 0,29 м 3 /час. Через сколько времени содержание газа на кухне превысит нижнюю границу взрывоопасных концентраций, если открыта одна горелка?.
- Может ли массовая доля водорода в алкане быть больше 25 %? Если да, то какая массовая доля водорода в алкане максимальна?
- Чем больше число атомов углерода в углеводороде, тем больше требуется кислорода для его сгорания. Выведите формулу для определения объёма воздуха, необходимого для сжигания 1 моль алкана, 1 г алкана. Постройте графики зависимости объёма воздуха от числа атомов углерода алкана.
- Напишите структурную формулу монобромида, преимущественно получающегося при бромировании 2,2,4-триметилоктана и назовите образовавшееся вещество.
- При действии хлора на некоторый алкан при интенсивном облучении в смеси было обнаружено наличие трех моногалогенпроизводных с плотностью их паров по исходному алкану, равной 1,48. Каким строением мог обладать исходный алкан?
- При хлорировании этана было выделено вещество, содержащее (87,5%) по массе хлора. Определите структуру вещества и назовите его.
- Напишите структурную формулу монобромида, преимущественно получающегося при бромировании 3,4-диметилгексана и назовите образовавшееся вещество.
- Какой объем хлороводорода образуется при взаимодействии 2 л метана (н.у.) с хлором, который может быть получен из 3 г оксида марганца (IV) и 50 мл 28,2% соляной кислоты (плотность 1,14 г/мл)/
- При действии хлора на некоторый алкан при интенсивном облучении в смеси было обнаружено наличие трех моногалогенпроизводных с плотностью их паров по исходному алкану, равной 1,48. Каким строением мог обладать исходный алкан?
- При хлорировании 96 г алкана образовалась смесь моно-, ди- и трихлоридов. Объемное соотношение (н.у.) продуктов реакции в газовой фазе составлянет1:2:3, а плотность по водороду паров дихлорида 42,5. Найдите состав исходного алкана и количественный состав смеси.
- При бромировании изобутана на свету первичный и третичный монобромиды образуются в мольном соотношении 1:180. Оцените, в каком мольном соотношении образуются монобромпроизводные при бромировании в тех же условиях 2,3-диметилбутана.
- Напишите формулы изомерных монохлорпроизводных: образующихся при хлорировании 2,2,4-триметилпентана. Каким будет относительное содержание изомеров (в %), если соотношение скоростей реакции замещения атома водорода у первичного, вторичного и третичного атома углерода составляет 1:3,3:4,4?
- Пропускание хлора через кипящий хлороформ CHCl3 (т.кип. 62 о С) при освещении сопровождается выделением газообразного вещества, хорошо растворимого в воде. Однако состав и свойства вещества , оставшегося в реакционном сосуде сильно зависят от интенсивности облучения. В одном случае образуется соединение А с т.кип. 77 о С, в другом – твердое вещество В с т.пл. 187 о С (возгоняется). Обсудите, каким строением могут обладать вещества А и В.
- (Муниц. 13-14) В неизвестном алкане число связей С-С на 8 меньше, чем связей С-Н. А. Установите строение алкана, если известно, что при его хлорировании образуется только одно монохлорпроизводное. Б. Напишите уравнение реакции хлорирования этого алкана и назовите его.
Тема 7. Реакции алканов. Получение алканов

1.Для какого алкана объем газообразных продуктов полного термического разложении в 3 раза больше объема исходного алкана? В ответе запишите название алкана в именительном падеже.
2.Назовите соединения, которые будут получаться при дегидрировании гептана на платине при 400-450 о С. Обсудите возможные варианты.
3,При нитровании изобутана в газовой фазе при 450°С образуется 65% первичного и 7% третичного нитросоединений. Каково соотношение скоростей нитрования изобутана по первичным и третичным атомам углерода? Избирательна ли эта реакция? Почему суммарный выход указанных нитробутанов не равен 100%?
4.В запаянной ампуле нагрели смесь гексана с безводным хлоридом алюминия. Полученная в результате опыта жидкость кипит в отличие от исходного гексана (69 о С) в интервале 50-69 о С. Как можно объяснить результаты эксперимента?
5.При крекинге углеводорода А образуются два других углеводорода с одинаковым числом углеродных атомов В и С. Углеводород В тяжелее воздуха, а углеводород С – легче воздуха. Приведите возможные формулы веществ А, В, С. Напишите уравнение реакции.
6.Смесь газов с плотностью 11 по гелию пропустили через раствор щелочи, при этом объем смеси уменьшился в три раза, а плотность не изменилась. Установите возможный качественный и количественный состав исходной смеси.
7.Как по реакции Вюрца получить: а) 2,3-диметилбутан, б) 2,2,3,3-тетраметилбутан, в) 3,4-диметилгексан? Напишите уравнения необходимых реакций и приведите условия их осуществления.
8.Какой объем (в пересчете на н.у.) займет смесь газов, образующаяся при кипячении раствора в октане 31,2 г этилиодида и 28,4 г метилиодида с металлическим натрием, взятым в избытке?
9.(Москва, 2004). При взаимодействии смеси двух монобромалканов с металлическим натрием получена смесь углеводородов А, Б, В (в порядке возрастания молекулярной массы). Бромированием А можно получить два изомерных монобромпроизводных с плотностью по воздуху 4,72. Бромирование В приводит к трем продуктам с плотностью по воздуху 6,66. Определите структурные формулы всех упомянутых веществ. Приведите уравнения реакций. Какой из трех продуктов бромирования углеводорода В образуется в большем количестве и почему?
10.При прокаливании смеси массой 41 г, содержащей ацетат натрия и избыток гидроксида натрия, выделился газ, прореагировавший при освещении с хлором. В результате последней реакции образовалось 11,95 г трихлорметана (хлороформа). Выход хлороформа составил 60% от теоретического. Найдите массовые доли веществ в исходной смеси.
11.При сплавлении натриевой соли одноосновной карбоновой кислоты с гидроксидом натрия выделилось 11,2 л газообразного органического соединения, 1 л которого при н.у. имеет массу 1,965 г. Определите массу соли, вступившей в реакцию и состав выделившегося газа.
12.При сплавлении 28,8 г натриевой соли предельной монокарбоновой кислоты с избытком гидроксида натрия выделилось 4,63 л. Газа (н.у.), что составляет 79% от теоретического выхода. Определите, какой выделился газ.
13.Смесь газов с плотностью 11 по гелию пропустили через раствор щелочи, при этом объем смеси уменьшился в три раза, а плотность не изменилась. Установите возможный качественный и количественный состав исходной смеси.

Тема 8. Циклоалканы
- В двух газовых баллончиках без этикеток находятся пропан и циклопропан. Как определить, какой газ содержится в каком баллончике?
- Три углеводорода А, Б и В имеют одинаковый элементный состав. Для полного сгорания 2 моль углеводорода А требуется такое же количество кислорода, что и для сжигания смеси 0,5 моль Б с 0,5 В. Б и В изомерны между собой, причем относятся к разным классам органических соединений. Углеводород А чуть легче воздуха. Определите возможные структурные формулы А, Б и В, назовите их.
- Приведите формулу углеводорода, в молекуле которого имеются 15 σ-связей и нет π-связей.
- Приведите формулу углеводорода, в молекуле которого имеются 18 σ-связей и нет π-связей.
- Приведите структурные формулы двух циклических изомерных углеводородов, один из которых содержит 5 вторичных атомов углерода, а второй – только один.
- В ходе реакции образовались только два вещества: 1,2-диметилциклобутан и бромид цинка. Какие два вещества вступили в реакцию?
- В ходе реакции образовались только два вещества: метилциклопентан и бромид магния. Какие два вещества вступили в реакцию?
- В ходе реакции образовались только два вещества: метилциклопропан и бромид магния. Какие два вещества вступили в реакцию?
- При взаимодействии 14 г циклоалкана состава С5Н10 с бромом образовалось 29,8 г органического продукта реакции. Определите структурную формулу циклоалкана, напишите уравнение реакции.
- При взаимодействии 7 г циклоалкана состава С5Н10 с бромом образовалось 23 г органического продукта реакции. Определите возможную структурную формулу циклоалкана, напишите уравнение реакции.
- При взаимодействии циклоалкана состава С5Н10 с бромом образовался органический продукт реакции, содержащий 26,09% углерода, 4,35% водорода и 69,56% брома по массе. Определите возможную структурную формулу циклоалкана, напишите уравнение реакции.
- Для полного сгорания 3,2 г смеси метана, бутена-1 и циклобутана требуется 37,3 л (н.у.) воздуха. Вычислите объемную долю метана в исходной смеси.
- Для полного сгорания 5,80 г смеси метана, пропена и циклопропана требуется 72,8 л (н.у.) воздуха. Вычислите объемную долю метана в исходной смеси.
- Для полного сгорания 2,90 г смеси метана, пропена и циклопропана требуется 36,4 л (н.у.) воздуха. Вычислите объемную долю метана в исходной смеси.
- Для полного сгорания 1,45 г смеси метана, пропена и циклопропана требуется 18,2 л воздуха. Вычислите объемную долю метана в исходной смеси.
- .Какой объем воздуха, содержащего 20% по объему кислорода, потребуется для сжигания 42 г смеси, состоящей из паров 2-метилпентена-2, циклогексана и 1,2-диметилциклобутана?
- Напишите ВСЕ циклоалканы состава С5Н10 и назовите их. Какие из них существуют в виде геометрических изомеров?
- Циклическое соединение состава С4Н8 прореагировало с водородом. При этом образовалась смесь бутана и 2-метилпропана. Определите структурную формулу исходного вещества.
- (ФНМ-2005). При взаимодействии углеводорода, не имеющего кратных связей, с избытком бромоводорода образовалось вещество, масса которого в 2.88 раз больше массы углеводорода. Определите состав углеводорода.
- (Москва 2005) Определите молекулярную формулу углеводорода, который имеет плотность по водороду меньше 75 и содержит 87,27% углерода по массе. Предложите строение этого углеводорода, если известно, что он имеет в своей структуре только вторичные и третичные атомы углерода и как минимум два шестичленных цикла. Сколько различных монохлорпроизводных образуется при его неселективном радикальном хлорировании на свету?
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:

Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Читайте также:

