Активные формы кислорода и рак

О том, почему свободных радикалов действительно стоит опасаться и откуда они берутся
Когда люди дышат загрязнённым воздухом, курят, едят еду, зажаренную до чёрной корочки, они создают в организме условия для производства вредных соединений или получают их напрямую. То же самое происходит, когда в организме происходит воспаление, в него попадает инфекция, он подвержен стрессу или перегружен физическим трудом. Эти соединения называются активные формы кислорода и их избыток помогает развиваться раку, диабету, атеросклерозу и другим заболеваниям.
Зачем нужны активные формы кислорода
Активные формы кислорода — химически активные молекулы, которые содержат кислород: супероксид, пероксид водорода, гидроксильные радикалы и синглетный кислород и другие. Обычно АФК производят митохондрии, энергостанции клетки. Материал для них формируют клеточные процессы: клеточное дыхание, метаболизм арахидоновой Омега 6 кислоты, иммунные реакции.
В норме АФК выполняют в организме полезные задачи — помогают синтезу клеточных структур, участвуют в сообщении между клетками, защищают клетку от патогенов. Клетки иммунной системы, фагоциты, специально синтезируют и хранят АФК, чтобы высвободить в случае вторжения патогенных микробов. Без АФК организму сложнее справляться с инфекциями — например, пациенты с хронической гранулематозной болезнью не способны производить супероксид и другие АФК, и потому подвержены частым и устойчивым инфекциям. Небольшое количество АФК необходимо организму для правильной работы.
Откуда берутся свободные радикалы и другие АФК
Часть АФК образуется в организме под влиянием внутренних процессов — дыхании клетки, иммунного ответа, чрезмерной физической нагрузки. Другие АФК образуются из-за внешних факторов. Вот примеры таких факторов:
Табачный дым. Содержит супероксид и оксид азота. Вдыхание дыма в лёгкие активирует производство воспалительных цитокинов, которые выделяют ферменты, разрушающие соединительную ткань легких.
Процессы приготовления. При копчении мяса, приготовлении еды на масле с низкой устойчивостью к нагреванию образуются АФК.
Ионы металлов. Железо, медь, кадмий, ртуть, никель, свинец и мышьяк могут провоцировать производство свободных радикалов и окислять компоненты клетки напрямую.
Загрязнители окружающей среды. Оксид азота способствует производству АФК, переходные металлы окисляют компоненты клетки, озон окисляет жиры и запускает поток нейтрофилов в дыхательные пути, твердые частицы катализируют восстановление кислорода.
Лекарственные препараты. Циклоспорин и такролимус — иммунодепрессанты, применяются при пересадке органов для снижения риска отторжения, гентамицин — антибиотик широкого действия, блеомицин — используется при терапии рака приводят к повышенному производству АФК.
Промышленные растворители. Вдыхание паров растворителей провоцирует окислительный стресс сразу несколькими механизмами — некоторые компоненты метаболизируются в организме с образованием АФК, некоторые провоцируют воспаление, которое приводит к образованию АФК, некоторые компоненты содержат АФК и окисляют компоненты клеток напрямую.
Что такое окислительный стресс
Чтобы в клетке нормально проходили процессы модификаций белка, расшифровки генов и противостояния микробам, АФК должно быть немного. Иначе они мешают работе клетки — ломают её структурные компоненты из белков, жиров и нуклеиновых кислот.
Справляться с АФК организму помогают энзимы-антиоксиданты — глутатион, супероксид дисмутаза и каталаза, а также внешние антиоксиданты как альфа-токоферол (форма витамина Е). По умолчанию, способность этих механизмов избавляться от активных форм кислорода всегда меньше, чем окислительная нагрузка и это нормально. Проблема возникает, когда активных форм кислорода становится настолько много, что они выходят из под контроля — окисляют компоненты клетки и создают новые АФК, подвергая клетку окислительному стрессу.
Окислительный стресс — процесс, который наносит вред частям клетки: мембранам, жирам, белкам, липопротеинам и ДНК. Окислительный стресс возникает, когда нарушается баланс между производством АФК и способностью клеток избавляться от них.
Как окислительный стресс вредит жирам, белкам и ДНК
АФК повреждают жировые структуры клеток — мембраны и липопротеины, которые переносят холестерол. Мембраны становятся более проницаемыми, липопротеинам проще туда попасть. Если окисленный липопротеин окажется в стенке сосуда, он может дать старт развитию атеросклеротической бляшки.
Окисление жиров происходит по цепочке и распространяется быстро, захватывая множество жировых молекул. Помимо этого, реакция окисления жиров образует токсичные и мутагенные соединения, например малондиальдегид, МДА. МДА в свою очередь нарушает работу белков.
АФК повреждают клеточные белки, и они становятся подвержены распаду (протеолизу). Окисление белков ухудшает или сводит на нет их ферментативную активность, может вызвать их денатурацию.
АФК повреждают ДНК — разрушает основания, создаёт разрывы ДНК цепочек. Повреждение ДНК может сформировать соединение 8-OHdG, оно ответственно за мутагенез и потерю эпигенетической информации. Повреждения ДНК через окисление отмечаются при росте раковых клеток, деменции, аутоиммунных и сердечно-сосудистых заболеваниях.
Неконтролируемый окислительный стресс провоцирует и поддерживает развитие хронических и дегенеративных заболеваний. Вот основные из них:
- рак
- атеросклероз и другие сердечно-сосудистые заболевания
- сахарный диабет
- хронические болезни почек и легких
- деменция — болезни Альцгеймера, Хантингтона, Паркинсона
- ревматоидный артрит
Как защитить клетки от окислительного стресса
Активные формы кислорода нужны. Они защищают организм от микробов, вирусов и участвуют в его работе. Чтобы организм работал нормально, АФК должно быть немного.
Когда АФК слишком много, они повреждают клетки и мешают их работе. Этот процесс называется окислительный стресс. Окислительный стресс ослабляет организм и способствует развитию хронических болезней.
Избыток АФК вызывают воспаления, инфекции, загрязнители воздуха, табачный дым, растворители, тяжелые металлы и некоторые лекарства.
Oxidative Stress and Antioxidant Defense
Oxidative Stress: Harms and Benefits for Human Health
Претерпевая окислительный стресс, биологическая система сталкивается с чрезмерной продукцией активных форм кислорода (АФК), несоразмерной нормальной продукции антиоксидантов или же сопряжённой с дефицитом тех в клетке. Окислительный стресс является сложным процессом. Его воздействие на организм зависит от типа окислителя, от места и интенсивности его производства, от состава и активности различных антиоксидантов — защитников наших внутренних биологических систем, а также от активности репарационных систем — целого сложного комплекса биологических ответов клетки. Например, естественные антиоксиданты, как то витамины Е, С и флавононы повышают устойчивость клетки к стрессу, когда как нейродегенеративные заболевания или рак тормозят процессы естественной защиты.
Концентрация доступного кислорода так же влияет на продукцию АФК. Однако, что интересно, в условиях гипоксии данная линейная зависимость нарушается, продукция АФК резко возрастает. В гипоксических условиях митохондрии участвуют в АФК-всплеске, генерируемом в комплексе III электрон-транспортной цепи. Гипоксия и реоксигенация приводят к обратимому нарушению работы АТФазы вместе с архитектурой митохондриальной мембраны. В том числе гемодинамические параметры, которые снижаются при гипоксических условиях, восстанавливаются во время реоксигенации.
Активные формы кислорода пагубно воздействуют на саму органеллу. Первичный центр повреждений – электрон-транспортная цепь на мембране, вторыми страдают белковые и нуклеотидные последовательности. Когда как последующая дисфункция митохондрий может привести, как уже было сказано ранее, к проявлению различных патологий.
Многочисленные подтверждения говорят о корреляции между митохондриальной дисфункцией и возникновением болезни Паркинсона. При повреждении электрон-транспортной цепи увеличивается количество дофамин-продуцирующих нейронов. Точно таким же образом ингибирующие комплекс I электрон-транспортной цепи агенты - ротенон, например, - вызывают селективное поглощение дофамина чёрным ядром и тем самым опосредуют синдромы, схожие с паркинсонизмом. Иные нейродегенеративные заболевания так же имеют схожие симптомы, связынные с ролью АФК в нейродегенеративном патогенезе – характерные белковые конгломераты во внутренней среде клетки во время болезни Альцгеймера или Хорея-Хантингтона.
АФК, продуцируемые в тканях, могут нанести прямой ущерб многим биополимерам. В частности, полиненасыщенные жирные кислоты являются одной из предпочтительных целей окисления . Кислородсодержащие радикалы, в частности супероксид, гидроксильный радикал и алкилпероксильный радикал (OOCR), являются мощными инициаторами перекисного окисления липидов, что является частью патогенеза широкого спектра заболеваний.
Нуклеиновые кислоты также очень восприимчивы к окислению, потому как окисление может вызывать мутации и делеции как в ядерной, так и в митохондриальной ДНК. Митохондриальная ДНК особенно подвержена окислительному повреждению из-за ее близости к опасным агентам и недостаточной репарационной способности по сравнению с ядерной ДНК. Таким образом, физиологическое воздействие, в данном случае, оказывается через транслируемые белки.
Окислительный стресс, связанный с дисфункцией иммунной системы играет ключевую роль в старении. Так же было обнаружено, что оксидаза NADPH может привести к индукции связанного с дыханием окислительного стресса. Оно отвечает за развитие аллергического воспаления, в ходе которого в место воспаления поставляются провоспалительные цитокины, а именно фактор некроза опухолей. Весь этот коктейль из белков инициирует рост дендритных клеток и скорую дифференцировку в оные. Таким образом, врожденный иммунитет локально может быть ослаблен из-за окислительного стресса, вызванного, например, воздействием пыльцы – потому как пыльца содержит оксидазу NADPH. Это, в свою очередь, помогает инициировать адаптивный иммунный ответ на пыльцевые антигены. Вот такой вот интересный механизм привычной нам весенней аллергии!
Состояние иммунной системы может вызывать сопутствующие болезни. Различные стрессоры определяют возникновение и тяжесть различных вирусных и бактериальных инфекций. Как врожденный, так и приобретенный иммунный ответ влияет на индукцию цитокинов. Таким образом, фатальные вирусные заболевания вызывают сильный окислительный стресс, что приводит к значительному клеточному повреждению. Однако инициирование, прогресс и репарация повреждений регулируются балансом окислителей и антиоксидантов.
Все факторы, ответственные за окислительный стресс, прямо или косвенно участвуют в механизме защиты иммунной системы (таблица ниже):

Все патогены, независимо от их классификации, бактериальные, вирусные или паразитарные, с нарушенной антиоксидантной защитой, показывают повышенную восприимчивость к фагоцитозу в тканях хозяина, что так же указывает на атакующую микробы активность активных форм кислорода. Антиоксидантные механизмы, в свою очередь, делают их обладателя более восприимчивым к тяжелым бактериальным, грибковым и вирусным инфекциям.
К тому же, АФК, накапливающиеся во время старения клетки, регулируют данный процесс. Старение является неотъемлемым механизмом, существующим во всех живых клетках, ассоциированным с постепенным снижением функций органов, таких как сердце, печень, мозг, вследствие накопления в оных АФК, либо из-за увеличения производства этих молекул, либо из-за снижения детоксикации, в том числе митохондрий, вместе с развитием возрастных заболеваний. Это сложное прогрессирующее физиологическое изменение организма, движимое окислительным процессом.
Поделиться сообщением в
Внешние ссылки откроются в отдельном окне
Внешние ссылки откроются в отдельном окне
Нобелевскую премию 2019 года по физиологии и медицине разделили два американских ученых - Грегг Семенца из Университета Джонса Хопкинса в Балтиморе и Уильям Келин-младший из Института рака Дэйны-Фарбера в Бостоне - и их британский коллега сэр Питер Рэтклифф из Оксфорда.
В заявлении Нобелевского комитета говорится, что премия присуждена "за открытие механизмов, при помощи которых клетки ощущают изменения в уровне доступного кислорода и адаптируются к ним".
Ученые проводили свои исследования независимо друг от друга, однако все вместе они "указывают путь для разработки новых многообещающих способов борьбы с анемией, раком и другими заболеваниями", говорится в сообщении.
- Рак - основная причина смерти в богатых странах
- Как вовремя обнаружить рак? Первые тревожные признаки
Русская служба Би-би-си коротко (в 100 словах) и чуть подробнее (в 500 словах) объясняет, в чем суть их открытий.
Чтобы превратить пищу, которую мы едим, в энергию, поддерживающую работу наших органов и позволяющую нам двигаться, организму необходим кислород.
Однако уровень кислорода в крови постоянно меняется под действием множества факторов. Как наши клетки адаптируются к этим изменениям и продолжают нормально функционировать, долгое время оставалось загадкой.
Известно, что при недостатке кислорода у человека и других животных развивается гипоксия - кислородное голодание, которое мешает нормальной работе органов.
Работы Семенцы, Кейлина и Рэтклиффа помогли обнаружить генетический механизм реакции на гипоксию и понять, как клетки ощущают дефицит кислорода и адаптируются к нему - в том числе как организм "запускает производство" гормона, отвечающего за образование новых переносящих кислород красных кровяных клеток.
От уровня кислорода в организме зависит нормальное кровоснабжение клеток, здоровый обмен веществ и количество энергии - ее вырабатывают митохондрии (они есть почти во всех живых клетках) из питательных веществ, поступающих в организм с едой, также с участием кислорода.
При этом количество доступного клеткам кислорода не является постоянным: оно может падать или повышаться в зависимости от множества факторов - от интенсивности дыхания и самого воздуха, которым мы дышим (например, он может быть загрязненным или разреженным), до гормональных выбросов и различного рода заболеваний.
Самый простой пример, с которым сталкивался каждый из нас, - это пережатие кровеносных сосудов за счет слишком тесно прилегающей одежды или при наложении жгута.
Когда кислорода становится недостаточно, нашему организму приходится адаптироваться - он включает сберегающие и компенсационные механизмы.
Но для этого клетки сначала должны "почувствовать", что им не хватает кислорода, с помощью какого-то специального механизма - а как именно это происходит, ученые не могли понять десятилетиями.
Притом что вопрос это отнюдь не праздный, ведь нарушение работы этого механизма имеет самые серьезные последствия: продолжительное кислородное голодание может в итоге привести к необратимым изменениям в тканях.
Особенно чувствительны к кислородной недостаточности сердце, печень, почки и центральная нервная система.
При чем здесь рак?
Ученым давно известно, что уровень кислорода в организме в целом отслеживают специальные рецепторы, прилегающие к сонной артерии - каротидные тельца. Когда кислорода становится недостаточно, они посылают в мозг сигналы, регулирующие частоту дыхания. Поэтому, например, мы начинаем чаще дышать при быстрой ходьбе или других физических нагрузках.
Кроме того, еще в начале прошлого века ученые выяснили, что при гипоксии происходит выброс гормона эритропоэтина. Он вырабатывается в почках и стимулирует производство эритроцитов - красных кровяных клеток, переносящих молекулы кислорода. Однако какой механизм обеспечивает эту реакцию, долго оставалось загадкой.
Проведя эксперименты на мышах, Грегг Семенца выяснил, что недостаток кислорода как-то влияет на участки ДНК, отвечающие за производство эритропоэтина.
Сэр Питер Рэтклифф изучал этот феномен параллельно - и оба ученых обнаружили, что механизм, позволяющий клеткам чувствовать недостаток кислорода, работает практически во всех тканях, а не только в почках, где вырабатывается нужный гормон.
Семенца продолжил исследования и открыл белковый комплекс, который так и назвал HIF - "фактор, индуцируемый гипоксией". Он связывается с ДНК и может тормозить или стимулировать выработку эритропоэтина.
Но от чего зависит, какой будет реакция?
На этот вопрос помог ответить онколог Уильям Келин, пытаясь решить совершенно другую проблему. Он изучал довольно редкое генетическое заболевание (болезнь Гиппеля-Линдау), которое серьезно увеличивает риск развития рака.
В процессе работы он обнаружил, что это происходит из-за сбоя в работе гена VHL. При этом раковые клетки с поврежденным геном очень чутко реагировали на недостаток кислорода, но при введении туда здорового VHL реакция приходила в норму.
Так выяснилось, что VHL отвечает за распад одного из компонентов белкового комплекса HIF и меняет его форму в зависимости от насыщенности кислородом - что и приводит к изменениям в экспрессии ДНК.
Таким образом клетки "чувствуют" недостаток кислорода и компенсируют этот дефицит за счет скорости обмена веществ.
Если гипоксия продолжается длительное время, организм реагирует на кислородное голодание строительством новых кровеносных сосудов и активным производством эритроцитов. Так, например, готовятся к высотным восхождениям альпинисты.
Однако ровно тот же механизм включается и при быстром росте новой ткани - например, агрессивной раковой опухоли. Если его отключить, этот рост можно замедлить или даже полностью остновить. Именно поэтому открытия Келина, Рэтклиффа и Семенцы могут найти широкое применение в онкологии.


В области физиологии и медицины Нобелевскую премию получили американские ученые Уильям Кейлин и Грегг Семенца, а также их британский коллега Петер Ратклифф. Они выяснили, какие молекулярные механизмы лежат в основе адаптации клетки к изменениям в снабжении кислородом. В пресс-релизе Нобелевского комитета сказано, что исследование сможет определить новые стратегии в лечении анемии, рака и еще ряда болезней.
Отсутствие кислорода в организме стимулирует выработку почками гормона эритропоэтина. Из-за этого производятся новые эритроциты, для снабжения органов кислородом. Но как именно клетки чувствуют, что пора запустить процесс, раньше было неизвестно. Теперь ответ на загадку природы известен, но чем это грозит человечеству?
Доктор медицинских наук, профессор кафедры спортивной медицины и медицинской реабилитации Сеченовского университета Владимир Фролов объяснил, что перенасыщение крови кислородом хорошо известно анестезиологам и реаниматологам. Когда человеку дается повышенное количество кислорода, он впадает в эйфорию. Этот эффект замечали и любители погружаться в толщу морей и океанов.

Источник фото: Pixabay
По словам Владимира Фролова, дайвера с многолетним стажем, для аквалангистов создаются специальные смеси, где исключен азот, который может вызывать многие осложнения. Зато в них много кислорода.
Владимир Александрович рассказал, что адаптация открытия к задаче создания фармакологических препаратов — вполне решаемая технологическая проблема. Так что создание допинга, который нельзя будет обнаружить, вполне реально.
Открытие американских и британского ученых он назвал серьезным и отметил, что его можно использовать как со знаком плюс, так и со знаком минус. Владимир Фролов напомнил историю Альфреда Нобеля, который даже не предполагал, что изобретенный им динамит может быть использован не в горнодобывающем, а военном деле. Только время покажет, как будет использоваться то, что выяснили ученые. Например, не исключено, что при помощи кислорода начнут лечить рак.

Источник фото: Pixabay

Смертоносная мутация генов. Новый рак крови убивает за несколько недель
Эксперт допустил, что у результатов исследования нобелевских лауреатов может быть даже неожиданное применение: начиная от психиатрии, психотерапии и заканчивая геронтологией, неонаталогией, терапией, хирургией.

МОСКВА, 13 октября. /ТАСС/. Опасные мутации и связанные с ними раковые опухоли чаще всего возникают в организме человека не из-за радиации, солнечного ультрафиолета или канцерогенов в еде, а из-за процессов, связанных с круговоротом кислорода и воды в организме. Об этом заявил Нобелевский лауреат по химии Томас Линдал, отвечая на вопросы корреспондента ТАСС в кулуарах московской части XIV Всероссийского фестиваля Nauka 0+, проходящей в МГУ.
"Мы все знаем, что ультрафиолет может вызвать рак кожи, а источники радиации - рак других органов. С другой стороны, никто не верит в то, что ультрафиолет способен породить опухоли в мозге, печени и других внутренних органах, и лишь 1% опухолей связан с ионизирующим излучением. Возникает вопрос - откуда берется рак?" - отметил Линдал.
Нобелевская премия по химии 2015 года была присуждена трем известным химикам и молекулярным биологам, работы которых помогли понять, как именно клетки "ремонтируют" свою ДНК - этот процесс называется репарацией. Лауреатами стали Томас Линдал (Швеция), Пол Модрич (США) и Азиз Санкар (США). На этой неделе шведский исследователь впервые посетил Россию и выступил с лекцией на XIV Всероссийском фестивале Nauka 0+.
Линдал открыл механизм так называемой эксцизионной репарации оснований. Участвующие в нем ферменты находят поврежденный участок ДНК, вырезают его и восстанавливают пробел, используя неповрежденную цепь ДНК в качестве образца. Этот процесс, как объяснил молекулярный биолог, помогает клеткам избегать ежедневного появления нескольких тысяч новых мутаций в геномах клеток.
Кислородные корни рака
Почти все эти "опечатки" в ДНК, как пояснил Линдал, связаны с двумя процессами - проникновением молекул кислорода и его агрессивных соединений внутрь ядра клетки, а также действием молекул воды на одиночные "буквы" нитей ДНК.
"Я готов поставить деньги на то, что почти все случаи рака, известные медицине, возникают не из-за радиации, канцерогенов или ультрафиолета, а в результате естественных процессов жизнедеятельности внутри самих клеток, связанных с гидролизом (разложением воды - прим. ТАСС) и появлением агрессивных форм кислорода", - заявил Нобелевский лауреат.
Эту особенность рака, по его словам, крайне важно понимать, так как и кислород, и вода играют ключевую роль в жизни организма. Их нельзя удалить из организма, предотвратить их появление в нем - в целом, с ними невозможно бороться. По этой причине, как считает Линдал, рак невозможно победить в принципе - можно лишь создать лекарства, которые позволят эффективнее и безопаснее уничтожать опухоли, а также максимально уменьшить другие факторы риска.
В частности, он порекомендовал всем курильщикам полностью отказаться от табака или хотя бы перестать курить одну сигарету за другой, так как вещества, присутствующие в дыме сигарет, действуют на клетки примерно так же, как агрессивные формы кислорода, и столь же сильно способствуют развитию мутаций.
"Конечно, можно попытаться усовершенствовать те системы починки мутаций, которые открыли мы и наши коллеги. Я сильно сомневаюсь, что мы сможем решить эту проблему - данная система совершенствовалась природой на протяжении многих миллиардов лет. Для сравнения, нам пришлось потратить более десяти лет только на то, чтобы раскрыть механизмы работы лишь одного из многочисленных механизмов репарации ДНК. Крайне сомнительно, что мы сможем что-то придумать, что природа уже не опробовала и забраковала за это время", - подытожил Линдал.
18 сентября 2013
- 4192
- 3,5
- 6
- 2
![]()
Антон Чугунов![]()
Андрей Панов

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Рак — это злокачественная опухоль, которая дает выросты в окружающие ее ткани, похожие на конечности ракообразного (отсюда и название). Ежегодно это заболевание уносит более 300 тысяч жизней. Основными причинами рака являются три группы факторов: физические (ионизирующее излучение, в т.ч. ультрафиолет), химические (канцерогенные вещества) и биологические (некоторые вирусы и бактерии). Под влиянием этих факторов клетки могут стать атипичными, поменять облик и свойства, что отражается во множестве молекулярно-генетических признаков, отличающих их от здоровых клеток:
- Увеличение лабильности и текучести клеточной мембраны, снижение адгезивности и контактного торможения. В норме клетки, вступая в контакт друг с другом, прекращают деление. В опухолевых клетках отсутствие контактного торможения приводит к безудержной пролиферации.
- Нарушение регуляции роста и дифференцировки опухолевых клеток. В нормальных клетках процессы роста и дифференцировки уравновешивает модулятор — кальций-зависимая протеинкиназа. В опухолевых клетках активность этого белка повышена, что приводит к резкой индукции пролиферации.
- Атипичный энергетический обмен, который проявляется в преобладании гликолиза. Нормальные дифференцированные клетки в присутствии кислорода в качестве основного источника энергии используют трёхэтапный процесс утилизация глюкозы (см. врезку):
- гидролиз высокомолекулярных органических соединений;
- гликолиз;
- окислительное фосфорилирование и цикл Кребса.
![]()
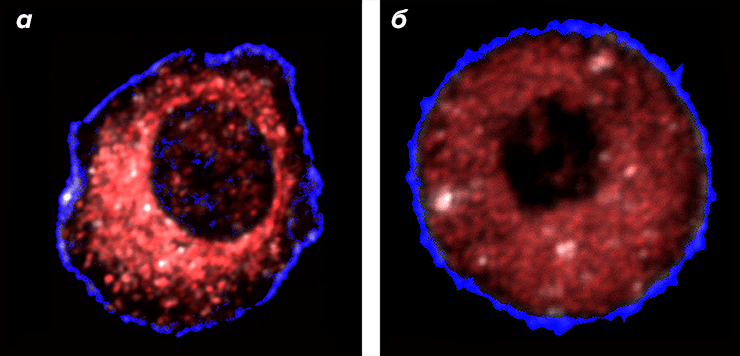
Рисунок 1. Здоровая (а) и раковая (б) клетки печени. Митохондрии помечены флуоресцентным красным красителем. У здоровой клетки митохондрии расположены кластерами вокруг ядра и отсутствуют вблизи внешней биомембраны. В раковой клетке митохондрии располагаются повсеместно и кластеров не образуют, поэтому интенсивность свечения снижается.
Особенности энергетического обмена
Живой организм — это открытая система, характеризующаяся постоянным обменом веществом и энергией с окружающей средой. На клеточном уровне существуют пластический (анаболизм) и энергетический (катаболизм) виды обмена. В ходе пластического обмена из простых веществ синтезируются более сложные (с затратой энергии). Энергетический обмен обеспечивает клетку энергией в виде АТФ. Все вещества в ходе энергетического обмена распадаются, а АТФ синтезируется. У животных энергетический обмен протекает в 3 этапа:
- Расщепление сложных органических веществ до более простых. Например, расщепление гликогена до глюкозы, фруктозы и галактозы. У многоклеточных организмов происходит в пищеварительном тракте, у одноклеточных — в лизосомах.
- Бескислородное окисление или гликолиз (расщепление глюкозы). Происходит в цитоплазме клетки без участия кислорода. На этом этапе из одной молекулы глюкозы образуется две молекулы пировиноградной кислоты и две молекулы АТФ. Также происходит восстановление молекулы НАД + до НАД•2Н. У животных и некоторых бактерий при недостатке кислорода происходит молочнокислое брожение с образованием молочной кислоты (лактата).
- Окислительное фосфорилирование и цикл Кребса происходят в митохондриях только в присутствии кислорода. На этом этапе расходуется пировиноградная кислота, ацетил-КоА, 12 молекул НАД•2Н и образуется 36 молекул АТФ.
Суммарно в ходе трёхэтапного цикла энергетического обмена из одной молекулы глюкозы образуется 38 молекул АТФ.
И голодно, и холодно, или раковый обмен
![]()
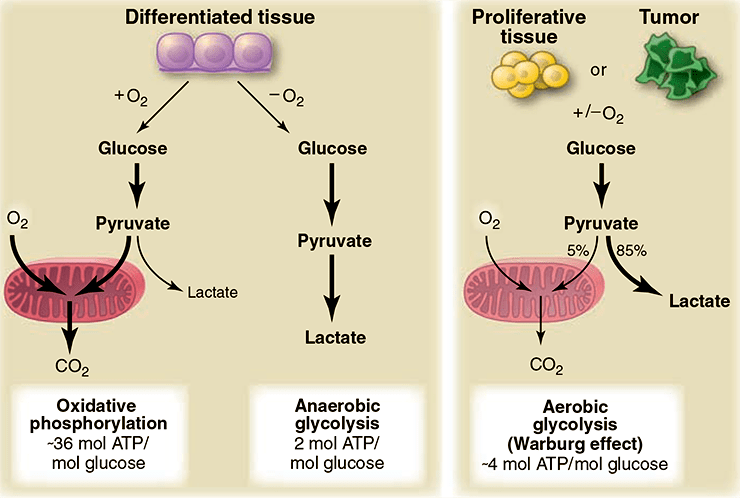
Рисунок 2. Различия между реакциями окислительного фосфорилирования, анаэробного гликолиза и аэробного гликолиза (эффект Варбурга). В присутствии кислорода в нормальных дифференцированных тканях в процессе гликолиза происходит расщепление глюкозы до пирувата, который затем в митохондриях в процессе окислительного фосфорилирования полностью окисляется до СО2. Кислород является необходимым компонентом полного окисления глюкозы; когда кислорода оказывается недостаточно, в клетках в процессе гликолиза синтезируется лактат. Лактат не является субстратом для реакции окислительного фосфорилирования, и полного окисления глюкозы в этом случае не происходит. Такой путь расщепления глюкозы до лактата способен поддерживать стабильный синтез минимального количества АТФ. Варбургом было отмечено, что раковые клетки имеют тенденцию к производству лактата, а не пирувата, независимо от присутствия кислорода в клетках. Это свойство также характерно и для нормальных пролиферирующих клеток. Часть митохондрий в раковых клетках остаются функционально активными, и как в раковых, так и в нормальных пролиферирующих клетках доля окислительного фосфорилирования может составлять примерно 10%.
Общебиологические законы ракового обмена
Одноклеточные организмы состоят всего из одной клетки, но эта клетка — целостный организм, ведущий самостоятельное существование. Одноклеточные организмы хорошо приспособлены к окружающей среде, в которой они растут и размножаются (рис. 3). Основным фактором эволюционного давления для одноклеточных, ограничивающим их размножение, является доступность питательных веществ. Поэтому метаболизм одноклеточных эволюционно развивался так, чтобы запасы питательных веществ и свободной энергии были направлены, в первую очередь, на построение структур, необходимых для возникновения новой клетки. Большинство одноклеточных размножается с использованием энергии гликолиза, даже когда кислорода достаточно. Следовательно, несмотря на низкую эффективность (две молекулы АТФ против 36), гликолиз может обеспечить достаточно энергии для клеточной пролиферации.
![]()
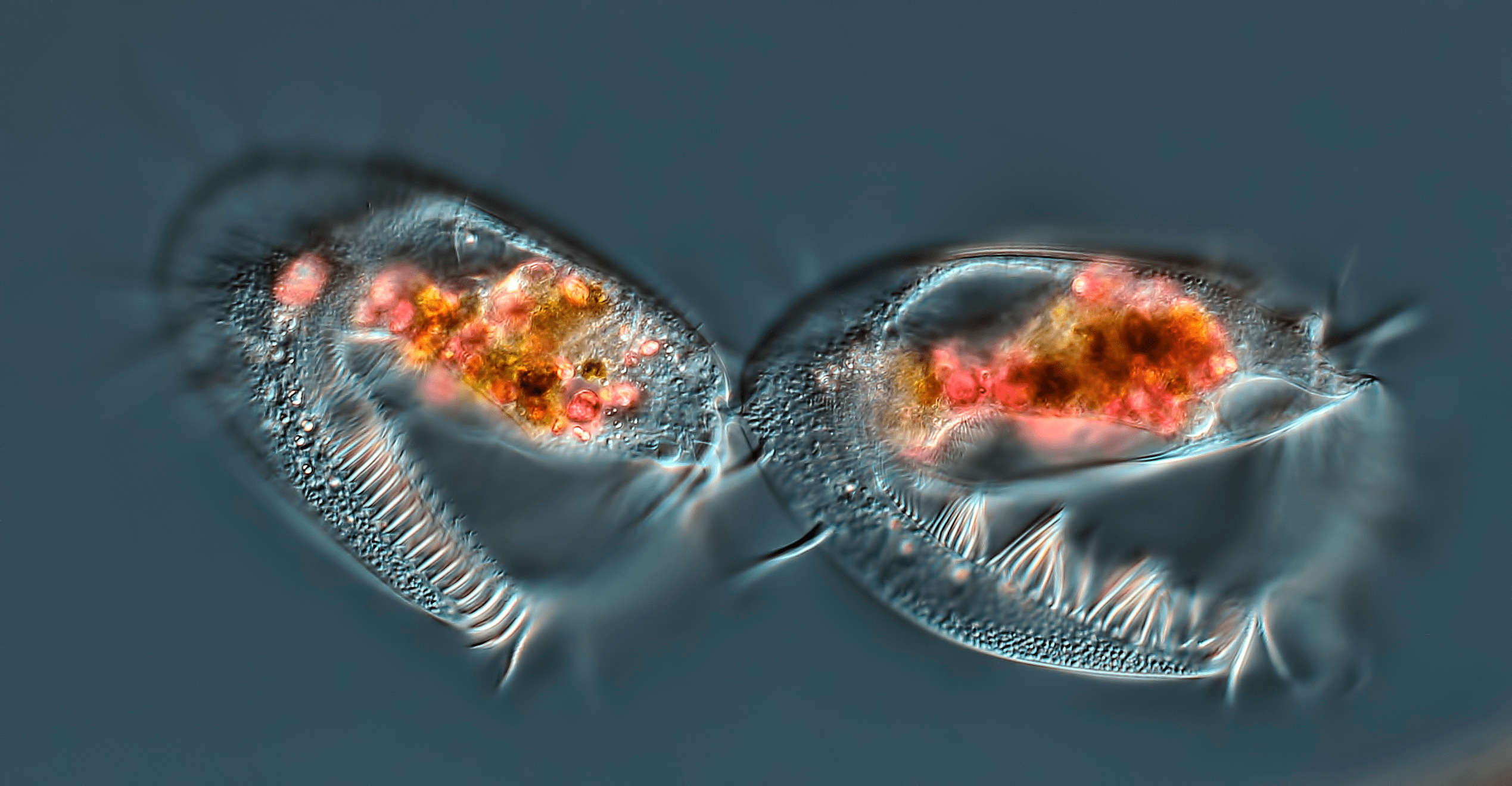
Рисунок 3. Завершающая стадия клеточного деления инфузории. Фотография сделана с использованием дифференциального интерференционного контраста ×40.
![]()
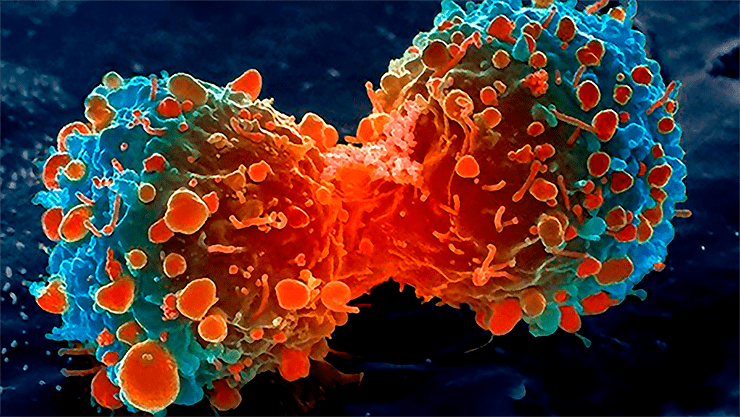
Рисунок 4. Пролиферация раковых клеток легкого, сканирующий электронный микроскоп (STEM)
Но почему же менее эффективный обмен веществ (с точки зрения производства АТФ) предпочтителен для размножения одноклеточных организмов или безудержной пролиферации раковых клеток?
Одно из возможных объяснений состоит в идее самой пролиферации. Для осуществления процесса деления необходимо наличие большого количества строительного материала — нуклеотидов, аминокислот и липидов [15]. Глюкоза обеспечивает клетку энергией (расщепление дает до 38 молекул АТФ в трёхэтапном процессе), но также используется как стройматериал в процессе биосинтеза (поскольку содержит шесть атомов углерода). Например, в ходе биосинтеза одного из основных компонентов клеточных мембран — пальмитата (эфира пальмитиновой кислоты) — необходимо 16 атомов углерода и семь молекул АТФ [16]. Для синтеза аминокислот и нуклеотидов также требуется больше углерода, чем энергии. Так, одна молекула глюкозы может обеспечить 36 молекул АТФ, либо предоставить свои шесть атомов углерода. Очевидно, что в пролиферирующей клетке бóльшая часть глюкозы не может участвовать в производстве АТФ посредством окислительного фосфорилирования, поскольку одну молекулу глюкозы выгоднее использовать для синтеза 16-ти углеродной цепи пальмитиновой кислоты, в процессе окисления которой образуется 35 молекул АТФ.
Альтернативное объяснение заключается в том, что здоровые клетки многоклеточного организма не испытывают недостатка в поставке глюкозы из циркулирующей крови, и АТФ синтезируется постоянно [17], [18]. При этом даже незначительные колебания содержания АТФ/АДФ в таких клетках могут нарушить их рост. Нормальные клетки с дефицитом АТФ подвергаются апоптозу [19], [20]. Поддержание оптимального уровня АТФ/АДФ обеспечивается активностью специальных регуляторных киназ, которые снижают производство АТФ путем преобразования двух молекул АДФ в одну молекулу АТФ и одну АМФ; пролиферация при этом условии блокируется.
Опухолевые клетки используют в качестве основного источника энергии гликолиз и характеризуются генерацией избыточного лактата (содержащего три атома углерода), который выводится из клетки, хотя мог быть использован для синтеза АТФ или биосинтеза. Но, возможно, вывод избыточного углерода (в виде лактата) имеет смысл, поскольку он позволяет ускорить включение углерода в биомассу и облегчить деление клеток. Для большинства делящихся клеток важным является не выход АТФ, а скорость метаболизма. Например, иммунные реакции и заживление ран зависят от скорости пролиферативного умножения эффекторных клеток. Чтобы выжить, организм должен максимизировать скорость роста клеток. Клетки, которые наиболее эффективно превращают глюкозу в биомассу, растут быстрее. Кроме того, если для организма питательных веществ оказывается недостаточно, включается механизм активной утилизации избытка лактата. В печени в цикле Кори происходит переработка лактата, запасающегося в результате метаболизма активно пролиферирующей ткани [16]. Такой способ переработки органических отходов, образующихся в результате пролиферации клеток при иммунном ответе в результате заживления ран, частично пополняет энергетические запасы организма.
Заключение
Читайте также: