Аденосквамозный рак как это
Под микроскопом паренхима новообразования, наряду с пластами типичного плоскоклеточного рака, содержит железистые структуры, выстланные уплощенными кубовидными эпителиоцитами, местами опущенными и заполняющими просветы железоподобных элементов опухоли. Иногда в раковой паренхиме встречаются участки, напоминающие синусоидные каналы, которые содержат эритроциты и опухолевые клетки. Поэтому опухоль похожа на ангиосаркому. Опухолевые клетки, выстилающие железы и каналы, вырабатывают гликоген, но не содержат слизи. Их ядра гиперхромны и полиморфны. Они обладают экспрессией цитокератина и эпителиального мембранного антигена, но не дают положительных реакций на эндотелиальные маркеры.
Эту форму рака следует дифференцировать от аденокарциномы, ангиосаркомы и аденосквамозного рака.
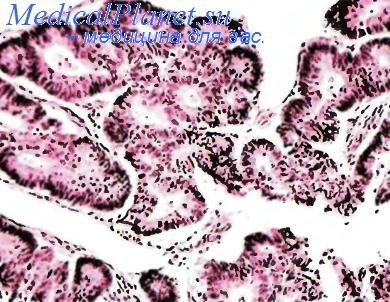
Синоназальная аденокарцинома.
Эту форму рака нужно дифференцировать от мукоэпидермоидной опухоли слюнных желез и базально-клеточного рака.
Аденокарцинома — вторая по частоте опухоль верхней части дыхательных путей, вслед за плоскоклеточным раком. Большинство аденокарцином головы и шеи возникают в больших и малых слюнных железах, а также в различных слизисто-серозных железах. Выделяют два типа указанной формы.
Синоназальная аденокарцинома кишечного типа по строению похожа на одноименную опухоль кишки. Чаше поражаются мужчины. По локализации на первом месте стоит задневерхний отдел полости носа и решетчатый лабиринт, на втором — полость носа, далее — верхнечелюстной синус. Среди факторов риска выделяют профессиональный контакт с твердой древесной и мучной пылью. Больные жалуются на заложенность носа, слизисто-кровянистые выделения и кровотечения из носа, припухлость лица, боли по ходу лицевого нерва, экзофтальм. Обычно жалобы предъявляются задолго до установления диагноза. При этом пациентам зачастую ставится диагноз хронического синусита или полипа. Макроскопически опухоль выглядит как полиповил ное, грибовидное или сосочковое новообразование беловато-розового или даже красного цвета, поверхность которого может быть изъязвлена. Изредка опухолевый узел имеет желеобразную консистенцию. Биологическая активность этого типа опухоли варьирует. Поражаются регионарные лимфатические узлы, реже встречаются отдаленные метастазы.
Все варианты слизи богаты кислыми мукополисахаридами и содержат умеренное количество нейтральных мукополисахаридов. Низкодифференцированная аденокарцинома может также иметь ацинарно-тубулярное строение. Однако атипия эпителиоцитов в ней сильно выражена, встречается много фигур митоза, включая атипический митоз, и более выражен инфильтративный и деструирующий рост. Наряду с железистыми комплексами в такой аденокарциноме образуются солидные пласты и тяжи клеток, а местами клетки располагаются поодиночке. Изредка в раковом узле преобладает строма, которая характеризуется многоклеточностью и активным ростом, создавая картину скиррозной аденокарциномы.
Аденокистозный рак представляет собой достаточно редкое заболевание. Он образуется из клеток эпителиальной ткани, которая выстилает просветы выводных желез. Следовательно, данная разновидность злокачественных опухолей может развиваться лишь в некоторых органах. Наиболее часто поражаются слюнные железы, трахея, бронхи, пищевод, шейка матки, верхние дыхательные пути, молочные железы.
- Особенности аденокистозного рака
- Клинические проявления
- Методы диагностики
- Особенности лечения аденокистозного рака
- Прогноз
Особенности аденокистозного рака
Для каждой локализации опухоли характерны определенные особенности. Например, среди органов дыхательной системы аденокистозный рак в трахее выявляется в два раза чаще, чем в бронхах. Первичная опухоль локализуется на ее боковой и задней стенке. Отдаленные метастазы в регионарных лимфатических узлах выявляются в 30-50% случаев. Аденокистозный рак не связан с курением. Наиболее частыми причинами его развития являются:
- Генетическая предрасположенность.
- Воздействие некоторых канцерогенов.
- Частые инфекции дыхательных путей.
Опухоль характеризуется экзофитным ростом. Во время диагностики определяется новообразование бугристой структуры, которое выступает в просвет трахеи или бронха. В некоторых случаях опухоль имеет вид полипа.
Характерные особенности присущи и для аденокистозного рака других локализаций. Врач должен помнить и учитывать их при осмотре пациента, составлении плана диагностики и лечения.
Клинические проявления
Специфические симптомы аденокистозного рака любой локализации отсутствуют. Пациенты могут предъявлять стандартные жалобы на боль, слабость, плохой аппетит. Как и при других видах злокачественных опухолей, на первых стадиях часто не отмечается никаких симптомов. По мере прогрессирования, клиническая картина становится более отчетливой.
- При поражении слюнных желез отмечается появление опухолевидного образования в области щеки или слизистых оболочек полости рта. При этом отмечается онемение и нарушение двигательной функции лицевых мышц, воспалительные процессы в слюнной железе.
- При аденокистозном раке трахеи и бронхов пациентов беспокоит одышка, кашель (сухой или с мокротой, в которой могут определяться прожилки крови), осиплость голоса, свистящие звуки во время дыхания.
- Если поражается молочная железа, то женщины могут отмечать небольшое объемное образование, которое при надавливании может быть болезненным. В некоторых случаях отмечаются патологические выделения из сосков, изменение кожи в области опухоли.
На поздних стадиях рака клиническая картина дополняется выраженным похудением, постоянно повышенной температурой тела и др.
Методы диагностики
Для того чтобы выявить очаг рака, определить его размер, точную локализацию и особенности роста, пациенту назначается комплексное обследование. Важное место в нем занимают методы визуальной оценки опухоли. К ним относятся:
- Бронхоскопия.
- Эзофагогастроскопия.
- Ультразвуковая диагностика.
- Магнитно-резонансная и компьютерная томография.
- Рентгенография и др.
Однако поставить точный диагноз после визуализации рака невозможно, поэтому дополнительно назначаются и другие методы диагностики, например, биопсия, молекулярно-генетические и лабораторные исследования, диагностические операции и др.
Особенности лечения аденокистозного рака
Выбор метода лечения во многом зависит от стадии опухолевого процесса. Если рак выявлен на 1-2 стадии, то предпочтение отдается радикальному хирургическому лечению, которое подразумевает удаление опухоли в пределах здоровых тканей или полное удаление органа. При наличии показаний проводится лимфодиссекция (удаление регионарных лимфоузлов).
Аденокистозный рак считается умеренно чувствительным к лучевой терапии, поэтому ее редко используют в качестве единственного метода лечения. Однако при комбинации с хирургическим вмешательством лучевая терапия может оказаться достаточно эффективной. Ее активно применяют в таком сочетании при лечении аденокистозного рака слюнных желез средней и низкой степени дифференцировки. Также комбинация дистанционной лучевой терапии и хирургического вмешательства применяется в тех случаях, когда выявляются дополнительные неблагоприятные признаки:
- Периневральная инвазия.
- Нарушение капсулы слюнной железы.
- Положительные края резекции.
Химиолучевую терапию применяют на поздних стадиях аденокистозного рака при наличии отдаленных метастазов в лимфатических узлах или органах. Схемы лечения подбираются индивидуально.
После проведенного лечения пациент должен регулярно наблюдаться у онколога. Причем в первые 1-2 года консультироваться у специалиста и проходить специальное обследование необходимо каждые 3-6 месяцев, а затем не реже двух раз в год. Если отмечается высокий риск рецидива рака, то врач может назначить индивидуальный график консультаций.
Прогноз
Существует прямая связь между прогнозом заболевания, его стадией, общим состоянием здоровья пациента и его ответом на проведенное лечение. Например, 5-летняя выживаемость после радикального лечения аденокистозного рака трахеи на начальных стадиях составляет 65-85%, что является очень хорошим показателем. Если лечение проводится на более поздних стадиях, и при этом применяют радикальные операции в сочетании с лучевой терапией, то вероятность прожить 10 лет составляет около 25%.
Самые худшие показатели выживаемости при аденокистозном раке отмечаются при запущенных случаях либо при агрессивных видах опухолей, которые плохо поддаются лечению. Продолжительность жизни таких пациентов может не превышать и года, но, к счастью, на практике такие примеры встречаются очень редко.
Апокриновый рак
При апокриновом раке более 90% опухолевой массы составляют клетки с признаками апокринизации.
Нужно отметить, что данная форма не имеет практического значения, а только теоретический интерес.
Апокриновый рак не имеет особенностей клинического течения и прогноза.
Частота выявления рака зависит от метода исследования. При использовании световой микроскопии колеблется в пределах 0,3-4%, при электронном микроскопическом исследовании — 0,4%. При использовании иммуногистохимического маркера анти-GCDFP-15 частота выявления составляет 12-72%.
Апокриновый рак может быть представлен двумя типами клеток: А и В. Клетки типа А — крупные, с выраженной монотонной эозинофильной цитоплазмой, их ядра крупные, светлые, похожие на клетки зернисто-клеточной опухоли.
Клетки типа В подобны клеткам гистиоцитарно-макрофагального происхождения и клеткам сального (sebaceous) рака. Отличие клеток от рака последнего типа заключается в отсутствии мелких светлых вакуолей липидов, цитоплазма апокринового рака монотонно светлая.
Представляет большой интерес иммунопрофиль апокринового рака. Позитивная реакция с антителом GCDFP-15 сочетается с отсутствием рецепторов эстрогена и прогестерона. Хотя ER мРНК в избытке содержится в ядрах опухолевых клеток, сам белок в большинстве случаев не продуцируется. Апокринный рак в 97% случаев имеет рецепторы андрогенов.
Метапластический рак
Метапластические карциномы составляют менее 1% всех инвазивных раков молочной железы (РМЖ). По имеющимся данным средний возраст больных 55 лет.
Клинические признаки данной опухоли не отличаются от инвазивной протоковой карциномы. В большинстве случаев отмечают хорошо отграниченную опухоль размером 3-4 см, однако существуют образования более 20 см, которые могут смещать сосок и изъязвлять кожу. На маммограмме большинство случаев рака метапластического типа выглядит в виде четко очерченного узла, иногда с микрокальцинатами.
Опухоль плотная на ощупь, хорошо отграничена от окружающей ткани. Зоны с плоскоклеточной или хондроидной дифференцировкой на поверхности разреза серого цвета, блестящие. В толще больших плоскоклеточных опухолей может находиться одна большая киста или несколько мелких (фото 80).

Фото 80. Внешний вид злокачественной листовидной опухоли, содержащей малигнизированный эпителиальный и стромальный компоненты
В зависимости от морфологического строения метаплacтические карциномы разделяют на подтипы: плоскоклеточный рак, аденокарпинома с веретеноклеточной метаплазией, аденосквамозная (железисто-плоскоклеточная) карцинома, смешанная эпителиально/мезенхимальная метапластическая карцинома, высокодифференцированная железисто-плоскоклеточная карцинома и другие.
Метапластическая плоскоклеточная карцинома молочной железы полностью построена из малигнизированного плоского эпителия с признаками ороговения или без них. Как и в других органах, плоскоклеточный рак может быть представлен веретенообразными клетками (фото 77, 78). Однако для установления диагноза необходимо исключить рак кожи или метастаз плоскоклеточного рака.

Фото 77. Метапластический рак. Видны очаги плоскоклеточной метаплазии с ороговением. Гематоксилин-эозин, х 100

Фото 78. Метапластический рак. Опухоль из веретенообразных клеток с очагами плоскоклеточной метаплазии. Гематоксилин-эозин, х 100
Плоскоклеточный рак молочной железы делят на фенотипы: крупноклеточный ороговевающий, неороговевающий, веретеноклеточный и акантотический. Возможны комбинации этих типов. Наиболее высокодифференцированные клетки часто ограничивают кистозные полости, в ходе распространения опухолевых клеток в окружающую строму эти клетки принимают всретеновидную форму и теряют черты, характерные для плоского эпителия.
В участках веретеноклеточной карциномы нередко отмечают пролиферацию стромальных клеточных элементов. Степень дифференцировки плоскоклеточной карциномы молочной железы зависит в основном от ядерной атипии.
При веретеноклеточном и акантотическом вариантах рака необходимо иммуногистохимическое подтверждение их эпителиальной природы. Эпителиальные опухолевые клетки дают позитивную реакцию с высокомолекулярными цитокератинами (СК5 и CK34betaE12), но негативную с маркерами сарком. Практически во всех метапластических карциномах молочной железы не выявляют рецепторов эстрогена и прогестерона (фото 77-79).
Аденокарцинома с веретеноклеточной метаплазией — это инвазивная карцинома с выраженной веретеноклеточной трансформацией (фото 79). Веретеновидныс клетки скорее всего образуются из железистого эпителия. Эту опухоль диагностируют главным образом у жен-шин в постменопаузальный период.

Фото 79. Метапластический рак. Опухоль из веретенообразных клеток. Гематоксилин-эозин, х 100
Опухоль состоит из тубулярных структур аденокарциномы, смешанных с опухолевыми веретеновидными клетками. Всретеновидные клетки имеют позитивную реакцию с эпителиальными маркерами, в том числе с цитокератином 7, но не с цитокератинами 5 и 6 или другими маркерами плоскоклеточной и миоэпителиальной дифференцировки.
Аденосквамозная (железисто-плоскоклеточная) карцинома — инвазивная карцинома с зонами хорошо развитых трубчато-железистых образований и широко распространенными солидными гнездами плоского эпителия.
Участки плоскоклеточной дифференцировки отмечали в 3,7% случаев инвазивной протоковой карциномы молочной железы, однако большая доля плоскоклеточной карциномы в опухолевой массе отмечается редко. Плоскоклеточный компонент, как правило, ороговевающий, однако зоны с выраженным ороговением могут соседствовать с участками неороговевающего рака.
Плоскоклеточный компонент дает отрицательную реакцию с антителами, выявляющими рецепторы эстрогена и прогестерона, в то время как протоковый компонент этих опухолей чаще позитивную.
Высокодифференцированная железисто-плоскоклеточная карцинома — это вариант метапластической карциномы, морфологическое строение которой похоже на аденосквамозную карциному кожи. Поэтому этот тип рака некоторые авторы классифицировали как сирингоматозную плоскоклеточную опухоль. Другие авторы обозначали ее как инфильтративную сирингоаденому с часто рецидивирующим после локального иссечения течением.
Возрастной диапазон заболевания широк. Опухоль, как правило, выявляют в виде небольшой пальпируемой массы размером от 5 до 80 мм.
Строма построена из бледных веретеновидных клеток. Стромальный компонент может содержать значительное количество коллагена, быть гиалинизированным, иметь клеточное строение, изредка выявляют фокусы хрящевой и костной ткани.
Высокодифференцированную железисто-плоскоклеточную карциному могут диагностировать в ассоциации с центральной склерозирующей пролиферацией (типа радиального рубца), склерозирующими папиллярными поражениями или склерозирующим аденозом.
Частота протоковой аденокарциномы in situ, ассоциированной с высокодифференцированной железисто-плоскоклеточной карциномой, вариабельна. Эти опухоли редко экспрессируют рецепторы эстрогена.
Аденосквамозный рак, как правило, имеет очень хороший прогноз, но в ряде случаев может давать рецидивы, что связано с неадекватностью локального иссечения. Метастатическое поражение лимфатических узлов отмечают редко.

Фото 81. Смешанная эпителиально-мезенхимальная опухоль с участком рабдоидной дифференцировки. Гематоксилин-эозин, х 100

Фото 82. Смешанная эпителиально-мезенхимальная опухоль, рабдоидная дифференцировка. Экспрессия Myogenina (клон F5D, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, что характерно для РМЖ, х 200

Фото 83. Смешанная эпителиально-мезенхимальная опухоль, участок с остеогенной дифференцировкой. Гематоксилин-эозин, х 100

Фото 84. Карциносаркома молочной железы. Гематоксилин-эозин, х 100
Верстеноклеточные элементы часто экспрессируют цитокератины, хондроидные элементы белок S-100, однако могут отмечать коэкспрессию цитокератинов. Гладкомышечный актин в этих опухолях не выявляют. Как правило, рецепторы эстрогена и прогестерона как в участках аденокарциномы, так и мезенхимальной дифференцировки отсутствуют.
В случаях низкой дифференцировки карциносарком мезенхимальный компонент теряет любую иммунореактивность.
Дифференциальную диагностику между различными вариантами сарком и карциносаркомой проводят с помощью иммуногистохимических исследований.
Ангиосаркома по морфологическому строению похожа на веретеноклеточную плоскоклеточную карциному, однако наличие участков сквамозной дифференцировки облегчает диагностику. Наличие участков эпителиальной опухоли подтверждает негативная реакция с сосудистыми эндотелиальными маркерами (CD34, CD31) и позитивная — с цитокератинами.
Плоскоклеточную и железисто-плоскоклеточную карциному следует отличать от плеоморфной карциномы, для которой характерна смесь любого вида роста с большим количеством причудливых гигантских клеток; это важно, так как плеоморфная карцинома более агрессивна, чем любая разновидность плоскоклеточной или железисто-плоскоклеточной карциномы молочной железы.
Аденокарциному с хондроидной дифференцировкой нужно отличать от плеоморфной аденомы. Последняя неизменно имеет миоэпителиальный компонент (который иногда может доминировать), растущий вокруг пространств, ограниченных доброкачественными эпителиальными клетками. Миоэпителиальные клетки не определяют в аденокарциномах с хондроидной дифференцировкой.
Большинство известных метапластических карцином имели размер более 3-4 см. Метастазы в регионарных лимфатических узлах выявляли относительно редко. В подмышечные лимфатические узлы метастазируют приблизительно 10-15% опухоли с плоскоклеточной метаплазией, около 19-25% с костно-хрящевой. Отдаленные метастазы отмечены в 21 % случаев смешанной эпителиально-мезенхимальной метапластической карциномы.
Метапластические карциномы в лимфатических узлах сохраняют кроме участков рака и очаги метаплазии, как и в первичной опухоли.
Карциносаркомы очень агрессивные опухоли. При этом эпителиальный и мезенхимальный компоненты опухоли могут метастазировать как совместно, так и поодиночке.
5-летняя выживаемость больных карциносаркомами с костно-хряшевой дифференцировкой составляет 28-68%. Выживаемость больных с верстеноклеточной или плоскоклеточной карциномой составляет 5 лет в 63% случаев. Вовлечение лимфатических узлов в опухолевый процесс всегда связано с более агрессивным клиническим течением.
Среди плоскоклеточных карцином акантотический вариант является самым агрессивным.
На сегодня существует недостаточно информации об эффективности лечения метапластических карцином.
Л.М. Захарцева, М.В. Дятел, А.В. Григорук
Рак легких на сегодняшний день является одним из наиболее часто встречающихся видов злокачественных новообразований. В среднем в мире на 100 000 человек приходится 40 страдающих раком легких, причем у мужчин болезнь диагностируется в десять раз чаще, чем у женщин, а доля городских жителей в составе всех заболевших в несколько раз больше сельских. Тем не менее современная медицина располагает мощным арсеналом для лечения этого вида онкологии: при своевременном обращении за помощью высока вероятность не только приостановить развитие заболевания, но и забыть о нем навсегда.
Рак легких: характеристика заболевания и прогноз излечения
Ежегодно в мире от рака легких умирает около пяти миллионов человек. Этот вид злокачественного новообразования также называют бронхогенной карциномой или бронхогенным раком. Опухоль развивается из покровного эпителия слизистой оболочки бронхов, альвеол и эпителия бронхиальных желез. Несмотря на то что этиология заболевания до сих пор остается неясной, к основным причинам его возникновения относят:
- курение, в том числе пассивное, — основной фактор риска (вызывает примерно 90% случаев рака легких);
- облучение (проводимая ранее лучевая терапия по причине других опухолей внутригрудной локализации);
- фиброз легких;
- ВИЧ и некоторые другие виды вирусной инфекции (вирус папилломы человека, JC вирус, обезьяний вирус 40, BK вирус и цитомегаловирус);
- генетические факторы;
- алкоголь;
- плохое питание;
- факторы внешней среды, например: повышенная концентрация пылевых частиц в воздухе, воздействие радона и некоторых канцерогенов (наиболее опасным для легких является минерал асбест, а также мышьяк).
Патогенез рака легких на сегодняшний день недостаточно изучен. Что касается роста опухоли, то здесь выделяют три стадии: трансформация нормальной клетки в злокачественную, активизация опухоли и стадия ее прогрессирования. Второй этап наиболее важен, так как злокачественные клетки могут долгое время находиться в неактивном состоянии. Активизации способствует регулярное воздействие вредных факторов, которые стимулируют размножение патогенных клеток. Кроме того, на образование опухоли влияет нарушение защитных функций организма (снижение противоопухолевого иммунитета).
Российская статистика
По заболеваемости рак легкого занимает первое место среди других злокачественных опухолей у мужчин в России, а по смертности — первое место среди мужчин и женщин как в России, так и в мире. От рака легкого ежегодно умирает больше людей, чем от рака простаты, молочной железы и толстой кишки вместе взятых [1] .
При отсутствии должного лечения рака легких прогноз неутешительный: 87% больных умирает в течение двух лет. При использовании хирургических методов выживаемость больных составляет 30% в течение пяти лет. Одновременное использование нескольких методов лечения поднимает данный показатель еще на 40%. Кроме того, шансы на излечение существенно возрастают при раннем обнаружении опухоли, достигая 80%.
Различают четыре стадии рака легких. Нулевой стадии предшествует скрытая, когда раковые клетки можно обнаружить только в результате проведения бронхоскопии, цитологического, гистологического исследования.
Международная классификация стадий злокачественных новообразований TNM (tumor, nodus, metastasis) была разработана французским хирургом Пьером Денуа в 1943–1952 годах. Данная классификация применяется прежде всего для описания анатомического распространения опухоли. В основе классификации лежат три компонента:
- Показатель T характеризует распространенность первичной опухоли.
- Показатель N говорит о наличии и распространенности метастазов в регионарных лимфатических узлах.
- Показатель M иллюстрирует наличие или отсутствие отдаленных метастазов.
Существует множество классификаций рака легких, построенных на разнообразных признаках.
Согласно гистологической классификации рак легких подразделяется на следующие типы:
- аденокарцинома;
- аденосквамозная карцинома;
- плоскоклеточный рак;
- крупноклеточный рак;
- веретеноклеточный рак;
- нейроэндокринная карцинома;
- диффузная идиопатическая легочная гиперплазия.
Самым частым является плоскоклеточный вид, который диагностируется в 80% случаев. Он распространяется медленнее и поддается хирургическому лечению. Мелкоклеточный рак составляет порядка 17% случаев и является особенно опасным, так как для него характерно быстрое распространение на другие органы, за пределы легочной ткани. Выживаемость при мелкоклеточном раке составляет 40% в течение трех лет.
Особенности локализации
По расположению рак легких подразделяется на центральный и периферический. В первом случае первичный опухолевый узел возникает в бронхах (главном, промежуточном, долевом, сегментарном и субсегментарном). По направлению роста выделяют [2] :
- экзофитный (эндобронхиальный) рак, когда опухоль растет в просвет бронха;
- эндофитный (экзобронхиальный) рак с преимущественным ростом опухоли в толщу легочной паренхимы;
- разветвленный рак с муфтообразно перибронхиальным ростом опухоли вокруг бронхов;
- со смешанным характером роста опухоли с преобладанием того или иного компонента.
Периферический рак легкого затрагивает эпителий более мелких бронхов или локализуется в паренхиме легкого. Различают узловую округлую опухоль, пневмониеподобный рак и рак верхушки легкого с синдромом Панкоста.
В большинстве случаев клинические проявления рака легких наблюдаются уже при поздней стадии заболевания — это кашель с выделением крови в мокроте, одышка, боль за грудиной, шумы при дыхании [3] . Симптомы могут возникать вследствие распространения первичной опухоли, метастазирования. Вследствие отдаленных эффектов, не связанных с метастазами, могут возникать паранеопластические синдромы [4] .
На разных стадиях рак легкого может сопровождаться тромбофлебитом, различными вариантами нейро- и миопатии, своеобразными дерматозами, нарушениями жирового и липидного обмена, артралгическими и ревматоидноподобными состояниями. Нередко проявляется остеоартропатией (утолщением и склерозом костей голеней и предплечий, мелких костей кистей и стоп, припухлостью суставов, утолщением фаланг пальцев кистей).
При периферическом раке верхушки легкого возможно появление синдрома Бернара — Горнера, при котором поражается одна сторона лица — опущение века, сужение зрачка и уменьшение потоотделения. Сочетается с болями в плечевом суставе и плече, прогрессирующей атрофией мышц предплечья. Поскольку вышеперечисленные симптомы проявляются вне легких, они довольно часто не распознаются пациентом и не всегда определяются в качестве онкосимптомов.
Помимо специфических, рак легких имеет ряд общих симптомов, таких как потеря аппетита и общая слабость, повышение температуры тела, потливость, потеря веса. Однако следует помнить, что некоторые разновидности данного заболевания долгое время не проявляют себя и не имеют заметных симптомов. Именно в таких случаях решающее значение имеет качественная и своевременная диагностика.
Основными методами диагностики рака легких являются:
- Компьютерная томография (КТ) (предпочтительно) — это наиболее информативный метод в выявлении очаговых изменений легочной ткани.
- Рентгенологическое обследование, которое может включать в себя флюорографию и рентгенографию.
- Бронхоскопия — это обязательное исследование при подозрении на рак легкого. Бронхоскопия дает возможность визуально исследовать трахею, главные, долевые, сегментарные, субсегментарные бронхи и в некоторых случаях бронхи 6-го, 7-го и более порядка. Во время бронхоскопии осуществляется забор материала на биопсию.
- Позитронно-эмиссионная томография (ПЭТ КТ) применяется для определения степени распространения метастазов (в соответствии с результатами производится подбор схемы лечения) и для последующего динамического контроля.
- Эндобронхиальное (EBUS) и эндоскопическое УЗИ (EUS) — современный метод, позволяющий хирургам получить образцы тканей лимфатических узлов в области грудной клетки с помощью одной лишь иглы с оптическим прибором и ультразвука (не прибегая к технике надрезов на шее). Метод позволяет диагностировать увеличенные лимфатические узлы в грудной клетке и точно установить стадию рака легких для планирования лечения.
- Обследование с помощью системы бронхолегочной электромагнитной навигацииSuperDimension Bronchus System™ — новейший метод, который дает возможность при помощи гибкого зонда исследовать пораженный участок, расположенный глубоко внутри лимфоузла или легкого. Данный способ позволяет пульмонологам диагностировать злокачественные новообразования на более ранних стадиях заболевания, что дает возможность выбрать соответствующее лечение рака легких и избежать тяжелых последствий.
- Торакоскопия, или трансторакальная биопсия (VATS), — это визуальное исследование поверхности легких и плевральной полости через грудную стенку при помощи прокола, в который вводится торакоскоп. Дает возможность рассмотреть поверхность легких и плевру, взять образцы опухолевого материала для иммуногистохимии с целью получения гистологического заключения, удалить подозрительные легочные узелки.
- Молекулярно-генетическое тестирование опухолевой ткани: PD-L1, EGFR, ALK; другие мутации — ROS1, BRAF, RET, TRK, MET and KRAS. Цель молекулярно-генетического тестирования заключается в выделении пациентов, которым показана таргетная терапия.
Это важно!
Современный высокоточный метод стадирования рака легкого — ПЭТ/КТ (позитронная эмиссионная томография, совмещенная с компьютерной томографией) всего тела. Исследование проводится при всех стадиях заболевания и показано перед операцией. ПЭТ/КТ может обнаружить очаги опухоли в лимфатических узлах, не детектируемые с помощью КТ, а также отдаленные метастазы в других органах. Зачастую по результатам ПЭТ/КТ пересматриваются первоначальная стадия и тактика лечения [5] .
Качественная диагностика легочной онкологии является крайне важной, поскольку от нее зависит выбор подходящих методов лечения. Основными методами являются хирургическое вмешательство, химио- и лучевая терапия. Благодаря бурному развитию медицинских технологий, данные подходы становятся все более безопасными и эффективными.
После завершения диагностического этапа проводится междисциплинарный консилиум, в рамках которого обсуждают этапы комплексного лечения.
Хирургическое лечение рака легких
Хирургическое лечение проводится на ранних стадиях заболевания и при условии технической возможности удаления опухоли в полном объеме. Обязательным этапом операции, независимо от объема удаляемой легочной ткани, является превентивное удаление лимфатических узлов в зоне регионарного метастазирования, включая средостенные.
Современной тенденцией лечения рака легких является использование малоинвазивных методов, которые производятся с применением миниатюрной видеокамеры. Методика носит название Video-Assisted Thoracoscopic Surgery (VATS). Такие операции сопровождаются менее выраженными болевыми ощущениями, а процесс реабилитации после них протекает быстрее. Данный метод применяются в тех случаях, когда удается диагностировать болезнь на клинической 1-й стадии.
Химиотерапия
Основной метод лечения для большинства пациентов, страдающих раком легких. Ее суть заключается в приеме лекарственных препаратов, разрушающих раковые клетки. Химиотерапия может проводиться в одном из двух режимов:
- Неоадъювантная — назначается перед проведением хирургической операции, чтобы остановить рост злокачественных клеток, уничтожить их и оценить эффективность стандартного лечения.
- Адъювантная — используется для уничтожения оставшихся раковых клеток после операции или курса радиотерапии и позволяет снизить риск рецидива болезни.
Таргетная (целевая) терапия рака легкого
Такие препараты распознают злокачественные клетки по их специфическим признакам и уничтожают их, воздействуя на жизненно важные функции (рост, деление). Кроме этого, такие препараты нарушают кровоснабжение опухоли. Таргетная (целевая) терапия может назначаться как самостоятельный метод лечения или в комбинации с химиотерапией в целях повышения эффективности лечения.
Иммунотерапия
Радиотерапия
Лучевую терапию применяют как самостоятельное лечение, а также в сочетании с химиотерапевтическим методом.
Облучение опухоли мощным пучком гамма-лучей, в результате чего раковые клетки погибают (приостанавливают рост и размножение). При радикальном лучевом лечении облучению подвергают как саму опухоль, так и зоны регионального метастазирования. Лучевая терапия применяется также при мелкоклеточном раке. Новейшие медицинские разработки в области радиотерапии включают в себя:
- дистанционную радиотерапию (External Beam Radiation Therapy — EBRT) — воздействие на раковые клетки производится с помощью наружного источника, расположенного вне человеческого тела;
- стереотаксическую лучевую терапию — методика SBRT — возможность лечения рака легкого первой стадии с помощью облучения опухоли высокой дозой;
- высокодозную брахитерапию (High Dose Rate Brachytherapy — HDR Brachytherapy) — воздействие посредством источника, имплантированного в тело пациента и располагающегося в непосредственной близости от опухоли (или внедренного в опухоль).
Одним из новейших методов лечения рака легких является радиотерапия IMRT RapidArc®, которая позволяет подавать всю дозу облучению исключительно на больную ткань без повреждения здоровых тканей. Применяется в том случае, если раковый процесс затрагивает более одной доли легких, но не распространился за их пределы.
Лучевая терапия зачастую проводится совместно с химиотерапией с целью достижения максимального эффекта лечения.
Паллиативное лечение рака легких
Применяется для неизлечимых больных, когда противоопухолевое лечение противопоказано по определенным причинам или возможности лечения исчерпаны. Паллиативное лечение направлено на борьбу с симптомами, а также повышение качества жизни. Паллиативная помощь может быть оказана в рамках стационара, а также на дому. Объем лечения определяется индивидуально.
Этот вопрос мы адресовали представителю многопрофильного медицинского центра. Рассказывает онколог Европейского медицинского центра Оксана Овсий:
«Рак легких — очень коварное заболевание, зачастую на первых стадиях протекающее бессимптомно. По этой причине при ухудшении общего самочувствия рекомендуется не затягивать с обращением к врачу и прохождением диагностического обследования. Помимо сотрудников государственных онкоцентров, помощь могут оказать и специалисты частных клиник.
Чтобы получить доступ к мировым методикам лечения, не уезжая за рубеж, рекомендую обратиться в Институт онкологии ЕМС в Москве, осуществляющий диагностику и лечение рака по современным американским и европейским протоколам.
Мы оказываем весь комплекс диагностических и лечебных процедур пациентам с раком легких:
- прием (осмотр, консультация) врача-онколога, радиотерапевта и других (первичный, повторный, ежедневный);
- компьютерная томография органов грудной полости, средостения и верхних отделов брюшной полости;
- позитронная эмиссионная томография, совмещенная с компьютерной томографией;
- бронхография, в том числе избирательная;
- аспирационная биопсия из нижних дыхательных путей;
- торакоцентез;
- клиническая лабораторная диагностика, включая сложные диагностические услуги (лабораторный, функциональный, инструментальный, рентгенорадиологический и другие методы исследования), формирующие диагностические комплексы;
- назначение лекарственных препаратов при онкологическом заболевании у взрослых;
- хирургическое лечение;
- радиотерапия;
- химио-, таргетная и иммунотерапия злокачественных опухолей;
- услуги по медицинской реабилитации пациента, перенесшего операцию по поводу онкологического заболевания, химиотерапию, лучевую терапию;
- прием (осмотр, консультация) врача по паллиативной медицинской помощи (первичный и повторный).
Институт онкологии EMC обладает новейшими системами для проведения лучевой и стереотаксической лучевой терапии. Стоит отметить, что высокотехнологичное оборудование позволяет выполнять облучение опухоли с миллиметровой точностью, не допуская облучения здоровой ткани и позволяя успешно бороться с раком легкого 1-й стадии. Во время сеанса аппарат контролирует положение пациента и отклонение мишени облучения в режиме online.
- медицинскую деятельность на основании лицензии ЛО-77-01-019876, выданной Департаментом здравоохранения города Москвы 10 апреля 2020 года;
- высокотехнологичную медицинскую деятельность на основании лицензии ФС-99-01-009514, выданной Федеральной службой по надзору в сфере здравоохранения 25 апреля 2018 года.
** Аккредитация Объединенной международной комиссии (Joint Commission International), полученная Европейским медицинским центром (госпиталь на ул. Щепкина, 35), распространяется на период с 7 апреля 2018 года по 6 апреля 2021 года.
Читайте также:

