Волосатоклеточный лейкоз лабораторная диагностика

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Диагноз рак вводит простых людей в ступор, состояние полнейшего шока. При этом диагнозе первая мысль, что жизнь окончена. Но не так все просто. Болезней, относящихся к онкологической области медицины достаточно много. Одни из них, при своевременном медицинском вмешательстве, дают возможность забыть человеку о болезни как о страшном сне, другие же, даже при вмешательстве квалифицированных специалистов, дают больному лишь непродолжительный отрезок жизни, отсрочку летального исхода. Одной из патологий, которая будет более подробно рассмотрена в данной статье, является волосатоклеточный лейкоз – заболевание тяжелое, но к счастью встречающееся достаточно редко.

[1], [2], [3], [4], [5], [6], [7], [8]
Код по МКБ-10
Причины волосатоклеточного лейкоза
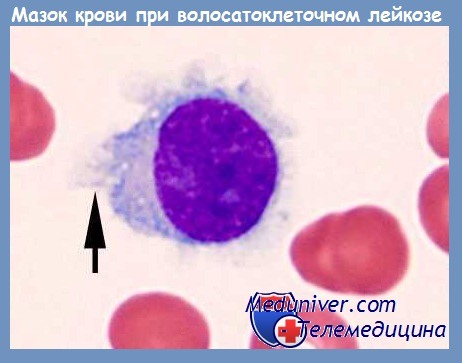
В случае зарождения лейкоза, данные структуры начинают трансформироваться, меняя свой нормальный абрис, и, соответственно теряя способность участвовать в иммунных процессах. При этом под многократным увеличением исследуемая клетка предстает как бесформенная структура с отходящими от нее отростками цитоплазмы, похожими на волоски.
Причины волосатоклеточного лейкоза на сегодняшний день учеными, работающими в сфере онкологии, досконально не изучены. Но как было установлено, вероятность его поражения и развития во многом зависит от пола человека и его возрастной принадлежности. Как показали клинические наблюдения, статистические периоды рассматриваемой патологии соответствует приблизительно 50 годам, при этом около 75 % больных, которым был диагностирован волосатоклеточный лейкоз, были представители сильной половины человечества. Объяснения этому феномену пока не найдено.
Возрастной период диагностики обуславливается не поздним поражением и скоростью прогрессирования, а медленными темпами развития с продолжительным бессимптомным периодом. То есть данное заболевание способно длительные годы прогрессировать в организме больного, а он этого даже не подозревает.
Катализатором данного процесса, как показали наблюдения, могут стать и другие факторы:
- Облучение организма человека некоторой категорией лучей.
- Канцерогены, которые сегодня в огромных количествах присутствуют в продуктах супермаркетов.
- Инфекционные заболевания.
Перечисленные выше патологии предположительно могут спровоцировать развитие рассматриваемого заболевания, но получить достоверных подтверждений этому пока не удалось. Ученые продолжают работать в данном направлении.

[9], [10], [11], [12]
Симптомы волосатоклеточного лейкоза
Пожалуй, одним из основных отличительных показателей рассматриваемой патологии является тот факт, что на ее фоне начинает развиваться спленомегалия, которая выражается медленным ростом объемов селезенки. Этому способствует высокий уровень распада патологических лейкоцитов.
Основываясь на механику развития патологического процесса, можно обозначить такие симптомы волосатоклеточного лейкоза:
- Развитие патологии может отозваться возникновением тянущей боли или тяжести, которая определяется с левой стороны брюшины.
- При пальпации левого бока лечащий доктор ощущает увеличенные размеры селезенки.
- Наблюдается анемия.
- Отдышка.
- Организм больного ослаблен и склонен к инфицированию. Такой симптом можно объяснить угнетением кроветворения, которое подавляется лейкозными клетками, локализованными в костном мозге.
- Симптомные проявления полной интоксикации организма.
- Человек начинает терять в весе.
- У него пропадает аппетит.
- Могут появиться признаки лихорадки.
- В ночные часы наблюдается повышенная выработка пота.
- Человек констатирует спонтанный необъяснимый рост температурных показателей тела.
- Больной начинает ощущать постоянную слабость, быструю утомляемость.
- По телу больного могут наблюдаться беспричинные появления многочисленных кровоподтеков и кровотечений.
- Воспаление и болезненность лимфатических узлов в подмышечной впадине, в области шеи, паха и живота.
Вся сложность в обнаружении данного заболевания состоит в том, что симптоматика начинает проявляться постепенно и не сразу, поэтому их появление зачастую списывают на переутомление после работы, эмоциональное истощение, возрастные изменения в организме.
Диагностика волосатоклеточного лейкоза
Если у участкового терапевта возникло даже малейшее подозрение по поводу онкологического заболевания, он дает больному направление к более узконаправленному специалисту на обследование, которое проводится в специализированной онкологической клинике.
Диагностика волосатоклеточного лейкоза представляет собой ряд стандартных мероприятий:

[13], [14], [15], [16], [17], [18]
Как уже говорилось ранее, очень информативным методом установления заболевания является лабораторная диагностика волосатоклеточного лейкоза.
Попав в онкоклинику, больному необходимо пройти ряд лабораторных исследований.
- Общий анализ крови дает возможность лечащему врачу – онкологу получить такие показатели как:
- Численные составляющие тромбоцитов, красных и белых кровяных телец.
- Данный анализ позволяет получить уровень гемоглобина, являющийся прямым показателем анемии и другой симптоматики.
- Скорость оседания эритроцитов (СОЭ).
Данный анализ берется забором материала из вены, используя медицинский шприц. После изъятия крови, она поступает в лабораторию, где, с применением необходимой аппаратуры, и удается произвести подсчет. Данное исследование является основой диагностики и других разноплановых заболеваний.
К кому обратиться?
Лечение волосатоклеточного лейкоза
Одним из основных методов, входящих в протокол противоопухолевой терапии являются препараты химиотерапии. Лечение волосатоклеточного лейкоза основывается на ряде факторов, которые и определяют выбираемую терапевтическую методику:
- Количественное соотношение здоровых и видоизмененных клеток, которые присутствуют в костном мозгу и крови.
- Размерные параметры селезенки и уровень отклонения их от нормы.
- Присутствие в анамнезе больного лейкемии, а так же получается ответ на вопрос, это первичное ее диагностирование или рецидив.
Еще совсем не давно, да и во многих случаях сейчас, онкологи при терапии цитопении на фоне рассматриваемого заболевания применяют спленэктомию (оперативное вмешательство по удалению селезенки). Данная процедура позволяет нормализовать клеточную формулу крови. Но как показали терапевтические наблюдения, постоянно проводимые с больными, прошедшими через эту процедуру, что ее эффективность наблюдается на протяжении восьми месяцев.
Желательно если лечение будет начато при появлении одного или двух патологических симптомов, то есть тогда, когда болезнь еще не приобрела более масштабные и тяжелые последствия.
Но на сегодняшний день найдено лекарственное средство, которое показывает при его применении в лечебной терапии, достаточно неплохие обнадеживающие результаты. Препарат нового поколения кладрибин, позволяющий добиться в восьми случаях из десяти длительную ремиссию. Бывает достаточно одного терапевтического курса, чтобы больной забыл о проблеме года на три.
Особенно стойкий эффект получается, если данный препарат назначается больному уже после полученного курса интерферона альфа или пентостатина.
Противоопухолевое (антибластомное) средство кладрибин вводится в организм больного внутривенно. Пациенту ставят капельницу. Скорость поступления лекарства в организм должна быть достаточно низкой. Такая процедура назначается в виде двухчасовой или 24-х часовой инфузии.
Дозировка и длительность лечебного курса для каждого больного назначается сугубо индивидуально, после анализа врачом – онкологом клинической картины заболевания, состояния организма больного на момент назначения.
Фармакологами рекомендуется стартовая доза препарата в размере от 0,09 до 0,1 мг, принятого на килограмм веса пациента. Данные об эффективности более повышенных доз ввода кладрибина на сегодняшний день отсутствуют. Средняя продолжительность лечебного курса составляет семь суток.
Непосредственно перед началом процедуры, лекарственный препарат разбавляется 9% раствором натрия хлорида, который берется в объемах от половины до одного литра.
Если доктором назначен 24 – х часовый ввод лекарственного средства, для его разведения обычно используется 0.9% раствор натрия хлорида бактериостатического характера, в составе которого присутствует бензиловый спирт, служащий для вводимого раствора консервантом. В данном случае данное химическое соединение необходимо, чтобы на протяжении всего времени инфузии препарат не потерял своей фармакологической ценности.
Противопоказанием к применению данного лекарственного средства можно отнести индивидуальную непереносимость организмом больного одного или нескольких его составляющих, дисфункция почек (кроме легкой формы), дисфункция печени (кроме легкой формы). Так же не следует назначать кладрибин совместно с миелосупрессивными лекарственными средствами, в период беременности и кормления грудью, а так же детям и подросткам, которым еще не исполнилось 16 лет. С большой осторожностью вводить при наличии в организме пациента вторичной инфекции или при угнетении функции костного мозга.
Прием рассматриваемого препарата дает обнадеживающие результаты. Больные, около 95 %, прошедшие курс лечения кладрибином показывают выживаемость около девяти лет.
Пентостатин. Это лекарство вводят инъекционно внутривенно непрерывно в течение предусмотренного отрезка времени. Лекарство назначается в дозировке 4 мг на площадь поверхности тела больного, пересчитанную на м 2 . Процедура проводится один раз в две недели на протяжении трех – шести месяцев. Данный препарат позволяет не только привести в норму формулу крови, но и привести к исчезновению патологически измененных клеточных структур, локализующихся в костном мозге.
Вводится больному с диагнозом волосатоклеточной лейкоз и интерферон. Противовирусное лекарственное средство интерферон призвано защитить ослабленный болезнью организм от инвазии болезнетворной патогенной микрофлоры.
Данный препарат попадает в организм больного через носовые ходы или перорально. На одну процедуру уходит 10 мл воды для инъекций, слегка подогретую до температуры 37 °С и три ампулы препарата (для проведения ингаляций). Как капли в нос, состав одной ампулы разводят 2 мл теплой водички. В каждый носовой ход закапывают по 0,25 мл, что соответствует пяти каплям раствора.
Процедура проводится с интервалом в час – два, не меньше пяти подходов в сутки. Продолжительность лечения двое – трое суток.
Так же в протокол лечения такого пациента обычно вводятся лекарственные средства, которые призваны нормализовать гормональный фон человека и поднять его иммунный статус.
Волосатоклеточный лейкоз (ВКЛ) является редким В-клеточным заболеванием, впервые описан в 1958 г.
Заболевание составляет около 2% от всех лейкозов и около 8% от всех лимфопролиферативных новообразований.
Заболевают преимущественно взрослые, возрастная медиана примерно 50 лет, соотношение мужчины: женщины составляет 4,5:1.
Интерес к ВКЛ повысился в связи с применением интерферона альфа и пентостатина в 1980-е годы и кладрибина в 1990-е годы.
Клиническая симптоматика у пациентов может отсутствовать и заболевание диагностируется при исследовании общего анализа крови по различным причинам. Некоторые пациенты имеют симптомы, обусловленные лейкопенией, в частности, при наличии инфекций.
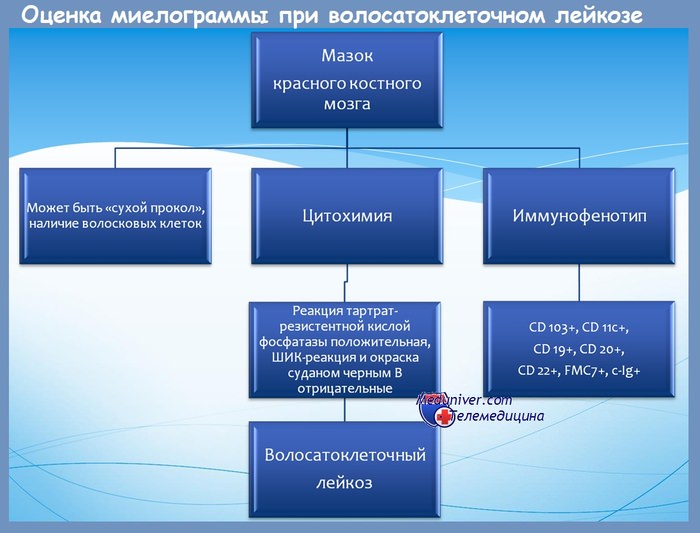
Клинические и лабораторные признаки при ВКЛ:
Диагностические тесты при волосатоклеточном лейкозе
В идеале столбик ткани в 2-3 см достаточен для приготовления мазка и гистологического исследования. Гистологическое исследование выявляет наличие очагов инфильтрации, диффузных интерстициальных или фокальных, при этом опухолевые клетки имеют светлоголубую цитоплазму.
Экспрессия TRAP и CD72 (антигена, реагирующего с DBA.44) имеет 100% чувствительность при ВКЛ и является высокоспецифичной для этого заболевания; комбинация TRAP/DBA.44 положительна только в 3% случаев других лимфопролиферативных заболеваний. Моноклональные CD11c, CD25, CD123 антитела не определяются при использовании парафиновых срезов, но аннексин А1, который является наиболее специфичным маркером ВКЛ, при этом определяется.
Аннексин А1 не экспрессируется при любых других В-клеточных лимфопролиферативных новообразованиях. В связи с этой специфичностью аннексина А1, его определение не проводится для определения минимального вовлечения или при низком уровне резидуального ВКЛ после лечения, поскольку он экспрессируется миелоидными клетками и некоторыми Т-клетками.
Следует отметить, что при проведении иммуногистохимического исследования при диагностике ВКЛ в трепанате 50% клеток являются положительными при исследовании ядерного циклина D1. Цитологически и гистологически волосатоклеточный лейкоз необходимо дифференцировать в первую очередь с лимфомой клеток мантии. Опухолевые клетки экспрессируют иммуногистохимически определяемый антиген CD10 примерно в 20% случаев, что не ассоциируется с плохим прогнозом.
Поэтому крайне необходимо иммуногистохимическое исследование на CD20. Свидетельством наличия минимальной остаточной болезни является наличие положительно реагирующих в виде кластеров или диффузно расположенных CD20 положительных лимфоцитов.
Определение TRAP цитохимическим методом является кардинальным тестом при диагностике ВКЛ, но способность моноклональных антител (mAbs) реагировать с TRAP может применяться при исследовании трепаната.
В исключительных случаях диагноз ВКЛ выставляется при гистологическом исследовании селезенки после спленэктомии или пункционной биопсии селезенки. Гистология селезенки выявляет инфильтрацию красной пульпы с нарушением нормальной цитоархитектоники стромы и синусоидов в сочетании с выраженной атрофией белой пульпы.
Эти показатели уникальны и не встречаются при других лимфопролиферативных заболеваниях, при которых белая пульпа обычно гиперплазирована. Исключением является В-клеточная лимфома красной пульпы (предлагаемая форма в ВОЗ-классификации лимфом, 2008) и ВКЛ-в с пролимфоцитарной морфологией. Гистологическое исследование селезенки позволяет верифицировать диагноз в затруднительных случаях, однако спленэктомия с диагностической целью показана в единичных случаях.
Диагностические тесты при волосатоклеточном лейкозе:
• Исследование мазка периферической крови,
• Трепанобиопсия КМ с окраской гематоксилин-эозином и окраской на ретикулин плюс иммунохимическое исследование: CD20, DBA.44, TRAP и дополнительная панель для исключения других лимфопролиферативных заболеваний из малых лимфоцитов,
• Проточная цитометрия периферической крови или взвеси клеток КМ с панелью моноклональных антител:
• Панель В-клеток: CD19, CD20, CD22, SmIg,
• Панель клеток ВКЛ: CD11c, CD25, CD103, CD123,
• Скрининг на наличие мутации гена BRAF V600E.
Стадии и прогностические признаки волосатоклеточного лейкоза
Не существует общепринятой системы для стадирования ВКЛ. Заболевание поражает в основном костнsq мозг и селезенку и медленно прогрессирует. Большинство прогностических признаков относится к состоянию пораженных органов. Максимальная степень лейкопении развивается при выраженной инфильтрации КМ и увеличенной селезенке.
Анемия (гемоглобин 9 /л) и тромбоцитопения ( 9 /л) в любом сочетании ассоциированы с относительно плохим прогнозом. По крайней мере, 9% пациентов имеют абдоминальную лимфоаденопатию, что повышает возможность рецидива, поскольку она ассоциирована с плохим ответом на терапию и с укорочением общей выживаемости (ОВ). Компьютерная томография (КТ) может давать некоторую прогностическую информацию. Если выявляется лимфоаденопатия, повторное исследование должно включать КТ.
Учет прогностических факторов включает ответ на терапию аналогами пуриновых нуклеозидов. Выход только в частичную ремиссию (ЧР) прогностически хуже, чем выход в полную ремиссию (ПР). Показано, что у пациентов, вышедших в ПР, бессобытийная выживаемость (БВ) составила в среднем около 20 лет; при выходе в ЧР - 4 года. При мультивариантном анализе ответ на терапию достоверно ассоциировался с улучшением БВ, поэтому достижение ПР является основным условием в лечении ВКЛ.
Выполнение спленэктомии, приводящее к улучшению гематологических показателей, является вариантом терапии и в некоторых случаях является обязательной частью терапии.
Лечение
Надо учитывать, что риск оппортунистических инфекций у пациентов с моноцитопенией и нейтропенией очень высокий, поэтому эти пациенты могут нуждаться в терапии на ранних стадиях заболевания. Основными показаниями для терапии являются: клинические проявления цитопении или спленомегалия с болевым синдромом.
Пентостатин (2-деоксиформицин,2-DCF), продукты крови необходимо облучать в дозе 25 Грей.
4 мг/м каждые 2 недели до достижения максимального эффекта, дополнительно одно или два введения. Измерение клиренса креатинина до начала лечения - при наличии клиренса креатинина 10 см ниже левой реберной дуги) при умеренном вовлечении в процесс КМ.
Поскольку введение кладрибина подкожно по эффекту сравнимо с другими вариантами введения, его можно рекомендовать в качестве режима первой линии терапии. Если после лечения достигнута только ЧР, целесообразно провести второй курс терапии.
При введении кладрибина рекомендуется минимизировать введение других препаратов во избежание аллергических реакций типа кожного зуда. Поскольку лечение должно быть комплексным, для профилактики пневмоцистной пневмонии и предупреждения реактивации герпес-инфекции необходимо применение ко-тримоксазола и ацикловира соответственно.
Если необходимо, нужно провести лечение имеющейся инфекции до начала лечения аналогами пуриновых нуклеозидов. Пациентам, получающим пентостатин или кладрибин, необходимо проводить трансфузии компонентов крови, облученных в дозе 25 Грей во избежание реакции трансплантат против хозяина (РТПХ).
Краеугольным камнем в терапии ВКЛ является применение двух аналогов пуриновых нуклеозидов - пентостатина и кладрибина. Оба препарата вызывают ПР у большинства пациентов (более 80%), которая является продолжительной в большинстве случаев; средняя продолжительность БВ превышает 10 лет.
Рандомизированных исследований по эффекту пентостатина в сравнении с кладрибином не проводилось. При длительном наблюдении не отмечено разницы в результатах при лечении обоими препаратами; БВ составила около 16 лет.
После того, как диагноз ВКЛ верифицирован и установлено, что необходимо проведение терапии, начинают лечение одним из аналогов пуриновых нуклеозидов. Применяются различные режимы терапии с целью достижения ПР при минимальной токсичности. Средняя БВ значительно выше при достижении полной ремиссии чем при достижении ЧР.
Из этих соображений, терапия одним из этих препаратов должна продолжаться во время ремиссии. Добавление 6-8 доз ритуксимаба совместно с терапией аналогами пуриновых нуклеозидов или после терапии ими может помочь пациентам в связи с сокращением количества курсов пентостатина или проведением второго курса кладрибина.
Пентостатин применяется в полной дозе при нормальном клиренсе креатинина (выше 60 мл/мин) и в половинной дозе при его клиренсе между 40 и 60 мл/мин Антиэметики должны назначаться при каждом введении препаратов; профилактика котримоксазолом проводится у пациентов с лимфопенией (менее 1,0х10 9 /л) на протяжении 6 месяцев. Во избежание поражения почек проводится гидратация путем введения 1,5 литра солевых растворов внутривенно при каждом введении препарата.
Кладрибин применяется различными путями включая постоянные внутривенные инфузии на протяжении 7 дней, внутривенные инфузии в течение 2 часов на протяжении 5 дней или ежедневные подкожные инъекции на протяжении 5 дней, а также еженедельные подкожные инъекции на протяжении 5-6 недель.
Не получено разницы при применении различных схем лечения, однако есть преимущество при применении кладрибина в виде постоянных внутривенных введений. Результаты подкожного или внутривенного болюсного введения кладрибина сходны с таковыми при его постоянном внутривенном введении.
В ПР при иммуногистохимии отсутствуют кластеры (более 3 клеток CD20 положительных или DBA.44 положительных клеток). ЧР считается нормализация цитопении и уменьшение минимум на 50% органомегалии и/или наличие более 5% циркулирующих волосатых клеток.
После применения кладрибина оценка ответа проводится спустя минимум 4 мес. по окончании терапии. Если достигнута ЧР, с достоверными остаточными данными ВКЛ, может быть проведен второй курс терапии кладрибином, обычно спустя 6 мес после окончания терапии. Ко второму курсу кладрибина можно добавить ритуксимаб.
При применении пентостатина после 8-9 курсов терапии при нормализации показателей периферической крови показано выполнение биопсии КМ (хотя лимфо-пения сохраняется). Если достигнута ЧР, рекомендуется провести дополнительно одну или две инъекции пентостатина.
Лечение рецидива волосатоклеточного лейкоза
Большинство пациентов в рецидиве достигают повторной ремиссии при повторном введении кладрибина или пентостатина. Выбор препарата при рецидиве зависит от длительности первой ремиссии: при короткой, 2 лет, повторяют лечение тем же препаратом.
Долговременное наблюдение показывает, что ПР имеет одинаковую продолжительность при применении терапии первой, второй или третьей линии. Конечно, процент пациентов в полной ремиссии уменьшается с каждым циклом терапии. Комбинация пентостатина или кладрибина в сочетании с ритуксимабом рекомендуется пациентам при рецидиве.
Данные по неответившим или рефрактерным к проводимой терапии пациентам показывают снижение перекрестной резистентности между пентостатином и кладрибином. Оба препарата хорошо переносятся при длительном лечении у пациентов с лимфоцитопенией.
Несмотря на достигнутый клинический эффект при применении кладрибина или пентостатина, необходимо определить наличие минимальной остаточной болезни (МОБ). Выявлено два подтипа МОБ, которые коррелируют с риском рецидива спустя 55 месяцев после лечения.
В группе пациентов, получавших ритуксимаб в комбинации с аналогами пуриновых нуклеозидов, МОБ не определялась методом молекулярного исследования или проточной цитометрии более чем у 90% пациентов. С другой стороны выявлено, что МОБ присутствует у длительно живущих пациентов без признаков прогрессирования заболевания.
В связи с отличными результатами, полученными при применении аналогов пуриновых нуклеозидов, интерферон альфа реже применяется при лечении ВКЛ. Роль интерферона альфа лимитирована сегодня применением у пациентов с выраженной панцитопенией и у пациентов, у которых необходимо возможно быстрое восстановление количества клеток крови.
Режим введения в дозе 3 млн ед. трижды в неделю вызывает ступенчатое улучшение гемограммы и обеспечивает условия для последовательного применения аналогов пуриновых нуклеозидов.
Имеются данные, что улучшение функции КМ до применения пентостатина улучшает долговременный эффект терапии и снижает количество инъекций, вызывающих ремиссию. Поддерживающая терапия этим препаратом не рекомендуется в связи с ограниченным эффектом и частотой побочных эффектов, ухудшающих качество жизни.
Показания для спленэктомии изменились с внедрением в терапию аналогов пуриновых нуклеозидов. Принципиальным показанием для спленэктомии является выраженная спленомегалия (нижний полюс селезенки >10 см ниже левой реберной дуги) при наличии незначительной инфильтрации КМ.
Если гемограмма нормализовалась и нет клинической симптоматики, вопрос о проведении терапии решается индивидуально, причем у этих пациентов необходимо проведение профилактики инфекций.
Лечение рефрактерного заболевания
Другим условием применения ритуксимаба в лечении ВКЛ является лечение пациентов, у которых заболевание рефрактерно к терапии пентостатином или кладрибином. Режимом с получением наилучшего эффекта является применение ритуксимаба в дозе 375 мг/м еженедельно на протяжении 8 недель.
В настоящее время недостаточно данных для решения вопроса об эффективности комбинации ритуксимаба с аналогами пуриновых нуклеозидов у неответивших пациентов. Изучается применение иммунотоксина, направленного против CD25 и CD22. Проводится изучение и других препаратов, которые могут быть внедрены в лечение пациентов ВКЛ.
Терапия волосатоклеточного лейкоза у беременных
Волосатоклеточный лейкоз вариантный (ВКЛ-в)
Это редкое В-лимфопролиферативное заболевание в принципе не относится к волосатоклеточному лейкозу и согласно классификации лимфом (ВОЗ, 2008) выделено в отдельную нозологическую форму. Идет дискуссия о дифференциальной диагностике этого заболевания и ВКЛ. В частности, необходимо дифференцированно подходить к стандартной терапии ВКЛ, поскольку ВКЛ-в резистентен к терапии интерфероном альфа и очень редко наступает ремиссия при терапии кладрибином и пентостатином.
По классификации ВОЗ (2008) гематопоэтических опухолей заболевание рассматривается как неклассифицируемая селезеночная В-клеточная лимфома/лейкоз (вариант селезеночной диффузной В-клеточной лимфомы красной пульпы селезенки).
Иммунофенотипирование В-клеток при ВКЛ-в отличается от клеток при ВКЛ: клетки экспрессируют CD25 и HC2, но не экспрессируют CD103 и очень редко бывают положительны по CD11c.
Адекватная терапия данного заболевания не разработана. Хорошая ПР достигается после спленэктомии. Очень редко достигается ПР после четырех курсов кладрибина; есть сообщения о полной ремиссии при лечении ритуксимабом. Поэтому в случае отсутствия эффекта при терапии аналогами пуриновых нуклеозидов возможным вариантом терапии является применение ритуксимаба.
Рекомендации по ведению пациентов с ВКЛ:
• исследование морфологии клеток периферической крови и костного мозга обязательно для установления диагноза ВКЛ,
• необходимо проведение проточной цитометрии при наличии жидкого материала на наличие CD25, CD 11c, CD103, CD123 при подозрении на ВКЛ,
• иммуногистохимия трепаната КМ должно включать определение CD20, CD72(DBA.44)
CD20 является наиболее гистохимически значимым критерием для уточнения ремиссионного статуса после проведения терапии,
• желательно проводит скрининг для определения мутации ВТШ7 V600E,
• пациенты при отсутствии клинических проявлений могут не требовать проведения терапии после установления диагноза, но нуждаются в активном мониторинге,
• пациенты с цитопенией при наличии клиники или спленомегалии с болевым синдромом нуждаются в терапии,
• аналоги пуриновых нуклеозидов (пентостатин и кладрибин) являются наиболее приемлемыми препаратами терапии первой линии. Не выявлено разницы по эффекту при применения любого из этих препаратов,
• подкожное введение кладрибина более приемлемо в связи с более низкой стоимостью,
пациентам, которые получают кладрибин или пентостатин, показаны трансфузии компонентов крови, облученных в дозе 25 Грей в течение всей жизни для минимизации риска ассоциированной с трансфузиями РТПХ,
• пациенты, которые получают пентостатин или кладрибин, должны получать ацикловир или котримоксазол для профилактики герпетической инфекции и пневмоцистной пневмонии при уровне лимфоцитов ниже 1,0х10 9 /л,
• пациенты, которые получают пентостатин или кладрибин и получают профилактику герпетической инфекции или пневмонии, должны получать длительную профилактику ацикловиром или котримоксазолом в связи со снижением уровня CD4+ ниже 0,2х10 9 /л,
• ответ на терапию аналогами пуриновых нуклеозидов следует оценивать при нормализации гемограммы исследованием КМ обычно 4-6 мес. спустя после терапии кладрибином или после 8-9 курсов пентостатина,
• при наличии МОБ необходимо проводить дальнейшую терапию аналогами пуриновых нуклеозидов,
• пациенты с рецидивом после терапии аналогами пуриновых нуклеозидов должны повторно лечиться или тем же самым препаратом или альтернативным аналогом пуриновых нуклеозидов в зависимости от длительности ремиссии. В таких случаях рекомендовано применение ритуксимаба,
применение ростовых факторов в обычной практике не рекомендуется,
• спленэктомия показана у пациентов при наличии болевого синдрома при минимальном вовлечении в процесс костного мозга,
• в отношении лечения ВКЛ-в в настоящее время рекомендации отсутствуют, однако спленэктомия эффективна для достижения ПР у части пациентов с ВКЛ-в,
• терапия аналогами пуриновых нуклеозидов в сочетании с ритуксимабом эффективна у части пациентов с ВКЛ-в.
Волосатоклеточный лейкоз — опухолевое заболевание для которого характерно появление волосатых лейкоцитов в крови с пораженим различных органов, в том числе, костного мозга.
Ранее это заболевание рассматривалось как вариант хронического лимфолейкоза, но позднее было выделено в самостоятельную нозологическую форму.
Частота волосатоклеточного лейкоза невелика (1-2% всех лейкозов). Средний возраст начала заболевания — 55 лет. Соотношение мужчин и женщин 5:1. В этиологии заболевания имеют значение химические мутагены и генетическая предрасположенность.
Клинические проявления обусловлены наличием и выраженностью панцитопении и соответствующих клинических синдромов (анемический, геморрагический, инфекционных осложнений) и спленомегалии (встречается у 90% больных). Увеличение печени выявляется у 50% пациентов, лимфаденопатия нехарактерна. У 20% больных развиваются аутоиммунные осложнения (артриты, васкулиты, узловатая эритема).

В периферической крови у 70% больных выявляется панцитопения, нередко отмечаются тяжелая нейтропения (нейтрофилов менее 1 • 10 9 /л) и тромбоцитопения (тромбоцитов менее 50 • 10 9 /л). Значительно реже обнаруживается умеренный лейкоцитоз (не более 20 • 10 9 /л).
Для диагностики имеет значение характерный иммунофенотип опухолевых клеток: SIg+, CD19+, CD20+, CD22+, CD25+, CD79a+, CD5-, CD10-, CD23-. Подтверждает диагноз цитохимическое исследование (яркая диффузная реакция на кислую фосфатазу, не подавляющаяся тартратом натрия). Специфические изменения кариотипа отсутствуют.

У 50-75% пациентов наблюдается гиперэкспрессия циклина D1, не ассоциирующаяся с цитогенетическими [(t (11;14)] или молекулярно-генетическими нарушениями (реаранжировка BCL-1), более характерными для лимфомы из зоны мантии.
Длительное время основным методом лечения волосатоклеточного лейкоза была спленэктомия. Существенное улучшение или нормализация гематологических показателей после спленэктомии наблюдается у 70-80% пациентов, однако в большинстве случаев длительность действия не превышает 2-3 лет.
При аутоиммунных осложнениях хороший эффект оказывают глюкокортикостероиды, но их длительное применение не улучшает отдаленных результатов лечения и одновременно увеличивает число инфекционных осложнений.
Цитостатическая терапия (обычно применяется хлорбутин) также увеличивает продолжительность жизни, однако в связи с исходной цитопенией часто сопровождается тяжелыми инфекционными осложнениями и поэтому используется редко.
Как и при других заболеваниях, в начале лечения интерфероном-а часто возникает гриппоподобный синдром, купирующийся нестероидными противовоспалительными препаратами и коррекцией дозы препарата. При волосатоклеточном лейкозе, кроме того, возможно развитие иммуносупрессии, однако необходимость отмены интерферона-а возникает очень редко.
Интерферон-а эффективен у 60-100% пациентов, причем препарат может использоваться и при рецидиве заболевания. Интерферон-а достоверно улучшает результаты лечения: 5-летняя выживаемость при отсутствии лечения составляет 30%, при химиотерапии или после спленэктомии — 60%, на фоне интерферона-а — 90%.
В последнее время доказана высокая эффективность лечения больных волосатоклеточным лейкозом пуриновыми аналогами. В отличие от ХЛЛ, наибольший эффект отмечается при использовании пентостатина и кладрибина. При использовании обоих препаратов полные ремиссии достигаются у 90-100% пациентов, а их продолжительность обычно превышает 5 лет.
Читайте также:

